第四章 化学反应与电能 复习课 课件(共28张PPT)
文档属性
| 名称 | 第四章 化学反应与电能 复习课 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 226.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:48:10 | ||
图片预览







文档简介
(共28张PPT)
第四章 化学反应与电能
总复习
一、导入新课
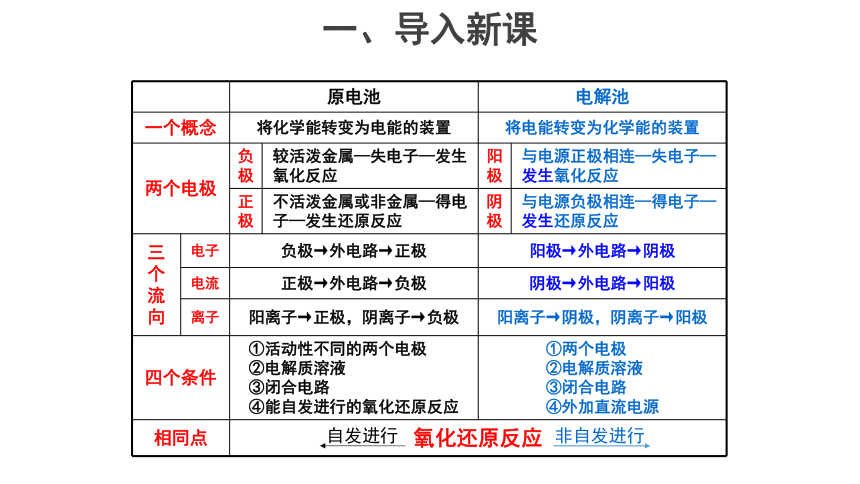
原电池 电解池 一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置 两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属—得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极 电流 正极→外电路→负极 阴极→外电路→阳极 离子 阳离子→正极,阴离子→负极 阳离子→阴极,阴离子→阳极 四个条件 ①活动性不同的两个电极 ②电解质溶液 ③闭合电路 ④能自发进行的氧化还原反应 ①两个电极 ②电解质溶液 ③闭合电路 ④外加直流电源 相同点 氧化还原反应 自发进行
非自发进行
一、导入新课
特别提示:原电池、电解池、电镀池判定规律
(1)若无外接电源,可能是原电池,然后依据原电池的形成条件分析判断。主要思路是“三看”:
先看电极:两极为导体且活泼性不同;
再看溶液:两极插入电解质溶液中;
后看回路:形成闭合回路或两极接触。
(2)若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
二、讲授新课
例1(双选)在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
解析:原电池的负极和电解池的阳极发生的是氧化反应,原电池的正极和电解池的阴极发生的是还原反应。
答案:BC
二、讲授新课
当堂检测一
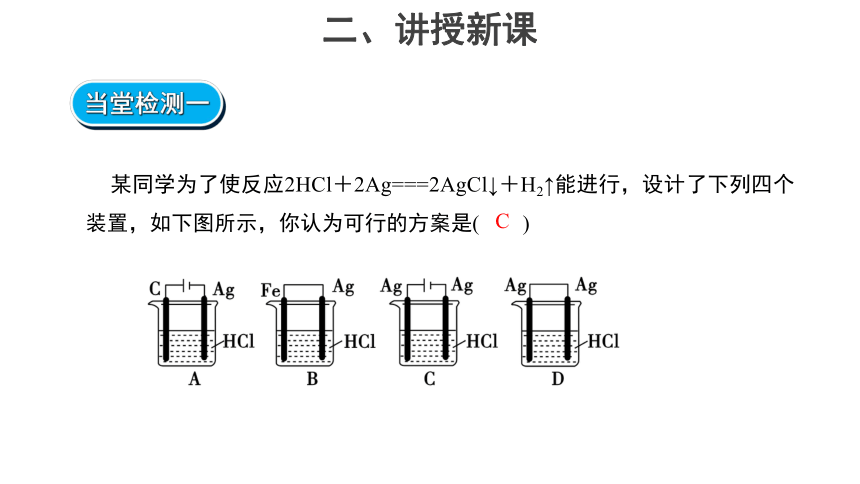
某同学为了使反应2HCl+2Ag===2AgCl↓+H2↑能进行,设计了下列四个装置,如下图所示,你认为可行的方案是( )
C
二、电极方程式的书写
1.碱性锌锰干电池
电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极反应:
正极反应:
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2+2H2O+2e-=2MnOOH+2OH-
二、电极方程式的书写
2.纽扣电池
银锌电池
负极反应:
正极反应:
总反应:
Zn+ 2OH- -2e- =Zn(OH)2
Ag2O +H2O +2e- =2Ag +2OH-
Ag2O + Zn+H2O =Zn(OH)2 + 2Ag
二、电极方程式的书写
3.锂电池
锂亚硫酰氯电池(Li-SOCl2):
总式:8Li+3SOCl2=6LiCl+Li2SO3+2S
负极:
正极:
8Li-8e-=8Li+
3SOCl2+8e-=6Cl-+SO32-+2S
二、电极方程式的书写
(1)放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H+ +SO42-+2e- =PbSO4 +2H2O
负极:
4.铅蓄电池
二、电极方程式的书写
(2)充电过程总反应:
阳极:
阴极:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
PbSO4 +2e- =Pb + SO42-
PbSO4 +2H2O-2e- = PbO2 + 4H+ + SO42-
还原反应
氧化反应
Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
放电
2PbSO4+2H2O
充电
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
5.氢氧燃料电池
2H2 -4e- =4H+
O2+4H+ +4e- =2H2O
(1)酸性介质
O2+2H2 =2H2O
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
O2+2H2 =2H2O
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
(2)碱性介质
5.氢氧燃料电池
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
O2+2H2 =2H2O
O2 + 2H2O + 4e-= 4OH-
2H2 -4e- =4H+
(3)中性介质
5.氢氧燃料电池
二、电极方程式的书写
原电池电极反应方程式的书写方法:
(1)明确正、负极;
(2)根据电极反应类型确定在电极上发生反应的物质;
(3)结合电解液的成分利用“三个守恒”(电子守恒、电荷守恒、原子守恒)写出(凑出)电极反应方程式。
方法归纳
三、有关电化学的计算
1.原电池和电解池的计算常涉及的问题
(1)两极产物的定量计算;
(2)溶液pH的计算{pH=-lg(H+)};
(3)相对原子质量的计算和阿伏加德罗常数的值的测定;
(4)根据转移电子的量求产物的量或根据产物的量求转移电子的量。
三、有关电化学的计算
2.常用的三种方法
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等;
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算;
(3)根据关系式计算:由得失电子守恒关系找到已知量与未知量之间的桥梁,得出计算所需的关系式。
三、有关电化学的计算
3.步骤
(1)根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称;
(2)准确写出电极反应式;
(3)根据题目所给条件和所要求解的问题,使用上述合适的方法建立等量关系求解。
三、有关电化学的计算
【例2】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
D
三、有关电化学的计算
当堂检测二
用两支惰性电极插入500 mL的AgNO3溶液中,通电电解。当电解质溶液的pH由6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出银的质量是( )
A.27 mg B.54 mg
C.108 mg D.216 mg
B
四、关于电解问题的解题步骤
1.明确电极反应规律
(1)阴极:得电子,还原反应。
①(一般)电极本身不参加反应;
②电解质溶液中阳离子“争”得电子。
(2)阳极:失电子,氧化反应。
①若为金属(非惰性,Au、Pt除外)电极,电极失电子;
②若为惰性电极,电解质溶液中阴离子“争”失电子。
四、关于电解问题的解题步骤
2.准确判断离子放电顺序
离子的放电顺序主要取决于离子本身性质,还与离子的浓度、溶液的酸碱性有关。
(1)阳离子放电顺序
(水溶液中只考虑此部分)
(浓度很大时排在前)
(只在熔化状态下放电)
上述顺序表明在金属活动性顺序中,越活泼的金属,其阳离子越难得电子,但Fe3+氧化性较强,排在Cu2+之前。
四、关于电解问题的解题步骤
(2)阴离子放电顺序
(水溶液中只考虑此部分)
若电极材料是活泼金属,因金属失电子能力强,阳极反应则是电极材料本身失电子被氧化,而不是阴离子放电。
四、关于电解问题的解题步骤
3.分析电解问题的基本思路
(1)通电前,电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(2)通电时,阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
(3)写电极反应式,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、 pH的变化等。
四、关于电解问题的解题步骤
4.判断电解后溶液pH变化的方法
根据原溶液的酸碱性和电极产物即可对电解后溶液pH的变化作出正确的判断,其方法如下:
(1)若电极产物只有H2而无O2,则pH变大。
(2)若电极产物只有O2而无H2,则pH变小。
(3)若电极产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。
四、关于电解问题的解题步骤
【例3】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,下列符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
C
四、关于电解问题的解题步骤
当堂检测三
用惰性电极电解CuSO4溶液,当Cu2+浓度下降至一半时停止通电,要想使CuSO4溶液恢复原浓度,应加入的物质是( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
B
五、课堂小结
第四章 电化学基础
一 、原电池、电解池的知识比较
二 、电极方程式的书写
三、有关电化学的计算
四、关于电解问题的解题步骤
再 见
第四章 化学反应与电能
总复习
一、导入新课
原电池 电解池 一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置 两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属—得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极 电流 正极→外电路→负极 阴极→外电路→阳极 离子 阳离子→正极,阴离子→负极 阳离子→阴极,阴离子→阳极 四个条件 ①活动性不同的两个电极 ②电解质溶液 ③闭合电路 ④能自发进行的氧化还原反应 ①两个电极 ②电解质溶液 ③闭合电路 ④外加直流电源 相同点 氧化还原反应 自发进行
非自发进行
一、导入新课
特别提示:原电池、电解池、电镀池判定规律
(1)若无外接电源,可能是原电池,然后依据原电池的形成条件分析判断。主要思路是“三看”:
先看电极:两极为导体且活泼性不同;
再看溶液:两极插入电解质溶液中;
后看回路:形成闭合回路或两极接触。
(2)若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
二、讲授新课
例1(双选)在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
解析:原电池的负极和电解池的阳极发生的是氧化反应,原电池的正极和电解池的阴极发生的是还原反应。
答案:BC
二、讲授新课
当堂检测一
某同学为了使反应2HCl+2Ag===2AgCl↓+H2↑能进行,设计了下列四个装置,如下图所示,你认为可行的方案是( )
C
二、电极方程式的书写
1.碱性锌锰干电池
电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极反应:
正极反应:
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2+2H2O+2e-=2MnOOH+2OH-
二、电极方程式的书写
2.纽扣电池
银锌电池
负极反应:
正极反应:
总反应:
Zn+ 2OH- -2e- =Zn(OH)2
Ag2O +H2O +2e- =2Ag +2OH-
Ag2O + Zn+H2O =Zn(OH)2 + 2Ag
二、电极方程式的书写
3.锂电池
锂亚硫酰氯电池(Li-SOCl2):
总式:8Li+3SOCl2=6LiCl+Li2SO3+2S
负极:
正极:
8Li-8e-=8Li+
3SOCl2+8e-=6Cl-+SO32-+2S
二、电极方程式的书写
(1)放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H+ +SO42-+2e- =PbSO4 +2H2O
负极:
4.铅蓄电池
二、电极方程式的书写
(2)充电过程总反应:
阳极:
阴极:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
PbSO4 +2e- =Pb + SO42-
PbSO4 +2H2O-2e- = PbO2 + 4H+ + SO42-
还原反应
氧化反应
Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
放电
2PbSO4+2H2O
充电
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
5.氢氧燃料电池
2H2 -4e- =4H+
O2+4H+ +4e- =2H2O
(1)酸性介质
O2+2H2 =2H2O
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
O2+2H2 =2H2O
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
(2)碱性介质
5.氢氧燃料电池
二、电极方程式的书写
负极反应:
正极反应:
总反应式:
O2+2H2 =2H2O
O2 + 2H2O + 4e-= 4OH-
2H2 -4e- =4H+
(3)中性介质
5.氢氧燃料电池
二、电极方程式的书写
原电池电极反应方程式的书写方法:
(1)明确正、负极;
(2)根据电极反应类型确定在电极上发生反应的物质;
(3)结合电解液的成分利用“三个守恒”(电子守恒、电荷守恒、原子守恒)写出(凑出)电极反应方程式。
方法归纳
三、有关电化学的计算
1.原电池和电解池的计算常涉及的问题
(1)两极产物的定量计算;
(2)溶液pH的计算{pH=-lg(H+)};
(3)相对原子质量的计算和阿伏加德罗常数的值的测定;
(4)根据转移电子的量求产物的量或根据产物的量求转移电子的量。
三、有关电化学的计算
2.常用的三种方法
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等;
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算;
(3)根据关系式计算:由得失电子守恒关系找到已知量与未知量之间的桥梁,得出计算所需的关系式。
三、有关电化学的计算
3.步骤
(1)根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称;
(2)准确写出电极反应式;
(3)根据题目所给条件和所要求解的问题,使用上述合适的方法建立等量关系求解。
三、有关电化学的计算
【例2】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
D
三、有关电化学的计算
当堂检测二
用两支惰性电极插入500 mL的AgNO3溶液中,通电电解。当电解质溶液的pH由6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出银的质量是( )
A.27 mg B.54 mg
C.108 mg D.216 mg
B
四、关于电解问题的解题步骤
1.明确电极反应规律
(1)阴极:得电子,还原反应。
①(一般)电极本身不参加反应;
②电解质溶液中阳离子“争”得电子。
(2)阳极:失电子,氧化反应。
①若为金属(非惰性,Au、Pt除外)电极,电极失电子;
②若为惰性电极,电解质溶液中阴离子“争”失电子。
四、关于电解问题的解题步骤
2.准确判断离子放电顺序
离子的放电顺序主要取决于离子本身性质,还与离子的浓度、溶液的酸碱性有关。
(1)阳离子放电顺序
(水溶液中只考虑此部分)
(浓度很大时排在前)
(只在熔化状态下放电)
上述顺序表明在金属活动性顺序中,越活泼的金属,其阳离子越难得电子,但Fe3+氧化性较强,排在Cu2+之前。
四、关于电解问题的解题步骤
(2)阴离子放电顺序
(水溶液中只考虑此部分)
若电极材料是活泼金属,因金属失电子能力强,阳极反应则是电极材料本身失电子被氧化,而不是阴离子放电。
四、关于电解问题的解题步骤
3.分析电解问题的基本思路
(1)通电前,电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(2)通电时,阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
(3)写电极反应式,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、 pH的变化等。
四、关于电解问题的解题步骤
4.判断电解后溶液pH变化的方法
根据原溶液的酸碱性和电极产物即可对电解后溶液pH的变化作出正确的判断,其方法如下:
(1)若电极产物只有H2而无O2,则pH变大。
(2)若电极产物只有O2而无H2,则pH变小。
(3)若电极产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。
四、关于电解问题的解题步骤
【例3】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,下列符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
C
四、关于电解问题的解题步骤
当堂检测三
用惰性电极电解CuSO4溶液,当Cu2+浓度下降至一半时停止通电,要想使CuSO4溶液恢复原浓度,应加入的物质是( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
B
五、课堂小结
第四章 电化学基础
一 、原电池、电解池的知识比较
二 、电极方程式的书写
三、有关电化学的计算
四、关于电解问题的解题步骤
再 见
