第一节 化学反应速率 第2课时 优秀课件(共23张PPT)
文档属性
| 名称 | 第一节 化学反应速率 第2课时 优秀课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:55:07 | ||
图片预览








文档简介
(共23张PPT)
第2课时 影响化学反应速率的因素
第二章 化学反应速率与化学平衡 第一节 化学反应速率
导入新课
加快反应速率的措施
给洗衣粉加酶
炉膛鼓风
导入新课
用煤粉代替煤块
汽车加大油门
加快反应速率的措施
把食物放进冰箱
食品袋中加除氧剂
导入新课
减慢反应速率的措施
一、影响化学反应速率的因素
1、内因:
反应物的组成、结构和性质的等因素。
2、外因:
浓度、压强、温度、催化剂、接触面积、光照等。
浓度:
其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。
压强:
对于有气体参加的化学反应,减小容器体积,增大压强,化学反应速率增大;增大容器体积,减小压强,化学反应速率减小。
升高温度,化学反应速率增大;降低温度,化学反应速率减小。
温度:
催化剂:
一般情况下,加入催化剂,化学反应速率增大。
其他因素:
增大反应物接触面积可以增大反应速率。
【介绍】 控制变量法思想
如果有多个因素(变量)对实验结果存在影响,往往控制其他因素保持不变,而仅对其中的一个因素进行改变,并通过对比实验来明确该因素是否会产生影响并且如何影响。(定多议一)
【学生活动】
选择课本中药品,设计实验方案,探究浓度、温度、催化剂对反应速率的影响。
二、实验探究影响化学反应速率的因素
【问题探究】
根据反应原理:Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O 通过什么现象说明反应进行的快慢?
【实验探究】
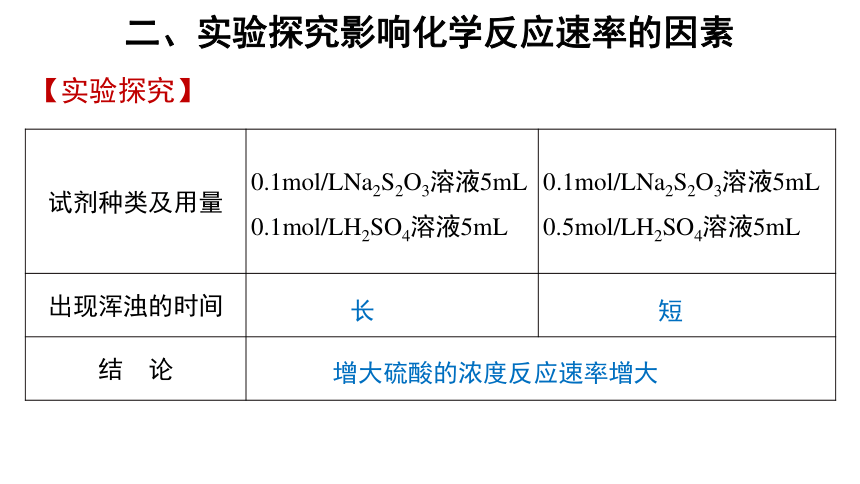
1.浓度对化学反应速率的影响
【实验药品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.5mol/LH2SO4溶液
【实验原理】Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O
【实验步骤】取两支试管,各加入5mL0.1mol/LNa2S2O3溶液,然后向一支试管中加入0.1mol/LH2SO4溶液5mL,振荡,记录出现浑浊的时间;向另一支试管中加入0.5mol/LH2SO4溶液,振荡,记录出现浑浊的时间。
二、实验探究影响化学反应速率的因素
试剂种类及用量 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL 0.1mol/LNa2S2O3溶液5mL
0.5mol/LH2SO4溶液5mL
出现浑浊的时间
结 论 【实验探究】
长
短
增大硫酸的浓度反应速率增大
二、实验探究影响化学反应速率的因素
2. 温度对化学反应速率的影响
【实验药品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、热水
【实验原理】Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O
【实验步骤】取两支试管,各加入5mL0.1mol/LNa2S2O3溶液;另取两支试管各加入5mL0.1mol/LH2SO4溶液;将四支试管分成两组(各有一支盛有Na2S2O3溶液和H2SO4 的试管),一组放入蒸馏水中,另一组放入热水中,经过一段时间后,分别混合并搅拌。记录出现浑浊的时间。
【实验探究】
二、实验探究影响化学反应速率的因素
【实验探究】
试剂种类及用量 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL 0.1mol/LNa2S2O3溶液5mL
0.1mol/LH2SO4溶液5mL
试验温度 蒸馏水 热水
出现浑浊的时间
结 论 长
短
温度升高,反应速率增大
二、实验探究影响化学反应速率的因素
3. 催化剂对反应速率的影响
【实验药品】5%H2O2溶液、1mol/LFeCl3 溶液、蒸馏水
【实验原理】2H2O2 = 2H2↑+ O2↑
【实验步骤】在两只试管中各加入2mL5%H2O2溶液,再向两只支试管中分别滴入1mol/LFeCl3 溶液和蒸馏水各1mL,摇匀,比较H2O2的分解速率。
【实验探究】
二、实验探究影响化学反应速率的因素
加入试剂 5%H2O2溶液、蒸馏水 5%H2O2溶液、1mol/LFeCl3 溶液
产生气泡快慢
结 论 慢
快
H2O2分解反应中,FeCl3做催化剂,加快了反应速率
【实验探究】
二、实验探究影响化学反应速率的因素
【实验探究Ⅱ】 通过实验测定并比较化学反应的速率
【实验药品】锌粒、1 mol/L的硫酸、4mol/L的硫酸
【实验装置】
【实验步骤】:
① 组装实验装置,在锥形瓶中放入2g锌粒,通过分液漏斗加入40 mL 1mol/L的硫酸溶液,测量并记录收集10 mL H2所用的时间。
② 另组一套装置,加入40 mL 4mol/L的硫酸,测量并记录收集10 mL H2所用的时间。
二、实验探究影响化学反应速率的因素
【实验探究Ⅱ】 通过实验测定并比较化学反应的速率
加入试剂 所用时间min 反应速率mol/(L·min) 结论
1mol/L H2SO4
4mol/L H2SO4 实验结论:4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
二、实验探究影响化学反应速率的因素
【总结】
影响化学反应速率的因素 影响结果
内因
外因
性质
反应物的性质越活泼,化学反应速率越快;反之则越慢
催化剂
使用催化剂,化学反应速率加快
温度
升高温度,化学反应速率加快;反之减慢
反应物的浓度
增大反应物的浓度,化学反应加快;反之减慢
气态反应物压强
增大气态反应物的压强,化学反应速率加快;反之减慢
固体反应物表面积
增大固体反应物的表面积,化学反应速率加快;反之减慢
其他
光波、电磁波、超声波、溶剂等
二、实验探究影响化学反应速率的因素
【课堂练习】
某学生做浓度对化学反应速率影响的实验时,将3支试管编号为①、②、③,并按下表中物质的量进行实验,记录下的时间数据是16 s、28 s、33 s,请将3个数据填入下表的适当位置,并写出实验结论。
(1)将对应①、②、③的时间分别写出:a_____,b_____,c_____
(2)实验结论: 。
(3)写出反应的化学方程式: 。
试管编号 加3%Na2S2O3 加H2O 加H2SO4(1∶5) 出现浑浊时间
① 3 mL 3 mL 5滴 a s
② 4 mL 2 mL 5滴 b s
③ 5 mL 1 mL 5滴 c s
33
28
16
增大反应物浓度,化学反应速率加快
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
【解析】参加反应的Na2S2O3的浓度由大到小的顺序为③>②>①,反应速率③>②>①,出现浑浊的时间③<②<①,这说明反应物浓度越大,化学反应速率越快。
二、实验探究影响化学反应速率的因素
课堂小结
课堂检测
1.下列做法利用了浓度对化学反应速率的影响的是( )
A.将食物保存在电冰箱里
B.做粉尘爆炸实验时选用很细的面粉
C.向过氧化氢溶液中加入MnO2
D.铁与稀盐酸反应太慢时加入较浓的盐酸
D
【解析】将食物保存在电冰箱里是温度对反应速率的影响;
做粉尘爆炸实验时选用很细的面粉是接触面积对反应速率的影响;
向过氧化氢溶液中加入MnO2是催化剂对反应速率的影响。
2.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
A
【解析】要想说明反应物本身的性质是影响化学反应速率的决定性因素,则该实验事实的区别应在反应物本身,而不是外界因素(如浓度、压强、温度、催化剂等)。
课堂检测
3.把镁条直接投入到盛有盐酸的敞口容器里,产生H2速率如图所示。下列因素中对产生H2速率有影响的是( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.①④ B.③④
C.①②③ D.②③
C
【解析】镁条与盐酸反应过程中盐酸浓度逐渐减小,同时放出一定的热量。
课堂检测
4.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,SO2和O2各10 mol 反应
乙:在500℃时,用V2O5作催化剂,10 mol SO2和5 mol O2起反应
丙:在450℃时,8 mol SO2和5 mol O2反应
丁:在500℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
C
【解析】影响化学反应速率的各因素,对反应速率影响程度大小的一般规律为:催化剂>温度>浓度,即有催化剂V2O5,温度高的化学反应速率快,所以反应速率由大到小顺序排列为乙、甲、丁、丙。
课堂检测
5.把0.01 mol MnO2粉末加入50 mL过氧化氢的溶液里(ρ=1.1 g·L-1),在标准状况下,放出气体的体积V和时间t的关系曲线如下图所示。
(1)A、B、C、D各点反应速率快慢的顺序是
。
(2)过氧化氢溶液的初始物质的量浓度为
。
(3)根据曲线形状解释反应速率的变化情况是
。
D>C>B>A
0.108mol/L
随着c(H2O2)减小,反应速率减小
【解析】曲线的斜率逐渐减小,说明随浓度的下降,反应速率逐渐减小。
课堂检测
再 见
第2课时 影响化学反应速率的因素
第二章 化学反应速率与化学平衡 第一节 化学反应速率
导入新课
加快反应速率的措施
给洗衣粉加酶
炉膛鼓风
导入新课
用煤粉代替煤块
汽车加大油门
加快反应速率的措施
把食物放进冰箱
食品袋中加除氧剂
导入新课
减慢反应速率的措施
一、影响化学反应速率的因素
1、内因:
反应物的组成、结构和性质的等因素。
2、外因:
浓度、压强、温度、催化剂、接触面积、光照等。
浓度:
其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。
压强:
对于有气体参加的化学反应,减小容器体积,增大压强,化学反应速率增大;增大容器体积,减小压强,化学反应速率减小。
升高温度,化学反应速率增大;降低温度,化学反应速率减小。
温度:
催化剂:
一般情况下,加入催化剂,化学反应速率增大。
其他因素:
增大反应物接触面积可以增大反应速率。
【介绍】 控制变量法思想
如果有多个因素(变量)对实验结果存在影响,往往控制其他因素保持不变,而仅对其中的一个因素进行改变,并通过对比实验来明确该因素是否会产生影响并且如何影响。(定多议一)
【学生活动】
选择课本中药品,设计实验方案,探究浓度、温度、催化剂对反应速率的影响。
二、实验探究影响化学反应速率的因素
【问题探究】
根据反应原理:Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O 通过什么现象说明反应进行的快慢?
【实验探究】
1.浓度对化学反应速率的影响
【实验药品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.5mol/LH2SO4溶液
【实验原理】Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O
【实验步骤】取两支试管,各加入5mL0.1mol/LNa2S2O3溶液,然后向一支试管中加入0.1mol/LH2SO4溶液5mL,振荡,记录出现浑浊的时间;向另一支试管中加入0.5mol/LH2SO4溶液,振荡,记录出现浑浊的时间。
二、实验探究影响化学反应速率的因素
试剂种类及用量 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL 0.1mol/LNa2S2O3溶液5mL
0.5mol/LH2SO4溶液5mL
出现浑浊的时间
结 论 【实验探究】
长
短
增大硫酸的浓度反应速率增大
二、实验探究影响化学反应速率的因素
2. 温度对化学反应速率的影响
【实验药品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、热水
【实验原理】Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 ↑+ H2O
【实验步骤】取两支试管,各加入5mL0.1mol/LNa2S2O3溶液;另取两支试管各加入5mL0.1mol/LH2SO4溶液;将四支试管分成两组(各有一支盛有Na2S2O3溶液和H2SO4 的试管),一组放入蒸馏水中,另一组放入热水中,经过一段时间后,分别混合并搅拌。记录出现浑浊的时间。
【实验探究】
二、实验探究影响化学反应速率的因素
【实验探究】
试剂种类及用量 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL 0.1mol/LNa2S2O3溶液5mL
0.1mol/LH2SO4溶液5mL
试验温度 蒸馏水 热水
出现浑浊的时间
结 论 长
短
温度升高,反应速率增大
二、实验探究影响化学反应速率的因素
3. 催化剂对反应速率的影响
【实验药品】5%H2O2溶液、1mol/LFeCl3 溶液、蒸馏水
【实验原理】2H2O2 = 2H2↑+ O2↑
【实验步骤】在两只试管中各加入2mL5%H2O2溶液,再向两只支试管中分别滴入1mol/LFeCl3 溶液和蒸馏水各1mL,摇匀,比较H2O2的分解速率。
【实验探究】
二、实验探究影响化学反应速率的因素
加入试剂 5%H2O2溶液、蒸馏水 5%H2O2溶液、1mol/LFeCl3 溶液
产生气泡快慢
结 论 慢
快
H2O2分解反应中,FeCl3做催化剂,加快了反应速率
【实验探究】
二、实验探究影响化学反应速率的因素
【实验探究Ⅱ】 通过实验测定并比较化学反应的速率
【实验药品】锌粒、1 mol/L的硫酸、4mol/L的硫酸
【实验装置】
【实验步骤】:
① 组装实验装置,在锥形瓶中放入2g锌粒,通过分液漏斗加入40 mL 1mol/L的硫酸溶液,测量并记录收集10 mL H2所用的时间。
② 另组一套装置,加入40 mL 4mol/L的硫酸,测量并记录收集10 mL H2所用的时间。
二、实验探究影响化学反应速率的因素
【实验探究Ⅱ】 通过实验测定并比较化学反应的速率
加入试剂 所用时间min 反应速率mol/(L·min) 结论
1mol/L H2SO4
4mol/L H2SO4 实验结论:4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
二、实验探究影响化学反应速率的因素
【总结】
影响化学反应速率的因素 影响结果
内因
外因
性质
反应物的性质越活泼,化学反应速率越快;反之则越慢
催化剂
使用催化剂,化学反应速率加快
温度
升高温度,化学反应速率加快;反之减慢
反应物的浓度
增大反应物的浓度,化学反应加快;反之减慢
气态反应物压强
增大气态反应物的压强,化学反应速率加快;反之减慢
固体反应物表面积
增大固体反应物的表面积,化学反应速率加快;反之减慢
其他
光波、电磁波、超声波、溶剂等
二、实验探究影响化学反应速率的因素
【课堂练习】
某学生做浓度对化学反应速率影响的实验时,将3支试管编号为①、②、③,并按下表中物质的量进行实验,记录下的时间数据是16 s、28 s、33 s,请将3个数据填入下表的适当位置,并写出实验结论。
(1)将对应①、②、③的时间分别写出:a_____,b_____,c_____
(2)实验结论: 。
(3)写出反应的化学方程式: 。
试管编号 加3%Na2S2O3 加H2O 加H2SO4(1∶5) 出现浑浊时间
① 3 mL 3 mL 5滴 a s
② 4 mL 2 mL 5滴 b s
③ 5 mL 1 mL 5滴 c s
33
28
16
增大反应物浓度,化学反应速率加快
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
【解析】参加反应的Na2S2O3的浓度由大到小的顺序为③>②>①,反应速率③>②>①,出现浑浊的时间③<②<①,这说明反应物浓度越大,化学反应速率越快。
二、实验探究影响化学反应速率的因素
课堂小结
课堂检测
1.下列做法利用了浓度对化学反应速率的影响的是( )
A.将食物保存在电冰箱里
B.做粉尘爆炸实验时选用很细的面粉
C.向过氧化氢溶液中加入MnO2
D.铁与稀盐酸反应太慢时加入较浓的盐酸
D
【解析】将食物保存在电冰箱里是温度对反应速率的影响;
做粉尘爆炸实验时选用很细的面粉是接触面积对反应速率的影响;
向过氧化氢溶液中加入MnO2是催化剂对反应速率的影响。
2.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
A
【解析】要想说明反应物本身的性质是影响化学反应速率的决定性因素,则该实验事实的区别应在反应物本身,而不是外界因素(如浓度、压强、温度、催化剂等)。
课堂检测
3.把镁条直接投入到盛有盐酸的敞口容器里,产生H2速率如图所示。下列因素中对产生H2速率有影响的是( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.①④ B.③④
C.①②③ D.②③
C
【解析】镁条与盐酸反应过程中盐酸浓度逐渐减小,同时放出一定的热量。
课堂检测
4.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,SO2和O2各10 mol 反应
乙:在500℃时,用V2O5作催化剂,10 mol SO2和5 mol O2起反应
丙:在450℃时,8 mol SO2和5 mol O2反应
丁:在500℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
C
【解析】影响化学反应速率的各因素,对反应速率影响程度大小的一般规律为:催化剂>温度>浓度,即有催化剂V2O5,温度高的化学反应速率快,所以反应速率由大到小顺序排列为乙、甲、丁、丙。
课堂检测
5.把0.01 mol MnO2粉末加入50 mL过氧化氢的溶液里(ρ=1.1 g·L-1),在标准状况下,放出气体的体积V和时间t的关系曲线如下图所示。
(1)A、B、C、D各点反应速率快慢的顺序是
。
(2)过氧化氢溶液的初始物质的量浓度为
。
(3)根据曲线形状解释反应速率的变化情况是
。
D>C>B>A
0.108mol/L
随着c(H2O2)减小,反应速率减小
【解析】曲线的斜率逐渐减小,说明随浓度的下降,反应速率逐渐减小。
课堂检测
再 见
