第一章 化学反应的热效应 章末归纳整理 优秀课件(共28张PPT)
文档属性
| 名称 | 第一章 化学反应的热效应 章末归纳整理 优秀课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 959.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:56:55 | ||
图片预览





文档简介
(共28张PPT)
章末归纳与整理
第一章 化学反应的热效应
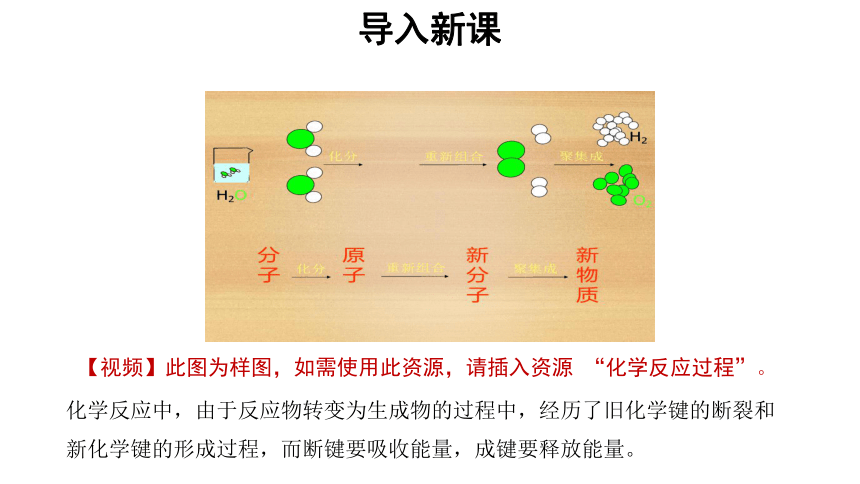
导入新课
化学反应中,由于反应物转变为生成物的过程中,经历了旧化学键的断裂和新化学键的形成过程,而断键要吸收能量,成键要释放能量。
【视频】此图为样图,如需使用此资源,请插入资源 “化学反应过程”。
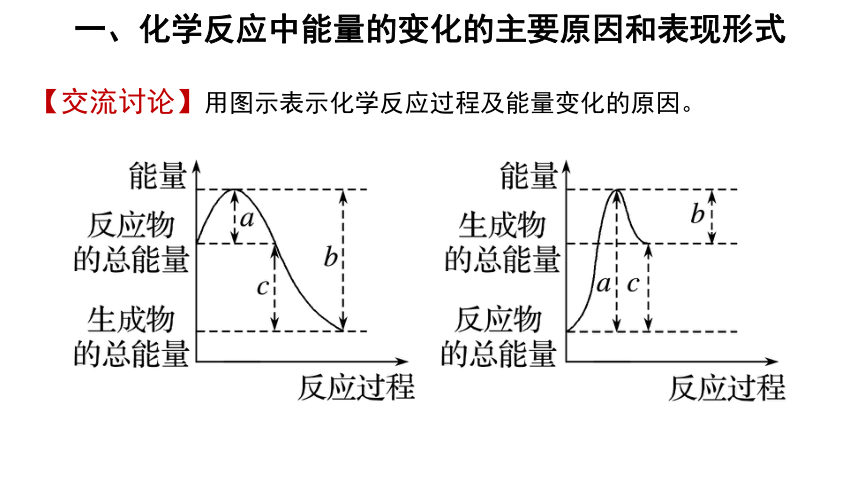
一、化学反应中能量的变化的主要原因和表现形式
【交流讨论】用图示表示化学反应过程及能量变化的原因。
1. 化学反应中能量变化的原因:
(1)当反应物中化学键的断裂所吸收的能量大于形成生成物中的化学键所释放的能量时,该反应就要吸收能量;反之,该化学反应就会释放能量。
(2)当反应物的总能量大于生成物的总能量,该化学反应就会放出能量; 当生成物的总能量大于反应物的总能量,该化学反应就会吸收能量。
因此,一个化学反应是吸收能量还是放出能量,取决于反应物的总能量和生成物的总能量的相对大小,它与物质结构中的化学键的关系密切。
一、化学反应中能量的变化的主要原因和表现形式
2.化学反应热与反应条件无必然关系:
3.化学反应热与物质的稳定性关系:
(1)放热反应往往也需要加热。
(2)吸热反应常温下也能自发进行。
一个反应能否自发进行,主要看在通常环境下是否能达到该反应发生的条件。因此,不能根据反应条件判断一个反应是放热反应还是吸热反应。
化学反应热与物质的稳定性:物质的能量越低,该物质越稳定;物质的能量越高,该物质越不稳定。即A→B,ΔH<0,A具有的能量高于B,B的稳定性强于A。
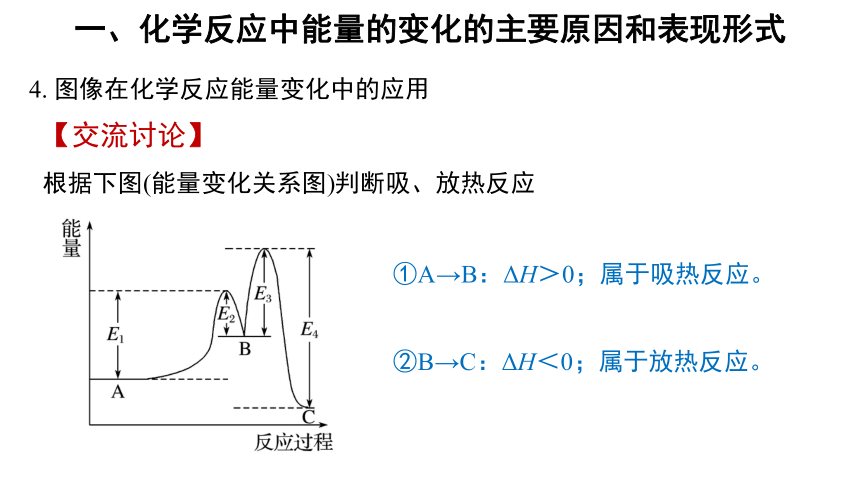
一、化学反应中能量的变化的主要原因和表现形式
4. 图像在化学反应能量变化中的应用
【交流讨论】
根据下图(能量变化关系图)判断吸、放热反应
①A→B:ΔH>0;属于吸热反应。
②B→C:ΔH<0;属于放热反应。
一、化学反应中能量的变化的主要原因和表现形式
【例题分析】
1.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)=CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应物ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
C
解析:根据图示,该反应反应物的总能量大于生成物的总能量,是放热反应;加入催化剂对反应热无影响;生成液态CH3OH时释放出的热量更多,ΔH更小。
一、化学反应中能量的变化的主要原因和表现形式
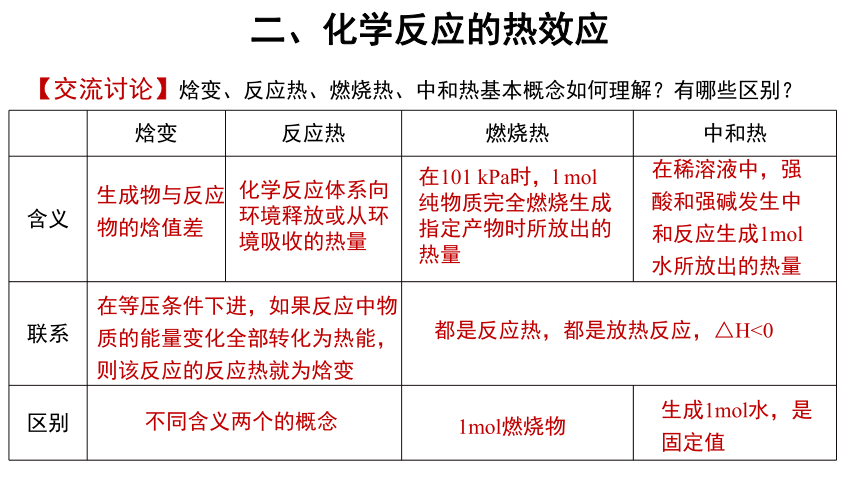
二、化学反应的热效应
【交流讨论】焓变、反应热、燃烧热、中和热基本概念如何理解?有哪些区别?
生成物与反应物的焓值差
化学反应体系向环境释放或从环境吸收的热量
在101 kPa时,l mol纯物质完全燃烧生成指定产物时所放出的热量
在稀溶液中,强酸和强碱发生中和反应生成1mol 水所放出的热量
在等压条件下进,如果反应中物质的能量变化全部转化为热能,则该反应的反应热就为焓变
都是反应热,都是放热反应,△H<0
不同含义两个的概念
1mol燃烧物
生成1mol水,是固定值
焓变 反应热 燃烧热 中和热
含义
联系 区别
三、热化学方程式及书写
【交流讨论】书写或进行热化学方程式正误的判断要注意哪些问题?
判断热化学方程式时应注意以下问题
1.检查ΔH符号的正误。
2.检查是否注明物质的聚集状态。
3.检查ΔH的数值与化学计量数是否对应。
4.特殊反应热,如燃烧热。
【例题分析】
2.下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:
2C(石墨,s)+O2(g)=2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l)=2H2(g)+O2(g) 的ΔH=+572 kJ·mol-1
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
C
【解析】合成氨的反应是可逆反应,反应不能进行到底。
三、热化学方程式及书写
【交流讨论】书写热化学方程式的方法及应注意的问题。
书写热化学方程式基本方法
一写方程式—写出配平的化学方程式。
二标状态—用s、l、g、aq标明物质的聚集状态。
三标条件—标明反应的温度和压强(101 kPa、25 ℃时可不标注)。
四标ΔH—在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”。
五标数值—根据化学计量数计算并写出ΔH的值。
三、热化学方程式及书写
【例题分析】
3.写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为_______________________
(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是___________________________
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1
4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
三、热化学方程式及书写
【例题分析】
3.写出下列反应的热化学方程式。
(3)已知断开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________
(4)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化
如图所示,请写出该反应的热化学方程式:______________________________________________________________
N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
A2(g)+B2(g)=2AB(g) ΔH=+(a-b) kJ·mol-1
三、热化学方程式及书写
四、反应热的计算
【交流讨论】反应热可以分为多种,如燃烧热、中和热,在计算反应热时用到的方法都有哪些呢?
【思考】根据键能计算反应热的方法?
△H=反应物键能和-生成物键能和
△H= a-b kJ/mol
+为吸热,-为放热
【交流讨论】如何比较反应热大小?
1.比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。
2.参加反应的物质的量不同,则反应热的数值也会发生相应的变化
3.对于可逆反应,如3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3时放出92.4 kJ的热量。
4.同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)=O2(g) ΔH1=-Q1 kJ·mol-1;S(s)+O2(g)=SO2(g) ΔH2=-Q2 kJ·mol-1Q1>Q2、ΔH1<ΔH2。
5.中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。若酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。若为弱酸或弱碱时,因为电离过程吸热,此时生成1 mol H2O放出的热量小于57.3 kJ。
四、反应热的计算
【例题分析】
4.已知:CO2(g)+C(s)=2CO(g) ΔH1
C(s)+H2O(g)=CO(g)+H2(g) ΔH2
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3
CuO(s)+CO(g)=Cu(s)+CO2(g) ΔH4
2CuO(s)+C(s)=2Cu(s)+CO2(g) ΔH5
下列关于上述反应焓变的判断中不正确的是( )
A.ΔH1>0 B.ΔH2>0
C.ΔH2<ΔH3 D.ΔH5=2ΔH4+ΔH1
C
【解析】将以上方程式依次编号为①②③④⑤,②-③=①,则ΔH2-ΔH3=ΔH1>0,故ΔH2>ΔH3,④×2+①=⑤,ΔH5=2ΔH4+ΔH1
四、反应热的计算
五、盖斯定律及应用
【交流讨论】利用盖斯定律计算要注意哪些问题?
1.要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
2.可以利用方程式加和法求反应热,当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
3.将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
4.同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
【例题分析】
5.氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为_____kJ·mol-1。
114
【解析】将题给两个热化学方程式依次编号为①、②,根据盖斯定律,由①×3+②可得:4SiHCl3(g)=SiH4(g)+3SiCl4(g),则有ΔH=3ΔH1+ΔH2=3×48 kJ·mol-1+(-30 kJ·mol-1)=114 kJ·mol-1
五、盖斯定律及应用
【例题分析】
6.研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:反应Ⅰ2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)
ΔH1=+551 kJ·mol-1
反应Ⅲ S(s)+O2(g)=SO2(g)
ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
。
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1
【解析】由题图可知,反应Ⅱ的化学方程式为3SO2+2H2O=2H2SO4+S↓。根据盖斯定律,反应Ⅱ=-(反应Ⅰ+反应Ⅲ)可得:
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1。
五、盖斯定律及应用
课堂小结
课堂检测
1.下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的化学计量数无关
C
【解析】ΔH=生成物的总能量-反应物的总能量,ΔH>0时为吸热反应。
2.下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g) = 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量。
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2 ,则ΔH1<ΔH2
D
课堂检测
3.下列表述中正确的是( )
A.根据图甲可知合成甲醇的热化学方程式为
CO(g)+2H2(g)=CH3OH(g) ΔH1=(b-a)kJ·mol-1
B.图乙表示2 mol H2(g)所具有的能量比
2 mol气态水所具有的能量多483.6 kJ
C.1 mol NaOH分别和1 mol CH3COOH、
1 mol HNO3反应,后者比前者ΔH小
D.汽油燃烧时将全部的化学能转化为热能
C
【解析】由题图甲可知,合成甲醇的反应是放热反应,ΔH1=-(b-a)kJ·mol-1;
由题图乙知,2 mol H2(g)和1 mol O2(g)的总能量比2 mol气态水的能量高483.6 kJ。
课堂检测
4.已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=a kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1 H—H、O=O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.+350 B.+130 C.-332 D.-118
B
【解析】已知①C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1>0
②2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
①×2-②得:2H2O(g)=O2(g)+2H2(g) ΔH=(2a+220)kJ·mol-1>0,即4×462-496-2×436=2a+220,解得 a=+130。
课堂检测
5.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+2(1)O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1此反应的热化学方程式是
。
2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270kJ·mol-1
根据盖斯定律,由①×2-②得:
2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270 kJ·mol-1。
课堂检测
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
标准状况下,用3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的数目为_____,放出的热量为 kJ(用含有a和b的代数式表示)
0.3NA
3(2a+b)/80
根据盖斯定律,由①×2+②得:
4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1。
课堂检测
(3)用CH4催化还原NOx,也可以消除氮氧化物的污染。
例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?
若1 mol CH4还原NO2至N2的过程中放出的热量为867 kJ,
则ΔH2= 。
-1160 kJ·mol-1
根据盖斯定律,由①+②可得:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1+ΔH2,则(ΔH1+ΔH2)÷2=-867 kJ·mol-1,解之得ΔH2=-1 160 kJ·mol-1。
课堂检测
再 见
章末归纳与整理
第一章 化学反应的热效应
导入新课
化学反应中,由于反应物转变为生成物的过程中,经历了旧化学键的断裂和新化学键的形成过程,而断键要吸收能量,成键要释放能量。
【视频】此图为样图,如需使用此资源,请插入资源 “化学反应过程”。
一、化学反应中能量的变化的主要原因和表现形式
【交流讨论】用图示表示化学反应过程及能量变化的原因。
1. 化学反应中能量变化的原因:
(1)当反应物中化学键的断裂所吸收的能量大于形成生成物中的化学键所释放的能量时,该反应就要吸收能量;反之,该化学反应就会释放能量。
(2)当反应物的总能量大于生成物的总能量,该化学反应就会放出能量; 当生成物的总能量大于反应物的总能量,该化学反应就会吸收能量。
因此,一个化学反应是吸收能量还是放出能量,取决于反应物的总能量和生成物的总能量的相对大小,它与物质结构中的化学键的关系密切。
一、化学反应中能量的变化的主要原因和表现形式
2.化学反应热与反应条件无必然关系:
3.化学反应热与物质的稳定性关系:
(1)放热反应往往也需要加热。
(2)吸热反应常温下也能自发进行。
一个反应能否自发进行,主要看在通常环境下是否能达到该反应发生的条件。因此,不能根据反应条件判断一个反应是放热反应还是吸热反应。
化学反应热与物质的稳定性:物质的能量越低,该物质越稳定;物质的能量越高,该物质越不稳定。即A→B,ΔH<0,A具有的能量高于B,B的稳定性强于A。
一、化学反应中能量的变化的主要原因和表现形式
4. 图像在化学反应能量变化中的应用
【交流讨论】
根据下图(能量变化关系图)判断吸、放热反应
①A→B:ΔH>0;属于吸热反应。
②B→C:ΔH<0;属于放热反应。
一、化学反应中能量的变化的主要原因和表现形式
【例题分析】
1.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)=CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应物ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
C
解析:根据图示,该反应反应物的总能量大于生成物的总能量,是放热反应;加入催化剂对反应热无影响;生成液态CH3OH时释放出的热量更多,ΔH更小。
一、化学反应中能量的变化的主要原因和表现形式
二、化学反应的热效应
【交流讨论】焓变、反应热、燃烧热、中和热基本概念如何理解?有哪些区别?
生成物与反应物的焓值差
化学反应体系向环境释放或从环境吸收的热量
在101 kPa时,l mol纯物质完全燃烧生成指定产物时所放出的热量
在稀溶液中,强酸和强碱发生中和反应生成1mol 水所放出的热量
在等压条件下进,如果反应中物质的能量变化全部转化为热能,则该反应的反应热就为焓变
都是反应热,都是放热反应,△H<0
不同含义两个的概念
1mol燃烧物
生成1mol水,是固定值
焓变 反应热 燃烧热 中和热
含义
联系 区别
三、热化学方程式及书写
【交流讨论】书写或进行热化学方程式正误的判断要注意哪些问题?
判断热化学方程式时应注意以下问题
1.检查ΔH符号的正误。
2.检查是否注明物质的聚集状态。
3.检查ΔH的数值与化学计量数是否对应。
4.特殊反应热,如燃烧热。
【例题分析】
2.下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:
2C(石墨,s)+O2(g)=2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l)=2H2(g)+O2(g) 的ΔH=+572 kJ·mol-1
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
C
【解析】合成氨的反应是可逆反应,反应不能进行到底。
三、热化学方程式及书写
【交流讨论】书写热化学方程式的方法及应注意的问题。
书写热化学方程式基本方法
一写方程式—写出配平的化学方程式。
二标状态—用s、l、g、aq标明物质的聚集状态。
三标条件—标明反应的温度和压强(101 kPa、25 ℃时可不标注)。
四标ΔH—在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”。
五标数值—根据化学计量数计算并写出ΔH的值。
三、热化学方程式及书写
【例题分析】
3.写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为_______________________
(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是___________________________
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1
4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
三、热化学方程式及书写
【例题分析】
3.写出下列反应的热化学方程式。
(3)已知断开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________
(4)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化
如图所示,请写出该反应的热化学方程式:______________________________________________________________
N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
A2(g)+B2(g)=2AB(g) ΔH=+(a-b) kJ·mol-1
三、热化学方程式及书写
四、反应热的计算
【交流讨论】反应热可以分为多种,如燃烧热、中和热,在计算反应热时用到的方法都有哪些呢?
【思考】根据键能计算反应热的方法?
△H=反应物键能和-生成物键能和
△H= a-b kJ/mol
+为吸热,-为放热
【交流讨论】如何比较反应热大小?
1.比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。
2.参加反应的物质的量不同,则反应热的数值也会发生相应的变化
3.对于可逆反应,如3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3时放出92.4 kJ的热量。
4.同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)=O2(g) ΔH1=-Q1 kJ·mol-1;S(s)+O2(g)=SO2(g) ΔH2=-Q2 kJ·mol-1Q1>Q2、ΔH1<ΔH2。
5.中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。若酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。若为弱酸或弱碱时,因为电离过程吸热,此时生成1 mol H2O放出的热量小于57.3 kJ。
四、反应热的计算
【例题分析】
4.已知:CO2(g)+C(s)=2CO(g) ΔH1
C(s)+H2O(g)=CO(g)+H2(g) ΔH2
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3
CuO(s)+CO(g)=Cu(s)+CO2(g) ΔH4
2CuO(s)+C(s)=2Cu(s)+CO2(g) ΔH5
下列关于上述反应焓变的判断中不正确的是( )
A.ΔH1>0 B.ΔH2>0
C.ΔH2<ΔH3 D.ΔH5=2ΔH4+ΔH1
C
【解析】将以上方程式依次编号为①②③④⑤,②-③=①,则ΔH2-ΔH3=ΔH1>0,故ΔH2>ΔH3,④×2+①=⑤,ΔH5=2ΔH4+ΔH1
四、反应热的计算
五、盖斯定律及应用
【交流讨论】利用盖斯定律计算要注意哪些问题?
1.要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
2.可以利用方程式加和法求反应热,当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
3.将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
4.同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
【例题分析】
5.氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为_____kJ·mol-1。
114
【解析】将题给两个热化学方程式依次编号为①、②,根据盖斯定律,由①×3+②可得:4SiHCl3(g)=SiH4(g)+3SiCl4(g),则有ΔH=3ΔH1+ΔH2=3×48 kJ·mol-1+(-30 kJ·mol-1)=114 kJ·mol-1
五、盖斯定律及应用
【例题分析】
6.研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:反应Ⅰ2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)
ΔH1=+551 kJ·mol-1
反应Ⅲ S(s)+O2(g)=SO2(g)
ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
。
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1
【解析】由题图可知,反应Ⅱ的化学方程式为3SO2+2H2O=2H2SO4+S↓。根据盖斯定律,反应Ⅱ=-(反应Ⅰ+反应Ⅲ)可得:
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1。
五、盖斯定律及应用
课堂小结
课堂检测
1.下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的化学计量数无关
C
【解析】ΔH=生成物的总能量-反应物的总能量,ΔH>0时为吸热反应。
2.下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g) = 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量。
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2 ,则ΔH1<ΔH2
D
课堂检测
3.下列表述中正确的是( )
A.根据图甲可知合成甲醇的热化学方程式为
CO(g)+2H2(g)=CH3OH(g) ΔH1=(b-a)kJ·mol-1
B.图乙表示2 mol H2(g)所具有的能量比
2 mol气态水所具有的能量多483.6 kJ
C.1 mol NaOH分别和1 mol CH3COOH、
1 mol HNO3反应,后者比前者ΔH小
D.汽油燃烧时将全部的化学能转化为热能
C
【解析】由题图甲可知,合成甲醇的反应是放热反应,ΔH1=-(b-a)kJ·mol-1;
由题图乙知,2 mol H2(g)和1 mol O2(g)的总能量比2 mol气态水的能量高483.6 kJ。
课堂检测
4.已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=a kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1 H—H、O=O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.+350 B.+130 C.-332 D.-118
B
【解析】已知①C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1>0
②2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
①×2-②得:2H2O(g)=O2(g)+2H2(g) ΔH=(2a+220)kJ·mol-1>0,即4×462-496-2×436=2a+220,解得 a=+130。
课堂检测
5.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+2(1)O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1此反应的热化学方程式是
。
2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270kJ·mol-1
根据盖斯定律,由①×2-②得:
2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH=-270 kJ·mol-1。
课堂检测
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
标准状况下,用3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的数目为_____,放出的热量为 kJ(用含有a和b的代数式表示)
0.3NA
3(2a+b)/80
根据盖斯定律,由①×2+②得:
4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1。
课堂检测
(3)用CH4催化还原NOx,也可以消除氮氧化物的污染。
例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?
若1 mol CH4还原NO2至N2的过程中放出的热量为867 kJ,
则ΔH2= 。
-1160 kJ·mol-1
根据盖斯定律,由①+②可得:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1+ΔH2,则(ΔH1+ΔH2)÷2=-867 kJ·mol-1,解之得ΔH2=-1 160 kJ·mol-1。
课堂检测
再 见
