微专题 化学平衡图像(共28张PPT)
文档属性
| 名称 | 微专题 化学平衡图像(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 501.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 14:02:58 | ||
图片预览






文档简介
(共28张PPT)
微专题 化学平衡图像
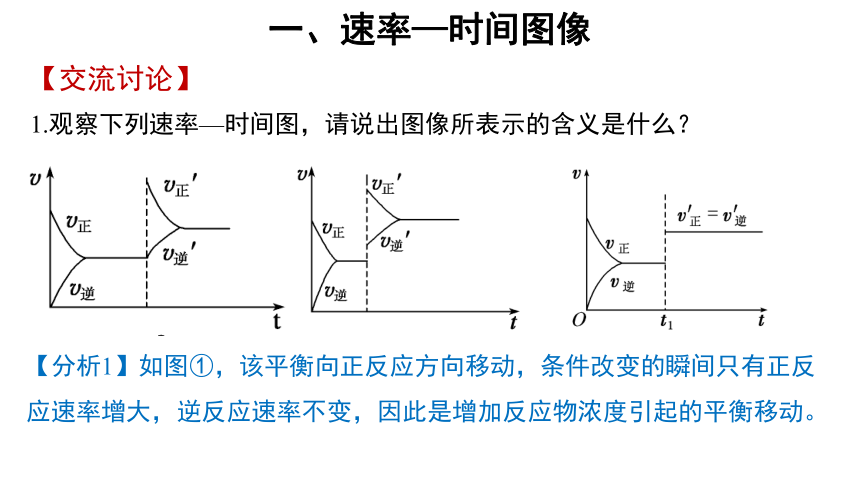
一、速率—时间图像
【交流讨论】
1.观察下列速率—时间图,请说出图像所表示的含义是什么?
【分析1】如图①,该平衡向正反应方向移动,条件改变的瞬间只有正反应速率增大,逆反应速率不变,因此是增加反应物浓度引起的平衡移动。
【分析2】如图②,该平衡向正反应方向移动,条件改变的瞬间正逆反应速率都增大,可能是升高温度或怎大压强引起的平衡移动,如果是升高温度,则该反应的正反应是吸热反应;如果是增大压强引起的平衡移动,则该反应的正反应是气体体积减小的反应。
【交流讨论】
【分析3】如图③,该平衡不移动,条件改变的瞬间正逆反应速率都增大,可能是加入催化剂或增大压强,如果是增大压强,则该反应是气体体积不变的反应。
一、速率—时间图像
【课堂练习】
1.对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( )
C
一、速率—时间图像
2.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:
下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
【课堂练习】
B
一、速率—时间图像
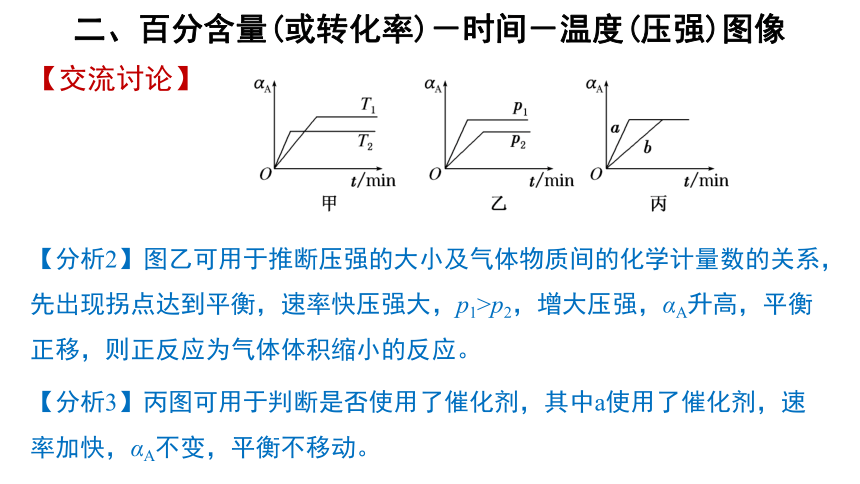
二、百分含量(或转化率)-时间-温度(压强)图像
【交流讨论】
反应A(g)+B(g)→C(g)中(αA为反应物的转化率),已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线如下图所示:
通过图像分析,你能得出什么结论?
【分析1】图甲可用于推断温度的高低及反应的热效应中,T2先出现拐点达到平衡,速率快,温度高,T2>T1,升高温度,αA降低,平衡逆移,正反应为放热反应。
【交流讨论】
【分析2】图乙可用于推断压强的大小及气体物质间的化学计量数的关系,先出现拐点达到平衡,速率快压强大,p1>p2,增大压强,αA升高,平衡正移,则正反应为气体体积缩小的反应。
【分析3】丙图可用于判断是否使用了催化剂,其中a使用了催化剂,速率加快,αA不变,平衡不移动。
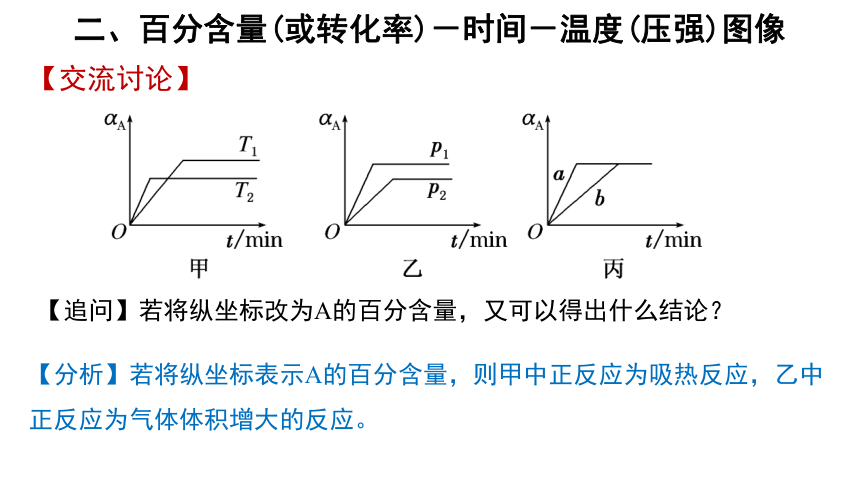
二、百分含量(或转化率)-时间-温度(压强)图像
【交流讨论】
【追问】若将纵坐标改为A的百分含量,又可以得出什么结论?
【分析】若将纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
二、百分含量(或转化率)-时间-温度(压强)图像
对于反应mA(g)+nB(g) eC(g)+fD(g),m+n>e+f且ΔH>0。有c-t(浓度—时间)图像。若通入一定量的反应物,从反应开始到反应达平衡后,若在不同压强(p1>p2)或不同温度(T1>T2)条件下(其他条件均不变),产物C的浓度将如何变化?请在图4和图5中补充画出产物C的浓度与时间图像(同时标注对应温度或压强)。
【交流讨论】
二、百分含量(或转化率)-时间-温度(压强)图像
【总结】解答这类图像题的解题方法是什么?
【分析】“先拐先平,数值大”原则:分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。
例(C%指产物的质量分数,B%指某反应物的质量分数)
二、百分含量(或转化率)-时间-温度(压强)图像
3.已知可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ/mol,若反应物的起始物质的量相同,下列关于该反应的示意图不正确的是( )
【课堂练习】
C
二、百分含量(或转化率)-时间-温度(压强)图像
【课堂练习】
4.一定条件下,下列反应中水蒸气含量
随反应时间的变化趋势符合如图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g) CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+ 2H2O(g) ΔH<0
A
二、百分含量(或转化率)-时间-温度(压强)图像
三、等温线(或等压线)图像
【交流讨论】
反应mA(g)+nB(g)→pC(g)中(αA为反应物的转化率),已知不同温度下的转化率-压强图像甲和不同压强下的转化率-温度图像乙,通过图像分析,你能得出什么结论?
【分析1】图甲曲线为等温线即同一曲线上各点温度相同,由图可知,温度不变,增大压强,反应物A的转化率αA增大,平衡正向移动,则有m+n>p;做一条平行于纵轴的辅助线,即沿辅助线方向,压强不变,升高温度,反应物A的转化率αA减小,平衡逆向移动,可知正向放热,逆向吸热。
【交流讨论】
【分析2】图乙曲线为等压线即同一曲线上各点压强相同,由图可知,压强不变,升高温度,反应物A的转化率αA减小,平衡逆向移动,可知正向放热,逆向吸热;做一条平行于纵轴的辅助线,即沿辅助线方向,温度不变,增大压强,反应物A的转化率αA增大,平衡正向移动,则有m+n>p。
三、等温线(或等压线)图像
【总结】如何解答这类有三个变量的图像?
“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。
如甲中任取一条温度曲线研究,压强增大,αA增大,平衡正移,正反应为气体体积减小的反应,乙中任取横坐标一点作横坐标垂直线,也能得出结论。
三、等温线(或等压线)图像
5.有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+nC.正反应是放热反应;m+nD.正反应是吸热反应;m+n>p+q
【课堂练习】
D
三、等温线(或等压线)图像
6.如图是温度和压强对反应X+Y 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A.X、Y、Z均为气态
B.恒容时,混合气体的密度可作为
此反应是否达到化学平衡状态的判断依据
C.升高温度时正反应速率增大,
逆反应速率减小,平衡向右移动
D.使用催化剂Z的产率提高
【课堂练习】
B
三、等温线(或等压线)图像
四、几种特殊图像
【交流讨论】
1.对于化学反应mA(g)+nB(g) pC(g)+qD(g),有下列图像,请分析图像的特点及含义?
【分析1】M点前,表示化学反应从反应物开始,则v正 >v逆;M点为刚达到的平衡点。M点后为平衡受温度的影响情况,即升温,A%增大(C%减小),平衡左移,ΔH<0。
2.对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。请分析图像的特点及含义?
【交流讨论】
【分析2】左上方(E点),A%大于此压强时平衡体系中的A%,E点必须朝正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正四、几种特殊图像
【分析1】1.化学平衡图像题的解答步骤。
①看图像:一看面(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
五、解答化学平衡图像题的的步骤和原则
【分析2】2.化学平衡图像题的解答原则。
以可逆反应aA(g)+bB(g) cC(g)为例说明。
①“定一议二”原则:在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个物理量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系和确定纵坐标所表示的量,讨论横坐标与曲线的关系。
五、解答化学平衡图像题的的步骤和原则
②“先拐先平,数值大”原则:在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。
图A表示T2>T1,正反应是放热反应。
图B表示p1<p2,A是反应物,正反应为气体总体积缩小的反应,即a+b>c。
以可逆反应aA(g)+bB(g) cC(g)为例说明
五、解答化学平衡图像题的的步骤和原则
课堂检测
1.右图是可逆反应A+2B 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( )
A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
B
2.同压、不同温度下的反应:A(g)+B(g) C(g),A的含量和温度的关系如图所示,下列结论正确的是( )
T1>T2,正反应吸热
B.T1<T2,正反应吸热
C.T1>T2,正反应放热
D.T1<T2,正反应放热
C
课堂检测
3.可逆反应2SO2+O2 2SO3ΔH<0,在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如图所示。下列说法正确的是( )
A.维持温度、反应体系容积不变,t1时充入SO3(g)
B.维持温度、压强不变,t1时充入SO3(g)
C.维持体积不变,t1时升高反应体系温度
D.维持温度、容积不变,t1时充入一定量Ar
B
课堂检测
4.在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)ΔH=﹣57 kJ mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
B
课堂检测
5. 如图表示反应M(g)+P(g) nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是( )
A.通过分析上图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)C.在T1、D状态时,v正D.在T2、B状态时,改变体积始终有v正=v逆,则n=2
C
课堂检测
再 见
微专题 化学平衡图像
一、速率—时间图像
【交流讨论】
1.观察下列速率—时间图,请说出图像所表示的含义是什么?
【分析1】如图①,该平衡向正反应方向移动,条件改变的瞬间只有正反应速率增大,逆反应速率不变,因此是增加反应物浓度引起的平衡移动。
【分析2】如图②,该平衡向正反应方向移动,条件改变的瞬间正逆反应速率都增大,可能是升高温度或怎大压强引起的平衡移动,如果是升高温度,则该反应的正反应是吸热反应;如果是增大压强引起的平衡移动,则该反应的正反应是气体体积减小的反应。
【交流讨论】
【分析3】如图③,该平衡不移动,条件改变的瞬间正逆反应速率都增大,可能是加入催化剂或增大压强,如果是增大压强,则该反应是气体体积不变的反应。
一、速率—时间图像
【课堂练习】
1.对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( )
C
一、速率—时间图像
2.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:
下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
【课堂练习】
B
一、速率—时间图像
二、百分含量(或转化率)-时间-温度(压强)图像
【交流讨论】
反应A(g)+B(g)→C(g)中(αA为反应物的转化率),已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线如下图所示:
通过图像分析,你能得出什么结论?
【分析1】图甲可用于推断温度的高低及反应的热效应中,T2先出现拐点达到平衡,速率快,温度高,T2>T1,升高温度,αA降低,平衡逆移,正反应为放热反应。
【交流讨论】
【分析2】图乙可用于推断压强的大小及气体物质间的化学计量数的关系,先出现拐点达到平衡,速率快压强大,p1>p2,增大压强,αA升高,平衡正移,则正反应为气体体积缩小的反应。
【分析3】丙图可用于判断是否使用了催化剂,其中a使用了催化剂,速率加快,αA不变,平衡不移动。
二、百分含量(或转化率)-时间-温度(压强)图像
【交流讨论】
【追问】若将纵坐标改为A的百分含量,又可以得出什么结论?
【分析】若将纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
二、百分含量(或转化率)-时间-温度(压强)图像
对于反应mA(g)+nB(g) eC(g)+fD(g),m+n>e+f且ΔH>0。有c-t(浓度—时间)图像。若通入一定量的反应物,从反应开始到反应达平衡后,若在不同压强(p1>p2)或不同温度(T1>T2)条件下(其他条件均不变),产物C的浓度将如何变化?请在图4和图5中补充画出产物C的浓度与时间图像(同时标注对应温度或压强)。
【交流讨论】
二、百分含量(或转化率)-时间-温度(压强)图像
【总结】解答这类图像题的解题方法是什么?
【分析】“先拐先平,数值大”原则:分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。
例(C%指产物的质量分数,B%指某反应物的质量分数)
二、百分含量(或转化率)-时间-温度(压强)图像
3.已知可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ/mol,若反应物的起始物质的量相同,下列关于该反应的示意图不正确的是( )
【课堂练习】
C
二、百分含量(或转化率)-时间-温度(压强)图像
【课堂练习】
4.一定条件下,下列反应中水蒸气含量
随反应时间的变化趋势符合如图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g) CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+ 2H2O(g) ΔH<0
A
二、百分含量(或转化率)-时间-温度(压强)图像
三、等温线(或等压线)图像
【交流讨论】
反应mA(g)+nB(g)→pC(g)中(αA为反应物的转化率),已知不同温度下的转化率-压强图像甲和不同压强下的转化率-温度图像乙,通过图像分析,你能得出什么结论?
【分析1】图甲曲线为等温线即同一曲线上各点温度相同,由图可知,温度不变,增大压强,反应物A的转化率αA增大,平衡正向移动,则有m+n>p;做一条平行于纵轴的辅助线,即沿辅助线方向,压强不变,升高温度,反应物A的转化率αA减小,平衡逆向移动,可知正向放热,逆向吸热。
【交流讨论】
【分析2】图乙曲线为等压线即同一曲线上各点压强相同,由图可知,压强不变,升高温度,反应物A的转化率αA减小,平衡逆向移动,可知正向放热,逆向吸热;做一条平行于纵轴的辅助线,即沿辅助线方向,温度不变,增大压强,反应物A的转化率αA增大,平衡正向移动,则有m+n>p。
三、等温线(或等压线)图像
【总结】如何解答这类有三个变量的图像?
“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。
如甲中任取一条温度曲线研究,压强增大,αA增大,平衡正移,正反应为气体体积减小的反应,乙中任取横坐标一点作横坐标垂直线,也能得出结论。
三、等温线(或等压线)图像
5.有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n
【课堂练习】
D
三、等温线(或等压线)图像
6.如图是温度和压强对反应X+Y 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A.X、Y、Z均为气态
B.恒容时,混合气体的密度可作为
此反应是否达到化学平衡状态的判断依据
C.升高温度时正反应速率增大,
逆反应速率减小,平衡向右移动
D.使用催化剂Z的产率提高
【课堂练习】
B
三、等温线(或等压线)图像
四、几种特殊图像
【交流讨论】
1.对于化学反应mA(g)+nB(g) pC(g)+qD(g),有下列图像,请分析图像的特点及含义?
【分析1】M点前,表示化学反应从反应物开始,则v正 >v逆;M点为刚达到的平衡点。M点后为平衡受温度的影响情况,即升温,A%增大(C%减小),平衡左移,ΔH<0。
2.对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。请分析图像的特点及含义?
【交流讨论】
【分析2】左上方(E点),A%大于此压强时平衡体系中的A%,E点必须朝正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正
【分析1】1.化学平衡图像题的解答步骤。
①看图像:一看面(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
五、解答化学平衡图像题的的步骤和原则
【分析2】2.化学平衡图像题的解答原则。
以可逆反应aA(g)+bB(g) cC(g)为例说明。
①“定一议二”原则:在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个物理量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系和确定纵坐标所表示的量,讨论横坐标与曲线的关系。
五、解答化学平衡图像题的的步骤和原则
②“先拐先平,数值大”原则:在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。
图A表示T2>T1,正反应是放热反应。
图B表示p1<p2,A是反应物,正反应为气体总体积缩小的反应,即a+b>c。
以可逆反应aA(g)+bB(g) cC(g)为例说明
五、解答化学平衡图像题的的步骤和原则
课堂检测
1.右图是可逆反应A+2B 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( )
A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
B
2.同压、不同温度下的反应:A(g)+B(g) C(g),A的含量和温度的关系如图所示,下列结论正确的是( )
T1>T2,正反应吸热
B.T1<T2,正反应吸热
C.T1>T2,正反应放热
D.T1<T2,正反应放热
C
课堂检测
3.可逆反应2SO2+O2 2SO3ΔH<0,在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如图所示。下列说法正确的是( )
A.维持温度、反应体系容积不变,t1时充入SO3(g)
B.维持温度、压强不变,t1时充入SO3(g)
C.维持体积不变,t1时升高反应体系温度
D.维持温度、容积不变,t1时充入一定量Ar
B
课堂检测
4.在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)ΔH=﹣57 kJ mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
B
课堂检测
5. 如图表示反应M(g)+P(g) nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是( )
A.通过分析上图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)
C
课堂检测
再 见
