第一章从实验学化学_单元检测题(含答案解析)
文档属性
| 名称 | 第一章从实验学化学_单元检测题(含答案解析) |  | |
| 格式 | zip | ||
| 文件大小 | 251.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-14 14:50:20 | ||
图片预览



文档简介
从实验学化学——单元检测题
一、选择题(本题共20小题,每题2分,共40分,每道题有且只有一个正确选项)
1、在盛放酒精的试剂瓶的标签上应印有的警示标志是( )
A B C D
2、下列化学实验操作或事故处理方法不正确的是
A.碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液
B.浓硫酸沾到皮肤上时,可立即用湿抹布冲洗,然后涂上3%~5%的NaHCO3溶液
C.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
3、检验某未知溶液中是否含有氯离子(Cl-),正确的操作是(???)
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
4、下列对于“摩尔”的理解正确的是(?? )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
5、下列叙述正确的是(?? )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
6、下列有关阿佛加德罗常数(NA)的说法错误的是(?? ) A.32克O2所含的原子数目为NA? ? ? ? ? ? ? ?21教育网
B.0.5molH2O含有的原子数目为1.5NA C.1molH2O含有的H2O分子数目为NA??????????21·cn·jy·com
D.0.5NA个氯气分子的物质的量是0.5mol
7、除去下列括号内杂质的试剂或方法错误的是(???) A.N2(O2):通过灼热的镁粉? ? ? ? ? ? ? ? ? ? ? ?www-2-1-cnjy-com
B.SiO2(Fe2O3):足量的盐酸,过滤 C.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气???????????【来源:21·世纪·教育·网】
D.C2H5OH(CH3COOH):加足量CaO,蒸馏
8、通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是(???) A.硝酸钠?? ?氢氧化钠???????????2-1-c-n-j-y
B.氧化铜???? 二氧化锰 C.氯化钾??? 碳酸钙? ? ? ? ? ? ?
D.硫酸铜???? 氢氧化钠
9、在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高(?? ) A.所用NaOH已经潮解? ? ? ? ? ? ? ? ? ? ?
B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水定容时俯视???????????
D.称量时误用“左码右物”
10、在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
A.气体甲可能为CO2或者SO2
B.沉淀丙中一定含有BaCO3,可能含有BaSO4
C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42—
D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。
11、实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是(?? ) A.950mL,111.2g???????????
B.500mL,117g???????????
C.1000mL,117g???????????
D.任意规格,111.2g?
12、某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为(?? ) A.6.25mol/L???????????
B.12.5mol/L???????????
C.7mol/L???????????
D.7.5mol/L? ??
13、将VLHCl气体(STP)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为(?? )
A.V/22400mol/L???????????
B.1000V/22.4mol/L???????????
C.V/22.4mol/L???????????
D.V/11.2mol/L??
14、2molCl2和2molCO2相比较,下列叙述中正确的是(?? )
A.分子数相等???????????
B.原子数相等???????????
C.体积相等???????????
D.质量相等?
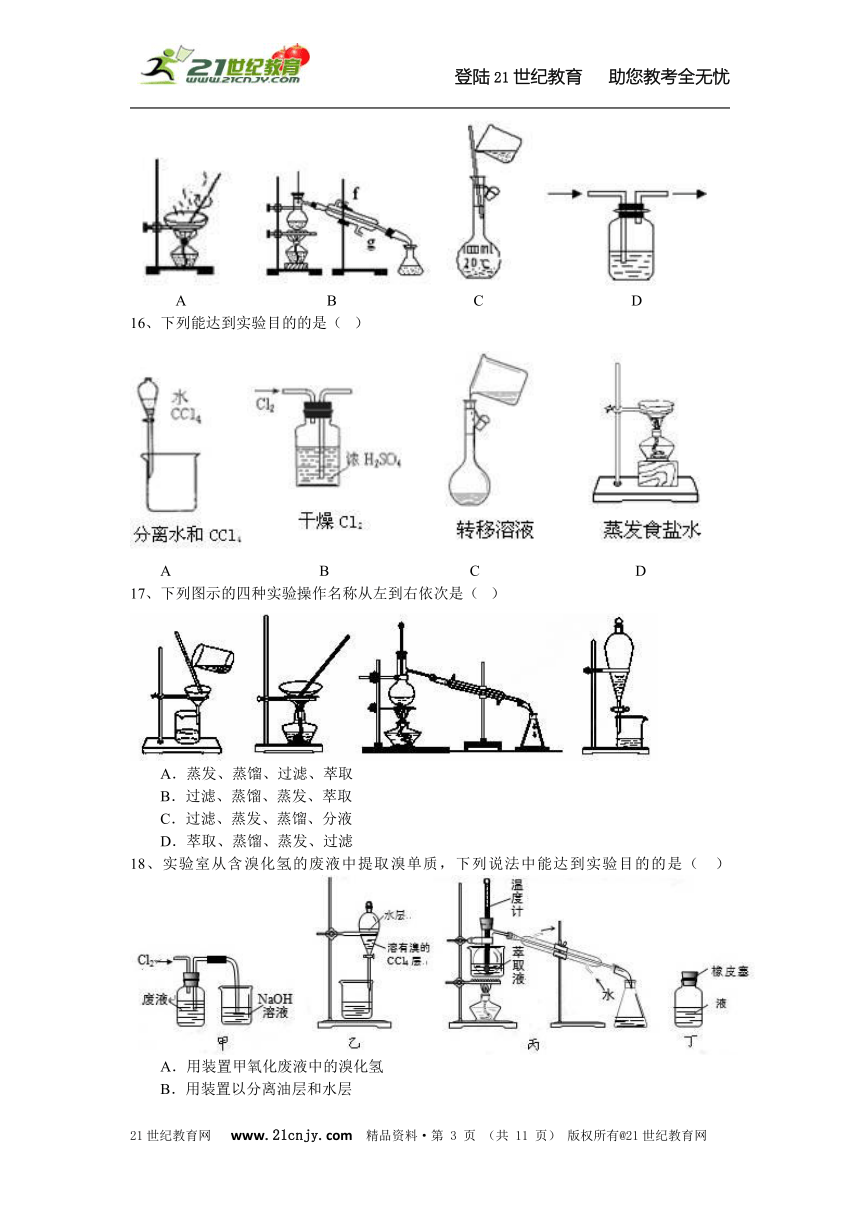
15、以下实验装置一般不用于分离物质的是(???)
A?????????? ?B????????? ?C???????? ???D? ? ? ? ??
16、下列能达到实验目的的是(???)
A??????? ????B?????????? ?C??????????? D? ? ? ??
17、下列图示的四种实验操作名称从左到右依次是(???)
A.蒸发、蒸馏、过滤、萃取???????????
B.过滤、蒸馏、蒸发、萃取 C.过滤、蒸发、蒸馏、分液???????????
D.萃取、蒸馏、蒸发、过滤
18、实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是(???)
A.用装置甲氧化废液中的溴化氢???????????
B.用装置以分离油层和水层 C.用装置甲分离四氯化碳和液溴???????????
D.用仪器丁密封存放单质溴
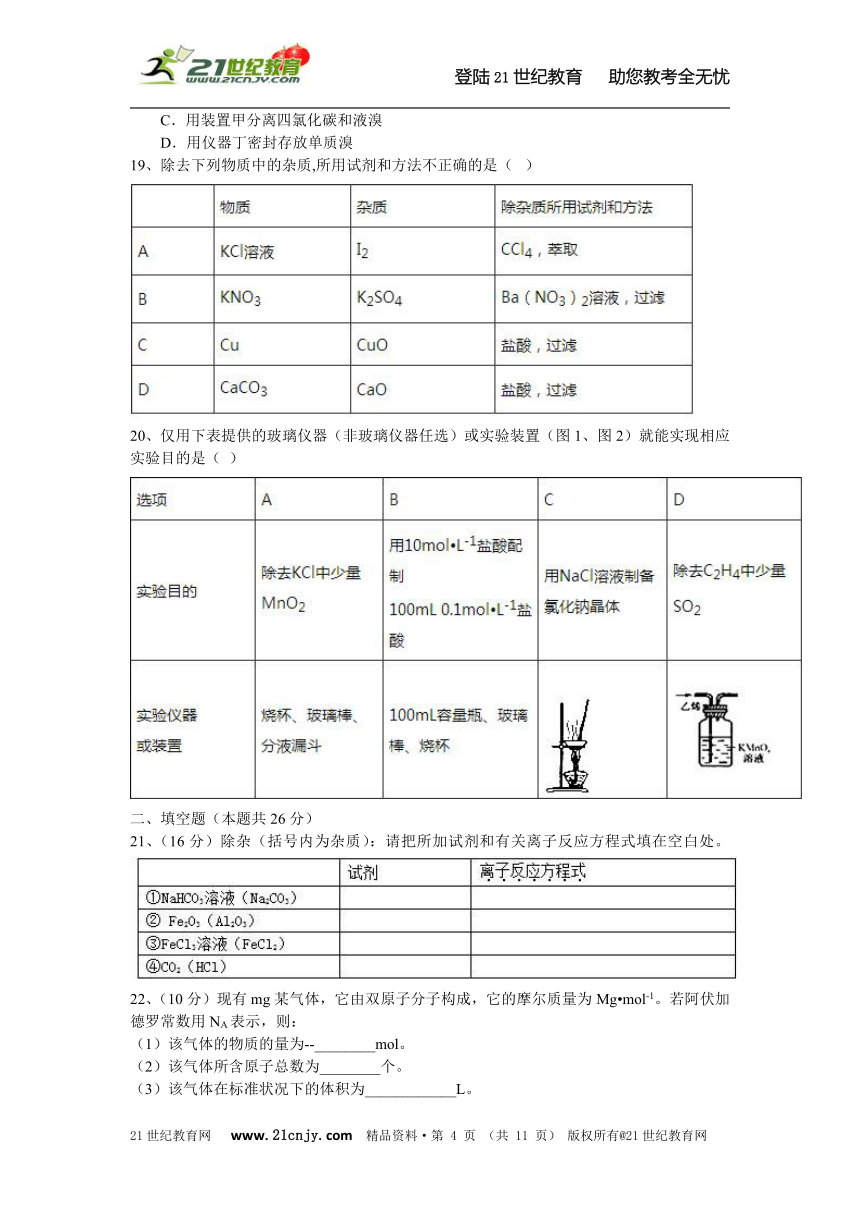
19、除去下列物质中的杂质,所用试剂和方法不正确的是(???)
20、仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是(??)21cnjy.com
二、填空题(本题共26分)
21、(16分)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
22、(10分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg?mol-1。若阿伏加德罗常数用NA表示,则: (1)该气体的物质的量为--________mol。 (2)该气体所含原子总数为________个。 (3)该气体在标准状况下的体积为____________L。 (4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为________。 (5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________g?mol-1。
三、实验题(本题共24分)
23、(12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:
①加入稍过量的BaCl2溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的Na2CO3溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,包含以下操作步骤:①固定铁圈位置;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③放置酒精灯;④加热搅拌;⑤停止加热。其正确的操作顺序为___ __。
(2)如何运用最简单方法检验粗盐的提纯步骤①后溶液中有无S?
?_________________________________________________________________。
(3)步骤③加入稍过量的Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是??______________________________。www.21-cn-jy.com
(4)步骤④为过滤操作。请问这一操作能除掉哪些杂质??__________________
?_________________________________________________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的作用分别是:?_____________________________________________。
24、(12分)实验室配制0.1 mol·L-1的BaCl2溶液分成两个阶段:
第一阶段:用托盘天平称取5.2 g无水BaCl2晶体。
第二阶段:溶解配制成0.1 mol·L-1的BaCl2溶液。
第一阶段操作有如下几步:
A.将游码拨至0.2 g处;
B.将游码拨至“0”处;
C.在天平的两边托盘上各放一张干净等质量的滤纸,调节天平两边螺丝使天平平衡;
D.取走药品,将砝码放回砝码盒内;
E.往左盘内逐步添加晶体至天平平衡;
F.在右盘放置5 g砝码。
(1)其正确的操作顺序是(填序号)B→C____________________________________________。
(2)进行E操作时,只缺少量晶体,则正确操作是___________________________。
(3)第二阶段操作,应先将5.2 g BaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有____ _________________,然后将溶液转入________中,再洗涤、________、摇匀后即可得到0.1 mol·L-1BaCl2溶液(填选项字母)。21世纪教育网版权所有
(4)下列操作使配制的BaCl2溶液浓度偏低的有________。
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
四、计算题(本题共10分)
25、常温下,在30.6g水中溶解15g CuSO4·5H2O恰好达到饱和,该溶液的密度为1.2g/cm-3,求:21·世纪*教育网
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度(保留两位有效数字)
(3)取出20mL 该溶液,配成浓度为0.2 mol?L-1的稀溶液,则稀释后溶液的体积为多少毫升?【来源:21cnj*y.co*m】
参考答案及解析
3、C
【解析】
Cl-检验是要先向溶液中加入稀硝酸酸化,排除一些干扰离子,再加入AgNO3溶液,,如果有白色沉淀产生说明有Cl-。 21*cnjy*com
4、B
【解析】
A.物质的量是国际科学界建议采用的一种物理量,单位是mol,故A错误;? B.摩尔是物质的量的单位,简称摩,符号为mol,故B正确; C.摩尔质量的单位是g/mol,HNO?3?的摩尔质量是63g/mol,故C错误; D.碳原子指含有6个质子6个中子的原子,本选项未明确,故D错误.
5、D
【解析】
A、同温同压下,相同体积的气体,其物质的量一定相等,不是气体物质的量不一定相等,故A错误; B、等体积的甲烷和一氧化碳所处的状态相同,含有相同的分子数,烷和一氧化碳所处的状态不一定相同,所含分子数不一定相同,故B错误; C、1L一氧化碳气体与1L氧气所处的状态相同,1L一氧化碳气体一定比1L氧气的质量小,但二者所处的状态不一定相同,因此1L一氧化碳气体与1L氧气的质量关系无法确定,或大或小或相等都有可能,故C错误; D、相同条件下的一氧化碳气体和氮气,若体积相等,则物质的量相等,二者摩尔质量相等,则质量一定相等,故D正确.【版权所有:21教育】
6、A
【解析】
A、32克O2物质的量为1mol,所含的原子数目为2NA,故A错误;
7、A
【解析】
A.N2和O2都可以与灼热的镁粉发生反应,应该用灼热的Cu粉,错误;
B.SiO2是酸性氧化物,杂质Fe2O3是碱性氧化物,前者不能与盐酸发生反应,后者发生反应产生可溶性的物质,因此加足量的盐酸,过滤就可以达到除杂的目的,正确;
C.SO2有还原性,能够与有强氧化性的物质酸性KMnO4溶液发生反应变为硫酸,而CO2不能发生反应,因此用浓硫酸酸性KMnO4溶液洗气,在用浓硫酸干燥,就可以得到纯净的CO2气体,正确;21教育名师原创作品
D.C2H5OH是中性物质,杂质CH3COOH是酸性物质,可以与碱性氧化物CaO发生反应变为离子化合物——盐,然后利用二者沸点的不同,通过蒸馏分离提纯得到乙醇,正确。
【解析】和盐酸反应生成气体的只有CO32—和SO32—,即二者至少含有一种。溶液甲中一定含有盐酸,因此加入NH4HCO3溶液会生成二氧化碳气体,乙是CO2,则甲就是SO2。所以一定含有SO32—,则Fe3+、Ag+、Ba2+就没有,那么K+就一定含有。能与NH4HCO3溶液反应生成沉淀的只有AlO2—,沉淀是氢氧化铝,所以一定含有AlO2—。由于溶液乙中含有NH4HCO3,所以当加入过量Ba(OH)2溶液并加热时一定会生成氨气和碳酸钡沉淀。即丙是氨气,沉淀不一定含有硫酸钡,即无法确定原溶液中是否含有SO42—。
11、C
【解析】
配制2mol/l的nacl溶液1000ml需氯化钠的质量为:2mol/l×1l×58.5g/mol═117.0g.
12、A
【解析】
设蒸发后溶液的质量是m。由于在蒸发过程中,溶质是不变的。所以(100g+m)×10%=m×20%,解得m=100g,因此80ml溶液中氢氧化钠的质量是20g,物质的量是0.5mol,所以氢氧化钠的浓度是0.5mol÷0.08l=6.25mol/l,答案选A。【出处:21教育名师】
13、C
【解析】
标准状况下Vm=22.4L/mol,HCl的物质的量为VL/22.4L/mol=V/22.4mol,1000mL盐酸溶液,即溶液的体积为1L,则该盐酸的物质的量浓度为V/22.4mol/1L?=V/22.4mol/L,
14、A
【解析】
A.由n=N/NA可知,分子数相等,故A正确; B.两种分子含有的原子数不同,分子数相同,则原子数不同,故B错误; C.由于不能确定气体存在的条件是否相同,则不能确定体积大小,故C错误; D.由于两种气体的摩尔质量不同,则质量不同,故D错误.21*cnjy*com
15、C
【解析】
A.为蒸发装置,可用来分离可溶性固体和水,错误;B.为蒸馏操作,可用来分离沸点不同的物质,错误;C.为配制一定物质的量浓度的溶液的操作,不用于分离物质,正确;D.为洗气装置,可用来除去气体杂质,错误。
16、A
【解析】
A是分液操作,正确;干燥氯气时氯气要从长导管进,B错;往容量瓶中加溶液要用玻璃棒引流,C错;加热蒸发要用玻璃棒搅拌,D错。2·1·c·n·j·y
A.由于Cl2有强的氧化性,会把HBr中的溴元素氧化为Br2,为使物质充分发生反应,应该把导气管伸入到液面一下,故不能用装置甲氧化废液中的溴化氢,错误;B.由于水的密度比四氯化碳小,二者是互不相溶的两种液体物质,因此可以用分液的方法分离,正确;C.四氯化碳和液溴是沸点不同的互溶的两种液态物质,用蒸馏的方法分离时,一个把温度计的水银球放在蒸馏烧瓶的支管口附近,不能在液面一下,因此不能用装置丙分离四氯化碳和液溴,错误;D.溴容易挥发,在保存时常加些水形成水封,由于溴有强的氧化性,会与橡胶发生反应,所以应该使用玻璃塞密封保存在,并加水形成水封,错误。
19、D
【解析】
A、碘在四氯化碳中的溶解度大于在水中的溶解度,可以用萃取的方法除去氯化钾中的碘,故A正确; B、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,可以除去硫酸根离子,故B正确; C、氧化铜和盐酸反应生成氯化铜和水,而金属铜不反应,过滤即可获得金属铜,故C正确; D、碳酸钙和氧化钙均可以和盐酸反应生成氯化钙,故不能用盐酸来除碳酸钙中的氧化钙,故D错误. 20、C
【解析】
A、除去KCl中少量MnO2,需要溶解过滤操作;过滤需要漏斗,故A错误; B、配制溶液需要用胶头滴管定容;实验缺少胶头滴管,故B错误; C、蒸发氯化钠溶液析出氯化钠晶体,需要玻璃棒不断搅拌防止局部受热液体飞溅;符合蒸发溶液得到溶质固体的操作,故C正确; D、乙烯和二氧化硫都和高锰酸钾溶液吸收反应;除去二氧化硫同时乙烯被吸收,故D错误; 21、①CO2;Na2CO3+H2O+CO2=2NaHCO3?????????
②NaOH;Al2O3+2OH-=2AlO2-+H2O?
③氯水;2Fe2++Cl2=2Fe3++2Cl-?????
④NaHCO3溶液;HCO3-+H+=CO2↑+H2O
22、(1)m/M
(2)2mNA/M?
(3)22.4m/M
(4)m/(m+1000)
(5)m/MV
【解析】
m?g某气体,它由双原子分子构成,它的摩尔质量为M?g?mol-1 所以该气体的物质的量为n=mg/Mg?mol-1 =m/Mmol.该气体所含原子总数为N=2×m/Mmol×NAmol-1=2mNA/M.
在标准状况下该气体的体积为V=m/Mmol×22.4L/mol=22.4m/ML. 水的质量为1000ml×1g/ml=1000g,所以mg该气体溶于水质量分数为mg/mg+1000g×100%=100m/m+1000%. 该气体溶于水后形成VL溶液,其溶液的物质的量浓度为c=mM mol/VL=m/VMmol/L.
24、(1)FAEDB
(2)左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足药品,使天平平衡
(3)烧杯、玻璃棒 250 mL容量瓶 定容
(4)AC
【解析】(1)称量操作的步骤:游码归零,放同等大小的纸,调节天平使之平衡,然后放砝码(由大到小),再拨游码,放称量物,称量完毕,取走称量物,砝码放回砝码盒,游码拨回零处。
(2)当天平接近平衡时,正确的操作是:左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足量药品,使天平平衡。
(3)经计算应配溶液的体积是250 mL。
(4)A项将砝码放错位置后,称得BaCl2的质量为4.8 g,故偏低;B项无影响;C项摇匀后再加水即增大了溶液体积,故偏低;D项不振荡,导致加水量偏少,故偏低。
25、(1)0.12 mol
(2)1.6 mol·L-1
(3)160 mL
(3) 设原溶液、稀释后的溶液的浓度和体积分别为?? C1? 、V1 、 C2? 、V2
则 C1 V1= C2 V2
1.6 mol·L-1 × 20 mL = 0.2 mol·L-1? ×V2
V2 =160 mL
稀释后溶液的体积为160 mL
一、选择题(本题共20小题,每题2分,共40分,每道题有且只有一个正确选项)
1、在盛放酒精的试剂瓶的标签上应印有的警示标志是( )
A B C D
2、下列化学实验操作或事故处理方法不正确的是
A.碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液
B.浓硫酸沾到皮肤上时,可立即用湿抹布冲洗,然后涂上3%~5%的NaHCO3溶液
C.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
3、检验某未知溶液中是否含有氯离子(Cl-),正确的操作是(???)
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
4、下列对于“摩尔”的理解正确的是(?? )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
5、下列叙述正确的是(?? )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
6、下列有关阿佛加德罗常数(NA)的说法错误的是(?? ) A.32克O2所含的原子数目为NA? ? ? ? ? ? ? ?21教育网
B.0.5molH2O含有的原子数目为1.5NA C.1molH2O含有的H2O分子数目为NA??????????21·cn·jy·com
D.0.5NA个氯气分子的物质的量是0.5mol
7、除去下列括号内杂质的试剂或方法错误的是(???) A.N2(O2):通过灼热的镁粉? ? ? ? ? ? ? ? ? ? ? ?www-2-1-cnjy-com
B.SiO2(Fe2O3):足量的盐酸,过滤 C.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气???????????【来源:21·世纪·教育·网】
D.C2H5OH(CH3COOH):加足量CaO,蒸馏
8、通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是(???) A.硝酸钠?? ?氢氧化钠???????????2-1-c-n-j-y
B.氧化铜???? 二氧化锰 C.氯化钾??? 碳酸钙? ? ? ? ? ? ?
D.硫酸铜???? 氢氧化钠
9、在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高(?? ) A.所用NaOH已经潮解? ? ? ? ? ? ? ? ? ? ?
B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水定容时俯视???????????
D.称量时误用“左码右物”
10、在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
A.气体甲可能为CO2或者SO2
B.沉淀丙中一定含有BaCO3,可能含有BaSO4
C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42—
D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。
11、实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是(?? ) A.950mL,111.2g???????????
B.500mL,117g???????????
C.1000mL,117g???????????
D.任意规格,111.2g?
12、某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为(?? ) A.6.25mol/L???????????
B.12.5mol/L???????????
C.7mol/L???????????
D.7.5mol/L? ??
13、将VLHCl气体(STP)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为(?? )
A.V/22400mol/L???????????
B.1000V/22.4mol/L???????????
C.V/22.4mol/L???????????
D.V/11.2mol/L??
14、2molCl2和2molCO2相比较,下列叙述中正确的是(?? )
A.分子数相等???????????
B.原子数相等???????????
C.体积相等???????????
D.质量相等?
15、以下实验装置一般不用于分离物质的是(???)
A?????????? ?B????????? ?C???????? ???D? ? ? ? ??
16、下列能达到实验目的的是(???)
A??????? ????B?????????? ?C??????????? D? ? ? ??
17、下列图示的四种实验操作名称从左到右依次是(???)
A.蒸发、蒸馏、过滤、萃取???????????
B.过滤、蒸馏、蒸发、萃取 C.过滤、蒸发、蒸馏、分液???????????
D.萃取、蒸馏、蒸发、过滤
18、实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是(???)
A.用装置甲氧化废液中的溴化氢???????????
B.用装置以分离油层和水层 C.用装置甲分离四氯化碳和液溴???????????
D.用仪器丁密封存放单质溴
19、除去下列物质中的杂质,所用试剂和方法不正确的是(???)
20、仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是(??)21cnjy.com
二、填空题(本题共26分)
21、(16分)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
22、(10分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg?mol-1。若阿伏加德罗常数用NA表示,则: (1)该气体的物质的量为--________mol。 (2)该气体所含原子总数为________个。 (3)该气体在标准状况下的体积为____________L。 (4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为________。 (5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________g?mol-1。
三、实验题(本题共24分)
23、(12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:
①加入稍过量的BaCl2溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的Na2CO3溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,包含以下操作步骤:①固定铁圈位置;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③放置酒精灯;④加热搅拌;⑤停止加热。其正确的操作顺序为___ __。
(2)如何运用最简单方法检验粗盐的提纯步骤①后溶液中有无S?
?_________________________________________________________________。
(3)步骤③加入稍过量的Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是??______________________________。www.21-cn-jy.com
(4)步骤④为过滤操作。请问这一操作能除掉哪些杂质??__________________
?_________________________________________________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的作用分别是:?_____________________________________________。
24、(12分)实验室配制0.1 mol·L-1的BaCl2溶液分成两个阶段:
第一阶段:用托盘天平称取5.2 g无水BaCl2晶体。
第二阶段:溶解配制成0.1 mol·L-1的BaCl2溶液。
第一阶段操作有如下几步:
A.将游码拨至0.2 g处;
B.将游码拨至“0”处;
C.在天平的两边托盘上各放一张干净等质量的滤纸,调节天平两边螺丝使天平平衡;
D.取走药品,将砝码放回砝码盒内;
E.往左盘内逐步添加晶体至天平平衡;
F.在右盘放置5 g砝码。
(1)其正确的操作顺序是(填序号)B→C____________________________________________。
(2)进行E操作时,只缺少量晶体,则正确操作是___________________________。
(3)第二阶段操作,应先将5.2 g BaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有____ _________________,然后将溶液转入________中,再洗涤、________、摇匀后即可得到0.1 mol·L-1BaCl2溶液(填选项字母)。21世纪教育网版权所有
(4)下列操作使配制的BaCl2溶液浓度偏低的有________。
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
四、计算题(本题共10分)
25、常温下,在30.6g水中溶解15g CuSO4·5H2O恰好达到饱和,该溶液的密度为1.2g/cm-3,求:21·世纪*教育网
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度(保留两位有效数字)
(3)取出20mL 该溶液,配成浓度为0.2 mol?L-1的稀溶液,则稀释后溶液的体积为多少毫升?【来源:21cnj*y.co*m】
参考答案及解析
3、C
【解析】
Cl-检验是要先向溶液中加入稀硝酸酸化,排除一些干扰离子,再加入AgNO3溶液,,如果有白色沉淀产生说明有Cl-。 21*cnjy*com
4、B
【解析】
A.物质的量是国际科学界建议采用的一种物理量,单位是mol,故A错误;? B.摩尔是物质的量的单位,简称摩,符号为mol,故B正确; C.摩尔质量的单位是g/mol,HNO?3?的摩尔质量是63g/mol,故C错误; D.碳原子指含有6个质子6个中子的原子,本选项未明确,故D错误.
5、D
【解析】
A、同温同压下,相同体积的气体,其物质的量一定相等,不是气体物质的量不一定相等,故A错误; B、等体积的甲烷和一氧化碳所处的状态相同,含有相同的分子数,烷和一氧化碳所处的状态不一定相同,所含分子数不一定相同,故B错误; C、1L一氧化碳气体与1L氧气所处的状态相同,1L一氧化碳气体一定比1L氧气的质量小,但二者所处的状态不一定相同,因此1L一氧化碳气体与1L氧气的质量关系无法确定,或大或小或相等都有可能,故C错误; D、相同条件下的一氧化碳气体和氮气,若体积相等,则物质的量相等,二者摩尔质量相等,则质量一定相等,故D正确.【版权所有:21教育】
6、A
【解析】
A、32克O2物质的量为1mol,所含的原子数目为2NA,故A错误;
7、A
【解析】
A.N2和O2都可以与灼热的镁粉发生反应,应该用灼热的Cu粉,错误;
B.SiO2是酸性氧化物,杂质Fe2O3是碱性氧化物,前者不能与盐酸发生反应,后者发生反应产生可溶性的物质,因此加足量的盐酸,过滤就可以达到除杂的目的,正确;
C.SO2有还原性,能够与有强氧化性的物质酸性KMnO4溶液发生反应变为硫酸,而CO2不能发生反应,因此用浓硫酸酸性KMnO4溶液洗气,在用浓硫酸干燥,就可以得到纯净的CO2气体,正确;21教育名师原创作品
D.C2H5OH是中性物质,杂质CH3COOH是酸性物质,可以与碱性氧化物CaO发生反应变为离子化合物——盐,然后利用二者沸点的不同,通过蒸馏分离提纯得到乙醇,正确。
【解析】和盐酸反应生成气体的只有CO32—和SO32—,即二者至少含有一种。溶液甲中一定含有盐酸,因此加入NH4HCO3溶液会生成二氧化碳气体,乙是CO2,则甲就是SO2。所以一定含有SO32—,则Fe3+、Ag+、Ba2+就没有,那么K+就一定含有。能与NH4HCO3溶液反应生成沉淀的只有AlO2—,沉淀是氢氧化铝,所以一定含有AlO2—。由于溶液乙中含有NH4HCO3,所以当加入过量Ba(OH)2溶液并加热时一定会生成氨气和碳酸钡沉淀。即丙是氨气,沉淀不一定含有硫酸钡,即无法确定原溶液中是否含有SO42—。
11、C
【解析】
配制2mol/l的nacl溶液1000ml需氯化钠的质量为:2mol/l×1l×58.5g/mol═117.0g.
12、A
【解析】
设蒸发后溶液的质量是m。由于在蒸发过程中,溶质是不变的。所以(100g+m)×10%=m×20%,解得m=100g,因此80ml溶液中氢氧化钠的质量是20g,物质的量是0.5mol,所以氢氧化钠的浓度是0.5mol÷0.08l=6.25mol/l,答案选A。【出处:21教育名师】
13、C
【解析】
标准状况下Vm=22.4L/mol,HCl的物质的量为VL/22.4L/mol=V/22.4mol,1000mL盐酸溶液,即溶液的体积为1L,则该盐酸的物质的量浓度为V/22.4mol/1L?=V/22.4mol/L,
14、A
【解析】
A.由n=N/NA可知,分子数相等,故A正确; B.两种分子含有的原子数不同,分子数相同,则原子数不同,故B错误; C.由于不能确定气体存在的条件是否相同,则不能确定体积大小,故C错误; D.由于两种气体的摩尔质量不同,则质量不同,故D错误.21*cnjy*com
15、C
【解析】
A.为蒸发装置,可用来分离可溶性固体和水,错误;B.为蒸馏操作,可用来分离沸点不同的物质,错误;C.为配制一定物质的量浓度的溶液的操作,不用于分离物质,正确;D.为洗气装置,可用来除去气体杂质,错误。
16、A
【解析】
A是分液操作,正确;干燥氯气时氯气要从长导管进,B错;往容量瓶中加溶液要用玻璃棒引流,C错;加热蒸发要用玻璃棒搅拌,D错。2·1·c·n·j·y
A.由于Cl2有强的氧化性,会把HBr中的溴元素氧化为Br2,为使物质充分发生反应,应该把导气管伸入到液面一下,故不能用装置甲氧化废液中的溴化氢,错误;B.由于水的密度比四氯化碳小,二者是互不相溶的两种液体物质,因此可以用分液的方法分离,正确;C.四氯化碳和液溴是沸点不同的互溶的两种液态物质,用蒸馏的方法分离时,一个把温度计的水银球放在蒸馏烧瓶的支管口附近,不能在液面一下,因此不能用装置丙分离四氯化碳和液溴,错误;D.溴容易挥发,在保存时常加些水形成水封,由于溴有强的氧化性,会与橡胶发生反应,所以应该使用玻璃塞密封保存在,并加水形成水封,错误。
19、D
【解析】
A、碘在四氯化碳中的溶解度大于在水中的溶解度,可以用萃取的方法除去氯化钾中的碘,故A正确; B、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,可以除去硫酸根离子,故B正确; C、氧化铜和盐酸反应生成氯化铜和水,而金属铜不反应,过滤即可获得金属铜,故C正确; D、碳酸钙和氧化钙均可以和盐酸反应生成氯化钙,故不能用盐酸来除碳酸钙中的氧化钙,故D错误. 20、C
【解析】
A、除去KCl中少量MnO2,需要溶解过滤操作;过滤需要漏斗,故A错误; B、配制溶液需要用胶头滴管定容;实验缺少胶头滴管,故B错误; C、蒸发氯化钠溶液析出氯化钠晶体,需要玻璃棒不断搅拌防止局部受热液体飞溅;符合蒸发溶液得到溶质固体的操作,故C正确; D、乙烯和二氧化硫都和高锰酸钾溶液吸收反应;除去二氧化硫同时乙烯被吸收,故D错误; 21、①CO2;Na2CO3+H2O+CO2=2NaHCO3?????????
②NaOH;Al2O3+2OH-=2AlO2-+H2O?
③氯水;2Fe2++Cl2=2Fe3++2Cl-?????
④NaHCO3溶液;HCO3-+H+=CO2↑+H2O
22、(1)m/M
(2)2mNA/M?
(3)22.4m/M
(4)m/(m+1000)
(5)m/MV
【解析】
m?g某气体,它由双原子分子构成,它的摩尔质量为M?g?mol-1 所以该气体的物质的量为n=mg/Mg?mol-1 =m/Mmol.该气体所含原子总数为N=2×m/Mmol×NAmol-1=2mNA/M.
在标准状况下该气体的体积为V=m/Mmol×22.4L/mol=22.4m/ML. 水的质量为1000ml×1g/ml=1000g,所以mg该气体溶于水质量分数为mg/mg+1000g×100%=100m/m+1000%. 该气体溶于水后形成VL溶液,其溶液的物质的量浓度为c=mM mol/VL=m/VMmol/L.
24、(1)FAEDB
(2)左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足药品,使天平平衡
(3)烧杯、玻璃棒 250 mL容量瓶 定容
(4)AC
【解析】(1)称量操作的步骤:游码归零,放同等大小的纸,调节天平使之平衡,然后放砝码(由大到小),再拨游码,放称量物,称量完毕,取走称量物,砝码放回砝码盒,游码拨回零处。
(2)当天平接近平衡时,正确的操作是:左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足量药品,使天平平衡。
(3)经计算应配溶液的体积是250 mL。
(4)A项将砝码放错位置后,称得BaCl2的质量为4.8 g,故偏低;B项无影响;C项摇匀后再加水即增大了溶液体积,故偏低;D项不振荡,导致加水量偏少,故偏低。
25、(1)0.12 mol
(2)1.6 mol·L-1
(3)160 mL
(3) 设原溶液、稀释后的溶液的浓度和体积分别为?? C1? 、V1 、 C2? 、V2
则 C1 V1= C2 V2
1.6 mol·L-1 × 20 mL = 0.2 mol·L-1? ×V2
V2 =160 mL
稀释后溶液的体积为160 mL
