钠及其化合物(共16张PPT) 必修 第一册 第二章 海水中的重要元素
文档属性
| 名称 | 钠及其化合物(共16张PPT) 必修 第一册 第二章 海水中的重要元素 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-17 18:44:55 | ||
图片预览





文档简介
(共16张PPT)
走近舌尖上的金属元素—Na
1.厨房里有哪些含元素的食物?
2.食盐除了食用还有什么用途?
3.单质可以进厨房吗?如何保存它?
英国化学家,1802年开创了农业化学,1807年用电解法离析出金属钾和钠;1808年分离出金属钙、锶、钡和镁。1813年在法国研究碘,指出碘是与氯类似的元素,并制备出碘化钾和碘酸钾等许多碘的化合物。后证实金刚石和木炭的化学成分相同。1815年发明矿用安全灯,1817年发现铂能促使醇蒸气在空气中氧化的催化作用。
金属钠的发现者——戴维
汉弗里·戴维 (1778-1829)
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
探究一:见一见
实验探究:金属钠的性质
切割钠
实验现象
新切开的钠具有_______的金属光泽
银白
活泼的金属单质——钠
实验探究:金属钠的性质
探究二:钠与氧气相遇会怎样?
实验探究:金属钠的性质
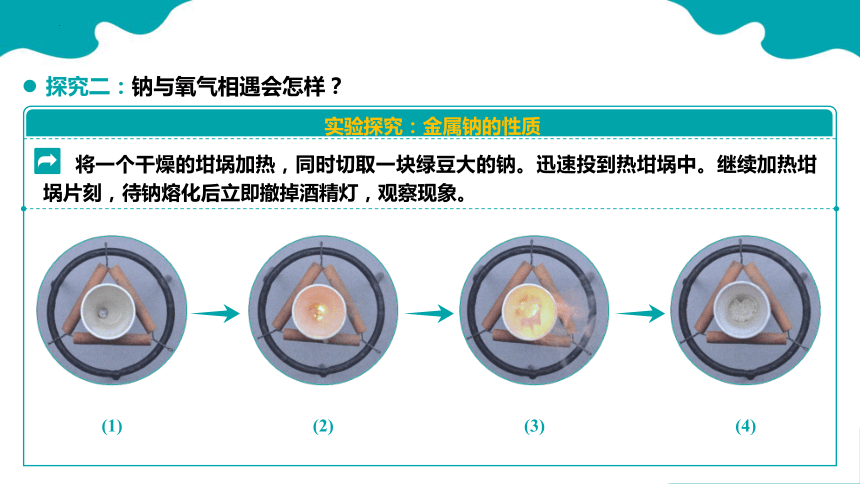
将一个干燥的坩埚加热,同时切取一块绿豆大的钠。迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
(1)
(2)
(3)
(4)
实验现象
活泼的金属单质——钠
实验探究:金属钠的性质
先_____,然后剧烈燃烧,火焰呈_____,生成_______固体
熔化
黄色
淡黄色
归纳总结:钠与非金属单质的反应
活泼的金属单质——钠
实验探究:金属钠的性质
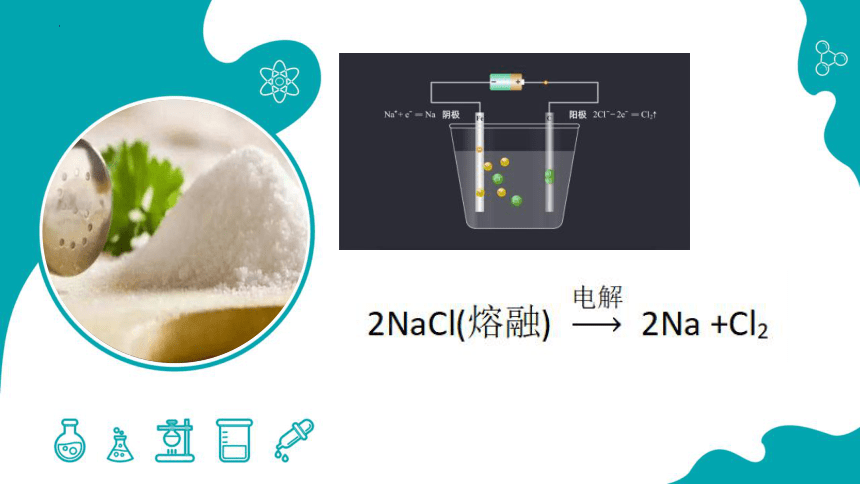
2+Cl2====2NaCl
加热
与Cl2在点燃条件下的反应
2+S====Na2S
与S在研磨条件下的反应
探究三:钠和水怎样反应
实验探究:金属钠的性质
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
现象 结论或解释
钠___在水面上 钠的密度比水___
钠_____成小球 钠的熔点___,反应放热
小球在水面上_________ 反应产生的_____推动小球运动
与水反应发出“嘶嘶”的响声, 逐渐变小,最后消失 钠与水_____反应,产生气体
反应后溶液的颜色逐渐变__ 有_____物质(________)生成
浮
小
熔化
低
迅速游动
氢气
剧烈
红
碱性
氢氧化钠
实验现象
活泼的金属单质——钠与水
实验探究:金属钠的性质
第一节
钠及其化合物
第1课时
原子结构
钠的物理性质
钠的化学性质
银白色固体、质软、熔点低、
密度小于水、导电导热
与氧气反应(条件不同,产物不同)
与水反应
钠的用途
钠是细胞外液中带正电的主要离子,参与水的代谢,保证体内水的平衡,调节体内水分与渗透压
钛、锆、铌、钽等金属的冶炼
作为化工原料,用于生产丁钠橡胶、氢化钠、过氧化钠、氰化钠、碳酸钠等含钠化合物,广泛应用于食品、生物、制药、橡胶、皮革、化工等工业
作为合金的成分,如钠汞齐、钠铅合金、钠钾合金等,用于有机合成、汽油抗爆剂、核反应堆的冷却剂和热交换剂
作为电光源,利用钠蒸气的黄光透雾力强,制造高压钠灯,用于公路和广场的照明
1.下列有关钠的叙述中, 不正确的是
A.金属钠是银白色金属,硬度小,钠切开的断面露置在空气中变暗,是因为生成了Na2O
B.钠元素在自然界中仅以化合物形式存在
C.将一小块钠投入到CuSO4溶液中,有红色固体Cu析出
D.少量金属钠可保存在煤油中,使用后剩余的钠必须放回原试剂瓶中
2.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两液体界面处反应,上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红
3.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
①MgSO4溶液②Na2SO4溶液③饱和澄清石灰水④Ca(HCO3)2溶液⑤CuSO4溶液⑥饱和NaCl溶液。
走近舌尖上的金属元素—Na
1.厨房里有哪些含元素的食物?
2.食盐除了食用还有什么用途?
3.单质可以进厨房吗?如何保存它?
英国化学家,1802年开创了农业化学,1807年用电解法离析出金属钾和钠;1808年分离出金属钙、锶、钡和镁。1813年在法国研究碘,指出碘是与氯类似的元素,并制备出碘化钾和碘酸钾等许多碘的化合物。后证实金刚石和木炭的化学成分相同。1815年发明矿用安全灯,1817年发现铂能促使醇蒸气在空气中氧化的催化作用。
金属钠的发现者——戴维
汉弗里·戴维 (1778-1829)
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
探究一:见一见
实验探究:金属钠的性质
切割钠
实验现象
新切开的钠具有_______的金属光泽
银白
活泼的金属单质——钠
实验探究:金属钠的性质
探究二:钠与氧气相遇会怎样?
实验探究:金属钠的性质
将一个干燥的坩埚加热,同时切取一块绿豆大的钠。迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
(1)
(2)
(3)
(4)
实验现象
活泼的金属单质——钠
实验探究:金属钠的性质
先_____,然后剧烈燃烧,火焰呈_____,生成_______固体
熔化
黄色
淡黄色
归纳总结:钠与非金属单质的反应
活泼的金属单质——钠
实验探究:金属钠的性质
2+Cl2====2NaCl
加热
与Cl2在点燃条件下的反应
2+S====Na2S
与S在研磨条件下的反应
探究三:钠和水怎样反应
实验探究:金属钠的性质
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
现象 结论或解释
钠___在水面上 钠的密度比水___
钠_____成小球 钠的熔点___,反应放热
小球在水面上_________ 反应产生的_____推动小球运动
与水反应发出“嘶嘶”的响声, 逐渐变小,最后消失 钠与水_____反应,产生气体
反应后溶液的颜色逐渐变__ 有_____物质(________)生成
浮
小
熔化
低
迅速游动
氢气
剧烈
红
碱性
氢氧化钠
实验现象
活泼的金属单质——钠与水
实验探究:金属钠的性质
第一节
钠及其化合物
第1课时
原子结构
钠的物理性质
钠的化学性质
银白色固体、质软、熔点低、
密度小于水、导电导热
与氧气反应(条件不同,产物不同)
与水反应
钠的用途
钠是细胞外液中带正电的主要离子,参与水的代谢,保证体内水的平衡,调节体内水分与渗透压
钛、锆、铌、钽等金属的冶炼
作为化工原料,用于生产丁钠橡胶、氢化钠、过氧化钠、氰化钠、碳酸钠等含钠化合物,广泛应用于食品、生物、制药、橡胶、皮革、化工等工业
作为合金的成分,如钠汞齐、钠铅合金、钠钾合金等,用于有机合成、汽油抗爆剂、核反应堆的冷却剂和热交换剂
作为电光源,利用钠蒸气的黄光透雾力强,制造高压钠灯,用于公路和广场的照明
1.下列有关钠的叙述中, 不正确的是
A.金属钠是银白色金属,硬度小,钠切开的断面露置在空气中变暗,是因为生成了Na2O
B.钠元素在自然界中仅以化合物形式存在
C.将一小块钠投入到CuSO4溶液中,有红色固体Cu析出
D.少量金属钠可保存在煤油中,使用后剩余的钠必须放回原试剂瓶中
2.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两液体界面处反应,上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红
3.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
①MgSO4溶液②Na2SO4溶液③饱和澄清石灰水④Ca(HCO3)2溶液⑤CuSO4溶液⑥饱和NaCl溶液。
