典型含铁物质的性质(第一课时)(共17张PPT)必修 第一册第三章 铁 金属材料实验活动2 铁及其化合物的性质
文档属性
| 名称 | 典型含铁物质的性质(第一课时)(共17张PPT)必修 第一册第三章 铁 金属材料实验活动2 铁及其化合物的性质 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-17 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
典型含铁物质的性质与转化
第一课时 探究补铁剂FeSO4的化学性质
(1)经常感觉到软弱无力、疲倦困乏
(2)皮肤、粘膜、指甲、口唇等颜色苍白或苍黄
(3)稍微运动就感到心悸、气短
(4)经常有头晕眼花、四肢无力、注意力不集中
(5)头发干枯、脱落
(6)嗜睡,且睡眠质量不好
(7)食欲减退、食不知味
你平时身体有以下症状吗?
缺铁
展示课前学习任务:写出铁及其化合物的化学式
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
铁的化合价
物质类别
典型含铁物质的性质与转化
第一课时 探究补铁剂FeSO4的化学性质
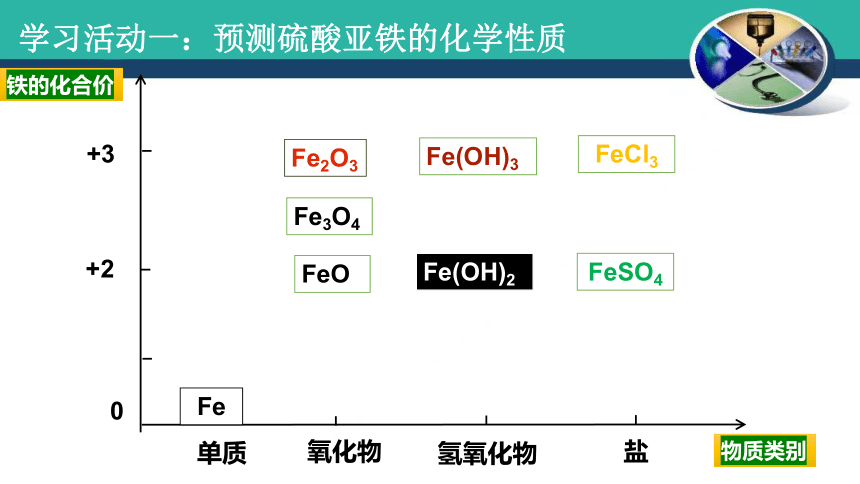
学习活动一:预测硫酸亚铁的化学性质
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
FeSO4
FeCl3
铁的化合价
物质类别
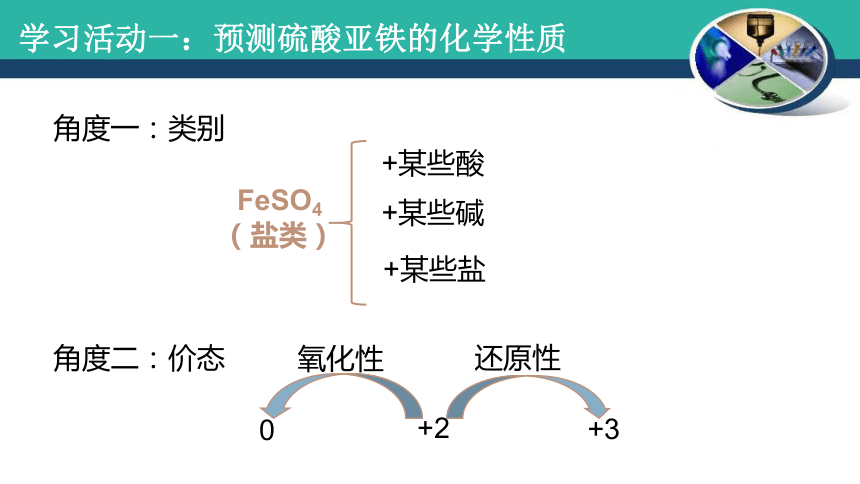
学习活动一:预测硫酸亚铁的化学性质
角度一:类别
角度二:价态
FeSO4
(盐类)
+某些酸
+某些碱
+某些盐
氧化性
还原性
+2
0
+3
学习活动二:根据提供的实验药品设计实验方案
实验目的 选择试剂 选择理由 预测产物和现象
1、 FeSO4+
2、 FeSO4+
实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、稀硫酸、氯水(主要成分Cl2)、KMnO4溶液、Zn、Cu
(一)物质类别角度
验证……
学习活动三:动手实验,验证预测
所选试剂 实验现象 结论及离子方程式
(一)物质类别角度—验证与盐、与碱反应
BaCl2溶液
FeSO4溶液
NaOH溶液
FeSO4溶液
生成白色沉淀,迅速变成灰绿色,最终变为红褐色
Fe2+ + 2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
生成白色沉淀
Ba2+ + SO42-=BaSO4↓
学习活动二:根据提供的实验药品设计实验方案
实验目的 选择试剂 选择理由 预测产物和现象
1、 FeSO4+
2、 FeSO4+
3、 FeSO4+
实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、稀硫酸、氯水(主要成分Cl2)、KMnO4溶液、Zn、Cu
(二)价态角度
学习活动三:动手实验,验证预测
(二)价态角度—验证还原性
所选试剂 实验现象 结论及离子方程式
FeSO4溶液
KMnO4溶液
FeSO4溶液
氯水
资料卡片:Fe3+的检验方法
Fe3+遇KSCN溶液显红色
Fe3++3SCN- =Fe(SCN)3
溶液变为黄色,滴入KSCN溶液变红
2Fe2+ + Cl2=2Fe3++2Cl-
证明Fe2+具有还原性
溶液紫色褪去
MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O
学习活动三:动手实验,验证预测
(二)价态角度—验证氧化性
所选试剂 实验现象 结论及离子方程式
Zn粉
FeSO4溶液
学习活动四:归纳梳理FeSO4的化学性质
类别:盐类
+某些碱
+某些盐
FeSO4
Fe2+ + 2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Ba2+ + SO42-=BaSO4↓
价态:中间价
氧化性:
还原性:
被Cl2、KMnO4、O2、Br2、H2O2、HNO3等氧化剂氧化为Fe3+
被Zn等还原剂还原为Fe
评价任务五:预测FeCl3的化学性质
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
铁的化合价
物质类别
1、除去下列物质中含有的少量杂质,括号内为杂质,写出除杂试剂的化学式和反应的离子方程式
(1)FeCl3(FeCl2) , 。
(2)FeSO4(CuSO4) , 。
课后评价任务:
2、下列试剂不能使Fe2+转化为Fe3+是( )
①新制氯水②NaCl溶液③酸性KMnO4溶液④H2O2溶液
⑤盐酸⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
3、 已知有以下相互转化关系,试回答:
(1)写出B的化学式:________,D的化学式:________。
(2)写出由E转变成F的化学方程式______________________________。
(3)写出由A转变成B的离子方程式______________________________。
(4)向G溶液加入A的离子方程式:______________________________。
谢谢大家!
典型含铁物质的性质与转化
第一课时 探究补铁剂FeSO4的化学性质
(1)经常感觉到软弱无力、疲倦困乏
(2)皮肤、粘膜、指甲、口唇等颜色苍白或苍黄
(3)稍微运动就感到心悸、气短
(4)经常有头晕眼花、四肢无力、注意力不集中
(5)头发干枯、脱落
(6)嗜睡,且睡眠质量不好
(7)食欲减退、食不知味
你平时身体有以下症状吗?
缺铁
展示课前学习任务:写出铁及其化合物的化学式
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
铁的化合价
物质类别
典型含铁物质的性质与转化
第一课时 探究补铁剂FeSO4的化学性质
学习活动一:预测硫酸亚铁的化学性质
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
FeSO4
FeCl3
铁的化合价
物质类别
学习活动一:预测硫酸亚铁的化学性质
角度一:类别
角度二:价态
FeSO4
(盐类)
+某些酸
+某些碱
+某些盐
氧化性
还原性
+2
0
+3
学习活动二:根据提供的实验药品设计实验方案
实验目的 选择试剂 选择理由 预测产物和现象
1、 FeSO4+
2、 FeSO4+
实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、稀硫酸、氯水(主要成分Cl2)、KMnO4溶液、Zn、Cu
(一)物质类别角度
验证……
学习活动三:动手实验,验证预测
所选试剂 实验现象 结论及离子方程式
(一)物质类别角度—验证与盐、与碱反应
BaCl2溶液
FeSO4溶液
NaOH溶液
FeSO4溶液
生成白色沉淀,迅速变成灰绿色,最终变为红褐色
Fe2+ + 2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
生成白色沉淀
Ba2+ + SO42-=BaSO4↓
学习活动二:根据提供的实验药品设计实验方案
实验目的 选择试剂 选择理由 预测产物和现象
1、 FeSO4+
2、 FeSO4+
3、 FeSO4+
实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、稀硫酸、氯水(主要成分Cl2)、KMnO4溶液、Zn、Cu
(二)价态角度
学习活动三:动手实验,验证预测
(二)价态角度—验证还原性
所选试剂 实验现象 结论及离子方程式
FeSO4溶液
KMnO4溶液
FeSO4溶液
氯水
资料卡片:Fe3+的检验方法
Fe3+遇KSCN溶液显红色
Fe3++3SCN- =Fe(SCN)3
溶液变为黄色,滴入KSCN溶液变红
2Fe2+ + Cl2=2Fe3++2Cl-
证明Fe2+具有还原性
溶液紫色褪去
MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O
学习活动三:动手实验,验证预测
(二)价态角度—验证氧化性
所选试剂 实验现象 结论及离子方程式
Zn粉
FeSO4溶液
学习活动四:归纳梳理FeSO4的化学性质
类别:盐类
+某些碱
+某些盐
FeSO4
Fe2+ + 2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Ba2+ + SO42-=BaSO4↓
价态:中间价
氧化性:
还原性:
被Cl2、KMnO4、O2、Br2、H2O2、HNO3等氧化剂氧化为Fe3+
被Zn等还原剂还原为Fe
评价任务五:预测FeCl3的化学性质
单质
氧化物
氢氧化物
盐
+2
+3
0
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
铁的化合价
物质类别
1、除去下列物质中含有的少量杂质,括号内为杂质,写出除杂试剂的化学式和反应的离子方程式
(1)FeCl3(FeCl2) , 。
(2)FeSO4(CuSO4) , 。
课后评价任务:
2、下列试剂不能使Fe2+转化为Fe3+是( )
①新制氯水②NaCl溶液③酸性KMnO4溶液④H2O2溶液
⑤盐酸⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
3、 已知有以下相互转化关系,试回答:
(1)写出B的化学式:________,D的化学式:________。
(2)写出由E转变成F的化学方程式______________________________。
(3)写出由A转变成B的离子方程式______________________________。
(4)向G溶液加入A的离子方程式:______________________________。
谢谢大家!
