共价键的极性和分子的极性(共23张PPT)>选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质
文档属性
| 名称 | 共价键的极性和分子的极性(共23张PPT)>选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-17 00:00:00 | ||
图片预览




文档简介
(共23张PPT)
第二章 分子的结构与性质
第三节 分子的性质
(第1课时 键的极性、分子极性)
1.通过探究实验,锻炼学生观察能力、归纳总结能力,掌握分子极性的判断方法。
2.通过实验和教具,使学生进一步理解物质结构决定性质,性质体现结构的理念。
3.通过回顾已学知识,用类比的方法处理新问题。
学习目标
学习重难点
多原子分子中,极性分子和非极性分子的判断。
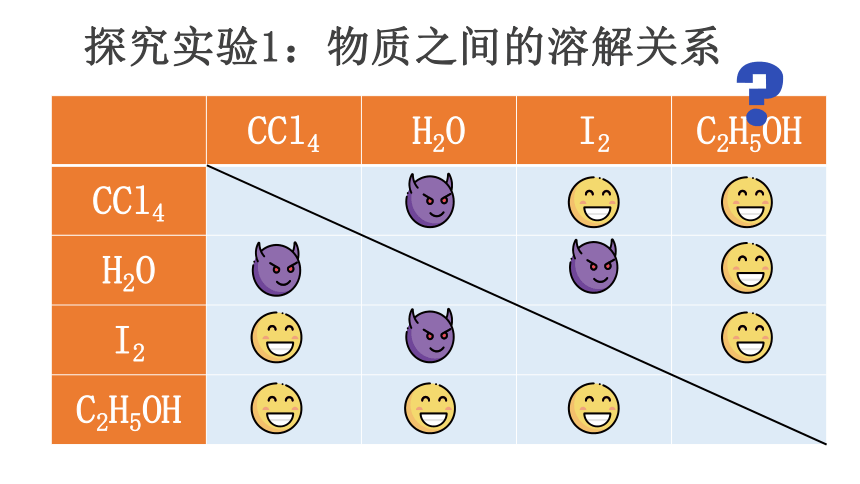
探究实验1:物质之间的溶解关系
CCl4 H2O I2 C2H5OH
CCl4
H2O
I2
C2H5OH
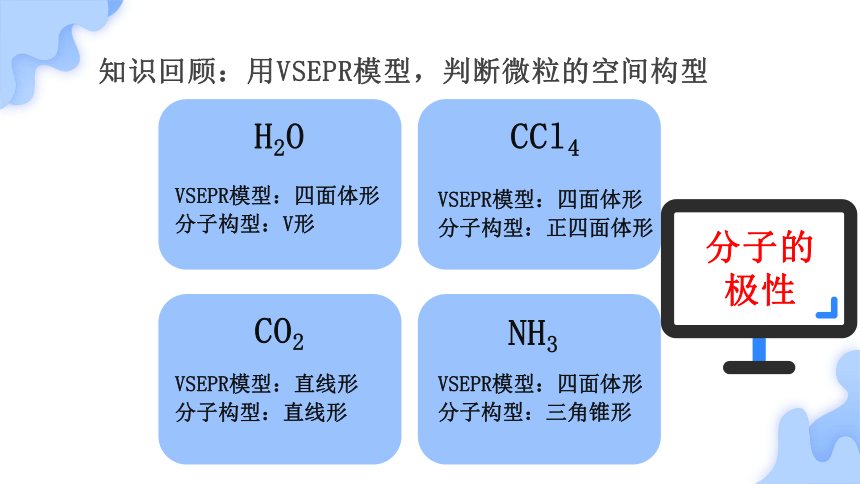
知识回顾:用VSEPR模型,判断微粒的空间构型
H2O
H2O
CCl4
CO2
NH3
NH3
VSEPR模型:四面体形
分子构型:V形
VSEPR模型:四面体形
分子构型:正四面体形
VSEPR模型:直线形
分子构型:直线形
VSEPR模型:四面体形
分子构型:三角锥形
分子的极性
一、键的极性和分子的极性
极性共价键:
正负电荷中心不重合
HCl
Cl2
1、共价键键的极性
非极性共价键:
正负电荷中心重合
练习:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
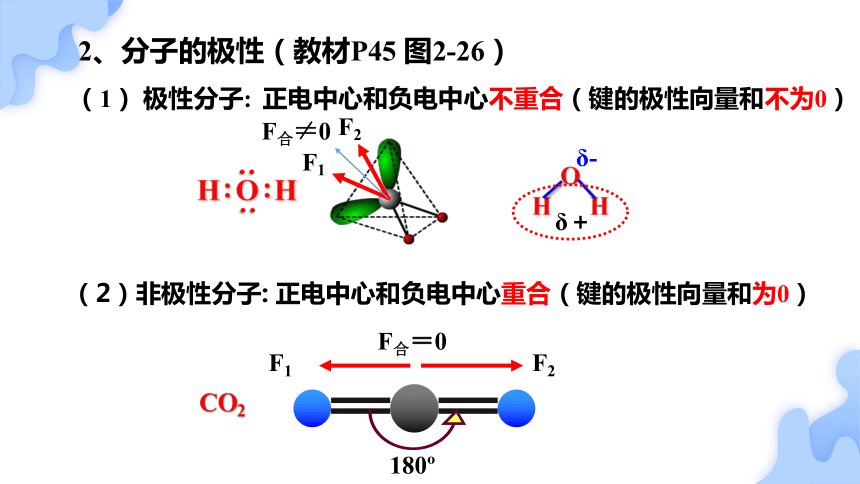
2、分子的极性(教材P45 图2-26)
O
H H
CO2
δ+
δ-
180
F1
F2
F合=0
正电中心和负电中心不重合(键的极性向量和不为0)
正电中心和负电中心重合(键的极性向量和为0)
(2)非极性分子:
(1) 极性分子:
F1
F2
F合≠0
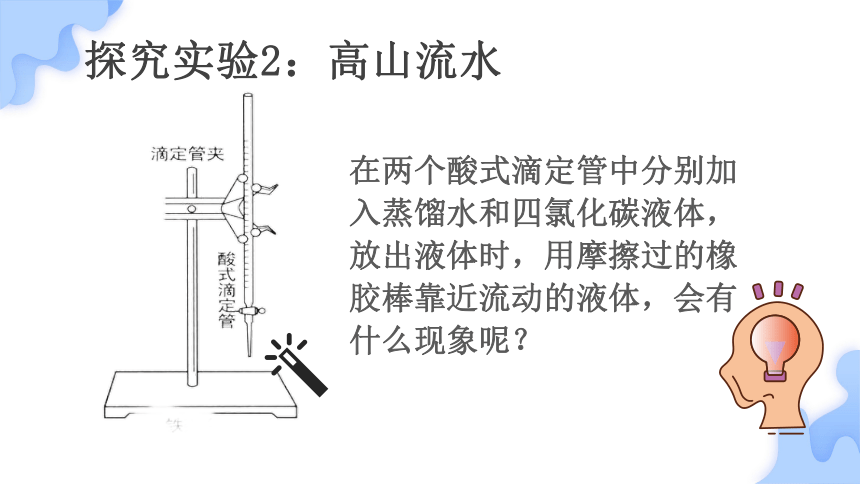
探究实验2:高山流水
在两个酸式滴定管中分别加入蒸馏水和四氯化碳液体,放出液体时,用摩擦过的橡胶棒靠近流动的液体,会有什么现象呢?
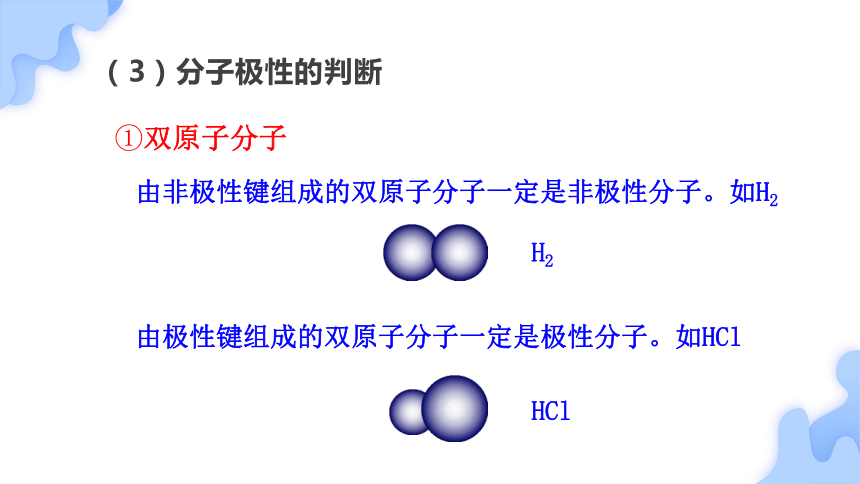
(3)分子极性的判断
①双原子分子
由极性键组成的双原子分子一定是极性分子。如HCl
由非极性键组成的双原子分子一定是非极性分子。如H2
H2
HCl
(3)分子极性的判断
②三原子分子
H2O
CO2
(3)分子极性的判断
③四原子分子
NH3
BF3
(3)分子极性的判断
④五原子分子
CH4
CH3Cl ?
CH2Cl2 ?
4、分子是否有极性判断方法归纳:
(1)本质是正电中心和负电中心是否重合
(2)根据共价键的极性和分子的空间构型判断
双原子分子:共价键的极性与分子的极性一致。
多原子分子:先看分子中键的极性,再看分子的空间构型
4、分子是否有极性判断方法:
多原子分子:先看分子中键的极性,再看分子的空间构型
①一般只含非极性键的分子是非极性分子,如P4、C60。
②含有极性键的多原子分子
空间结构对称:(直线形、平面正三角形、正四面体形等)是非极性分子;
空间结构不对称:(V形、三角锥形、四面体形等)是极性分子。
(3)根据通过极性键的向量和判断
注意:O3
H2 HF N2 H20 CO2
SO2 NH3 BF3 CH3Cl CH2Cl2
CCl4 P4 C60 O3 HCH0
跟进练习:判断一下分子是极性分子还是非极性分子
课前问题思考
CCl4 H2O I2 C2H5OH
CCl4
H2O
I2
C2H5OH
科学视野—表面活性剂和细胞膜
1、肥皂和洗涤剂的去污。
2、防水材料。
3、微波炉加热食品。
3、生活应用:
学生自主小结
本节课共学习两个内容:
1、极性共价键和非极性共价键的判断。
2、极性分子与非极性分子的判断。
课后作业:课本55页 1,2,3题
跟进练习:
1.下列从分子的立体结构角度对分子极性的解释正确的是 ( )
A.H2O是极性分子,因为分子中氧原子不处在2个氢原子所连成的直线中央
B.NH3是极性分子,因为分子中氮原子处在3个氢原子所组成的三角形的中心
C.CO2是非极性分子,因为分子中碳原子不处在2个氧原子所连成的直线的中央
D.CCl4是非极性分子,因为分子中碳原子处在4个氯原子所组成的正方形的中心
A
2.下列各组分子中,只由极性键构成的非极性分子是 ( )
A.CH4 B.O3 C.NH3 D.Cl2
A
3.已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中正确的是 ( )
A.分子的正、负电荷中心重合
B.分子的正、负电荷中心不重合
C.H2O2是含极性键的非极性分子
D.H2O2是只含非极性键的极性分子
B
4、下列化合物中,化学键的类型和分子的极性(极性或非极性)都相同的是 ( )
A.CO2和SO2 B.CH4和SO2
C.BF3和NH3 D.HCl和HI
D
感谢聆听
第二章 分子的结构与性质
第三节 分子的性质
(第1课时 键的极性、分子极性)
1.通过探究实验,锻炼学生观察能力、归纳总结能力,掌握分子极性的判断方法。
2.通过实验和教具,使学生进一步理解物质结构决定性质,性质体现结构的理念。
3.通过回顾已学知识,用类比的方法处理新问题。
学习目标
学习重难点
多原子分子中,极性分子和非极性分子的判断。
探究实验1:物质之间的溶解关系
CCl4 H2O I2 C2H5OH
CCl4
H2O
I2
C2H5OH
知识回顾:用VSEPR模型,判断微粒的空间构型
H2O
H2O
CCl4
CO2
NH3
NH3
VSEPR模型:四面体形
分子构型:V形
VSEPR模型:四面体形
分子构型:正四面体形
VSEPR模型:直线形
分子构型:直线形
VSEPR模型:四面体形
分子构型:三角锥形
分子的极性
一、键的极性和分子的极性
极性共价键:
正负电荷中心不重合
HCl
Cl2
1、共价键键的极性
非极性共价键:
正负电荷中心重合
练习:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
2、分子的极性(教材P45 图2-26)
O
H H
CO2
δ+
δ-
180
F1
F2
F合=0
正电中心和负电中心不重合(键的极性向量和不为0)
正电中心和负电中心重合(键的极性向量和为0)
(2)非极性分子:
(1) 极性分子:
F1
F2
F合≠0
探究实验2:高山流水
在两个酸式滴定管中分别加入蒸馏水和四氯化碳液体,放出液体时,用摩擦过的橡胶棒靠近流动的液体,会有什么现象呢?
(3)分子极性的判断
①双原子分子
由极性键组成的双原子分子一定是极性分子。如HCl
由非极性键组成的双原子分子一定是非极性分子。如H2
H2
HCl
(3)分子极性的判断
②三原子分子
H2O
CO2
(3)分子极性的判断
③四原子分子
NH3
BF3
(3)分子极性的判断
④五原子分子
CH4
CH3Cl ?
CH2Cl2 ?
4、分子是否有极性判断方法归纳:
(1)本质是正电中心和负电中心是否重合
(2)根据共价键的极性和分子的空间构型判断
双原子分子:共价键的极性与分子的极性一致。
多原子分子:先看分子中键的极性,再看分子的空间构型
4、分子是否有极性判断方法:
多原子分子:先看分子中键的极性,再看分子的空间构型
①一般只含非极性键的分子是非极性分子,如P4、C60。
②含有极性键的多原子分子
空间结构对称:(直线形、平面正三角形、正四面体形等)是非极性分子;
空间结构不对称:(V形、三角锥形、四面体形等)是极性分子。
(3)根据通过极性键的向量和判断
注意:O3
H2 HF N2 H20 CO2
SO2 NH3 BF3 CH3Cl CH2Cl2
CCl4 P4 C60 O3 HCH0
跟进练习:判断一下分子是极性分子还是非极性分子
课前问题思考
CCl4 H2O I2 C2H5OH
CCl4
H2O
I2
C2H5OH
科学视野—表面活性剂和细胞膜
1、肥皂和洗涤剂的去污。
2、防水材料。
3、微波炉加热食品。
3、生活应用:
学生自主小结
本节课共学习两个内容:
1、极性共价键和非极性共价键的判断。
2、极性分子与非极性分子的判断。
课后作业:课本55页 1,2,3题
跟进练习:
1.下列从分子的立体结构角度对分子极性的解释正确的是 ( )
A.H2O是极性分子,因为分子中氧原子不处在2个氢原子所连成的直线中央
B.NH3是极性分子,因为分子中氮原子处在3个氢原子所组成的三角形的中心
C.CO2是非极性分子,因为分子中碳原子不处在2个氧原子所连成的直线的中央
D.CCl4是非极性分子,因为分子中碳原子处在4个氯原子所组成的正方形的中心
A
2.下列各组分子中,只由极性键构成的非极性分子是 ( )
A.CH4 B.O3 C.NH3 D.Cl2
A
3.已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中正确的是 ( )
A.分子的正、负电荷中心重合
B.分子的正、负电荷中心不重合
C.H2O2是含极性键的非极性分子
D.H2O2是只含非极性键的极性分子
B
4、下列化合物中,化学键的类型和分子的极性(极性或非极性)都相同的是 ( )
A.CO2和SO2 B.CH4和SO2
C.BF3和NH3 D.HCl和HI
D
感谢聆听
