1.2.1原子结构与元素周期表(共39张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2.1原子结构与元素周期表(共39张ppt)化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-18 00:00:00 | ||
图片预览








文档简介
(共39张PPT)
原子结构与元素的性质
第一章·第二节
第一课时
原子结构与元素周期表
PART 01
元素周期律
元素周期系
元素周期表
门捷列夫
按相对原子质量从小到大的顺序排列
从最轻的元素氢开始进行编号
原子序数
元素性质随着____________递增发生周期性的重复
1、元素周期律
原子序数
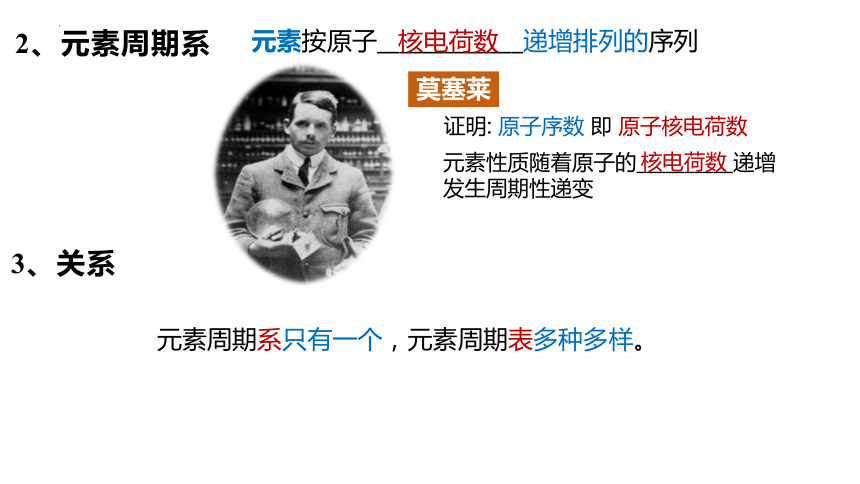
元素周期系只有一个,元素周期表多种多样。
莫塞莱
证明: 原子序数 即 原子核电荷数
元素性质随着原子的__________递增发生周期性递变
元素按原子_____________递增排列的序列
2、元素周期系
核电荷数
核电荷数
3、关系
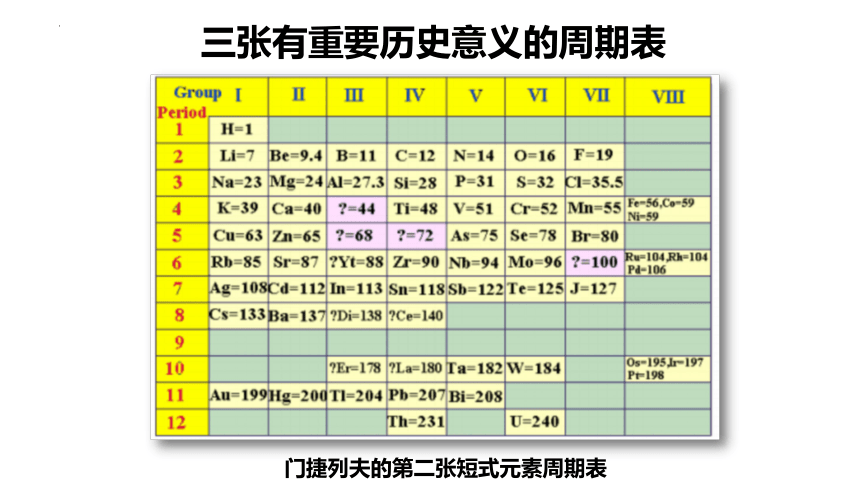
三张有重要历史意义的周期表
门捷列夫的第二张短式元素周期表
三张有重要历史意义的周期表
一张神奇的表
1871年门捷列夫
预言
类铝(Ea)
相对原子质量约为69
密度约为5.9 g/cm3~6.0g/cm3
熔点应该很低
可用分光镜发现其存在
1875年发现后
测定
镓(Ga)
相对原子质量约为69.72
密度约为5.94 g/cm3
熔点30.1℃
镓是用分光镜发现的
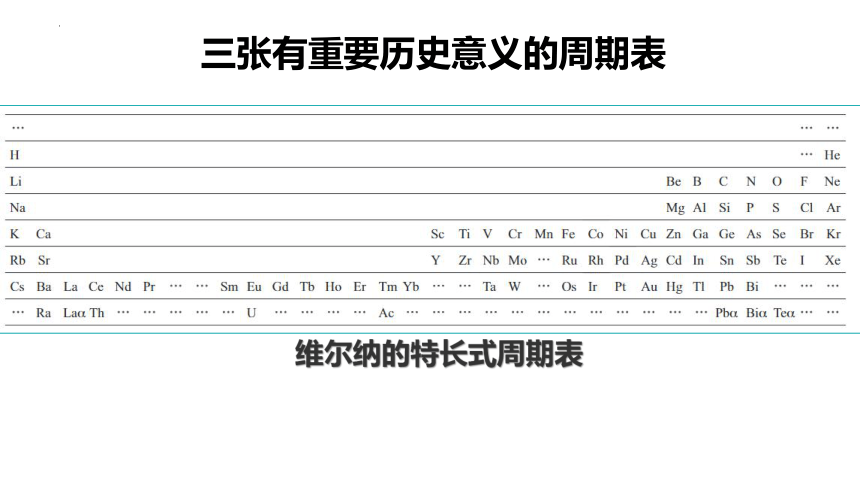
1866年12月12日,维尔纳出生在法国阿尔萨斯的一个铁匠家庭,1871年普鲁士入侵法国,家乡成了德占区,但他家仍坚持说法语,他从小倔强,有反抗精神。
进入苏黎世大学后,虽数学和几何总是不及格,但几何的空间概念和丰富想象力使他在化学中发挥了巨大作用。
1893年,他发表了"论无机化合物的结构"一文,大胆提出了划时代的配位理论,这是无机化学和配位化学结构理论的开端。
1894年他与博士姑娘结婚并加入瑞士籍,后来担任苏黎世化学研究所所长,他开始从事有机化学,后转向无机化学,最后全神贯注于配位化学。他的主要著作有"立体化学手册","论无机化合物的结构","无机化学领域的新观点"等。由于对配位理论的贡献,1913年获诺贝尔化学奖。
科学家简介
维尔纳
维尔纳的特长式周期表
三张有重要历史意义的周期表
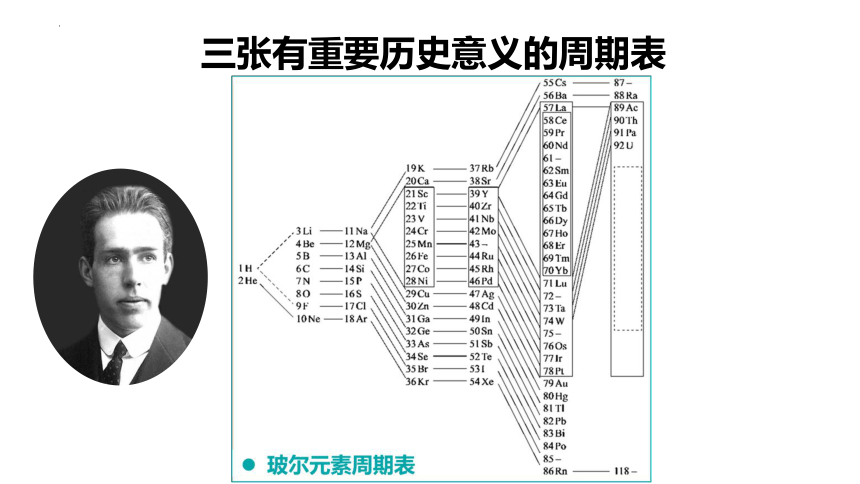
玻尔是第一个对元素周期表进行物理解释的科学家,他在1916年对门捷列夫提出的元素周期表进行了仔细研究,当时的是按相对原子质量来排列的。
玻尔首次按照电子组态的周期性进行排列,给予了元素周期表物理化的解释。
1922年,玻尔获诺贝尔奖时做了题为“原子结构(The Structure of the a Atom)”报告,有一张元素周期表。
资料在线
三张有重要历史意义的周期表
PART 02
构造原理和
元素周期表
周期的分类
周期
横
7个
三短
一、 二、 三
四长
四、 五、 六、 七
(2种)
(8种)
(8种)
(18种)
(18种)
(32种)
(32种)
元素周期律表的结构
观察与思考
族的分类
主族
主族
副族
副族
Ⅷ族
零族
族
纵
16个
7主
7副
1个
1个
纵行数 1 2
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
纵行数 3 4 5 6 7 11 12
族序数
Ⅷ
0
周期
横
7个
三短
一、 二、 三
四长
四、 五、 六、 七
(2种)
(8种)
(8种)
(18种)
(18种)
(32种)
(32种)
元素周期律表的结构
构造原理与元素周期表
之间存在什么关系呢?
根据基态原子的价层电子排布式找规律。
第一周期:
从 开始,以 结束
1s1
1s2
1s1
2s1
3s1
4s1
1s2
2s2
3s2
4s2
2s2
2p6
3s2
3p6
4s2
4p6
2s2
2p1
2s2
2p2
2s2
2p3
2s2
2p4
2s2
2p5
3s2
3p1
3s2
3p2
3s2
3p3
3s2
3p4
3s2
3p5
4s2
4p1
4s2
4p2
4s2
4p3
4s2
4p4
4s2
4p5
3d1
4s2
3d2
4s2
3d3
4s2
3d5
4s1
3d5
4s2
3d6
4s2
3d7
4s2
3d8
4s2
3d10
4s1
3d10
4s2
其余各周期:
从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
写出12号、29号元素的基态原子的电子排布式,判断属于哪个周期?
周期序数=基态原子的能层数
探究原子核外电子排布与周期的划分
周期 序数 电子 层数 各周期 增加的能级 电子数 元素
种数
1 1
2 2
3 3
4 4
5 5
6 6
7 7
1s
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
构造原理得出的核外电子排布
解释
元素周期系的基本结构
每周期的元素种数
=
以ns开始、np结束递增的核电荷数(或电子数)
2
8
8
18
18
32
32
周期 价层电子排布 各周期增加的能级 元素种数
ⅠA族 0族 最外层最多容纳电子数 一 1s1 1s2 2 1s 2
二 2s1 2s22p6 8 2s、2p 8
三 3s1 3s23p6 8 3s、3p 8
四 4s1 4s24p6 8 4s、3d、4p 18
五 5s1 5s25p6 8 5s、4d、5p 18
六 6s1 6s26p6 8 6s、4f、5d、6p 32
七 7s1 7s27p6 8 7s、5f、6d、7p 32
规律:①周期序数= = ②本周期包含的元素种数= 的2倍
=对应能级组最多容纳的电子数(递增的核电荷数或电子数)
对应能级组所含原子轨道数
原子电子层数
原子最外层能层序数
1.划分依据:取决于原子的价层电子数目和价层电子排布。主族元素的价层电子为该元素原子的最外层电子。如碱金属元素原子的价层电子排布为ns1。副族元素的价层电子与其最外层电子和次外层电子有关(镧系、锕系元素还与次次外层的f电子有关)。如铁元素的价层电子排布式为3d64s2。2.特点:同族元素的价层电子数目和价层电子排布相同。
核外电子排布与族的划分
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价层电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
3.规律①主族元素的族序数=价电子总数=最高正价(O、F除外)。同主族元素原子的价层电子排布完全相同,价层电子全部排布在ns或ns、np轨道上
核外电子排布与族的划分
3.规律:②过渡元素(副族和Ⅷ族)(第四周期为例)的价电子排布
核外电子排布与族的划分
族序数 价电子排布
ⅢB (n-1)d1ns2
ⅣB (n-1)d2ns2
ⅤB (n-1)d3ns2
ⅥB (n-1)d5ns1
ⅦB (n-1)d5ns2
Ⅷ (n-1)d6~8ns2
ⅠB (n-1)d10ns1
ⅡB (n-1)d10ns2
注意 ①ⅢB→ⅦB族:族序数=价电子数=原子最外层ns电子数+次外层(n-1)d电子数=最高正价。②Ⅷ族:原子最外层ns电子数+次外层(n-1)d电子数之和分别为8、9、10。③ⅠB和ⅡB的族序数=原子最外层电子数。
3.规律:
③0族最外层电子排布为1s2或ns2np6。
核外电子排布与族的划分
【即学即练1】
1.关于价电子排布式为
的元素的说法不正确的是
A.原子序数为25 B.价电子数为7C.位于第四周期ⅦB族 D.位于第四周期VB族
2.某元素位于周期表中第四周期ⅤA族,则该元素的名称和价电子排布式均正确的是A.砷,4s24p3 B.溴,4s24p5
C.磷,4s24p3 D.锑,5s25p3
3.根据下列微粒的最外层电子排布,能确定该元素在元素周期表中位置的是( )A.4s1 B.3d104sn
C.nsnnp3n D.ns2np3
√
√
√
如何将下图变成书末的元素周期表呢?
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
元素周期表的分区
按核外电子排布式中最后填入电子的能级符号可将元素周期表(ⅠB族、ⅡB族除外)分为s、p、d、f 以及ds这5个区
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
元素周期表的分区
元素周期表的分区
①金属元素和非金属元素的分界线为
沿 与 之间所画的一条连线,非金属性较强的元素处于元素周期表的 位置,金属性较强的元素处于元素周期表的 位置。
B、Si、As、Te、At
Al、Ge、Sb、Po
右上角
左下角
元素周期表的分区
②处于d区、ds区和f区的元素全部是 元素。s区的元素除 外,也全部是金属元素。
金属
氢
元素周期表的分区
③金属与非金属交界处元素的性质特点:在元素周期表中位于金属和非金属交界处的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为准金属或半金属(一般可用作半导体材料)。
【探究讨论】课本P21
1.为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2
s区
d区
ds区
p区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
2.s区、d区、ds区、 p区分别有几个列?
s区有2列,d区有8列,ds区有2列、 p区有6列。
【探究讨论】课本P21
(2) 为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(3) 处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
【探究讨论】课本P21
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
【探究讨论】课本P21
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
预言第八周期有多少种元素?
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
【探究讨论】课本P21
各区元素的特点
包括的元素 价层电子排布 化学性质
s区 第ⅠA、ⅡA族 ns1~2 (最后的电子填在ns上) 除氢外,都是活泼金属元素(碱金属和碱土金属元素)
p区 第ⅢA~ⅦA族、0族 ns2np1~6 (最后的电子填在np上) 随着最外层电子数目的增加,非金属性增强,金属性减弱
d区 第ⅢB~ⅦB、Ⅷ族 (n-1)d1~9ns1~2[最后的电子填在(n-1)d上] 均为过渡金属,由于d轨道都未充满电子,因此d轨道可以不同程度地参与化学键的形成
各区元素的特点
包括的元素 价层电子排布 化学性质
ds区 第ⅠB、ⅡB族 (n-1)d10ns1~2 [(n-1)d全充满] 均为过渡金属,d轨道已充满电子,因此d轨道一般不再参与化学键的形成
f区 镧系、锕系 (n-2)f0~14(n-1)d0~2ns2 镧系元素的化学性质非常相近,锕系元素的化学性质也非常相近
【即学即练2】
1.下列说法正确的是A.所有金属元素都分布在d区和ds区
B.元素周期表中IIIB~IIB族10个纵列的元素都是金属元素C.原子最外层电子数为2的元素都分布在s区
D.s区均为金属元素
2.周期表中共有18个纵列,从左到右分别为1~18列,按这种规定,下列说法正确的是A.第1列是碱金属元素
B.只有第2列的元素原子价电子排布为ns2C.第1列和第18列所含元素种数不同
D.第8列没有非金属元素
√
√
原子结构与元素的性质
第一章·第二节
第一课时
原子结构与元素周期表
PART 01
元素周期律
元素周期系
元素周期表
门捷列夫
按相对原子质量从小到大的顺序排列
从最轻的元素氢开始进行编号
原子序数
元素性质随着____________递增发生周期性的重复
1、元素周期律
原子序数
元素周期系只有一个,元素周期表多种多样。
莫塞莱
证明: 原子序数 即 原子核电荷数
元素性质随着原子的__________递增发生周期性递变
元素按原子_____________递增排列的序列
2、元素周期系
核电荷数
核电荷数
3、关系
三张有重要历史意义的周期表
门捷列夫的第二张短式元素周期表
三张有重要历史意义的周期表
一张神奇的表
1871年门捷列夫
预言
类铝(Ea)
相对原子质量约为69
密度约为5.9 g/cm3~6.0g/cm3
熔点应该很低
可用分光镜发现其存在
1875年发现后
测定
镓(Ga)
相对原子质量约为69.72
密度约为5.94 g/cm3
熔点30.1℃
镓是用分光镜发现的
1866年12月12日,维尔纳出生在法国阿尔萨斯的一个铁匠家庭,1871年普鲁士入侵法国,家乡成了德占区,但他家仍坚持说法语,他从小倔强,有反抗精神。
进入苏黎世大学后,虽数学和几何总是不及格,但几何的空间概念和丰富想象力使他在化学中发挥了巨大作用。
1893年,他发表了"论无机化合物的结构"一文,大胆提出了划时代的配位理论,这是无机化学和配位化学结构理论的开端。
1894年他与博士姑娘结婚并加入瑞士籍,后来担任苏黎世化学研究所所长,他开始从事有机化学,后转向无机化学,最后全神贯注于配位化学。他的主要著作有"立体化学手册","论无机化合物的结构","无机化学领域的新观点"等。由于对配位理论的贡献,1913年获诺贝尔化学奖。
科学家简介
维尔纳
维尔纳的特长式周期表
三张有重要历史意义的周期表
玻尔是第一个对元素周期表进行物理解释的科学家,他在1916年对门捷列夫提出的元素周期表进行了仔细研究,当时的是按相对原子质量来排列的。
玻尔首次按照电子组态的周期性进行排列,给予了元素周期表物理化的解释。
1922年,玻尔获诺贝尔奖时做了题为“原子结构(The Structure of the a Atom)”报告,有一张元素周期表。
资料在线
三张有重要历史意义的周期表
PART 02
构造原理和
元素周期表
周期的分类
周期
横
7个
三短
一、 二、 三
四长
四、 五、 六、 七
(2种)
(8种)
(8种)
(18种)
(18种)
(32种)
(32种)
元素周期律表的结构
观察与思考
族的分类
主族
主族
副族
副族
Ⅷ族
零族
族
纵
16个
7主
7副
1个
1个
纵行数 1 2
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
纵行数 3 4 5 6 7 11 12
族序数
Ⅷ
0
周期
横
7个
三短
一、 二、 三
四长
四、 五、 六、 七
(2种)
(8种)
(8种)
(18种)
(18种)
(32种)
(32种)
元素周期律表的结构
构造原理与元素周期表
之间存在什么关系呢?
根据基态原子的价层电子排布式找规律。
第一周期:
从 开始,以 结束
1s1
1s2
1s1
2s1
3s1
4s1
1s2
2s2
3s2
4s2
2s2
2p6
3s2
3p6
4s2
4p6
2s2
2p1
2s2
2p2
2s2
2p3
2s2
2p4
2s2
2p5
3s2
3p1
3s2
3p2
3s2
3p3
3s2
3p4
3s2
3p5
4s2
4p1
4s2
4p2
4s2
4p3
4s2
4p4
4s2
4p5
3d1
4s2
3d2
4s2
3d3
4s2
3d5
4s1
3d5
4s2
3d6
4s2
3d7
4s2
3d8
4s2
3d10
4s1
3d10
4s2
其余各周期:
从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
写出12号、29号元素的基态原子的电子排布式,判断属于哪个周期?
周期序数=基态原子的能层数
探究原子核外电子排布与周期的划分
周期 序数 电子 层数 各周期 增加的能级 电子数 元素
种数
1 1
2 2
3 3
4 4
5 5
6 6
7 7
1s
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
构造原理得出的核外电子排布
解释
元素周期系的基本结构
每周期的元素种数
=
以ns开始、np结束递增的核电荷数(或电子数)
2
8
8
18
18
32
32
周期 价层电子排布 各周期增加的能级 元素种数
ⅠA族 0族 最外层最多容纳电子数 一 1s1 1s2 2 1s 2
二 2s1 2s22p6 8 2s、2p 8
三 3s1 3s23p6 8 3s、3p 8
四 4s1 4s24p6 8 4s、3d、4p 18
五 5s1 5s25p6 8 5s、4d、5p 18
六 6s1 6s26p6 8 6s、4f、5d、6p 32
七 7s1 7s27p6 8 7s、5f、6d、7p 32
规律:①周期序数= = ②本周期包含的元素种数= 的2倍
=对应能级组最多容纳的电子数(递增的核电荷数或电子数)
对应能级组所含原子轨道数
原子电子层数
原子最外层能层序数
1.划分依据:取决于原子的价层电子数目和价层电子排布。主族元素的价层电子为该元素原子的最外层电子。如碱金属元素原子的价层电子排布为ns1。副族元素的价层电子与其最外层电子和次外层电子有关(镧系、锕系元素还与次次外层的f电子有关)。如铁元素的价层电子排布式为3d64s2。2.特点:同族元素的价层电子数目和价层电子排布相同。
核外电子排布与族的划分
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价层电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
3.规律①主族元素的族序数=价电子总数=最高正价(O、F除外)。同主族元素原子的价层电子排布完全相同,价层电子全部排布在ns或ns、np轨道上
核外电子排布与族的划分
3.规律:②过渡元素(副族和Ⅷ族)(第四周期为例)的价电子排布
核外电子排布与族的划分
族序数 价电子排布
ⅢB (n-1)d1ns2
ⅣB (n-1)d2ns2
ⅤB (n-1)d3ns2
ⅥB (n-1)d5ns1
ⅦB (n-1)d5ns2
Ⅷ (n-1)d6~8ns2
ⅠB (n-1)d10ns1
ⅡB (n-1)d10ns2
注意 ①ⅢB→ⅦB族:族序数=价电子数=原子最外层ns电子数+次外层(n-1)d电子数=最高正价。②Ⅷ族:原子最外层ns电子数+次外层(n-1)d电子数之和分别为8、9、10。③ⅠB和ⅡB的族序数=原子最外层电子数。
3.规律:
③0族最外层电子排布为1s2或ns2np6。
核外电子排布与族的划分
【即学即练1】
1.关于价电子排布式为
的元素的说法不正确的是
A.原子序数为25 B.价电子数为7C.位于第四周期ⅦB族 D.位于第四周期VB族
2.某元素位于周期表中第四周期ⅤA族,则该元素的名称和价电子排布式均正确的是A.砷,4s24p3 B.溴,4s24p5
C.磷,4s24p3 D.锑,5s25p3
3.根据下列微粒的最外层电子排布,能确定该元素在元素周期表中位置的是( )A.4s1 B.3d104sn
C.nsnnp3n D.ns2np3
√
√
√
如何将下图变成书末的元素周期表呢?
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
元素周期表的分区
按核外电子排布式中最后填入电子的能级符号可将元素周期表(ⅠB族、ⅡB族除外)分为s、p、d、f 以及ds这5个区
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
元素周期表的分区
元素周期表的分区
①金属元素和非金属元素的分界线为
沿 与 之间所画的一条连线,非金属性较强的元素处于元素周期表的 位置,金属性较强的元素处于元素周期表的 位置。
B、Si、As、Te、At
Al、Ge、Sb、Po
右上角
左下角
元素周期表的分区
②处于d区、ds区和f区的元素全部是 元素。s区的元素除 外,也全部是金属元素。
金属
氢
元素周期表的分区
③金属与非金属交界处元素的性质特点:在元素周期表中位于金属和非金属交界处的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为准金属或半金属(一般可用作半导体材料)。
【探究讨论】课本P21
1.为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2
s区
d区
ds区
p区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
2.s区、d区、ds区、 p区分别有几个列?
s区有2列,d区有8列,ds区有2列、 p区有6列。
【探究讨论】课本P21
(2) 为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(3) 处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
【探究讨论】课本P21
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
【探究讨论】课本P21
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
预言第八周期有多少种元素?
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
【探究讨论】课本P21
各区元素的特点
包括的元素 价层电子排布 化学性质
s区 第ⅠA、ⅡA族 ns1~2 (最后的电子填在ns上) 除氢外,都是活泼金属元素(碱金属和碱土金属元素)
p区 第ⅢA~ⅦA族、0族 ns2np1~6 (最后的电子填在np上) 随着最外层电子数目的增加,非金属性增强,金属性减弱
d区 第ⅢB~ⅦB、Ⅷ族 (n-1)d1~9ns1~2[最后的电子填在(n-1)d上] 均为过渡金属,由于d轨道都未充满电子,因此d轨道可以不同程度地参与化学键的形成
各区元素的特点
包括的元素 价层电子排布 化学性质
ds区 第ⅠB、ⅡB族 (n-1)d10ns1~2 [(n-1)d全充满] 均为过渡金属,d轨道已充满电子,因此d轨道一般不再参与化学键的形成
f区 镧系、锕系 (n-2)f0~14(n-1)d0~2ns2 镧系元素的化学性质非常相近,锕系元素的化学性质也非常相近
【即学即练2】
1.下列说法正确的是A.所有金属元素都分布在d区和ds区
B.元素周期表中IIIB~IIB族10个纵列的元素都是金属元素C.原子最外层电子数为2的元素都分布在s区
D.s区均为金属元素
2.周期表中共有18个纵列,从左到右分别为1~18列,按这种规定,下列说法正确的是A.第1列是碱金属元素
B.只有第2列的元素原子价电子排布为ns2C.第1列和第18列所含元素种数不同
D.第8列没有非金属元素
√
√
