2024中考 化学 重难专项 物质的检验与鉴别、除杂(含答案)
文档属性
| 名称 | 2024中考 化学 重难专项 物质的检验与鉴别、除杂(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 534.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-18 20:04:09 | ||
图片预览




文档简介
重难专项5 物质的检验与鉴别、除杂
类型1 物质的检验与鉴别
一、物质的检验
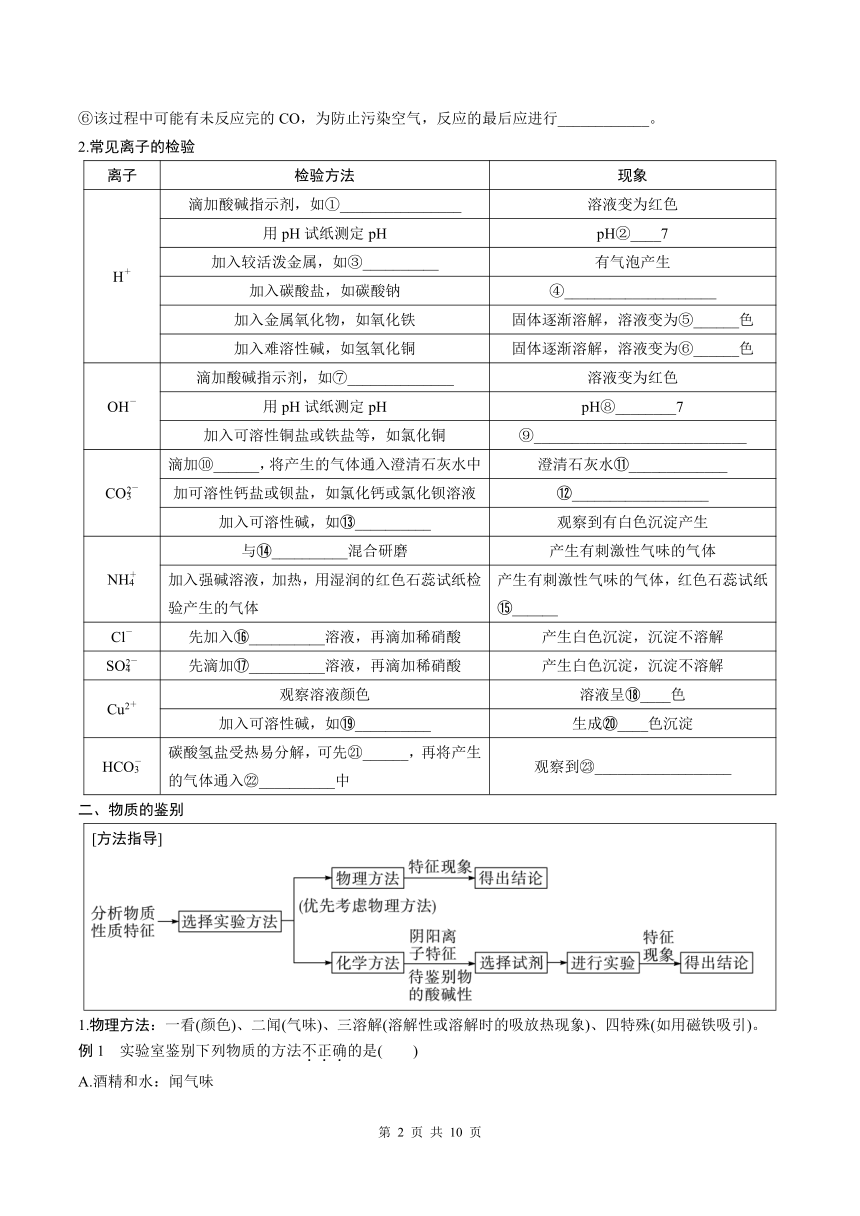
【思路与方法】 物质检验的思路与方法: 某兴趣小组同学为验证其产物中含有SO2,进行如图实验。 【查阅资料】SO2和CO2都能使澄清石灰水变浑浊,同时SO2能使品红溶液褪色。 (1)实验时先通入一段时间氧气,再点燃酒精灯,观察到气球胀大,澄清石灰水变浑浊,小丽据此得出煤燃烧产物有SO2,小华对此提出质疑,理由是___________________________________。 (2)为进一步完善方案,只需将装置B中试剂替换为_______________,若观察到溶液褪色,可证明上述结论。
1.气体的检验
(1)单一气体的检验
【备考补充】可燃物中碳、氢元素的检验:①氢元素:将可燃物点燃,用干冷的烧杯罩在火焰上方,观察到______________________;②碳元素:将可燃物点燃,用______________,观察到澄清石灰水变浑浊。
(2)混合气体的检验。某混合气体中含CO2、CO、H2和H2O,请完成相关检验
①检验H2O:在CO2、CO和H2的检验及除杂过程中涉及到溶液,会带出水,所以应先检验H2O。
②检验并除去CO2:为避免后续对CO的检验造成干扰,应先检验并除去CO2。B装置的作用是_________________;C中NaOH溶液的作用是______________________。
③用浓硫酸除去溶液中带出的水的目的是避免后续对H2的检验造成干扰。
④检验H2:利用H2还原氧化铜后得到的H2O能使白色的无水CuSO4变______的性质进行检验。
⑤检验CO:利用CO还原氧化铜后得到的CO2能使澄清石灰水变浑浊的性质进行检验。
⑥该过程中可能有未反应完的CO,为防止污染空气,反应的最后应进行____________。
2.常见离子的检验
离子 检验方法 现象
H+ 滴加酸碱指示剂,如①________________ 溶液变为红色
用pH试纸测定pH pH②____7
加入较活泼金属,如③__________ 有气泡产生
加入碳酸盐,如碳酸钠 ④____________________
加入金属氧化物,如氧化铁 固体逐渐溶解,溶液变为⑤______色
加入难溶性碱,如氢氧化铜 固体逐渐溶解,溶液变为⑥______色
OH- 滴加酸碱指示剂,如⑦______________ 溶液变为红色
用pH试纸测定pH pH⑧________7
加入可溶性铜盐或铁盐等,如氯化铜 ⑨____________________________
CO 滴加⑩______,将产生的气体通入澄清石灰水中 澄清石灰水 _____________
加可溶性钙盐或钡盐,如氯化钙或氯化钡溶液 __________________
加入可溶性碱,如 __________ 观察到有白色沉淀产生
NH 与 __________混合研磨 产生有刺激性气味的气体
加入强碱溶液,加热,用湿润的红色石蕊试纸检验产生的气体 产生有刺激性气味的气体,红色石蕊试纸 ______
Cl- 先加入 __________溶液,再滴加稀硝酸 产生白色沉淀,沉淀不溶解
SO 先滴加 __________溶液,再滴加稀硝酸 产生白色沉淀,沉淀不溶解
Cu2+ 观察溶液颜色 溶液呈 ____色
加入可溶性碱,如 __________ 生成 ____色沉淀
HCO 碳酸氢盐受热易分解,可先 ______,再将产生的气体通入 __________中 观察到 __________________
二、物质的鉴别
[方法指导]
1.物理方法:一看(颜色)、二闻(气味)、三溶解(溶解性或溶解时的吸放热现象)、四特殊(如用磁铁吸引)。
例1 实验室鉴别下列物质的方法不正确的是( )
A.酒精和水:闻气味
B.CaCO3固体和CaCl2固体:加水,观察是否溶解
C.CuCl2溶液和FeCl3溶液:观察颜色
D.铁粉和四氧化三铁:用磁铁吸引
2.化学方法:通过化学反应,观察并分析反应现象(如燃烧现象、产生气泡、沉淀、放热、变色等),得出结论。
例2 判断下列各组物质的鉴别试剂选择或方法的正误。
(1)硫酸、氢氧化钠、硫酸钠:测溶液的pH( )
(2)氢氧化钠、碳酸钠:稀盐酸( )
(3)稀盐酸和稀硫酸:氯化钡溶液( )
(4)氯化铵和氯化钠固体:硝酸银溶液( )
(5)木炭粉和氧化铜粉末:在空气中灼烧( )
例3 生活中几种常见物质的鉴别。
(1)硬水和软水:加入________,振荡,产生泡沫多、浮渣少的为________,反之为________。
(2)黄金和假黄金(铜锌合金):①加入盐酸,______________的是铜锌合金,反之为黄金。
②灼烧:有黑色物质生成的是____________。
(3)羊毛、棉花和合成纤维(灼烧法):羊毛燃烧时有________的气味;棉花燃烧时有烧纸的气味;合成纤维燃烧时有________气味。
(4)黄铜和纯铜:相互刻画,表面划痕较深的为________,反之为________。
(5)化肥:①看外观或加水:灰白色或不溶于水或部分溶于水的是磷肥。
②加________研磨:有________________产生的为铵态氮肥。
(6)白酒和白醋(闻气味):________具有醇香味,________具有酸味。
(7)食盐和小苏打:__________________________________________________________。
[针对训练]
1.区别下列物质的方法错误的是( )
A.羊绒与棉花(灼烧)
B.醋酸与盐酸(滴入酚酞)
C.硬水与软水(加入肥皂水)
D.氯化钾与氯化铵(加熟石灰研磨)
2.实验室中有两瓶失去标签的无色溶液,分别为稀盐酸与氢氧化钠溶液。下列选用的物质不能将它们鉴别出来的是( )
A.紫色石蕊溶液 B.镁条 C.氧化铜 D.硫酸钠溶液
【同类素材拓展】 第2题 实验室有一瓶失去标签的试剂如图,咨询老师后得知可能是盐酸或硫酸中的一种,为确定其成分,可选用的试剂为( ) A.铁粉 B.碳酸钠溶液 C.硝酸钡溶液 D.紫色石蕊溶液
3.有一混合气体通过澄清石灰水无明显现象,剩余气体经浓硫酸洗气后点燃,在火焰上方罩上干冷烧杯,内壁出现水雾。符合上述现象的气体组合是( )
A.H2、CO、CO2 B.N2、O2、CO2 C.H2、CH4、CO D.H2、CH4、CO2
4.(2023重庆B卷改编)鉴别是重要的实验技能。分别鉴别两组物质:①C、Fe,②稀H2SO4、Na2CO3溶液,都能选用的试剂是( )
A.O2 B.NaOH溶液 C.铁片 D.稀H2SO4
5.下列实验方案不能解决相应实际问题的是( )
选项 实际问题 实验方案
A 区分硫酸钠与碳酸钠 取样后分别加入稀盐酸
B 检验雨水是否为酸雨 取样后滴加酚酞溶液
C 区分蔗糖水和生理盐水 取样后测导电性
D 检验NaCl溶液中是否含有MgCl2 取样后加入NaOH溶液
6.某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是___________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细、干燥后的木炭(0.3 g)和CuO(2.0 g),混合均匀并装入试管,连接装置,高温反应,检验气体。
【实验过程】(1)由图示装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为________→尾气处理(填字母)。
A.①→②→③→④
B.④→①→②→③→①
C.①→④→①→③→②
D.③→④→①→②
(2)上述进一步确定CO存在的现象是_____________________(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是__________________________。
(4)写出CO尾气处理的方法:__________________(一种即可)。
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意______________________________________。
【解题有策略】 第6题 气体成分的检验 第1步:根据题干分析出需要检验的气体→气体产物中一定有CO2,要检验是否还含有CO; 第2步:根据各装置的目的分析装置的连接顺序→装置①:检验CO2,CO2使澄清石灰水变浑浊;装置②:干燥气体;装置③:检验还原性气体CO;装置④:除去混合气体中的二氧化碳; 第3步:根据实验结论写出实验现象→要确定有CO存在需观察到装置③中黑色固体变红,并且要检验通过装置③后有二氧化碳生成即生成了能使澄清石灰水变浑浊的气体。
类型2 物质的除杂
[方法指导] (1)先考虑物理方法,再考虑化学方法 (2)物理方法 ①过滤法:适用于被提纯物质与杂质中只有一种可溶于水或杂质能与水反应。 ②结晶法:适用于被提纯物质与杂质均溶于水,且溶解度随温度变化差异较大。 ③其他方法:磁铁吸引、蒸馏、吸附等。 (3)化学方法:利用杂质的化学性质将杂质转化为气体或沉淀或被提纯物质。 【注意】固体和杂质均溶于水,可转化为液体的除杂。
1.除杂原则
2.除杂方法
(1)气体除杂
(2)固体除杂
物质 杂质 除杂试剂、方法
Cu Fe 加入______________,过滤、洗涤、干燥;或用磁铁吸引
CuO Cu ________________
CaO CaCO3 ________________________________
KCl MnO2 溶解、过滤、蒸发结晶
KNO3 NaCl 溶解、降温结晶
(3)液体除杂
[方法指导] ①对比,找出杂质离子和非杂质离子;②找出与杂质离子不共存且不引入新杂质的离子;③结合杂质离子和非杂质离子,确定除杂试剂。如除去NaOH溶液中的Na2CO3:
物质(杂质) 杂质离子 除杂试剂(写化学式)
NaOH溶液(Na2CO3) ________ ________________
NaCl溶液(NaOH) ________ ________________
NaOH溶液[Ca(OH)2] ________ ________________
NaCl溶液(Na2SO4) ________ ________________
NaNO3溶液(CuSO4) ________ ________________
[针对训练]
1.下列除杂方法正确的是( )
选项 物质 (括号内为杂质) 方法
A K2CO3溶液(K2SO4) 加BaCl2溶液,过滤
B N2(O2) 将气体通过灼热的铜网
C NaOH溶液(Na2CO3) 加入稀硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
【解题有策略】 第1题 物质的除杂 第1步:明确要保留的物质和要除去的杂质→本题B选项中需要保留的物质是N2,需要除去的是O2。 第2步:判断用所给实验方案操作后所得成分→本题B选项中混合气体通过灼热的铜网,氧气与铜在加热条件下反应生成氧化铜,氮气不与灼热的铜反应。 第3步:判断能否达到实验目的。①杂质被除去的同时,主物质不能减少→如A选项最终得到的为氯化钾溶液,杂质及原物质均被除去; ②杂质被除去,且未引入新杂质→如D选项除去杂质硫酸铜,但引入新杂质硫酸亚铁。
2.除去下列物质中的杂质,所选方法正确的是( )
选项 物质 杂质 除去杂质的方法
A MnO2 KCl 加水溶解、过滤、蒸发
B NaCl Na2CO3 加入足量稀硫酸,蒸发结晶
C CO2 CO 通过氢氧化钠溶液
D C CuO 加入足量稀硫酸,过滤、洗涤、干燥
3.下表物质中含有少量杂质,其中除杂方法正确的是( )
物质 杂质 除去杂质的方法
A CaCl2溶液 HCl 滴入碳酸钠溶液
B CO2 O2 通过灼热的铜网
C NaOH Na2CO3 加入稀盐酸至不再产生气泡
D CuO Cu 加足量稀盐酸,充分搅拌后再过滤
4.除去下列物质中的少量杂质, 所选试剂及操作方法正确的是( )
选项 物质 杂质 选用试剂及操作方法
A CO CO2 通过灼热的CuO
B Cu Fe 加入足量的稀盐酸,过滤、洗涤、干燥
C CaO CaCO3 加水溶解,过滤
D NaOH溶液 Ca(OH)2溶液 加入过量的碳酸钠溶液,过滤
5.除去下列物质中含有的少量杂质,所选择的除杂方法正确的是( )
选项 物质(杂质) 除杂方法
A 硝酸铜溶液(硝酸银溶液) 加入过量的铜,充分反应后过滤
B 铜粉(石墨粉) 在空气中充分灼烧
C 氮气(氧气) 将气体缓缓通过红热的木炭粉
D 硫酸亚铁溶液(硫酸铜溶液) 加入过量的锌粉,过滤
6.[中华优秀传统文化]我国古代提纯焰硝(含 KNO3和少量 NaCl、CaCl2等)工艺的主要过程示意如下:
(1)步骤Ⅰ中,“搅拌”的作用是________________(写一种)。
(2)步骤Ⅲ加小灰水(含 K2CO3)时,发生反应的化学方程式为__________________________。
(3)如图为硝酸钾、氯化钠的溶解度曲线。步骤Ⅳ在较高温度下过滤的目的是__________________。
(4)步骤Ⅴ析出硝酸钾晶体的过程称之为________。
[强化训练]
1.鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是( )
选项 实验目的 实验设计
A 去除铁粉中的碳粉 在足量的氧气中灼烧
B 鉴别CO与H2 分别点燃,观察火焰颜色
C 去除粗盐中难溶性杂质 溶解、过滤、蒸发
D 鉴别BaCl2溶液与Ba(NO3)2溶液 分别滴加稀硫酸
2.除杂和鉴别都是进行科学探究的重要方式,下列实验设计不能达到目的的是( )
选项 实验目的 实验设计
A 除去 H2中混有的少量 HCl气体 先通过 NaOH溶液,再通过浓硫酸
B 鉴别稀盐酸与 NaCl溶液 分别滴加无色酚酞溶液,观察颜色
C 除去CaCO3中的Na2CO3 取样,加足量水溶解,过滤
D 鉴别化肥 NH4Cl和 KNO3 取样,分别加熟石灰研磨,闻气味
3.下列实验方案设计合理的是( )
选项 实验目的 实验方案
A 鉴别CO(NH2)2和K2SO4 取样,分别加入熟石灰,研磨,闻气味
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个内壁涂有澄清石灰水的烧杯
C 提纯混有少量NaCl的KNO3固体 将固体溶解,蒸发结晶
D 除去铁制品表面的铁锈 将铁制品长时间浸泡在过量的稀硫酸中
4.有A~E五种稀溶液,分别为氢氧化钙溶液、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液、稀盐酸中的一种。各取少量溶液两两混合,可以观察到:
A+E―→ 无色气体,B+E―→ 白色沉淀,其余无明显现象。回答下列问题:
(1)A为________。
(2)A与E反应的化学方程式为________________________________________。
(3)B与E反应的化学方程式为________________________________________。
(4)对还没有确定的两种溶液,下列鉴别方法中可行的是________(填序号)。
①分别滴加酚酞溶液
②分别滴加氯化镁溶液
③分别加入铁粉
重难专项5
类型1
一、1.(1)【备考补充】①烧杯内壁有水雾产生 ②涂有澄清石灰水的烧杯罩在火焰上方
(2)②检验二氧化碳 除去二氧化碳 ④蓝 ⑥尾气处理
【思路与方法】 (1)产生的二氧化碳也会使气球变大,澄清石灰水变浑浊 (2)品红溶液
2.①紫色石蕊溶液 ②< ③锌(合理即可) ④固体逐渐溶解,有气泡产生 ⑤黄 ⑥蓝 ⑦无色酚酞溶液 ⑧> ⑨产生蓝色沉淀 ⑩稀盐酸(合理即可) 变浑浊 有白色沉淀生成 氢氧化钡溶液(合理即可) 熟石灰 变蓝 硝酸银 硝酸钡(合理即可) 蓝 氢氧化钠溶液(合理即可) 蓝 加热 澄清石灰水 澄清石灰水变浑浊
二、例1 D
例2 (1)√ (2)√ (3)√ (4)× (5)√
例3 (1)肥皂水 软水 硬水 (2)①有气泡产生
②假黄金(或铜锌合金) (3)烧焦羽毛 特殊
(4)纯铜 黄铜 (5)②熟石灰 刺激性气味气体 (6)白酒 白醋 (7)加食醋,有气泡产生的为小苏打,反之为食盐(合理即可)
针对训练
1.B 2.D
【同类素材拓展】 第2题 C
3. C 4. D 5.B
6.【猜想与假设】C+CO2 2CO
【实验过程】(1)B (2)装置③前的澄清石灰水不变浑浊,装置③后的澄清石灰水变浑浊 (3)CO+CuO Cu+CO2 (4)点燃尾气(或用气球收集等,合理即可) 【延伸应用】保持室内通风,防止CO中毒
类型2
2.(2) 足量稀盐酸(或足量稀硫酸) 在氧气中加热 高温煅烧至固体质量不变 (3)CO Ca(OH)2[或Ba(OH)2] OH- CuCl2(或HCl,合理即可) Ca2+
Na2CO3 SO BaCl2 Cu2+、SO Ba(OH)2
针对训练
1.B 2.D 3.B 4.B 5.A
6.(1)加快溶解(或均匀受热)
(2)CaCl2+K2CO3 === CaCO3↓+2KCl
(3)防止硝酸钾析出 (4)结晶
强化训练
1.C 2.B 3.B
4.(1)稀盐酸
(2)2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
(3)Ca(OH)2+ Na2CO3=== CaCO3↓+2NaOH
(4)①②
类型1 物质的检验与鉴别
一、物质的检验
【思路与方法】 物质检验的思路与方法: 某兴趣小组同学为验证其产物中含有SO2,进行如图实验。 【查阅资料】SO2和CO2都能使澄清石灰水变浑浊,同时SO2能使品红溶液褪色。 (1)实验时先通入一段时间氧气,再点燃酒精灯,观察到气球胀大,澄清石灰水变浑浊,小丽据此得出煤燃烧产物有SO2,小华对此提出质疑,理由是___________________________________。 (2)为进一步完善方案,只需将装置B中试剂替换为_______________,若观察到溶液褪色,可证明上述结论。
1.气体的检验
(1)单一气体的检验
【备考补充】可燃物中碳、氢元素的检验:①氢元素:将可燃物点燃,用干冷的烧杯罩在火焰上方,观察到______________________;②碳元素:将可燃物点燃,用______________,观察到澄清石灰水变浑浊。
(2)混合气体的检验。某混合气体中含CO2、CO、H2和H2O,请完成相关检验
①检验H2O:在CO2、CO和H2的检验及除杂过程中涉及到溶液,会带出水,所以应先检验H2O。
②检验并除去CO2:为避免后续对CO的检验造成干扰,应先检验并除去CO2。B装置的作用是_________________;C中NaOH溶液的作用是______________________。
③用浓硫酸除去溶液中带出的水的目的是避免后续对H2的检验造成干扰。
④检验H2:利用H2还原氧化铜后得到的H2O能使白色的无水CuSO4变______的性质进行检验。
⑤检验CO:利用CO还原氧化铜后得到的CO2能使澄清石灰水变浑浊的性质进行检验。
⑥该过程中可能有未反应完的CO,为防止污染空气,反应的最后应进行____________。
2.常见离子的检验
离子 检验方法 现象
H+ 滴加酸碱指示剂,如①________________ 溶液变为红色
用pH试纸测定pH pH②____7
加入较活泼金属,如③__________ 有气泡产生
加入碳酸盐,如碳酸钠 ④____________________
加入金属氧化物,如氧化铁 固体逐渐溶解,溶液变为⑤______色
加入难溶性碱,如氢氧化铜 固体逐渐溶解,溶液变为⑥______色
OH- 滴加酸碱指示剂,如⑦______________ 溶液变为红色
用pH试纸测定pH pH⑧________7
加入可溶性铜盐或铁盐等,如氯化铜 ⑨____________________________
CO 滴加⑩______,将产生的气体通入澄清石灰水中 澄清石灰水 _____________
加可溶性钙盐或钡盐,如氯化钙或氯化钡溶液 __________________
加入可溶性碱,如 __________ 观察到有白色沉淀产生
NH 与 __________混合研磨 产生有刺激性气味的气体
加入强碱溶液,加热,用湿润的红色石蕊试纸检验产生的气体 产生有刺激性气味的气体,红色石蕊试纸 ______
Cl- 先加入 __________溶液,再滴加稀硝酸 产生白色沉淀,沉淀不溶解
SO 先滴加 __________溶液,再滴加稀硝酸 产生白色沉淀,沉淀不溶解
Cu2+ 观察溶液颜色 溶液呈 ____色
加入可溶性碱,如 __________ 生成 ____色沉淀
HCO 碳酸氢盐受热易分解,可先 ______,再将产生的气体通入 __________中 观察到 __________________
二、物质的鉴别
[方法指导]
1.物理方法:一看(颜色)、二闻(气味)、三溶解(溶解性或溶解时的吸放热现象)、四特殊(如用磁铁吸引)。
例1 实验室鉴别下列物质的方法不正确的是( )
A.酒精和水:闻气味
B.CaCO3固体和CaCl2固体:加水,观察是否溶解
C.CuCl2溶液和FeCl3溶液:观察颜色
D.铁粉和四氧化三铁:用磁铁吸引
2.化学方法:通过化学反应,观察并分析反应现象(如燃烧现象、产生气泡、沉淀、放热、变色等),得出结论。
例2 判断下列各组物质的鉴别试剂选择或方法的正误。
(1)硫酸、氢氧化钠、硫酸钠:测溶液的pH( )
(2)氢氧化钠、碳酸钠:稀盐酸( )
(3)稀盐酸和稀硫酸:氯化钡溶液( )
(4)氯化铵和氯化钠固体:硝酸银溶液( )
(5)木炭粉和氧化铜粉末:在空气中灼烧( )
例3 生活中几种常见物质的鉴别。
(1)硬水和软水:加入________,振荡,产生泡沫多、浮渣少的为________,反之为________。
(2)黄金和假黄金(铜锌合金):①加入盐酸,______________的是铜锌合金,反之为黄金。
②灼烧:有黑色物质生成的是____________。
(3)羊毛、棉花和合成纤维(灼烧法):羊毛燃烧时有________的气味;棉花燃烧时有烧纸的气味;合成纤维燃烧时有________气味。
(4)黄铜和纯铜:相互刻画,表面划痕较深的为________,反之为________。
(5)化肥:①看外观或加水:灰白色或不溶于水或部分溶于水的是磷肥。
②加________研磨:有________________产生的为铵态氮肥。
(6)白酒和白醋(闻气味):________具有醇香味,________具有酸味。
(7)食盐和小苏打:__________________________________________________________。
[针对训练]
1.区别下列物质的方法错误的是( )
A.羊绒与棉花(灼烧)
B.醋酸与盐酸(滴入酚酞)
C.硬水与软水(加入肥皂水)
D.氯化钾与氯化铵(加熟石灰研磨)
2.实验室中有两瓶失去标签的无色溶液,分别为稀盐酸与氢氧化钠溶液。下列选用的物质不能将它们鉴别出来的是( )
A.紫色石蕊溶液 B.镁条 C.氧化铜 D.硫酸钠溶液
【同类素材拓展】 第2题 实验室有一瓶失去标签的试剂如图,咨询老师后得知可能是盐酸或硫酸中的一种,为确定其成分,可选用的试剂为( ) A.铁粉 B.碳酸钠溶液 C.硝酸钡溶液 D.紫色石蕊溶液
3.有一混合气体通过澄清石灰水无明显现象,剩余气体经浓硫酸洗气后点燃,在火焰上方罩上干冷烧杯,内壁出现水雾。符合上述现象的气体组合是( )
A.H2、CO、CO2 B.N2、O2、CO2 C.H2、CH4、CO D.H2、CH4、CO2
4.(2023重庆B卷改编)鉴别是重要的实验技能。分别鉴别两组物质:①C、Fe,②稀H2SO4、Na2CO3溶液,都能选用的试剂是( )
A.O2 B.NaOH溶液 C.铁片 D.稀H2SO4
5.下列实验方案不能解决相应实际问题的是( )
选项 实际问题 实验方案
A 区分硫酸钠与碳酸钠 取样后分别加入稀盐酸
B 检验雨水是否为酸雨 取样后滴加酚酞溶液
C 区分蔗糖水和生理盐水 取样后测导电性
D 检验NaCl溶液中是否含有MgCl2 取样后加入NaOH溶液
6.某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是___________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细、干燥后的木炭(0.3 g)和CuO(2.0 g),混合均匀并装入试管,连接装置,高温反应,检验气体。
【实验过程】(1)由图示装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为________→尾气处理(填字母)。
A.①→②→③→④
B.④→①→②→③→①
C.①→④→①→③→②
D.③→④→①→②
(2)上述进一步确定CO存在的现象是_____________________(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是__________________________。
(4)写出CO尾气处理的方法:__________________(一种即可)。
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意______________________________________。
【解题有策略】 第6题 气体成分的检验 第1步:根据题干分析出需要检验的气体→气体产物中一定有CO2,要检验是否还含有CO; 第2步:根据各装置的目的分析装置的连接顺序→装置①:检验CO2,CO2使澄清石灰水变浑浊;装置②:干燥气体;装置③:检验还原性气体CO;装置④:除去混合气体中的二氧化碳; 第3步:根据实验结论写出实验现象→要确定有CO存在需观察到装置③中黑色固体变红,并且要检验通过装置③后有二氧化碳生成即生成了能使澄清石灰水变浑浊的气体。
类型2 物质的除杂
[方法指导] (1)先考虑物理方法,再考虑化学方法 (2)物理方法 ①过滤法:适用于被提纯物质与杂质中只有一种可溶于水或杂质能与水反应。 ②结晶法:适用于被提纯物质与杂质均溶于水,且溶解度随温度变化差异较大。 ③其他方法:磁铁吸引、蒸馏、吸附等。 (3)化学方法:利用杂质的化学性质将杂质转化为气体或沉淀或被提纯物质。 【注意】固体和杂质均溶于水,可转化为液体的除杂。
1.除杂原则
2.除杂方法
(1)气体除杂
(2)固体除杂
物质 杂质 除杂试剂、方法
Cu Fe 加入______________,过滤、洗涤、干燥;或用磁铁吸引
CuO Cu ________________
CaO CaCO3 ________________________________
KCl MnO2 溶解、过滤、蒸发结晶
KNO3 NaCl 溶解、降温结晶
(3)液体除杂
[方法指导] ①对比,找出杂质离子和非杂质离子;②找出与杂质离子不共存且不引入新杂质的离子;③结合杂质离子和非杂质离子,确定除杂试剂。如除去NaOH溶液中的Na2CO3:
物质(杂质) 杂质离子 除杂试剂(写化学式)
NaOH溶液(Na2CO3) ________ ________________
NaCl溶液(NaOH) ________ ________________
NaOH溶液[Ca(OH)2] ________ ________________
NaCl溶液(Na2SO4) ________ ________________
NaNO3溶液(CuSO4) ________ ________________
[针对训练]
1.下列除杂方法正确的是( )
选项 物质 (括号内为杂质) 方法
A K2CO3溶液(K2SO4) 加BaCl2溶液,过滤
B N2(O2) 将气体通过灼热的铜网
C NaOH溶液(Na2CO3) 加入稀硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
【解题有策略】 第1题 物质的除杂 第1步:明确要保留的物质和要除去的杂质→本题B选项中需要保留的物质是N2,需要除去的是O2。 第2步:判断用所给实验方案操作后所得成分→本题B选项中混合气体通过灼热的铜网,氧气与铜在加热条件下反应生成氧化铜,氮气不与灼热的铜反应。 第3步:判断能否达到实验目的。①杂质被除去的同时,主物质不能减少→如A选项最终得到的为氯化钾溶液,杂质及原物质均被除去; ②杂质被除去,且未引入新杂质→如D选项除去杂质硫酸铜,但引入新杂质硫酸亚铁。
2.除去下列物质中的杂质,所选方法正确的是( )
选项 物质 杂质 除去杂质的方法
A MnO2 KCl 加水溶解、过滤、蒸发
B NaCl Na2CO3 加入足量稀硫酸,蒸发结晶
C CO2 CO 通过氢氧化钠溶液
D C CuO 加入足量稀硫酸,过滤、洗涤、干燥
3.下表物质中含有少量杂质,其中除杂方法正确的是( )
物质 杂质 除去杂质的方法
A CaCl2溶液 HCl 滴入碳酸钠溶液
B CO2 O2 通过灼热的铜网
C NaOH Na2CO3 加入稀盐酸至不再产生气泡
D CuO Cu 加足量稀盐酸,充分搅拌后再过滤
4.除去下列物质中的少量杂质, 所选试剂及操作方法正确的是( )
选项 物质 杂质 选用试剂及操作方法
A CO CO2 通过灼热的CuO
B Cu Fe 加入足量的稀盐酸,过滤、洗涤、干燥
C CaO CaCO3 加水溶解,过滤
D NaOH溶液 Ca(OH)2溶液 加入过量的碳酸钠溶液,过滤
5.除去下列物质中含有的少量杂质,所选择的除杂方法正确的是( )
选项 物质(杂质) 除杂方法
A 硝酸铜溶液(硝酸银溶液) 加入过量的铜,充分反应后过滤
B 铜粉(石墨粉) 在空气中充分灼烧
C 氮气(氧气) 将气体缓缓通过红热的木炭粉
D 硫酸亚铁溶液(硫酸铜溶液) 加入过量的锌粉,过滤
6.[中华优秀传统文化]我国古代提纯焰硝(含 KNO3和少量 NaCl、CaCl2等)工艺的主要过程示意如下:
(1)步骤Ⅰ中,“搅拌”的作用是________________(写一种)。
(2)步骤Ⅲ加小灰水(含 K2CO3)时,发生反应的化学方程式为__________________________。
(3)如图为硝酸钾、氯化钠的溶解度曲线。步骤Ⅳ在较高温度下过滤的目的是__________________。
(4)步骤Ⅴ析出硝酸钾晶体的过程称之为________。
[强化训练]
1.鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是( )
选项 实验目的 实验设计
A 去除铁粉中的碳粉 在足量的氧气中灼烧
B 鉴别CO与H2 分别点燃,观察火焰颜色
C 去除粗盐中难溶性杂质 溶解、过滤、蒸发
D 鉴别BaCl2溶液与Ba(NO3)2溶液 分别滴加稀硫酸
2.除杂和鉴别都是进行科学探究的重要方式,下列实验设计不能达到目的的是( )
选项 实验目的 实验设计
A 除去 H2中混有的少量 HCl气体 先通过 NaOH溶液,再通过浓硫酸
B 鉴别稀盐酸与 NaCl溶液 分别滴加无色酚酞溶液,观察颜色
C 除去CaCO3中的Na2CO3 取样,加足量水溶解,过滤
D 鉴别化肥 NH4Cl和 KNO3 取样,分别加熟石灰研磨,闻气味
3.下列实验方案设计合理的是( )
选项 实验目的 实验方案
A 鉴别CO(NH2)2和K2SO4 取样,分别加入熟石灰,研磨,闻气味
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个内壁涂有澄清石灰水的烧杯
C 提纯混有少量NaCl的KNO3固体 将固体溶解,蒸发结晶
D 除去铁制品表面的铁锈 将铁制品长时间浸泡在过量的稀硫酸中
4.有A~E五种稀溶液,分别为氢氧化钙溶液、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液、稀盐酸中的一种。各取少量溶液两两混合,可以观察到:
A+E―→ 无色气体,B+E―→ 白色沉淀,其余无明显现象。回答下列问题:
(1)A为________。
(2)A与E反应的化学方程式为________________________________________。
(3)B与E反应的化学方程式为________________________________________。
(4)对还没有确定的两种溶液,下列鉴别方法中可行的是________(填序号)。
①分别滴加酚酞溶液
②分别滴加氯化镁溶液
③分别加入铁粉
重难专项5
类型1
一、1.(1)【备考补充】①烧杯内壁有水雾产生 ②涂有澄清石灰水的烧杯罩在火焰上方
(2)②检验二氧化碳 除去二氧化碳 ④蓝 ⑥尾气处理
【思路与方法】 (1)产生的二氧化碳也会使气球变大,澄清石灰水变浑浊 (2)品红溶液
2.①紫色石蕊溶液 ②< ③锌(合理即可) ④固体逐渐溶解,有气泡产生 ⑤黄 ⑥蓝 ⑦无色酚酞溶液 ⑧> ⑨产生蓝色沉淀 ⑩稀盐酸(合理即可) 变浑浊 有白色沉淀生成 氢氧化钡溶液(合理即可) 熟石灰 变蓝 硝酸银 硝酸钡(合理即可) 蓝 氢氧化钠溶液(合理即可) 蓝 加热 澄清石灰水 澄清石灰水变浑浊
二、例1 D
例2 (1)√ (2)√ (3)√ (4)× (5)√
例3 (1)肥皂水 软水 硬水 (2)①有气泡产生
②假黄金(或铜锌合金) (3)烧焦羽毛 特殊
(4)纯铜 黄铜 (5)②熟石灰 刺激性气味气体 (6)白酒 白醋 (7)加食醋,有气泡产生的为小苏打,反之为食盐(合理即可)
针对训练
1.B 2.D
【同类素材拓展】 第2题 C
3. C 4. D 5.B
6.【猜想与假设】C+CO2 2CO
【实验过程】(1)B (2)装置③前的澄清石灰水不变浑浊,装置③后的澄清石灰水变浑浊 (3)CO+CuO Cu+CO2 (4)点燃尾气(或用气球收集等,合理即可) 【延伸应用】保持室内通风,防止CO中毒
类型2
2.(2) 足量稀盐酸(或足量稀硫酸) 在氧气中加热 高温煅烧至固体质量不变 (3)CO Ca(OH)2[或Ba(OH)2] OH- CuCl2(或HCl,合理即可) Ca2+
Na2CO3 SO BaCl2 Cu2+、SO Ba(OH)2
针对训练
1.B 2.D 3.B 4.B 5.A
6.(1)加快溶解(或均匀受热)
(2)CaCl2+K2CO3 === CaCO3↓+2KCl
(3)防止硝酸钾析出 (4)结晶
强化训练
1.C 2.B 3.B
4.(1)稀盐酸
(2)2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
(3)Ca(OH)2+ Na2CO3=== CaCO3↓+2NaOH
(4)①②
同课章节目录
