1.3 氧化还原反应 课件(共19张PPT)-2023-2024学年高一上学期-人教版(2019)高中化学必修1
文档属性
| 名称 | 1.3 氧化还原反应 课件(共19张PPT)-2023-2024学年高一上学期-人教版(2019)高中化学必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-19 00:20:48 | ||
图片预览



文档简介
(共19张PPT)
氧化还原反应
(第一课时)
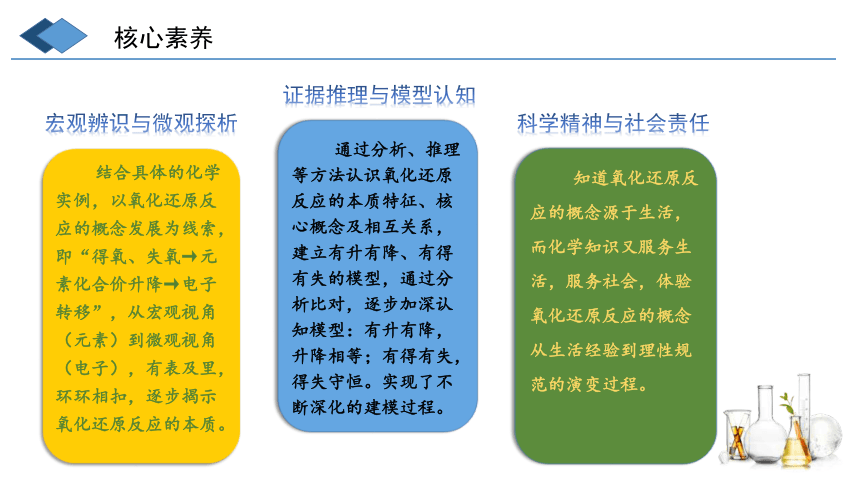
宏观辨识与微观探析
结合具体的化学实例,以氧化还原反应的概念发展为线索,即“得氧、失氧→元素化合价升降→电子转移”,从宏观视角(元素)到微观视角(电子),有表及里,环环相扣,逐步揭示氧化还原反应的本质。
证据推理与模型认知
通过分析、推理等方法认识氧化还原反应的本质特征、核心概念及相互关系,建立有升有降、有得有失的模型,通过分析比对,逐步加深认知模型:有升有降,升降相等;有得有失,得失守恒。实现了不断深化的建模过程。
科学精神与社会责任
知道氧化还原反应的概念源于生活,而化学知识又服务生活,服务社会,体验氧化还原反应的概念从生活经验到理性规范的演变过程。
核心素养
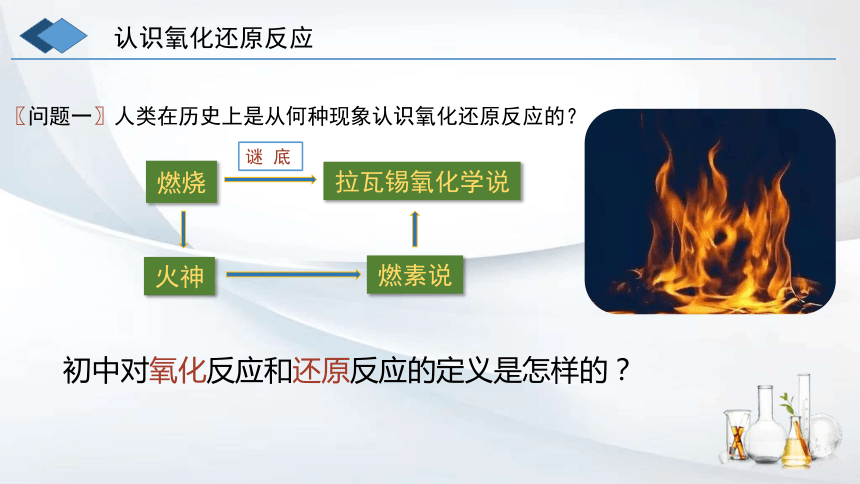
燃烧
认识氧化还原反应
火神
燃素说
拉瓦锡氧化学说
谜 底
初中对氧化反应和还原反应的定义是怎样的?
人类在历史上是从何种现象认识氧化还原反应的?
〖问题一〗
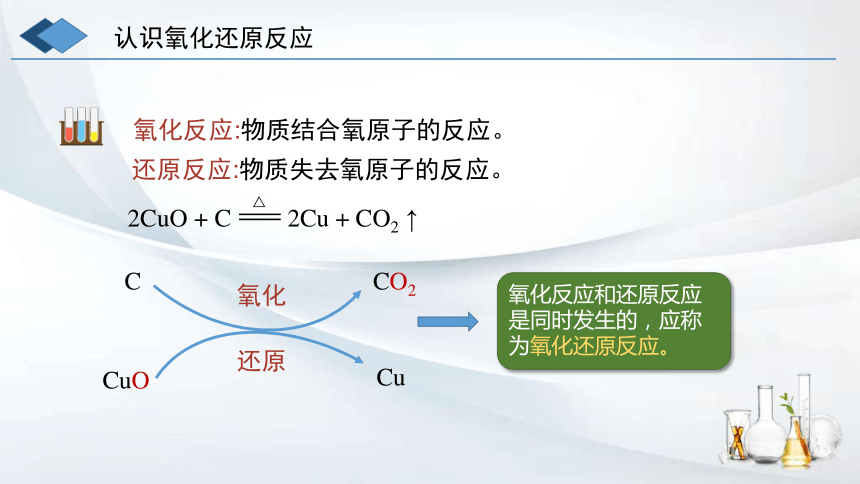
认识氧化还原反应
氧化反应:物质结合氧原子的反应。
还原反应:物质失去氧原子的反应。
2CuO + C 2Cu + CO2 ↑
△
CuO
Cu
C
CO2
氧化
还原
氧化反应和还原反应是同时发生的,应称为氧化还原反应。
以上反应与可燃物在氧气中燃烧有何共同特征?
没有氧气参与的反应也可能是燃烧吗?
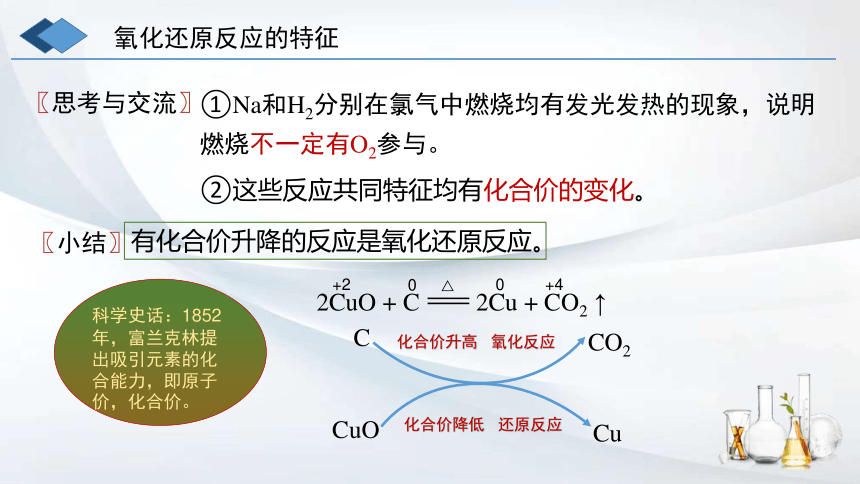
氧化还原反应的特征
〖问题二〗
〖问题三〗
请观察实验现象并思考提出的问题。
氧化还原反应的特征
②这些反应共同特征均有化合价的变化。
①Na和H2分别在氯气中燃烧均有发光发热的现象,说明
燃烧不一定有O2参与。
氧化还原反应的特征
〖小结〗
〖思考与交流〗
有化合价升降的反应是氧化还原反应。
2CuO + C 2Cu + CO2 ↑
△
+2
0
0
+4
C
CuO
CO2
Cu
化合价升高 氧化反应
化合价降低 还原反应
科学史话:1852年,富兰克林提出吸引元素的化合能力,即原子价,化合价。
氧化还原反应的特征
(1)H2O 、H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素
化合价代数和为0进行求算。
巩固提升
1、下列反应中,属于氧化还原反应的是( )
A.CaCO3+2HCl CaCl2+CO2↑ +H2O
B.CaO+H2O Ca(OH)2
C.WO3+3H2 W+3H2O
D.CaCO3 CaO +CO2↑
C
2、下列有关氧化还原反应说法错误的是( )
A、 实现Cu2+→Cu的化学反应一定是氧化还原反应
B、元素化合价升高的反应是氧化反应
C、元素化合价的升降是氧化还原反应的重要特征
D、氧化还原反应前后一定有氧的得失
D
微观探析
〖问题四〗
化合价升降的本质是什么?请从原子结构变化的角度,解释化合价变化的原因。
+11
+17
+11
+17
Na+
Cl-
+1
+17
都不易失去电子
+17
+1
H
Cl
化合价升高
化合价降低
共用电子对偏向Cl
化合价升高
化合价降低
电子的转移
本质
宏观辨识与微观探析
〖问题五〗
写出锌与硫酸溶液反应的化学方程式,判断该反应是否属于
氧化还原反应。
Zn + H2SO4 ZnSO4+ H2
0
0
+1
+2
氧化还原反应的本质
〖小结〗
有电子的转移(电子得失或共用电子对的偏移)的反应是氧化还原反应。
元素的原子失去电子
(或电子对偏离)
化合价升高
物质被氧化(氧化反应)
得到氧化产物
元素的原子得到电子
(或电子对偏向)
化合价降低
物质被还原(还原反应)
得到还原产物
科学史话:1897年,汤姆森发现了电子。
矛盾对立统一体
氧化还原反应的本质
反 应
原子结构变化
化合价变化
反应类型
1个Na失去1个e-
Na由0价→+1价
氧化反应
1个Cl得到1个e-
Cl由0价→ -1价
还原反应
共用电子对偏离H
共用电子对偏向Cl
H由0价→+1价
Cl由0价→ -1价
氧化反应
还原反应
1个Zn失去2个e-
Zn由0价→+2价
氧化反应
2个H得到2个e-
H由+1价→0价
还原反应
Zn+H2SO4 ZnSO4+H2
↑
模型认知
1个原子每失去1个e-(或一对共用电子对偏离),化合价升高1价。
1个原子每得到1个e-(或一对共用电子对偏向),化合价降低1价。
1、双线桥法
0
0
+1
-1
化合价升高2价,失去2×e-,被氧化
化合价降低2价,得到2×e-,被还原
双线桥:①箭头指向。②电子转移数目,前面数字表示有化合价变化的原子个数,后面数字表示每个原子电子转移数。③化合价升降和被氧化、被还原情况。
总结双线桥和单线桥箭头和化学符号的表征意义。
模型认知
2、单线桥法
2e-
〖思考与讨论〗
单线桥:①箭头指向。②电子转移数目。
3、下列反应中,电子转移方向、数目和反应类型正确的是( )
A、
B、
C、
D、
C
巩固提升
4、下列变化中,属于氧化反应的是( )
A、H+→H2O B、SO3→H2SO4 C、Fe3+→Fe2+ D、Cl-→Cl2
A
课后活动
氧化还原反应在工农业生产、科学技术和日常生活中的作用意义,例如:氧化还原反应在金属冶炼工业、化工产品(合成氨,工业制硝酸等)的生产、农业生产,化学电源的制造等方面的应用。请同学们课后查找有关资料加深对氧化还原反应的认识。
课堂小结
观察现象
燃烧
提出假设
燃素说
证据推理
氧化还原反应特征(化合价的变化)
模型认知
氧化还原反应实质(电子的转移与表示)
实际应用
氧化还原反应与生活实际
从氧化还原的认识规律展开
结束语
敬请批评指正!
Thank You!
氧化还原反应
(第一课时)
宏观辨识与微观探析
结合具体的化学实例,以氧化还原反应的概念发展为线索,即“得氧、失氧→元素化合价升降→电子转移”,从宏观视角(元素)到微观视角(电子),有表及里,环环相扣,逐步揭示氧化还原反应的本质。
证据推理与模型认知
通过分析、推理等方法认识氧化还原反应的本质特征、核心概念及相互关系,建立有升有降、有得有失的模型,通过分析比对,逐步加深认知模型:有升有降,升降相等;有得有失,得失守恒。实现了不断深化的建模过程。
科学精神与社会责任
知道氧化还原反应的概念源于生活,而化学知识又服务生活,服务社会,体验氧化还原反应的概念从生活经验到理性规范的演变过程。
核心素养
燃烧
认识氧化还原反应
火神
燃素说
拉瓦锡氧化学说
谜 底
初中对氧化反应和还原反应的定义是怎样的?
人类在历史上是从何种现象认识氧化还原反应的?
〖问题一〗
认识氧化还原反应
氧化反应:物质结合氧原子的反应。
还原反应:物质失去氧原子的反应。
2CuO + C 2Cu + CO2 ↑
△
CuO
Cu
C
CO2
氧化
还原
氧化反应和还原反应是同时发生的,应称为氧化还原反应。
以上反应与可燃物在氧气中燃烧有何共同特征?
没有氧气参与的反应也可能是燃烧吗?
氧化还原反应的特征
〖问题二〗
〖问题三〗
请观察实验现象并思考提出的问题。
氧化还原反应的特征
②这些反应共同特征均有化合价的变化。
①Na和H2分别在氯气中燃烧均有发光发热的现象,说明
燃烧不一定有O2参与。
氧化还原反应的特征
〖小结〗
〖思考与交流〗
有化合价升降的反应是氧化还原反应。
2CuO + C 2Cu + CO2 ↑
△
+2
0
0
+4
C
CuO
CO2
Cu
化合价升高 氧化反应
化合价降低 还原反应
科学史话:1852年,富兰克林提出吸引元素的化合能力,即原子价,化合价。
氧化还原反应的特征
(1)H2O 、H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素
化合价代数和为0进行求算。
巩固提升
1、下列反应中,属于氧化还原反应的是( )
A.CaCO3+2HCl CaCl2+CO2↑ +H2O
B.CaO+H2O Ca(OH)2
C.WO3+3H2 W+3H2O
D.CaCO3 CaO +CO2↑
C
2、下列有关氧化还原反应说法错误的是( )
A、 实现Cu2+→Cu的化学反应一定是氧化还原反应
B、元素化合价升高的反应是氧化反应
C、元素化合价的升降是氧化还原反应的重要特征
D、氧化还原反应前后一定有氧的得失
D
微观探析
〖问题四〗
化合价升降的本质是什么?请从原子结构变化的角度,解释化合价变化的原因。
+11
+17
+11
+17
Na+
Cl-
+1
+17
都不易失去电子
+17
+1
H
Cl
化合价升高
化合价降低
共用电子对偏向Cl
化合价升高
化合价降低
电子的转移
本质
宏观辨识与微观探析
〖问题五〗
写出锌与硫酸溶液反应的化学方程式,判断该反应是否属于
氧化还原反应。
Zn + H2SO4 ZnSO4+ H2
0
0
+1
+2
氧化还原反应的本质
〖小结〗
有电子的转移(电子得失或共用电子对的偏移)的反应是氧化还原反应。
元素的原子失去电子
(或电子对偏离)
化合价升高
物质被氧化(氧化反应)
得到氧化产物
元素的原子得到电子
(或电子对偏向)
化合价降低
物质被还原(还原反应)
得到还原产物
科学史话:1897年,汤姆森发现了电子。
矛盾对立统一体
氧化还原反应的本质
反 应
原子结构变化
化合价变化
反应类型
1个Na失去1个e-
Na由0价→+1价
氧化反应
1个Cl得到1个e-
Cl由0价→ -1价
还原反应
共用电子对偏离H
共用电子对偏向Cl
H由0价→+1价
Cl由0价→ -1价
氧化反应
还原反应
1个Zn失去2个e-
Zn由0价→+2价
氧化反应
2个H得到2个e-
H由+1价→0价
还原反应
Zn+H2SO4 ZnSO4+H2
↑
模型认知
1个原子每失去1个e-(或一对共用电子对偏离),化合价升高1价。
1个原子每得到1个e-(或一对共用电子对偏向),化合价降低1价。
1、双线桥法
0
0
+1
-1
化合价升高2价,失去2×e-,被氧化
化合价降低2价,得到2×e-,被还原
双线桥:①箭头指向。②电子转移数目,前面数字表示有化合价变化的原子个数,后面数字表示每个原子电子转移数。③化合价升降和被氧化、被还原情况。
总结双线桥和单线桥箭头和化学符号的表征意义。
模型认知
2、单线桥法
2e-
〖思考与讨论〗
单线桥:①箭头指向。②电子转移数目。
3、下列反应中,电子转移方向、数目和反应类型正确的是( )
A、
B、
C、
D、
C
巩固提升
4、下列变化中,属于氧化反应的是( )
A、H+→H2O B、SO3→H2SO4 C、Fe3+→Fe2+ D、Cl-→Cl2
A
课后活动
氧化还原反应在工农业生产、科学技术和日常生活中的作用意义,例如:氧化还原反应在金属冶炼工业、化工产品(合成氨,工业制硝酸等)的生产、农业生产,化学电源的制造等方面的应用。请同学们课后查找有关资料加深对氧化还原反应的认识。
课堂小结
观察现象
燃烧
提出假设
燃素说
证据推理
氧化还原反应特征(化合价的变化)
模型认知
氧化还原反应实质(电子的转移与表示)
实际应用
氧化还原反应与生活实际
从氧化还原的认识规律展开
结束语
敬请批评指正!
Thank You!
