第12章盐基础复习题(含解析)2023-2024学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第12章盐基础复习题(含解析)2023-2024学年九年级化学京改版(2013)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 328.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-19 00:00:00 | ||
图片预览



文档简介
第12章 盐 基础复习题
一、选择题
1.王阿姨种植的盆栽近期叶片发黄,查询后发现是缺氮所致。王阿姨可在盆栽中适量施用( )
A.Ca(H2PO4) 2 B.KH2PO4
C.NH4NO3 D.K2SO4
2.某小孩将零食包装袋中的干燥剂(主要成分为CaO)放入盛有水的塑料瓶中,盖紧瓶盖后摇一摇,竟然发生爆炸。下列有关CaO的说法正确的是
A.是石灰石的主要成分
B.作干燥剂能有效避免食品氧化变质
C.与水反应得到的生成物微溶于水
D.长期暴露于空气中将转化为Ca(OH)2
3.类比推理是一种重要的学习方法,下列推理正确的是( )
A.氢氧化钠与氯化铵固体研磨反应放出氨气,同理氢氧化钾也能与硝酸铵反应放出氨气
B.常温下,铝表面的氧化铝能起到保护作用,同理铁表面的氧化铁也能起到保护作用
C.离子是带电的原子或原子团,同理带电的粒子就是离子
D.浓硫酸有吸水性,同理浓盐酸也有吸水性
4.下列各组物质同时加入水中,能得到无色透明溶液的是
A.H2SO4 NaCl Na2SO4
B.Ba(NO3)2 H2SO4 NaOH
C.NaCl NaOH CuSO4
D.FeCl3 KNO3 KCl
5.某无色溶液中存在大量的 K+、OH-、CO,该溶液中还可能大量存在的离子是( )
A.H+ B.NH C.Fe3+ D.SO
6.分类是学习化学的一种重要方法。下列物质所属类别有错误的一组是
选项 物质 类别
A 煤、石油、干冰 混合物
B 氮气、水银、金刚石 单质
C 氨水、尿素、碳酸氢铵 氮肥
D 甲烷、乙醇、乙酸 有机物
A.A B.B C.C D.D
7.一蔬一饭,即是生活。焙制糕点所用的发酵粉的主要成分之一是小苏打,小苏打的化学式为
A.Na2CO3 B.NaHCO3 C.NaOH D.NaCl
8.除去如表各组物质中的杂质,所用试剂和方法不可行的是
序号 物质 杂质(少量) 试剂和操作方法
A Na2CO3粉末 NaHCO3粉末 加热
B KNO3溶液 Ba(NO3)2溶液 加入适量的Na2SO4溶液,过滤
C FeSO4溶液 CuSO4 加足量的铁粉,充分反应后过滤
D 稀盐酸 稀硫酸 加入适量氯化钡溶液,过滤
A.A B.B C.C D.D
9.将下列各组物质加水后混合,有化学反应发生,但既无沉淀生成,又无气体放出的是____________。
A.CaCl2、KOH、Na2CO3
B.K2CO3、BaCl2、HCl
C.K2SO4、HCl、NaOH
D.CuSO4、HCl、NaCl
10.下列实验设计能达到实验目的的是
选项 实验目的 实验设计
A 除去中混有的固体 加足量水溶解、过滤、洗涤、烘干
B 除去CO2中混有的HCl 先通过足量氢氧化钠溶液,再通过浓硫酸
C 除去CuO中的Cu 加入过量稀盐酸
D 除去NaCl溶液中混有的Na2SO4 滴加过量BaCl2溶液后过滤
A.A B.B C.C D.D
11.把NaCl、Fe(OH)3、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2O NaOH H2SO4
B.H2O KOH HCl
C.H2O NaOH HCl
D.H2O KOH H2SO4
12.物质与水发生的复分解反应称为水解反应。例如: 。根据上述观点,下列说法中不正确的是
A.NaF的水解产物是NaOH和HF
B.CaC2的水解产物是Ca(OH)2和C2H2
C.PCl3的水解产物之一是PH3
D.Mg3N2水解产物是Mg(OH)2和NH3
二、填空与简答
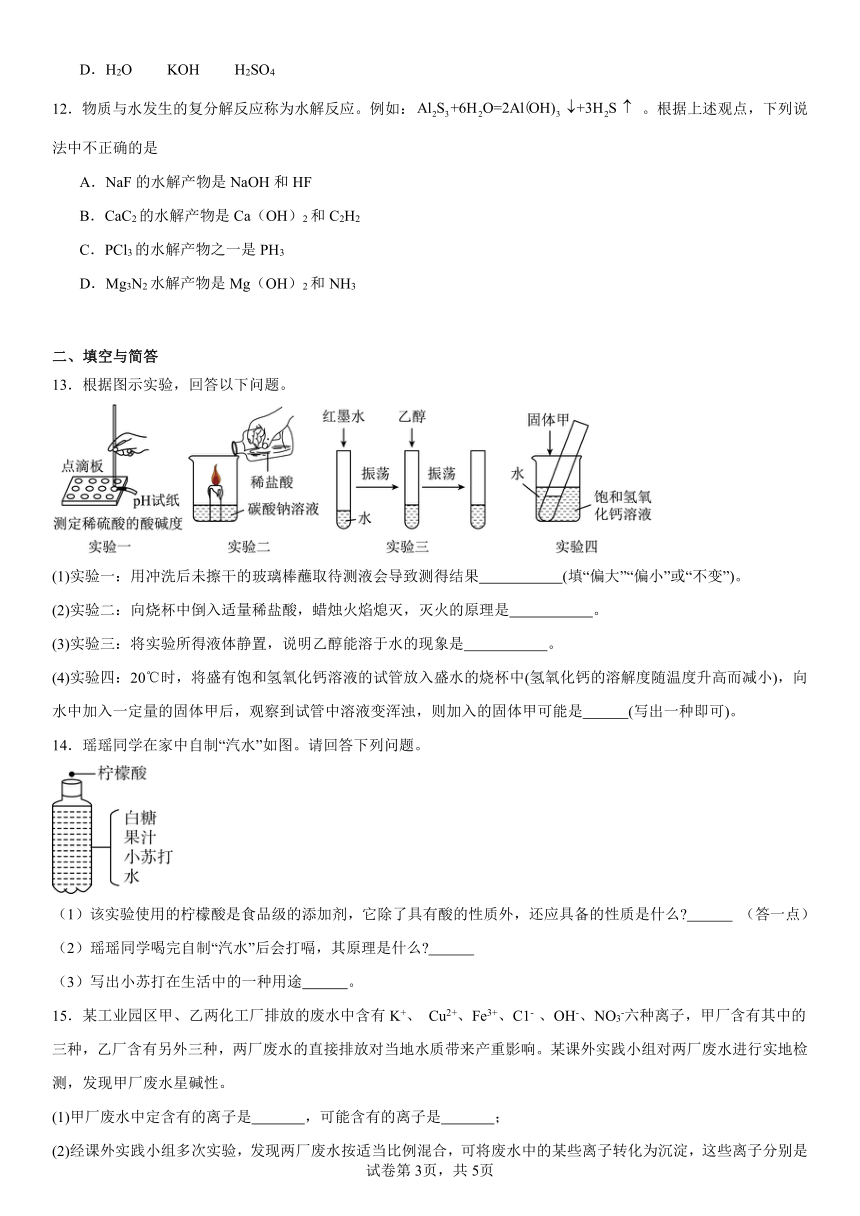
13.根据图示实验,回答以下问题。
(1)实验一:用冲洗后未擦干的玻璃棒蘸取待测液会导致测得结果 (填“偏大”“偏小”或“不变”)。
(2)实验二:向烧杯中倒入适量稀盐酸,蜡烛火焰熄灭,灭火的原理是 。
(3)实验三:将实验所得液体静置,说明乙醇能溶于水的现象是 。
(4)实验四:20℃时,将盛有饱和氢氧化钙溶液的试管放入盛水的烧杯中(氢氧化钙的溶解度随温度升高而减小),向水中加入一定量的固体甲后,观察到试管中溶液变浑浊,则加入的固体甲可能是 (写出一种即可)。
14.瑶瑶同学在家中自制“汽水”如图。请回答下列问题。
(1)该实验使用的柠檬酸是食品级的添加剂,它除了具有酸的性质外,还应具备的性质是什么 (答一点)
(2)瑶瑶同学喝完自制“汽水”后会打嗝,其原理是什么
(3)写出小苏打在生活中的一种用途 。
15.某工业园区甲、乙两化工厂排放的废水中含有K+、 Cu2+、Fe3+、C1- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来产重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水星碱性。
(1)甲厂废水中定含有的离子是 ,可能含有的离子是 ;
(2)经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是 (填离子符号),过滤后的废水中主要含有 两种物质(填化学式),处理后的废水符合排放标准。
16.请从氧气、水、尿素、磷酸二氢铵中选择适当的物质,用化学式填空:人体含量最多的物质是 ;属于复合肥的是 。
17.从①H②N③④⑤氦⑥K中进行适当选择,用符合要求的化学用语填空:
(1)用于填充气球和焊接金属的保护气 。
(2)由③和④形成的一种氧化物 。
(3)写出一种碱的化学式 。
(4)上述元素组成的一种复合肥 。
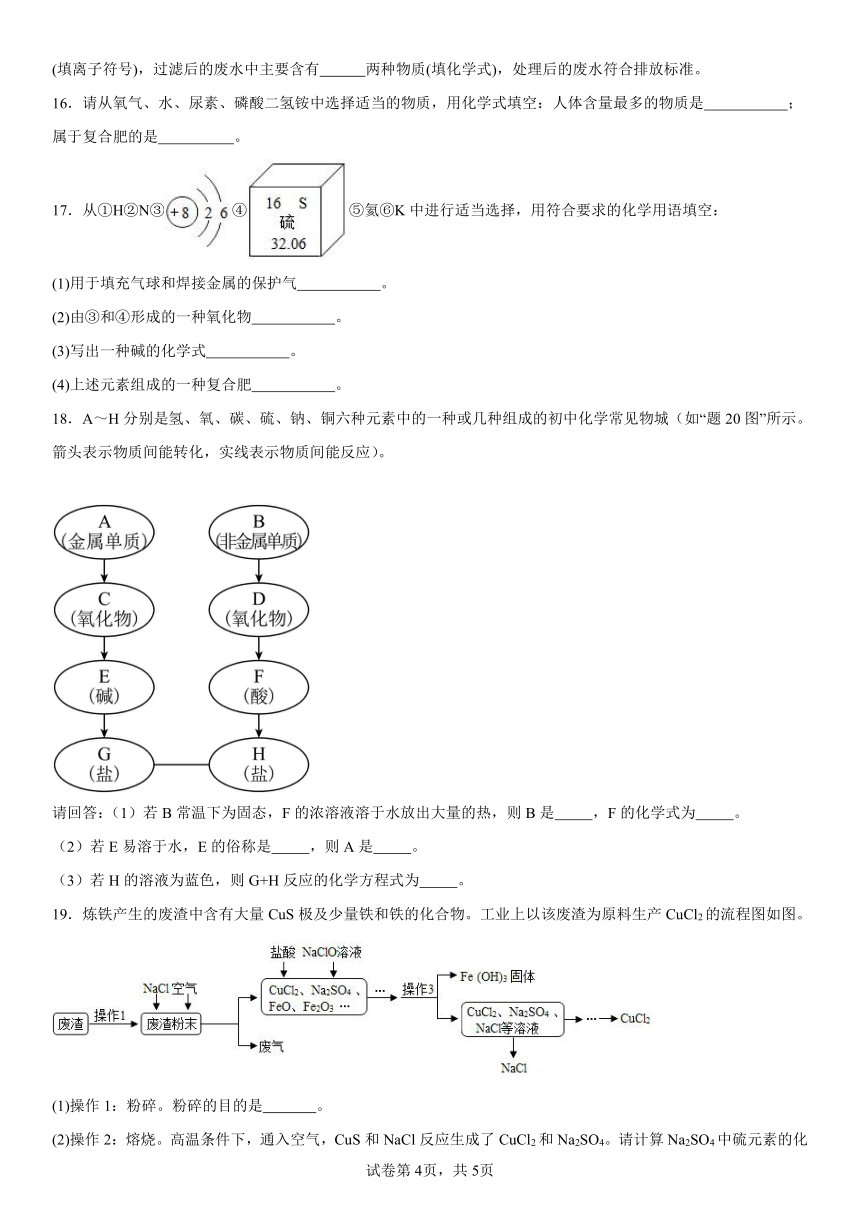
18.A~H分别是氢、氧、碳、硫、钠、铜六种元素中的一种或几种组成的初中化学常见物城(如“题20图”所示。箭头表示物质间能转化,实线表示物质间能反应)。
请回答:(1)若B常温下为固态,F的浓溶液溶于水放出大量的热,则B是 ,F的化学式为 。
(2)若E易溶于水,E的俗称是 ,则A是 。
(3)若H的溶液为蓝色,则G+H反应的化学方程式为 。
19.炼铁产生的废渣中含有大量CuS极及少量铁和铁的化合物。工业上以该废渣为原料生产CuCl2的流程图如图。
(1)操作1:粉碎。粉碎的目的是 。
(2)操作2:熔烧。高温条件下,通入空气,CuS和NaCl反应生成了CuCl2和Na2SO4。请计算Na2SO4中硫元素的化合价 。
(3)操作3: (填操作名称)。
(4)流程图中能循环利用的物质是 。
三、科学探究题
20.草木灰是农家肥料,主要含钾盐。请回答相关问题。
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是 ;
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是 ;
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。
【成分探究】
(4)取得的晶体少量溶于水,分别倒入到两支试管中。
(5)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体。请写出使澄清石灰水变浑浊的化学方程式: ;
(6)第二支:滴加酚酞溶液后,溶液变为红色,说明溶液 性。为证明溶液呈碱性是由CO32﹣引起的,再向试管中加入 [可供选择试剂:澄清石灰水、KCl溶液(呈中性)、CaCl2溶液(呈中性)],此时发生反应的方程式为 ,当看到 时即可证明。
四、计算题
21.某校综合实践活动小组在进行”诚信商品”研究时,检验商品标签所列成分及含量与事实是否相符,随机取出市售某纯碱样品(成分说明见图)。经检验杂质仅是氯化钠,准确称取样品10.9克,加入50克氯化钙溶液使其充分反应(纯碱指碳酸钠),将反应生成的沉淀物经过滤、洗涤、干燥后得到白色固体10克。
纯碱 化学式:Na2CO3 杂质:NaCl<5%
(1)此产品能否列入诚信商品。
(2)所用氯化钙溶液中溶质质量分数。
(3)生成物溶液中溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】根据题意,种植的盆栽近期叶片发黄,查询后发现是缺氮所致,应施用含氮元素的化肥,进行分析判断。
【详解】A、Ca(H2PO4)2中含有磷元素,属于磷肥,故选项错误。
B、KH2PO4中含有钾元素和磷元素,属于复合肥,故选项错误。
C、NH4NO3中含有氮元素,属于氮肥,故选项正确。
D、K2SO4中含有钾元素,属于钾肥,故选项错误。故选C。
【点睛】掌握化肥的种类及作用是正确解答本题的关键。
2.C
【详解】A、石灰石的主要成分是碳酸钙,氧化钙俗称生石灰,不符合题意;
B、氧化钙能与水反应生成氢氧化钙,故可作干燥剂,但是不能吸收氧气,不能有效避免食品氧化变质,不符合题意;
C、氧化钙与水反应生成氢氧化钙,氢氧化钙微溶于水,符合题意;
D、氧化钙能与水反应生成氢氧化钙,氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,故长期暴露于空气中,会将其转化为碳酸钙,不符合题意。
故选C。
3.A
【详解】A、氢氧化钠与氯化铵固体 研磨反应放出氨气,同理氢氧化钾也能与硝酸铵反应放出氨气,故选项推理正确;B、铝表面的氧化铝薄膜能起到保护作用,但铁表面的铁锈很疏松,不能起到保护作用,故选项推理错误;C、离子是带电的原子或原子团,带电的粒子不一定是离子,也可能是质子、电子等,故选项推理错误;D、浓盐酸具有挥发性,敞口放置后溶质氯化氢挥发;浓硫酸具有吸水性,故选项推理错误。故选A。
4.A
【详解】A、各物质间都不发生化学反应,且都是无色的,故A正确;
B、硝酸钡与硫酸会产生硫酸钡沉淀,不满足条件,故B错误;
C、硫酸铜溶于水得到蓝色溶液,不满足条件,故C错误;
D、氯化铁溶于水得到黄色溶液,不满足条件,故D错误;
故选A。
5.D
【分析】复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存。
【详解】A、氢离子和氢氧根离子生成水,氢离子和碳酸根离子生成水和二氧化碳,不能大量共存,故A不正确;
B、铵根离子和氢氧根离子生成水和氨气,不能大量共存,故B不正确;
C、铁离子溶液显黄色,和氢氧根离子生成氢氧化铁沉淀,不能大量共存,故C不正确;
D、硫酸根离子和K+、OH-、CO均不能生成沉淀、气体和水,均不反应,能大量共存,故D正确。故选D。
6.A
【详解】A、煤的主要成分是碳、含有氮、硫等杂质,属于混合物;石油中含有汽油、煤油、柴油等多种物质,属于混合物;干冰是固态二氧化碳,由一种物质组成属于纯净物。错误;
B、氮气是由氮元素组成的纯净物,水银是由汞元素组成的纯净物、金刚石是由碳元素组成的纯净物,三种物质都属于单质,正确;
C、氨水、尿素、碳酸氢铵都含有氮元素,属于氮肥,正确;
D、甲烷、乙醇、乙酸都是含有碳元素的化合物,属于有机物,正确。
故选A。
7.B
【详解】小苏打是碳酸氢钠的俗称,碳酸氢钠的化学式为NaHCO3。
故选B。
8.B
【详解】A、NaHCO3粉末在加热条件下生成碳酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
B、硝酸钡能与适量的硫酸钠溶液反应生成硫酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误。
C、足量的铁粉能与CuSO4溶液反应生成硫酸亚铁溶液和铜,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、稀硫酸能与适量氯化钡溶液反应生成硫酸钡沉淀和盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:B。
9.C
【分析】根据碳酸根离子会与钙离子生成沉淀;碳酸根离子会与氢离子生成气体;氢离子会与氢氧根离子生成水进行分析解答。
【详解】A、氯化钙会与碳酸钠反应生成白色的碳酸钙沉淀,而要求无沉淀生成,不符合题意。
B、虽然碳酸钾和氯化钡会生成会生成碳酸钡沉淀,但是该沉淀会溶于酸,碳酸钡会与盐酸反应生成二氧化碳气体,而题中要求无气体放出,不符合题意。
C、硫酸和氢氧化钠反应生成了水和硫酸钠,酸碱中和,会反应,生成的水且无沉淀、气体,符合题意。
D、CuSO4、HCl、NaCl两两之间都无反应发生,题中要求能发生化学反应,不符合题意。
故选:C。
10.A
【详解】A、氯化钙易溶于水,碳酸钙不溶于水,加入足量的水溶解,过滤,洗涤、烘干得到碳酸钙;符合题意;
B、氢氧化钠和二氧化碳反应生成碳酸钠和水,氢氧化钠溶液和HCl反应产生氯化钠和水,二氧化碳也被反应了;不符合题意;
C、铜不与盐酸反应,氧化铜和盐酸反应产生氯化铜和水,主要物质被反应了;不符合题意;
D、加入过量的BaCl2溶液和硫酸钠反应产生硫酸钡沉淀和氯化钠,过滤除去了硫酸钡,但是引入了过量的氯化钡;不符合题意;
故选:A。
11.C
【解析】根据Fe(OH)3难溶于水,氯化钠、氯化镁易溶于水,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,氢氧化镁能与稀盐酸反应生成氯化镁和水,进行分析解答。
【详解】A、Fe(OH)3难溶于水,NaCl、MgCl2溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3;然后滴加适量的氢氧化钠溶液,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,再进行过滤,分离出氯化钠溶液和氢氧化镁沉淀;最后向氢氧化镁沉淀中滴加稀硫酸,氢氧化镁能与硫酸反应生成硫酸镁和水,引入ア新的杂质硫酸钠,故选项错误;
B、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出CaCO3;然后滴加适量的氢氧化钾溶液,氯化镁能与氢氧化钾溶液反应生成氢氧化镁白色沉淀和氯化钾,引入了新的杂质氯化钾,故选项错误;
C、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3,然后滴加适量的氢氧化钠溶液,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,再进行过滤,分离出氯化钠溶液和氢氧化镁沉淀;最后向氢氧化镁沉淀中滴加稀盐酸,氢氧化镁能与稀盐酸反应生成氯化镁和水;能将固体混合物逐一分离,故选项正确;
D、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3,然后滴加适量的氢氧化钾溶液,氯化镁能与氢氧化钾溶液反应生成氢氧化镁白色沉淀和氯化钾,引入了新的杂质氯化钾,氢氧化镁沉淀中滴加稀硫酸,氢氧化镁能与硫酸反应生成硫酸镁和水;引入了新的杂质硫酸钠,故选项错误。
故选:C。
【点睛】本题难度不大,考查物质的分离,熟练掌握酸碱盐的化学性质并能灵活运用是正确解答本题的关键,解题时要注意反应后不能引入新的杂质。
12.C
【分析】根据题意的分析可知,Al2S3和水发生复分解反应。
复分解反应是两种化合物互相交换成分,生成另外两种新的化合物的反应。
Al2S3和水反应,则Al2S3中的铝离子和水中的氢氧根结合形成氢氧化铝,Al2S3中的硫离子和水中的氢离子结合形成硫化氢气体。
【详解】A、通过分析可知,NaF和水发生复分解反应的方程式为:NaF+H2O=NaOH+HF↑。故A正确;
B、通过分析可知,CaC2和水发生复分解反应的方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑。故B正确;
C、通过分析可知,PCl3和水发生复分解反应的产物不可能是PH3,故C错误;
D、通过分析可知,Mg3N2和水发生复分解反应的方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。故D正确。
故选C。
13.(1)偏大
(2)隔绝氧气
(3)溶液呈均匀红色,不分层
(4)NaOH/CaO
【详解】(1)实验一:用冲洗后未擦干的玻璃捧蘸取待测液,由于溶液被稀释,会导致酸的浓度降低,酸性变弱,测得结果偏大;
(2)实验二:由于碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳密度比空气大,且二氧化碳既不能燃烧也不支持燃烧,当二氧化碳充满烧杯,会隔绝氧气使蜡烛熄灭;
(3)实验三:乙醇能溶于水,说明乙醇与水能形成溶液,将实验所得液体静置,说明乙醇能溶于水的现象是红色均匀,不分层。
(4)实验四:氢氧化钙的溶解度随温度升高而减小,向水中加入一定量的固体甲后,观察到试管中溶液变浑浊,说明溶液的温度升高,氧化钙与水反应放热,氢氧化钠固体溶于水放热,则加入的固体甲可能是NaOH(或CaO)。
14. 无毒无害、易溶于水等 温度升高,气体溶解度减小 治疗胃酸过多症;焙制糕点所用的发酵粉的主要成分之一
【详解】(1)柠檬酸做为食品级添加剂,首先要满足无毒无害的特点,其次用于制“汽水”还应满足易溶于水等特点。
(2)喝完“汽水”后会打嗝,主要是因为柠檬酸和小苏打发生反应会有二氧化碳气体产生,当人体喝入“汽水”后,“汽水”由常温进入人体,温度升高,二氧化碳气体的溶解度因温度升高而减小,所以喝完“汽水”后会打嗝。
(3)小苏打可以用于做糕点类发酵粉,也可以用于治疗胃酸过多症,还可以清理油污。
15. OH-和K+ 氯离子,硝酸根离子 OH-,Fe3+,Cu2+ KCl和KNO3
【详解】(1)甲厂的废水呈碱性,故废水中一定含有氢氧根离子,不可能 含有铜离子和铁离子,则一定含有钾离子,可能含有氯离子,硝酸根离子;
(2)铜离子和铁离子遇到氢氧根离子生成沉淀,故这些离子是OH-,Fe3+,Cu2+;过滤后溶液中含有的阴离子主要由氯离子和硝酸根离子,阳离子含有钾离子,故过滤后的废水中主要含有KCl和KNO3;
16. H2O NH4H2PO4
【详解】人体中含量最多的物质是水,其化学式为:H2O;氮、磷、钾三种元素中至少含有两种的化肥是复合肥,磷酸二氢铵含N、P两种营养元素,属于复合肥,其化学式为:NH4H2PO4。
17.(1)He
(2)SO2(或SO3)
(3)KOH(或NH3·H2O)
(4)KNO3
【详解】(1)氦气密度小,化学性质稳定,可用于填充气球和焊接金属的保护气,故填:He。
(2)③质子数是8属于氧元素,④是硫元素,可以形成的氧化物有二氧化硫或三氧化硫,故填:SO2(或SO3)。
(3)氢氧化钾和氨水都属于碱,故填:KOH(或NH3·H2O)。
(4)硝酸钾含有钾元素和氮元素,属于复合肥,故填:KNO3。
18. S H2SO4 烧碱(或火碱、苛性钠) 钠 Na2CO3+CuSO4=CuCO3↓+Na2SO4
【分析】根据A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质,若B常温下为固态,又是非金属单质,所以B是硫,硫转化成的氧化物又会生成酸,所以D是二氧化硫,F是硫酸;若E易溶于水,E的俗称是烧碱,则A为钠;若H的溶液为蓝色,则G+H反应,即碳酸钠与硫酸铜溶液反应生成硫酸钠和碳酸铜沉淀,然后将推出的物质进行验证即可。
【详解】A~H分别是氢、氧、碳、硫、钠、铜六种元素中的一种或几种组成的初中化学常见物质,
(1)若B常温下为固态,又是非金属单质,所以B是硫,硫转化成的氧化物又会生成酸,所以D是二氧化硫,F是硫酸,则B是S,F的化学式为H2SO4。
(2)若E易溶于水,E的俗称是烧碱,则A是钠。
(3)若H的溶液为蓝色,则G+H反应的化学方程式为Na2CO3+CuSO4=CuCO3↓+Na2SO4。
故答案为
(1)S,H2SO4;(2)烧碱(或火碱、苛性钠),钠;(3)Na2CO3+CuSO4=CuCO3↓+Na2SO4。
19.(1)增大反应物的接触面积
(2)+6
(3)过滤
(4)氯化钠/NaCl
【详解】(1)粉碎可以加大反应物的接触面积,达到加快反应的目的;
(2)Na2SO4中钠元素显+1价,氧元素显-2价,设硫元素的化合价为x,化合物中各元素正负化合价代数和为0,则的(+1)×2+x+(-2)×4=0,故x=+6。
(3)操作3将前面的物质分离成固体和液体两部分,所以为过滤(将可溶物和难溶物分离)。
(4)通过流程图可以看出,能循环利用的物质是NaCl,氯化钠既是反应物,又是生成物。
20. 钾离子 重新过滤 Ca(OH)2+CO2═CaCO3↓+H2O 碱 CaCl2溶液 K2CO3+CaCl2═CaCO3↓+2KCl 溶液由红色变成无色
【详解】(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是钾离子;
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是重新过滤;
(5)二氧化碳和氢氧化钙反应生成碳酸钙和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
(6)第二支:滴加酚酞溶液后,溶液变为红色,说明溶液呈碱性;
为证明溶液呈碱性是由CO32﹣引起的,再向试管中加入足量氯化钙溶液,当看到溶液由红色变成无色,产生白色沉淀时即可证明,即氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀,反应的化学方程式K2CO3+CaCl2═CaCO3↓+2KCl,当看到溶液由红色变成无色时即可证明。
21.(1)能
(2)设氯化钙溶液中氯化钙为y,则
解得y=11.1g
则所用氯化钙溶液中溶质质量分数为
答:所用氯化钙溶液中溶质质量分数为22.2%。
(3)设生成的氯化钠的质量为z,则
解得z=11.7g
则生成物溶液中溶质质量分数为
答:生成物溶液中溶质质量分数为23.6%。
【详解】(1)设样品中Na2CO3的质量为x,则
解得x=10.6g
则样品中氯化钠的质量分数为<5%,则该产品能列入诚信商品。
(2)见答案。
(3)见答案。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.王阿姨种植的盆栽近期叶片发黄,查询后发现是缺氮所致。王阿姨可在盆栽中适量施用( )
A.Ca(H2PO4) 2 B.KH2PO4
C.NH4NO3 D.K2SO4
2.某小孩将零食包装袋中的干燥剂(主要成分为CaO)放入盛有水的塑料瓶中,盖紧瓶盖后摇一摇,竟然发生爆炸。下列有关CaO的说法正确的是
A.是石灰石的主要成分
B.作干燥剂能有效避免食品氧化变质
C.与水反应得到的生成物微溶于水
D.长期暴露于空气中将转化为Ca(OH)2
3.类比推理是一种重要的学习方法,下列推理正确的是( )
A.氢氧化钠与氯化铵固体研磨反应放出氨气,同理氢氧化钾也能与硝酸铵反应放出氨气
B.常温下,铝表面的氧化铝能起到保护作用,同理铁表面的氧化铁也能起到保护作用
C.离子是带电的原子或原子团,同理带电的粒子就是离子
D.浓硫酸有吸水性,同理浓盐酸也有吸水性
4.下列各组物质同时加入水中,能得到无色透明溶液的是
A.H2SO4 NaCl Na2SO4
B.Ba(NO3)2 H2SO4 NaOH
C.NaCl NaOH CuSO4
D.FeCl3 KNO3 KCl
5.某无色溶液中存在大量的 K+、OH-、CO,该溶液中还可能大量存在的离子是( )
A.H+ B.NH C.Fe3+ D.SO
6.分类是学习化学的一种重要方法。下列物质所属类别有错误的一组是
选项 物质 类别
A 煤、石油、干冰 混合物
B 氮气、水银、金刚石 单质
C 氨水、尿素、碳酸氢铵 氮肥
D 甲烷、乙醇、乙酸 有机物
A.A B.B C.C D.D
7.一蔬一饭,即是生活。焙制糕点所用的发酵粉的主要成分之一是小苏打,小苏打的化学式为
A.Na2CO3 B.NaHCO3 C.NaOH D.NaCl
8.除去如表各组物质中的杂质,所用试剂和方法不可行的是
序号 物质 杂质(少量) 试剂和操作方法
A Na2CO3粉末 NaHCO3粉末 加热
B KNO3溶液 Ba(NO3)2溶液 加入适量的Na2SO4溶液,过滤
C FeSO4溶液 CuSO4 加足量的铁粉,充分反应后过滤
D 稀盐酸 稀硫酸 加入适量氯化钡溶液,过滤
A.A B.B C.C D.D
9.将下列各组物质加水后混合,有化学反应发生,但既无沉淀生成,又无气体放出的是____________。
A.CaCl2、KOH、Na2CO3
B.K2CO3、BaCl2、HCl
C.K2SO4、HCl、NaOH
D.CuSO4、HCl、NaCl
10.下列实验设计能达到实验目的的是
选项 实验目的 实验设计
A 除去中混有的固体 加足量水溶解、过滤、洗涤、烘干
B 除去CO2中混有的HCl 先通过足量氢氧化钠溶液,再通过浓硫酸
C 除去CuO中的Cu 加入过量稀盐酸
D 除去NaCl溶液中混有的Na2SO4 滴加过量BaCl2溶液后过滤
A.A B.B C.C D.D
11.把NaCl、Fe(OH)3、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2O NaOH H2SO4
B.H2O KOH HCl
C.H2O NaOH HCl
D.H2O KOH H2SO4
12.物质与水发生的复分解反应称为水解反应。例如: 。根据上述观点,下列说法中不正确的是
A.NaF的水解产物是NaOH和HF
B.CaC2的水解产物是Ca(OH)2和C2H2
C.PCl3的水解产物之一是PH3
D.Mg3N2水解产物是Mg(OH)2和NH3
二、填空与简答
13.根据图示实验,回答以下问题。
(1)实验一:用冲洗后未擦干的玻璃棒蘸取待测液会导致测得结果 (填“偏大”“偏小”或“不变”)。
(2)实验二:向烧杯中倒入适量稀盐酸,蜡烛火焰熄灭,灭火的原理是 。
(3)实验三:将实验所得液体静置,说明乙醇能溶于水的现象是 。
(4)实验四:20℃时,将盛有饱和氢氧化钙溶液的试管放入盛水的烧杯中(氢氧化钙的溶解度随温度升高而减小),向水中加入一定量的固体甲后,观察到试管中溶液变浑浊,则加入的固体甲可能是 (写出一种即可)。
14.瑶瑶同学在家中自制“汽水”如图。请回答下列问题。
(1)该实验使用的柠檬酸是食品级的添加剂,它除了具有酸的性质外,还应具备的性质是什么 (答一点)
(2)瑶瑶同学喝完自制“汽水”后会打嗝,其原理是什么
(3)写出小苏打在生活中的一种用途 。
15.某工业园区甲、乙两化工厂排放的废水中含有K+、 Cu2+、Fe3+、C1- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来产重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水星碱性。
(1)甲厂废水中定含有的离子是 ,可能含有的离子是 ;
(2)经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是 (填离子符号),过滤后的废水中主要含有 两种物质(填化学式),处理后的废水符合排放标准。
16.请从氧气、水、尿素、磷酸二氢铵中选择适当的物质,用化学式填空:人体含量最多的物质是 ;属于复合肥的是 。
17.从①H②N③④⑤氦⑥K中进行适当选择,用符合要求的化学用语填空:
(1)用于填充气球和焊接金属的保护气 。
(2)由③和④形成的一种氧化物 。
(3)写出一种碱的化学式 。
(4)上述元素组成的一种复合肥 。
18.A~H分别是氢、氧、碳、硫、钠、铜六种元素中的一种或几种组成的初中化学常见物城(如“题20图”所示。箭头表示物质间能转化,实线表示物质间能反应)。
请回答:(1)若B常温下为固态,F的浓溶液溶于水放出大量的热,则B是 ,F的化学式为 。
(2)若E易溶于水,E的俗称是 ,则A是 。
(3)若H的溶液为蓝色,则G+H反应的化学方程式为 。
19.炼铁产生的废渣中含有大量CuS极及少量铁和铁的化合物。工业上以该废渣为原料生产CuCl2的流程图如图。
(1)操作1:粉碎。粉碎的目的是 。
(2)操作2:熔烧。高温条件下,通入空气,CuS和NaCl反应生成了CuCl2和Na2SO4。请计算Na2SO4中硫元素的化合价 。
(3)操作3: (填操作名称)。
(4)流程图中能循环利用的物质是 。
三、科学探究题
20.草木灰是农家肥料,主要含钾盐。请回答相关问题。
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是 ;
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是 ;
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。
【成分探究】
(4)取得的晶体少量溶于水,分别倒入到两支试管中。
(5)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体。请写出使澄清石灰水变浑浊的化学方程式: ;
(6)第二支:滴加酚酞溶液后,溶液变为红色,说明溶液 性。为证明溶液呈碱性是由CO32﹣引起的,再向试管中加入 [可供选择试剂:澄清石灰水、KCl溶液(呈中性)、CaCl2溶液(呈中性)],此时发生反应的方程式为 ,当看到 时即可证明。
四、计算题
21.某校综合实践活动小组在进行”诚信商品”研究时,检验商品标签所列成分及含量与事实是否相符,随机取出市售某纯碱样品(成分说明见图)。经检验杂质仅是氯化钠,准确称取样品10.9克,加入50克氯化钙溶液使其充分反应(纯碱指碳酸钠),将反应生成的沉淀物经过滤、洗涤、干燥后得到白色固体10克。
纯碱 化学式:Na2CO3 杂质:NaCl<5%
(1)此产品能否列入诚信商品。
(2)所用氯化钙溶液中溶质质量分数。
(3)生成物溶液中溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】根据题意,种植的盆栽近期叶片发黄,查询后发现是缺氮所致,应施用含氮元素的化肥,进行分析判断。
【详解】A、Ca(H2PO4)2中含有磷元素,属于磷肥,故选项错误。
B、KH2PO4中含有钾元素和磷元素,属于复合肥,故选项错误。
C、NH4NO3中含有氮元素,属于氮肥,故选项正确。
D、K2SO4中含有钾元素,属于钾肥,故选项错误。故选C。
【点睛】掌握化肥的种类及作用是正确解答本题的关键。
2.C
【详解】A、石灰石的主要成分是碳酸钙,氧化钙俗称生石灰,不符合题意;
B、氧化钙能与水反应生成氢氧化钙,故可作干燥剂,但是不能吸收氧气,不能有效避免食品氧化变质,不符合题意;
C、氧化钙与水反应生成氢氧化钙,氢氧化钙微溶于水,符合题意;
D、氧化钙能与水反应生成氢氧化钙,氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,故长期暴露于空气中,会将其转化为碳酸钙,不符合题意。
故选C。
3.A
【详解】A、氢氧化钠与氯化铵固体 研磨反应放出氨气,同理氢氧化钾也能与硝酸铵反应放出氨气,故选项推理正确;B、铝表面的氧化铝薄膜能起到保护作用,但铁表面的铁锈很疏松,不能起到保护作用,故选项推理错误;C、离子是带电的原子或原子团,带电的粒子不一定是离子,也可能是质子、电子等,故选项推理错误;D、浓盐酸具有挥发性,敞口放置后溶质氯化氢挥发;浓硫酸具有吸水性,故选项推理错误。故选A。
4.A
【详解】A、各物质间都不发生化学反应,且都是无色的,故A正确;
B、硝酸钡与硫酸会产生硫酸钡沉淀,不满足条件,故B错误;
C、硫酸铜溶于水得到蓝色溶液,不满足条件,故C错误;
D、氯化铁溶于水得到黄色溶液,不满足条件,故D错误;
故选A。
5.D
【分析】复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存。
【详解】A、氢离子和氢氧根离子生成水,氢离子和碳酸根离子生成水和二氧化碳,不能大量共存,故A不正确;
B、铵根离子和氢氧根离子生成水和氨气,不能大量共存,故B不正确;
C、铁离子溶液显黄色,和氢氧根离子生成氢氧化铁沉淀,不能大量共存,故C不正确;
D、硫酸根离子和K+、OH-、CO均不能生成沉淀、气体和水,均不反应,能大量共存,故D正确。故选D。
6.A
【详解】A、煤的主要成分是碳、含有氮、硫等杂质,属于混合物;石油中含有汽油、煤油、柴油等多种物质,属于混合物;干冰是固态二氧化碳,由一种物质组成属于纯净物。错误;
B、氮气是由氮元素组成的纯净物,水银是由汞元素组成的纯净物、金刚石是由碳元素组成的纯净物,三种物质都属于单质,正确;
C、氨水、尿素、碳酸氢铵都含有氮元素,属于氮肥,正确;
D、甲烷、乙醇、乙酸都是含有碳元素的化合物,属于有机物,正确。
故选A。
7.B
【详解】小苏打是碳酸氢钠的俗称,碳酸氢钠的化学式为NaHCO3。
故选B。
8.B
【详解】A、NaHCO3粉末在加热条件下生成碳酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
B、硝酸钡能与适量的硫酸钠溶液反应生成硫酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误。
C、足量的铁粉能与CuSO4溶液反应生成硫酸亚铁溶液和铜,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、稀硫酸能与适量氯化钡溶液反应生成硫酸钡沉淀和盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:B。
9.C
【分析】根据碳酸根离子会与钙离子生成沉淀;碳酸根离子会与氢离子生成气体;氢离子会与氢氧根离子生成水进行分析解答。
【详解】A、氯化钙会与碳酸钠反应生成白色的碳酸钙沉淀,而要求无沉淀生成,不符合题意。
B、虽然碳酸钾和氯化钡会生成会生成碳酸钡沉淀,但是该沉淀会溶于酸,碳酸钡会与盐酸反应生成二氧化碳气体,而题中要求无气体放出,不符合题意。
C、硫酸和氢氧化钠反应生成了水和硫酸钠,酸碱中和,会反应,生成的水且无沉淀、气体,符合题意。
D、CuSO4、HCl、NaCl两两之间都无反应发生,题中要求能发生化学反应,不符合题意。
故选:C。
10.A
【详解】A、氯化钙易溶于水,碳酸钙不溶于水,加入足量的水溶解,过滤,洗涤、烘干得到碳酸钙;符合题意;
B、氢氧化钠和二氧化碳反应生成碳酸钠和水,氢氧化钠溶液和HCl反应产生氯化钠和水,二氧化碳也被反应了;不符合题意;
C、铜不与盐酸反应,氧化铜和盐酸反应产生氯化铜和水,主要物质被反应了;不符合题意;
D、加入过量的BaCl2溶液和硫酸钠反应产生硫酸钡沉淀和氯化钠,过滤除去了硫酸钡,但是引入了过量的氯化钡;不符合题意;
故选:A。
11.C
【解析】根据Fe(OH)3难溶于水,氯化钠、氯化镁易溶于水,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,氢氧化镁能与稀盐酸反应生成氯化镁和水,进行分析解答。
【详解】A、Fe(OH)3难溶于水,NaCl、MgCl2溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3;然后滴加适量的氢氧化钠溶液,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,再进行过滤,分离出氯化钠溶液和氢氧化镁沉淀;最后向氢氧化镁沉淀中滴加稀硫酸,氢氧化镁能与硫酸反应生成硫酸镁和水,引入ア新的杂质硫酸钠,故选项错误;
B、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出CaCO3;然后滴加适量的氢氧化钾溶液,氯化镁能与氢氧化钾溶液反应生成氢氧化镁白色沉淀和氯化钾,引入了新的杂质氯化钾,故选项错误;
C、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3,然后滴加适量的氢氧化钠溶液,氯化镁能与氢氧化钠溶液反应生成氢氧化镁白色沉淀和氯化钠,再进行过滤,分离出氯化钠溶液和氢氧化镁沉淀;最后向氢氧化镁沉淀中滴加稀盐酸,氢氧化镁能与稀盐酸反应生成氯化镁和水;能将固体混合物逐一分离,故选项正确;
D、Fe(OH)3难溶于水,NaCl、MgCl2易溶于水,可加水溶解,再进行过滤,分离出Fe(OH)3,然后滴加适量的氢氧化钾溶液,氯化镁能与氢氧化钾溶液反应生成氢氧化镁白色沉淀和氯化钾,引入了新的杂质氯化钾,氢氧化镁沉淀中滴加稀硫酸,氢氧化镁能与硫酸反应生成硫酸镁和水;引入了新的杂质硫酸钠,故选项错误。
故选:C。
【点睛】本题难度不大,考查物质的分离,熟练掌握酸碱盐的化学性质并能灵活运用是正确解答本题的关键,解题时要注意反应后不能引入新的杂质。
12.C
【分析】根据题意的分析可知,Al2S3和水发生复分解反应。
复分解反应是两种化合物互相交换成分,生成另外两种新的化合物的反应。
Al2S3和水反应,则Al2S3中的铝离子和水中的氢氧根结合形成氢氧化铝,Al2S3中的硫离子和水中的氢离子结合形成硫化氢气体。
【详解】A、通过分析可知,NaF和水发生复分解反应的方程式为:NaF+H2O=NaOH+HF↑。故A正确;
B、通过分析可知,CaC2和水发生复分解反应的方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑。故B正确;
C、通过分析可知,PCl3和水发生复分解反应的产物不可能是PH3,故C错误;
D、通过分析可知,Mg3N2和水发生复分解反应的方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。故D正确。
故选C。
13.(1)偏大
(2)隔绝氧气
(3)溶液呈均匀红色,不分层
(4)NaOH/CaO
【详解】(1)实验一:用冲洗后未擦干的玻璃捧蘸取待测液,由于溶液被稀释,会导致酸的浓度降低,酸性变弱,测得结果偏大;
(2)实验二:由于碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳密度比空气大,且二氧化碳既不能燃烧也不支持燃烧,当二氧化碳充满烧杯,会隔绝氧气使蜡烛熄灭;
(3)实验三:乙醇能溶于水,说明乙醇与水能形成溶液,将实验所得液体静置,说明乙醇能溶于水的现象是红色均匀,不分层。
(4)实验四:氢氧化钙的溶解度随温度升高而减小,向水中加入一定量的固体甲后,观察到试管中溶液变浑浊,说明溶液的温度升高,氧化钙与水反应放热,氢氧化钠固体溶于水放热,则加入的固体甲可能是NaOH(或CaO)。
14. 无毒无害、易溶于水等 温度升高,气体溶解度减小 治疗胃酸过多症;焙制糕点所用的发酵粉的主要成分之一
【详解】(1)柠檬酸做为食品级添加剂,首先要满足无毒无害的特点,其次用于制“汽水”还应满足易溶于水等特点。
(2)喝完“汽水”后会打嗝,主要是因为柠檬酸和小苏打发生反应会有二氧化碳气体产生,当人体喝入“汽水”后,“汽水”由常温进入人体,温度升高,二氧化碳气体的溶解度因温度升高而减小,所以喝完“汽水”后会打嗝。
(3)小苏打可以用于做糕点类发酵粉,也可以用于治疗胃酸过多症,还可以清理油污。
15. OH-和K+ 氯离子,硝酸根离子 OH-,Fe3+,Cu2+ KCl和KNO3
【详解】(1)甲厂的废水呈碱性,故废水中一定含有氢氧根离子,不可能 含有铜离子和铁离子,则一定含有钾离子,可能含有氯离子,硝酸根离子;
(2)铜离子和铁离子遇到氢氧根离子生成沉淀,故这些离子是OH-,Fe3+,Cu2+;过滤后溶液中含有的阴离子主要由氯离子和硝酸根离子,阳离子含有钾离子,故过滤后的废水中主要含有KCl和KNO3;
16. H2O NH4H2PO4
【详解】人体中含量最多的物质是水,其化学式为:H2O;氮、磷、钾三种元素中至少含有两种的化肥是复合肥,磷酸二氢铵含N、P两种营养元素,属于复合肥,其化学式为:NH4H2PO4。
17.(1)He
(2)SO2(或SO3)
(3)KOH(或NH3·H2O)
(4)KNO3
【详解】(1)氦气密度小,化学性质稳定,可用于填充气球和焊接金属的保护气,故填:He。
(2)③质子数是8属于氧元素,④是硫元素,可以形成的氧化物有二氧化硫或三氧化硫,故填:SO2(或SO3)。
(3)氢氧化钾和氨水都属于碱,故填:KOH(或NH3·H2O)。
(4)硝酸钾含有钾元素和氮元素,属于复合肥,故填:KNO3。
18. S H2SO4 烧碱(或火碱、苛性钠) 钠 Na2CO3+CuSO4=CuCO3↓+Na2SO4
【分析】根据A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质,若B常温下为固态,又是非金属单质,所以B是硫,硫转化成的氧化物又会生成酸,所以D是二氧化硫,F是硫酸;若E易溶于水,E的俗称是烧碱,则A为钠;若H的溶液为蓝色,则G+H反应,即碳酸钠与硫酸铜溶液反应生成硫酸钠和碳酸铜沉淀,然后将推出的物质进行验证即可。
【详解】A~H分别是氢、氧、碳、硫、钠、铜六种元素中的一种或几种组成的初中化学常见物质,
(1)若B常温下为固态,又是非金属单质,所以B是硫,硫转化成的氧化物又会生成酸,所以D是二氧化硫,F是硫酸,则B是S,F的化学式为H2SO4。
(2)若E易溶于水,E的俗称是烧碱,则A是钠。
(3)若H的溶液为蓝色,则G+H反应的化学方程式为Na2CO3+CuSO4=CuCO3↓+Na2SO4。
故答案为
(1)S,H2SO4;(2)烧碱(或火碱、苛性钠),钠;(3)Na2CO3+CuSO4=CuCO3↓+Na2SO4。
19.(1)增大反应物的接触面积
(2)+6
(3)过滤
(4)氯化钠/NaCl
【详解】(1)粉碎可以加大反应物的接触面积,达到加快反应的目的;
(2)Na2SO4中钠元素显+1价,氧元素显-2价,设硫元素的化合价为x,化合物中各元素正负化合价代数和为0,则的(+1)×2+x+(-2)×4=0,故x=+6。
(3)操作3将前面的物质分离成固体和液体两部分,所以为过滤(将可溶物和难溶物分离)。
(4)通过流程图可以看出,能循环利用的物质是NaCl,氯化钠既是反应物,又是生成物。
20. 钾离子 重新过滤 Ca(OH)2+CO2═CaCO3↓+H2O 碱 CaCl2溶液 K2CO3+CaCl2═CaCO3↓+2KCl 溶液由红色变成无色
【详解】(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是钾离子;
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是重新过滤;
(5)二氧化碳和氢氧化钙反应生成碳酸钙和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
(6)第二支:滴加酚酞溶液后,溶液变为红色,说明溶液呈碱性;
为证明溶液呈碱性是由CO32﹣引起的,再向试管中加入足量氯化钙溶液,当看到溶液由红色变成无色,产生白色沉淀时即可证明,即氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀,反应的化学方程式K2CO3+CaCl2═CaCO3↓+2KCl,当看到溶液由红色变成无色时即可证明。
21.(1)能
(2)设氯化钙溶液中氯化钙为y,则
解得y=11.1g
则所用氯化钙溶液中溶质质量分数为
答:所用氯化钙溶液中溶质质量分数为22.2%。
(3)设生成的氯化钠的质量为z,则
解得z=11.7g
则生成物溶液中溶质质量分数为
答:生成物溶液中溶质质量分数为23.6%。
【详解】(1)设样品中Na2CO3的质量为x,则
解得x=10.6g
则样品中氯化钠的质量分数为<5%,则该产品能列入诚信商品。
(2)见答案。
(3)见答案。
答案第1页,共2页
答案第1页,共2页
