新课标人教版高中化学必修2第一章第三节《化学键》同步练习.doc
文档属性
| 名称 | 新课标人教版高中化学必修2第一章第三节《化学键》同步练习.doc |  | |
| 格式 | doc | ||
| 文件大小 | 428.0KB | ||
| 资源类型 | 素材 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-17 09:05:52 | ||
图片预览

文档简介
人教版化学高一必修2第一章
第三节化学键同步练习
一.选择题
1.下列物质只含有离子键的是( )
A.CO2 B.CaCl2 C.NH4Cl D.NaOH
答案:B
知识点:离子化合物的结构特征与性质.
解析:
解答:A.二氧化碳分子中C﹣O原子之间只存在共价键,故A错误;
B.氯化钙中钙离子和氯离子之间只存在离子键,故B正确;
C.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N﹣H原子之间存在共价键,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O﹣H原子之间存在共价键,故D错误;故选B.
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属元素、第IIA族元素和第VIA族、第VIIA族元素之间易形成离子键,铵根离子和酸根离子之间存在离子键.
2.下列物质属于共价化合物的是( )
A.O2 B.Na2O C.HCl D.NH4Cl
答案:C
知识点:共价键的形成及共价键的主要类型.
解析:
解答:A.O2中只含O元素,属于非金属单质,不是化合物,故A错误;
B.NaCl中只存在离子键,属于离子化合物,故B错误;
C.HCl分子中只存在共价键,属于共价化合物,故C正确;
D.NH4Cl中存在离子键,又存在共价键,属于离子化合物,故D错误;故选C.
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物属于共价化合物,共价化合物中一定不含离子键,含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,据此分析解答.
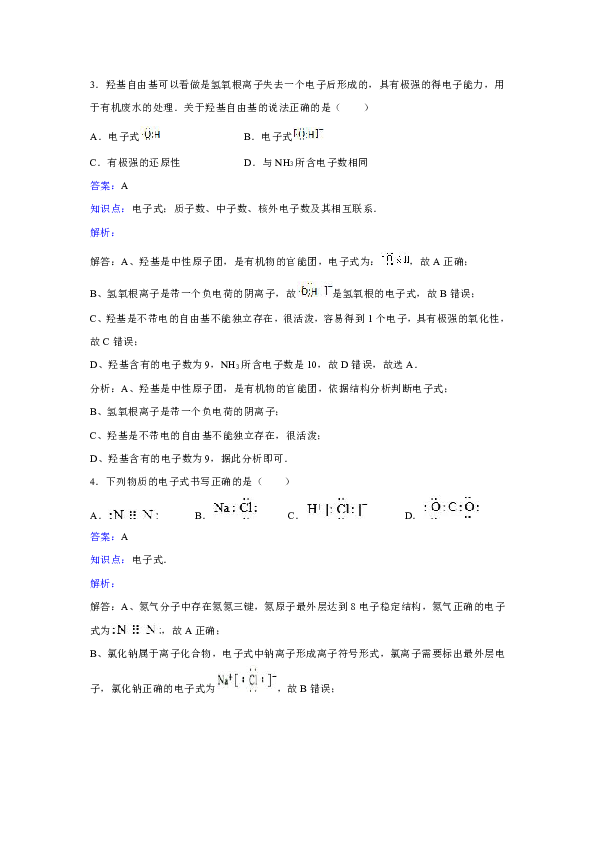
3.羟基自由基可以看做是氢氧根离子失去一个电子后形成的,具有极强的得电子能力,用于有机废水的处理.关于羟基自由基的说法正确的是( )
A.电子式 B.电子式
C.有极强的还原性 D.与NH3所含电子数相同
答案:A
知识点:电子式;质子数、中子数、核外电子数及其相互联系.
解析:
解答:A、羟基是中性原子团,是有机物的官能团,电子式为:,故A正确;
B、氢氧根离子是带一个负电荷的阴离子,故是氢氧根的电子式,故B错误;
C、羟基是不带电的自由基不能独立存在,很活泼,容易得到1个电子,具有极强的氧化性,故C错误;
D、羟基含有的电子数为9,NH3所含电子数是10,故D错误,故选A.
分析:A、羟基是中性原子团,是有机物的官能团,依据结构分析判断电子式;
B、氢氧根离子是带一个负电荷的阴离子;
C、羟基是不带电的自由基不能独立存在,很活泼;
D、羟基含有的电子数为9,据此分析即可.
4.下列物质的电子式书写正确的是( )
A. B. C. D.
答案:A
知识点:电子式.
解析:
解答:A、氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为,故A正确;
B、氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为,故B错误;
C、氯化氢属于共价化合物,分子中存在一个H﹣Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为,故C错误;
D、CO2为共价化合物,电子式为,故D错误;
故选A.
分析:A.氮气分子中存在氮氮三键,应该存在3对共用电子对;
B.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
C.氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子;
D.二氧化碳中存在两对C=O双键.
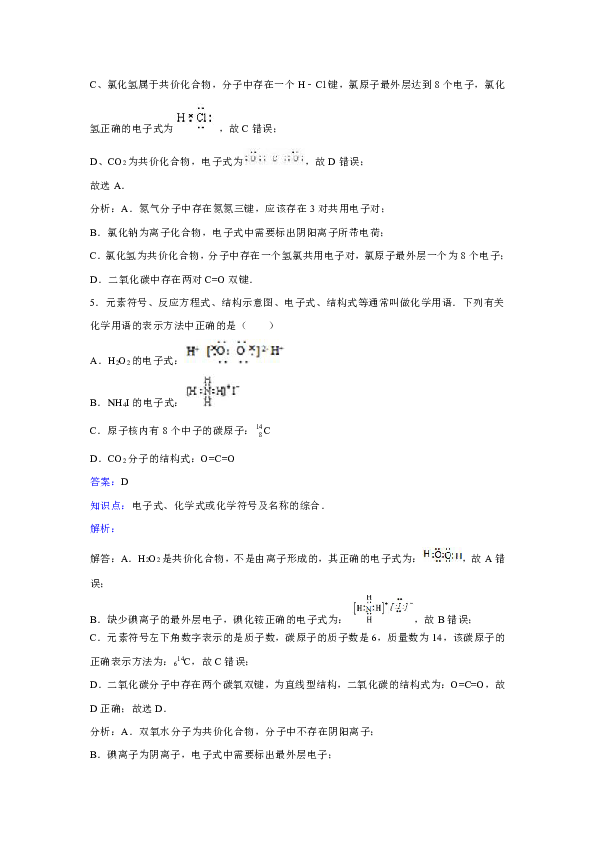
5.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
A.H2O2的电子式:
B.NH4I的电子式:
C.原子核内有8个中子的碳原子:C
D.CO2分子的结构式:O=C=O
答案:D
知识点:电子式、化学式或化学符号及名称的综合.
解析:
解答:A.H2O2是共价化合物,不是由离子形成的,其正确的电子式为:,故A错误;
B.缺少碘离子的最外层电子,碘化铵正确的电子式为:,故B错误;
C.元素符号左下角数字表示的是质子数,碳原子的质子数是6,质量数为14,该碳原子的正确表示方法为:614C,故C错误;
D.二氧化碳分子中存在两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O,故D正确;故选D.
分析:A.双氧水分子为共价化合物,分子中不存在阴阳离子;
B.碘离子为阴离子,电子式中需要标出最外层电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键.
6.下列有关化学用语表达正确的是( )
A.NH4Cl的电子式: B.氚表示为T
C.次氯酸的结构式为H﹣O﹣Cl D.16O2和18O2互为同素异形体
答案:C
知识点:电子式、化学式或化学符号及名称的综合;同位素及其应用;同素异形体.
解析:
解答:A.氯化铵为离子化合物,铵根离子需要标出其原子的最外层电子,氯化铵正确的电子式为:,故A错误;
B.氚的质量数为3、质子数为1,该原子可以表示为:31H,故B错误;
C.次氯酸分子中存在1个氢氧键和1个氧氯键,其结构式为:H﹣O﹣Cl,故C正确;
D.16O2和18O2都是氧气分子,为同一种物质,不属于同素异形体,故D错误;故选C.
分析:A.铵根离子为复杂阳离子,没有表示出N、H原子的最外层电子;
B.氚的质量数为3,元素符号应该H表示;
C.次氯酸分子的中心原子为O原子,分子中存在1个氢氧键和1个氧氯键;
D.同素异形体为同种元素形成的不同单质,二者都是氧气,为同一种物质.
7.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O═4NaOH+O2↑
B.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
C.CaC2+2H2O═Ca(OH)2+CH≡CH↑
D.NH4Cl+NaOH═NaCl+NH3↑+H2O
答案:A
知识点:化学键.
解析:
解答:A.2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A选;
B.该反应中没有非极性共价键的形成,故B不选;
C.CaC2+2H2O→Ca(OH)2+HC≡CH↑中既有离子键、极性键断裂,又有离子键、极性键,没有非极性键断裂、非极性键形成,故C不选;
D.该反应中没有非极性键的断裂和形成,故D不选.
故选A.
分析:一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
8.下列物质加热熔化时破坏极性共价键的是( )
A.干冰 B.晶体硅 C.氢氧化钠 D.二氧化硅
答案:D
知识点:化学键.
解析:
解答:A.干冰属于分子晶体,熔化时发生物理变化,破坏分子间作用力,故A错误;
B.晶体硅是原子晶体,硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键,故B错误;
C.氢氧化钠是离子晶体,钠离子和氢氧根离子之间存在离子键,所以氢氧化钠熔化时破坏离子键,故C错误;
D.二氧化硅是原子晶体,硅原子和氧原子之间存在极性共价键,二氧化硅熔化时破坏极性共价键,故D正确;故选D.
分析:分子晶体熔化不破坏化学键,原子晶体熔化破坏共价键,离子晶体熔化破坏离子键;
同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,活泼金属和活泼非金属元素之间存在离子键.
9.下列说法正确的是( )
A.离子化合物中可能含有共价键
B.非金属元素只能形成共价化合物
C.阳离子只能被还原
D.阴离子中不含金属元素
答案:A
知识点::化学键;氧化还原反应.
解析:
解答:A.离子化合物中可以含共价键,如NaOH中含有离子键、共价键,故A正确;
B.铵盐全部为非金属元素,为离子化合物,故B错误;
C.阳离子也可被氧化,如+2价铁离子可以被氧化成+3价铁离子,故C错误;
D.阴离子可能含金属元素,如AlO2﹣,故D错误;故选A.
分析:A.离子化合物中可以含共价键;
B.铵盐全部为非金属元素;
C.+2价铁离子可以被氧化成+3价铁离子,也可还原成单质铁;
D.AlO2﹣中含有金属元素.
10.下列物质中,既含极性共价键又含非极性共价键的化合物是( )
A.NH4Cl B.Cl2 C.H2O2 D.CCl4
答案:C
知识点:共价键的形成及共价键的主要类型.
解析:
解答:A.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N﹣H原子之间存在极性键,属于离子化合物,故A错误;
B.氯气分子中Cl﹣Cl原子之间只存在非极性键,属于单质,故B错误;
C.双氧水分子中H﹣O原子之间存在极性键、O﹣O原子之间存在非极性键,属于共价化合物,故C正确;
D.四氯化碳分子中C﹣Cl原子之间只存在极性键,属于共价化合物,故D错误;故选C.
分析:同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,只含共价键的化合物是共价化合物,据此分析解答.
11.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl﹣、S2﹣ 四种离子的半径依次减小
C.Po、Po、Po三种原子的核外电子数分别为124、125、126
D.ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
答案:D
知识点:化学键;元素周期律的作用;核素.
解析:
解答:A.只含有共价键的化合物是共价化合物,则共价化合物中不可能含有离子键,故A错误;
B.电子排布相同的离子,原子序数越大,则离子半径越小,所以Ca2+、K+、Cl﹣、S2﹣﹣四种离子的半径依次增大,故B错误;
C.电子数等于质子数,同种元素不同核素的电子数相同,则Po、Po、Po三种原子的核外电子数相同均为84,故C错误;
D.元素的非金属性越强,则氢化物的稳定性越强,非金属性:O>S>Se,则H2O、H2S、H2Se稳定性依次减弱,故D正确.故选D.
分析:A.只含有共价键的化合物是共价化合物;
B.电子排布相同的离子,原子序数越大,则离子半径越小;
C.电子数等于质子数,同种元素不同核素的电子数相同;
D.元素的非金属性越强,则氢化物的稳定性越强.
12.对下列物质溶于水时破坏的作用力描述错误的是( )
A.氯化钠,破坏了离子键 B.氯化氢,破坏了共价键
C.蔗糖,破坏了分子间作用力 D.二氧化碳,没有破坏作用力
答案:D
知识点:化学键和分子间作用力的区别.
解析:
解答:A、氯化钠是离子晶体,微粒间的作用力是离子键,氯化钠溶于水,破坏的是离子键,故A正确;
B、氯化氢气体溶于水,氯化氢在水分子的作用下电离出自由移动的离子,克服的是共价键,故B正确;
C、蔗糖溶于水,克服的是分子间作用力,故C正确;
D、二氧化碳溶于水,克服的是分子间作用力,故D错误;故选D.
13.下列现象中,能用范德华力解释的是( )
A.氮气的化学性质稳定
B.通常状况下,溴呈液态,碘呈固态
C.水的沸点比硫化氢高
D.锂的熔点比钠高
答案:B
知识点:分子间作用力对物质的状态等方面的影响.
解析:
解答:A.由氮气分子中含有氮氮三键,键能较大,化学性质稳定,与范德华力无关,故A错误;
B.溴、碘等共价化合物,它们的熔沸点与分子间作用力即范德华力有关,故B正确;
C.水分子中有氢键的作用力大于范德华力,导致熔沸点变大,硫化氢分子间没有氢键,所以水的沸点比硫化氢的沸点高,故C错误;
D.钠离子半径大于锂离子半径,故钠中金属键减弱,其熔点比锂低,故D错误;故选B.
分析:A.物质的化学性质稳定与否与分子内的化学键有关,与范德华力无关;
B.根据分子晶体,相对分子质量越大,范德华力越大,熔沸点越高;
C.根据分子间氢键使物质的沸点升高;
D.离子半径越大,金属键越弱,单质熔点越低;
14.下列说法错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键
答案:A
知识点:化学键;离子化合物的结构特征与性质;
解析:
解答:A:含有共价键的化合物不一定是共价化合物,如NH4NO3等铵盐,故A错.
B:只含有共价键的化合物是共价化合物,故B对.
C:物质只要含有离子键就是离子化合物,故C对.
D:双原子单质分子形成的共价健,由于原子相同得电子能力相等,共用电子对不发生偏移,一定是非极性键,故D对.故选A
分析:根据化合物元素组成判断含有的化学键,从而判断选项正误.注意:1、共价化合物中一定不含离子键,离子化合物中可能含有共价键.2、不是所有物质都含有化学键,如:稀有气体是单原子分子,所以不含化学键,只存在分子间作用力.
15.下列说法中正确的是( )
①水分子的电子式为
②离子半径由小到大的顺序是:Mg2+<Na+<Cl﹣<S2﹣
③氮分子的电子式为
④只含有离子键的化合物才是离子化合物.
A.①② B.③④ C.①④ D.②③
答案:D
知识点:电子式;微粒半径大小的比较;离子化合物的结构特征与性质.
解析:
解答:①水是共价化合物,原子间通过共用电子对形成化学键,其电子式为,故①错误;
②电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小,离子半径由小到大的顺序是:Mg2+<Na+<Cl﹣<S2﹣,故②正确;
③氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为,故C正确;
④只要化合物中含有离子键,这种化合物就是离子化合物,既有离子键又有共价键的化合物也是离子化合物,故④错误.故选:D.
分析:①水是共价化合物,原子间通过共用电子对形成化学键;
②电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小;
③氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键;
④只要化合物中含有离子键,这种化合物就是离子化合物.
16.下列说法正确的是( )
A.H2O和H2O2中的化学键类型完全相同
B.N2的结构式为N﹣N
C.一个D216O分子所含的中子数为10
D.NaCl的电子式为
答案:C
知识点:电子式;结构式;质子数、中子数、核外电子数及其相互联系;化学键.
解析:
解答:A.水分子中O原子和H原子只存在极性键,双氧水分子中O原子和H原子之间存在极性键、O原子和O原子之间存在非极性键,故A错误;
B.氮气分子中存在氮氮三键,氮气分子的结构式为N≡N,故B错误;
C.D原子中含1个中子、O原子中含有8个中子,所以一个D2O分子所含的中子数为1×2+8=10,故C正确;
D.氯化钠为离子化合物,其电子式为,故D错误;故选C.
分析:A.双氧水分子中含有O﹣O非极性键;
B.氮气分子中存在氮氮三键;
C.D原子含有1个中子;
D.氯化钠为离子化合物,应该符合离子化合物电子式特点
解答:解:
点评:本题主要考查了化学用语,属于基础题,涉及结构式、化学键、电子式等知识点,根据这些知识点的书写规则书写,注意离子化合物和共价化合物电子式书写区别,为易错点.
17.下列化合物的电子式书写正确的是( )
A. B.
C. D.
答案:D
知识点:电子式.
解析:
解答:A、氯化钙电子式为,故A错误;
B、氯原子最外层7个电子成1个共价键、氧原子的最外层6个电子,成2个共价键,电子式为,故B错误;
C、过氧化氢是共价化合物,不存在离子键,氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对,电子式为,故C错误;
D、氟化钾为离子化合物,电子式为,书写正确,故D正确,
故选D.
分析:A、氯化钙为离子化合物,阴离子个数不能合并;
B、次氯酸中O分别与H和Cl形成一对共价键;
C、水为共价化合物,不能用括号;
D.KF为离子化合物,阴离子需要括号,且标明所带电荷数.
18.下列化学用语中,正确的是( )
A.用电子式表示溴化氢的形成过程为:
B.海水中Br﹣的电子式为:
C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl
D.氯离子的结构示意图为:
答案:B
知识点:电子式;原子结构示意图;离子方程式的书写.
解析:
解答:A.溴化氢分子中不存在阴阳离子,,故A错误;
B.溴离子最外层达到8个电子稳定结构,电子式需要标出阴离子所带电荷及最外层电子,溴离子的电子式为:,故B正确;
C.海水中通入氯气时发生反应的离子方程式为:2Br﹣+Cl2=Br2+2Cl﹣,故C错误;
D.氯离子最外层达到8电子稳定结构,氯离子正确的结构示意图为:
,故D错误;
故选B.
分析:本题考查了电子式、离子方程式、离子结构示意图等化学用语的判断,注意掌握常见化学用语的概念及正确表示方法,明确离子结构示意图与原子结构示意图的表示方法及区别.
19.下列有关化学用语的表示方法中错误的是( )
A.CO2分子的结构式:O=C=O
B.S2﹣的结构示意图:
C.R2+离子核外有a个电子,b个中子,R原子符号为:R
D.次氯酸的电子式:
答案:D
知识点:电子式、化学式或化学符号及名称的综合;原子结构示意图;质量数与质子数、中子数之间的相互关系.
解析:
解答:A.二氧化碳分子中碳原子和每个氧原子之间共用两个电子对,所以其结构式为:O=C=O,故A正确;
B.硫离子核外有3个电子层,最外层有8个电子,其离子结构示意图为:
,故B正确;
C.R2+离子核外有a个电子,b个中子,则R原子的质子数为a+2,质量数为a+b+2,R原子符号为:R,故C正确;
D.次氯酸的中心原子为O原子,次氯酸的电子式为:,故D错误;
故选D.
分析:本题考查了化学用语的表示方法,题目难度中等,注意掌握离子结构示意图、元素符号、结构式、电子式的概念及书写原则,D为易错点,需要明确次氯酸的中心原子为O原子.A.二氧化碳分子中碳原子和每个氧原子之间共用两个电子对;
B.硫离子核外有3个电子层,最外层有8个电子;
C.元素符合左下角的数字表示质子数,左上角数字表示质量数;
D.次氯酸的中心原子是氧原子,分子中存在1个氢氧键和1个氧氯键.
点评:
20.下列各组物质中,化学键类型和化合物类型都相同的是( )
A.SO2和H2O B.CO2和Na2CO3 C.KOH和NaCl D.NaCl和HCl
答案:A
知识点:化学键.
解析:
解答:A.SO2和H2O都为共价化合物,只有共价键,故A正确;
B.CO2为共价化合物,含有共价键,Na2CO3为离子化合物,含有离子键和共价键,故B错误;
C.KOH和NaCl都为离子化合物,但NaOH含有离子键和共价键,NaCl只含有离子键,故C错误;
D.NaCl为离子化合物,含有离子键,HCl为共价化合物,只有共价键,故D错误.故选A.
分析:化学键分为离子键和共价键,离子键为阴阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键,以此解答该题.
二.填空题
21.(1)用电子式表示.
①铝原子
②硫离子
③溴化镁的形成过程
(2)在 Li、N、Na、Mg、Li、C中:
① 和 互为同位素.
② 和 质量数相等,但不能互称同位素.
③ 和 的中子数相等,但质子数不相等,所以不是同一种元素.
答案:(1)①;②;
③;
(2)①63Li、73Li;②146C、147N;③2311Na、2412Mg.
知识点:电子式;同位素及其应用;质量数与质子数、中子数之间的相互关系.
解析:
解答:(1)①铝原子最外层为3个电子,氯原子的电子式为,故答案为:;
②硫离子为阴离子,电子式中需要标出所带电荷及最外层电子,硫离子的电子式为:,故答案为:;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为,故答案为:;
(2)①63Li和73Li的质子数都是3,中子数分别为6﹣3=3、7﹣3=4,即质子数相同、中子数不同的同种元素的原子,则互为同位素,故答案为:63Li、73Li;
②146C和 147N的质量数都是14,质子数分别为6、7,中子数分别为8、7,质子数等于电子数,即质量数相同,但不是同位素,故答案为:146C、147N;
③2311Na和2412Mg的质子数分别为11、12,质量数分别为23、24,中子数分别为23﹣11=12、24﹣12=12,即中子数相同,但不是同一种元素,故答案为:2311Na、2412Mg.
分析:(1)①依据元素的原子最外层电子个数的多少,先用小黑点“ ”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对;
②阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(2)具有相同质子数、不同中子数的原子互为同位素;在原子的构成中,元素符号左上角的数字表示原子的质量数;原子中,质量数=质子数+中子数,据此解答即可.
22.现有①BaCl2 ②碘片 ③NH4Cl ④Na2SO4 ⑤干冰 五种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是 .(填写物质的序号,下同)
(2)属于离子化合物的是 ,只有离子键的物质是 .
(3)①的电子式是 ,
⑤的形成过程用电子式表示为 .
答案:(1)②⑤;(2)①③④;①;
(3); .
知识点:化学键;电子式;用电子式表示简单的离子化合物和共价化合物的形成.
解析:
解答:(1)分子晶体熔化时不需要破坏化学键,只破坏分子间作用力,干冰和碘片都属于分子晶体,熔化时不需要破坏化学键;
故答案为:②⑤;
(2)含有离子键的化合物是离子化合物,则属于离子化合物的是:BaCl2、NH4Cl、Na2SO4,只含有离子键的是BaCl2,
故答案为:①③④;①;
(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合,二氧化碳电子式为,则形成过程为:,
故答案为:.
分析:(1)分子晶体熔化时不需要破坏化学键;(2)含有离子键的化合物是离子化合物,活泼金属和活泼非金属元素之间易形成离子键,铵盐中含有离子键;非金属元素之间易形成共价键;(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合.
23.对于HCl、H2SO4、NaOH、NaCl、NH4Cl、Ne、N2、金刚石,回答下列问题:
(1)不存在化学键的是 .
(2)属于共价化合物的是 、 .
(3)属于离子化合物的是 、 、 .
(4)既含离子键,又含共价键的是 .
答案:(1)Ne;(2)HCl、H2SO4;(3)NaOH、NaCl、NH4Cl;(4)NH4Cl.
知识点:化学键;离子化合物的结构特征与性质.
解析:
解答:(1)稀有气体为单原子分子,不存在化学键,则不存在化学键的是Ne;故答案为:Ne;
(2)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,则属于共价化合物的是HCl、H2SO4;故答案为:HCl、H2SO4;
(3)一般活泼金属和活泼非金属元素之间易形成离子键,铵盐中存在离子键,则属于离子化合物的是NaOH、NaCl、NH4Cl;
故答案为:NaOH、NaCl、NH4Cl;
(4)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N元素与H元素之间存在共价键,则NH4Cl既含离子键,又含共价键;故答案为:NH4Cl.
分析:一般活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;稀有气体为单原子分子,不存在化学键.
24.书写电子式或用电子式回答下列问题
①NaOH ②H2O ③O=C=O ④CCl4
⑤以氟化氢为例表示共价键形成过程
⑥以硫化钠为例表示离子键形成过程 .
答案:① ;②;③;④;
⑤;⑥.
知识点:电子式.
解析:
解答:①NaOH为离子化合物,电子式为,故答案为:;
②H2O为共价化合物,电子式为,故答案为:;
③O=C=O为共价化合物,C=O之间含有两对电子,满足8电子稳定结构,电子式为,
故答案为:;
④CCl4为共价化合物,各原子满足8电子稳定结构,电子式为,故答案为:;
⑤HF为共价化合物,各原子满足8电子稳定结构,共价键形成过程为,
故答案为:;
⑥硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为,
故答案为:.
分析:首先判断化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
25.有下列物质:①N2 ②Na2O ③NaOH ④CH4 ⑤CO2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是 .
(2)只由极性键构成的物质是 .
(3)只由非极性键构成的物质是 .
(4)只由非金属元素组成的离子化合物是 .
(5)请写出②Na2O和④CH4的电子式 、 .
(6)请用电子式表示⑤CO2 ⑥MgF2 的形成过程.CO2: MgF2: .
答案:
(1)②⑥;(2)④⑤;(3)①;(4)⑦;
(5);;
(6);
知识点:离子化合物的结构特征与性质;电子式;共价键的形成及共价键的主要类型;用电子式表示简单的离子化合物和共价化合物的形成.
解析:
解答:①N2中N原子之间只存在共价键,属于单质;
②Na2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
(1)只由离子键构成的物质是②⑥,故答案为:②⑥;
(2)只由极性键构成的物质是④⑤,故答案为:④⑤;
(3)只由非极性键构成的物质是①,故答案为:①;
(4)只由非金属元素组成的离子化合物是⑦,故答案为:⑦;
(5)②Na2O的电子式为,CH4的电子式为故答案为:;;
(6)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
故答案为:;
.
分析:①N2中N原子之间只存在共价键,属于单质;
②Na2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;结合电子式的书写特点、物质的性质过程等知识点来分析解答.
+17
2
8
7
+17
2
8
8
+16
2
8
8
+16
2
8
8
第三节化学键同步练习
一.选择题
1.下列物质只含有离子键的是( )
A.CO2 B.CaCl2 C.NH4Cl D.NaOH
答案:B
知识点:离子化合物的结构特征与性质.
解析:
解答:A.二氧化碳分子中C﹣O原子之间只存在共价键,故A错误;
B.氯化钙中钙离子和氯离子之间只存在离子键,故B正确;
C.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N﹣H原子之间存在共价键,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O﹣H原子之间存在共价键,故D错误;故选B.
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属元素、第IIA族元素和第VIA族、第VIIA族元素之间易形成离子键,铵根离子和酸根离子之间存在离子键.
2.下列物质属于共价化合物的是( )
A.O2 B.Na2O C.HCl D.NH4Cl
答案:C
知识点:共价键的形成及共价键的主要类型.
解析:
解答:A.O2中只含O元素,属于非金属单质,不是化合物,故A错误;
B.NaCl中只存在离子键,属于离子化合物,故B错误;
C.HCl分子中只存在共价键,属于共价化合物,故C正确;
D.NH4Cl中存在离子键,又存在共价键,属于离子化合物,故D错误;故选C.
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物属于共价化合物,共价化合物中一定不含离子键,含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,据此分析解答.
3.羟基自由基可以看做是氢氧根离子失去一个电子后形成的,具有极强的得电子能力,用于有机废水的处理.关于羟基自由基的说法正确的是( )
A.电子式 B.电子式
C.有极强的还原性 D.与NH3所含电子数相同
答案:A
知识点:电子式;质子数、中子数、核外电子数及其相互联系.
解析:
解答:A、羟基是中性原子团,是有机物的官能团,电子式为:,故A正确;
B、氢氧根离子是带一个负电荷的阴离子,故是氢氧根的电子式,故B错误;
C、羟基是不带电的自由基不能独立存在,很活泼,容易得到1个电子,具有极强的氧化性,故C错误;
D、羟基含有的电子数为9,NH3所含电子数是10,故D错误,故选A.
分析:A、羟基是中性原子团,是有机物的官能团,依据结构分析判断电子式;
B、氢氧根离子是带一个负电荷的阴离子;
C、羟基是不带电的自由基不能独立存在,很活泼;
D、羟基含有的电子数为9,据此分析即可.
4.下列物质的电子式书写正确的是( )
A. B. C. D.
答案:A
知识点:电子式.
解析:
解答:A、氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为,故A正确;
B、氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为,故B错误;
C、氯化氢属于共价化合物,分子中存在一个H﹣Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为,故C错误;
D、CO2为共价化合物,电子式为,故D错误;
故选A.
分析:A.氮气分子中存在氮氮三键,应该存在3对共用电子对;
B.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
C.氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子;
D.二氧化碳中存在两对C=O双键.
5.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
A.H2O2的电子式:
B.NH4I的电子式:
C.原子核内有8个中子的碳原子:C
D.CO2分子的结构式:O=C=O
答案:D
知识点:电子式、化学式或化学符号及名称的综合.
解析:
解答:A.H2O2是共价化合物,不是由离子形成的,其正确的电子式为:,故A错误;
B.缺少碘离子的最外层电子,碘化铵正确的电子式为:,故B错误;
C.元素符号左下角数字表示的是质子数,碳原子的质子数是6,质量数为14,该碳原子的正确表示方法为:614C,故C错误;
D.二氧化碳分子中存在两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O,故D正确;故选D.
分析:A.双氧水分子为共价化合物,分子中不存在阴阳离子;
B.碘离子为阴离子,电子式中需要标出最外层电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键.
6.下列有关化学用语表达正确的是( )
A.NH4Cl的电子式: B.氚表示为T
C.次氯酸的结构式为H﹣O﹣Cl D.16O2和18O2互为同素异形体
答案:C
知识点:电子式、化学式或化学符号及名称的综合;同位素及其应用;同素异形体.
解析:
解答:A.氯化铵为离子化合物,铵根离子需要标出其原子的最外层电子,氯化铵正确的电子式为:,故A错误;
B.氚的质量数为3、质子数为1,该原子可以表示为:31H,故B错误;
C.次氯酸分子中存在1个氢氧键和1个氧氯键,其结构式为:H﹣O﹣Cl,故C正确;
D.16O2和18O2都是氧气分子,为同一种物质,不属于同素异形体,故D错误;故选C.
分析:A.铵根离子为复杂阳离子,没有表示出N、H原子的最外层电子;
B.氚的质量数为3,元素符号应该H表示;
C.次氯酸分子的中心原子为O原子,分子中存在1个氢氧键和1个氧氯键;
D.同素异形体为同种元素形成的不同单质,二者都是氧气,为同一种物质.
7.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O═4NaOH+O2↑
B.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
C.CaC2+2H2O═Ca(OH)2+CH≡CH↑
D.NH4Cl+NaOH═NaCl+NH3↑+H2O
答案:A
知识点:化学键.
解析:
解答:A.2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A选;
B.该反应中没有非极性共价键的形成,故B不选;
C.CaC2+2H2O→Ca(OH)2+HC≡CH↑中既有离子键、极性键断裂,又有离子键、极性键,没有非极性键断裂、非极性键形成,故C不选;
D.该反应中没有非极性键的断裂和形成,故D不选.
故选A.
分析:一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
8.下列物质加热熔化时破坏极性共价键的是( )
A.干冰 B.晶体硅 C.氢氧化钠 D.二氧化硅
答案:D
知识点:化学键.
解析:
解答:A.干冰属于分子晶体,熔化时发生物理变化,破坏分子间作用力,故A错误;
B.晶体硅是原子晶体,硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键,故B错误;
C.氢氧化钠是离子晶体,钠离子和氢氧根离子之间存在离子键,所以氢氧化钠熔化时破坏离子键,故C错误;
D.二氧化硅是原子晶体,硅原子和氧原子之间存在极性共价键,二氧化硅熔化时破坏极性共价键,故D正确;故选D.
分析:分子晶体熔化不破坏化学键,原子晶体熔化破坏共价键,离子晶体熔化破坏离子键;
同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,活泼金属和活泼非金属元素之间存在离子键.
9.下列说法正确的是( )
A.离子化合物中可能含有共价键
B.非金属元素只能形成共价化合物
C.阳离子只能被还原
D.阴离子中不含金属元素
答案:A
知识点::化学键;氧化还原反应.
解析:
解答:A.离子化合物中可以含共价键,如NaOH中含有离子键、共价键,故A正确;
B.铵盐全部为非金属元素,为离子化合物,故B错误;
C.阳离子也可被氧化,如+2价铁离子可以被氧化成+3价铁离子,故C错误;
D.阴离子可能含金属元素,如AlO2﹣,故D错误;故选A.
分析:A.离子化合物中可以含共价键;
B.铵盐全部为非金属元素;
C.+2价铁离子可以被氧化成+3价铁离子,也可还原成单质铁;
D.AlO2﹣中含有金属元素.
10.下列物质中,既含极性共价键又含非极性共价键的化合物是( )
A.NH4Cl B.Cl2 C.H2O2 D.CCl4
答案:C
知识点:共价键的形成及共价键的主要类型.
解析:
解答:A.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N﹣H原子之间存在极性键,属于离子化合物,故A错误;
B.氯气分子中Cl﹣Cl原子之间只存在非极性键,属于单质,故B错误;
C.双氧水分子中H﹣O原子之间存在极性键、O﹣O原子之间存在非极性键,属于共价化合物,故C正确;
D.四氯化碳分子中C﹣Cl原子之间只存在极性键,属于共价化合物,故D错误;故选C.
分析:同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,只含共价键的化合物是共价化合物,据此分析解答.
11.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl﹣、S2﹣ 四种离子的半径依次减小
C.Po、Po、Po三种原子的核外电子数分别为124、125、126
D.ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
答案:D
知识点:化学键;元素周期律的作用;核素.
解析:
解答:A.只含有共价键的化合物是共价化合物,则共价化合物中不可能含有离子键,故A错误;
B.电子排布相同的离子,原子序数越大,则离子半径越小,所以Ca2+、K+、Cl﹣、S2﹣﹣四种离子的半径依次增大,故B错误;
C.电子数等于质子数,同种元素不同核素的电子数相同,则Po、Po、Po三种原子的核外电子数相同均为84,故C错误;
D.元素的非金属性越强,则氢化物的稳定性越强,非金属性:O>S>Se,则H2O、H2S、H2Se稳定性依次减弱,故D正确.故选D.
分析:A.只含有共价键的化合物是共价化合物;
B.电子排布相同的离子,原子序数越大,则离子半径越小;
C.电子数等于质子数,同种元素不同核素的电子数相同;
D.元素的非金属性越强,则氢化物的稳定性越强.
12.对下列物质溶于水时破坏的作用力描述错误的是( )
A.氯化钠,破坏了离子键 B.氯化氢,破坏了共价键
C.蔗糖,破坏了分子间作用力 D.二氧化碳,没有破坏作用力
答案:D
知识点:化学键和分子间作用力的区别.
解析:
解答:A、氯化钠是离子晶体,微粒间的作用力是离子键,氯化钠溶于水,破坏的是离子键,故A正确;
B、氯化氢气体溶于水,氯化氢在水分子的作用下电离出自由移动的离子,克服的是共价键,故B正确;
C、蔗糖溶于水,克服的是分子间作用力,故C正确;
D、二氧化碳溶于水,克服的是分子间作用力,故D错误;故选D.
13.下列现象中,能用范德华力解释的是( )
A.氮气的化学性质稳定
B.通常状况下,溴呈液态,碘呈固态
C.水的沸点比硫化氢高
D.锂的熔点比钠高
答案:B
知识点:分子间作用力对物质的状态等方面的影响.
解析:
解答:A.由氮气分子中含有氮氮三键,键能较大,化学性质稳定,与范德华力无关,故A错误;
B.溴、碘等共价化合物,它们的熔沸点与分子间作用力即范德华力有关,故B正确;
C.水分子中有氢键的作用力大于范德华力,导致熔沸点变大,硫化氢分子间没有氢键,所以水的沸点比硫化氢的沸点高,故C错误;
D.钠离子半径大于锂离子半径,故钠中金属键减弱,其熔点比锂低,故D错误;故选B.
分析:A.物质的化学性质稳定与否与分子内的化学键有关,与范德华力无关;
B.根据分子晶体,相对分子质量越大,范德华力越大,熔沸点越高;
C.根据分子间氢键使物质的沸点升高;
D.离子半径越大,金属键越弱,单质熔点越低;
14.下列说法错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键
答案:A
知识点:化学键;离子化合物的结构特征与性质;
解析:
解答:A:含有共价键的化合物不一定是共价化合物,如NH4NO3等铵盐,故A错.
B:只含有共价键的化合物是共价化合物,故B对.
C:物质只要含有离子键就是离子化合物,故C对.
D:双原子单质分子形成的共价健,由于原子相同得电子能力相等,共用电子对不发生偏移,一定是非极性键,故D对.故选A
分析:根据化合物元素组成判断含有的化学键,从而判断选项正误.注意:1、共价化合物中一定不含离子键,离子化合物中可能含有共价键.2、不是所有物质都含有化学键,如:稀有气体是单原子分子,所以不含化学键,只存在分子间作用力.
15.下列说法中正确的是( )
①水分子的电子式为
②离子半径由小到大的顺序是:Mg2+<Na+<Cl﹣<S2﹣
③氮分子的电子式为
④只含有离子键的化合物才是离子化合物.
A.①② B.③④ C.①④ D.②③
答案:D
知识点:电子式;微粒半径大小的比较;离子化合物的结构特征与性质.
解析:
解答:①水是共价化合物,原子间通过共用电子对形成化学键,其电子式为,故①错误;
②电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小,离子半径由小到大的顺序是:Mg2+<Na+<Cl﹣<S2﹣,故②正确;
③氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为,故C正确;
④只要化合物中含有离子键,这种化合物就是离子化合物,既有离子键又有共价键的化合物也是离子化合物,故④错误.故选:D.
分析:①水是共价化合物,原子间通过共用电子对形成化学键;
②电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小;
③氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键;
④只要化合物中含有离子键,这种化合物就是离子化合物.
16.下列说法正确的是( )
A.H2O和H2O2中的化学键类型完全相同
B.N2的结构式为N﹣N
C.一个D216O分子所含的中子数为10
D.NaCl的电子式为
答案:C
知识点:电子式;结构式;质子数、中子数、核外电子数及其相互联系;化学键.
解析:
解答:A.水分子中O原子和H原子只存在极性键,双氧水分子中O原子和H原子之间存在极性键、O原子和O原子之间存在非极性键,故A错误;
B.氮气分子中存在氮氮三键,氮气分子的结构式为N≡N,故B错误;
C.D原子中含1个中子、O原子中含有8个中子,所以一个D2O分子所含的中子数为1×2+8=10,故C正确;
D.氯化钠为离子化合物,其电子式为,故D错误;故选C.
分析:A.双氧水分子中含有O﹣O非极性键;
B.氮气分子中存在氮氮三键;
C.D原子含有1个中子;
D.氯化钠为离子化合物,应该符合离子化合物电子式特点
解答:解:
点评:本题主要考查了化学用语,属于基础题,涉及结构式、化学键、电子式等知识点,根据这些知识点的书写规则书写,注意离子化合物和共价化合物电子式书写区别,为易错点.
17.下列化合物的电子式书写正确的是( )
A. B.
C. D.
答案:D
知识点:电子式.
解析:
解答:A、氯化钙电子式为,故A错误;
B、氯原子最外层7个电子成1个共价键、氧原子的最外层6个电子,成2个共价键,电子式为,故B错误;
C、过氧化氢是共价化合物,不存在离子键,氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对,电子式为,故C错误;
D、氟化钾为离子化合物,电子式为,书写正确,故D正确,
故选D.
分析:A、氯化钙为离子化合物,阴离子个数不能合并;
B、次氯酸中O分别与H和Cl形成一对共价键;
C、水为共价化合物,不能用括号;
D.KF为离子化合物,阴离子需要括号,且标明所带电荷数.
18.下列化学用语中,正确的是( )
A.用电子式表示溴化氢的形成过程为:
B.海水中Br﹣的电子式为:
C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl
D.氯离子的结构示意图为:
答案:B
知识点:电子式;原子结构示意图;离子方程式的书写.
解析:
解答:A.溴化氢分子中不存在阴阳离子,,故A错误;
B.溴离子最外层达到8个电子稳定结构,电子式需要标出阴离子所带电荷及最外层电子,溴离子的电子式为:,故B正确;
C.海水中通入氯气时发生反应的离子方程式为:2Br﹣+Cl2=Br2+2Cl﹣,故C错误;
D.氯离子最外层达到8电子稳定结构,氯离子正确的结构示意图为:
,故D错误;
故选B.
分析:本题考查了电子式、离子方程式、离子结构示意图等化学用语的判断,注意掌握常见化学用语的概念及正确表示方法,明确离子结构示意图与原子结构示意图的表示方法及区别.
19.下列有关化学用语的表示方法中错误的是( )
A.CO2分子的结构式:O=C=O
B.S2﹣的结构示意图:
C.R2+离子核外有a个电子,b个中子,R原子符号为:R
D.次氯酸的电子式:
答案:D
知识点:电子式、化学式或化学符号及名称的综合;原子结构示意图;质量数与质子数、中子数之间的相互关系.
解析:
解答:A.二氧化碳分子中碳原子和每个氧原子之间共用两个电子对,所以其结构式为:O=C=O,故A正确;
B.硫离子核外有3个电子层,最外层有8个电子,其离子结构示意图为:
,故B正确;
C.R2+离子核外有a个电子,b个中子,则R原子的质子数为a+2,质量数为a+b+2,R原子符号为:R,故C正确;
D.次氯酸的中心原子为O原子,次氯酸的电子式为:,故D错误;
故选D.
分析:本题考查了化学用语的表示方法,题目难度中等,注意掌握离子结构示意图、元素符号、结构式、电子式的概念及书写原则,D为易错点,需要明确次氯酸的中心原子为O原子.A.二氧化碳分子中碳原子和每个氧原子之间共用两个电子对;
B.硫离子核外有3个电子层,最外层有8个电子;
C.元素符合左下角的数字表示质子数,左上角数字表示质量数;
D.次氯酸的中心原子是氧原子,分子中存在1个氢氧键和1个氧氯键.
点评:
20.下列各组物质中,化学键类型和化合物类型都相同的是( )
A.SO2和H2O B.CO2和Na2CO3 C.KOH和NaCl D.NaCl和HCl
答案:A
知识点:化学键.
解析:
解答:A.SO2和H2O都为共价化合物,只有共价键,故A正确;
B.CO2为共价化合物,含有共价键,Na2CO3为离子化合物,含有离子键和共价键,故B错误;
C.KOH和NaCl都为离子化合物,但NaOH含有离子键和共价键,NaCl只含有离子键,故C错误;
D.NaCl为离子化合物,含有离子键,HCl为共价化合物,只有共价键,故D错误.故选A.
分析:化学键分为离子键和共价键,离子键为阴阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键,以此解答该题.
二.填空题
21.(1)用电子式表示.
①铝原子
②硫离子
③溴化镁的形成过程
(2)在 Li、N、Na、Mg、Li、C中:
① 和 互为同位素.
② 和 质量数相等,但不能互称同位素.
③ 和 的中子数相等,但质子数不相等,所以不是同一种元素.
答案:(1)①;②;
③;
(2)①63Li、73Li;②146C、147N;③2311Na、2412Mg.
知识点:电子式;同位素及其应用;质量数与质子数、中子数之间的相互关系.
解析:
解答:(1)①铝原子最外层为3个电子,氯原子的电子式为,故答案为:;
②硫离子为阴离子,电子式中需要标出所带电荷及最外层电子,硫离子的电子式为:,故答案为:;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为,故答案为:;
(2)①63Li和73Li的质子数都是3,中子数分别为6﹣3=3、7﹣3=4,即质子数相同、中子数不同的同种元素的原子,则互为同位素,故答案为:63Li、73Li;
②146C和 147N的质量数都是14,质子数分别为6、7,中子数分别为8、7,质子数等于电子数,即质量数相同,但不是同位素,故答案为:146C、147N;
③2311Na和2412Mg的质子数分别为11、12,质量数分别为23、24,中子数分别为23﹣11=12、24﹣12=12,即中子数相同,但不是同一种元素,故答案为:2311Na、2412Mg.
分析:(1)①依据元素的原子最外层电子个数的多少,先用小黑点“ ”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对;
②阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(2)具有相同质子数、不同中子数的原子互为同位素;在原子的构成中,元素符号左上角的数字表示原子的质量数;原子中,质量数=质子数+中子数,据此解答即可.
22.现有①BaCl2 ②碘片 ③NH4Cl ④Na2SO4 ⑤干冰 五种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是 .(填写物质的序号,下同)
(2)属于离子化合物的是 ,只有离子键的物质是 .
(3)①的电子式是 ,
⑤的形成过程用电子式表示为 .
答案:(1)②⑤;(2)①③④;①;
(3); .
知识点:化学键;电子式;用电子式表示简单的离子化合物和共价化合物的形成.
解析:
解答:(1)分子晶体熔化时不需要破坏化学键,只破坏分子间作用力,干冰和碘片都属于分子晶体,熔化时不需要破坏化学键;
故答案为:②⑤;
(2)含有离子键的化合物是离子化合物,则属于离子化合物的是:BaCl2、NH4Cl、Na2SO4,只含有离子键的是BaCl2,
故答案为:①③④;①;
(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合,二氧化碳电子式为,则形成过程为:,
故答案为:.
分析:(1)分子晶体熔化时不需要破坏化学键;(2)含有离子键的化合物是离子化合物,活泼金属和活泼非金属元素之间易形成离子键,铵盐中含有离子键;非金属元素之间易形成共价键;(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合.
23.对于HCl、H2SO4、NaOH、NaCl、NH4Cl、Ne、N2、金刚石,回答下列问题:
(1)不存在化学键的是 .
(2)属于共价化合物的是 、 .
(3)属于离子化合物的是 、 、 .
(4)既含离子键,又含共价键的是 .
答案:(1)Ne;(2)HCl、H2SO4;(3)NaOH、NaCl、NH4Cl;(4)NH4Cl.
知识点:化学键;离子化合物的结构特征与性质.
解析:
解答:(1)稀有气体为单原子分子,不存在化学键,则不存在化学键的是Ne;故答案为:Ne;
(2)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,则属于共价化合物的是HCl、H2SO4;故答案为:HCl、H2SO4;
(3)一般活泼金属和活泼非金属元素之间易形成离子键,铵盐中存在离子键,则属于离子化合物的是NaOH、NaCl、NH4Cl;
故答案为:NaOH、NaCl、NH4Cl;
(4)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N元素与H元素之间存在共价键,则NH4Cl既含离子键,又含共价键;故答案为:NH4Cl.
分析:一般活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;稀有气体为单原子分子,不存在化学键.
24.书写电子式或用电子式回答下列问题
①NaOH ②H2O ③O=C=O ④CCl4
⑤以氟化氢为例表示共价键形成过程
⑥以硫化钠为例表示离子键形成过程 .
答案:① ;②;③;④;
⑤;⑥.
知识点:电子式.
解析:
解答:①NaOH为离子化合物,电子式为,故答案为:;
②H2O为共价化合物,电子式为,故答案为:;
③O=C=O为共价化合物,C=O之间含有两对电子,满足8电子稳定结构,电子式为,
故答案为:;
④CCl4为共价化合物,各原子满足8电子稳定结构,电子式为,故答案为:;
⑤HF为共价化合物,各原子满足8电子稳定结构,共价键形成过程为,
故答案为:;
⑥硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为,
故答案为:.
分析:首先判断化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
25.有下列物质:①N2 ②Na2O ③NaOH ④CH4 ⑤CO2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是 .
(2)只由极性键构成的物质是 .
(3)只由非极性键构成的物质是 .
(4)只由非金属元素组成的离子化合物是 .
(5)请写出②Na2O和④CH4的电子式 、 .
(6)请用电子式表示⑤CO2 ⑥MgF2 的形成过程.CO2: MgF2: .
答案:
(1)②⑥;(2)④⑤;(3)①;(4)⑦;
(5);;
(6);
知识点:离子化合物的结构特征与性质;电子式;共价键的形成及共价键的主要类型;用电子式表示简单的离子化合物和共价化合物的形成.
解析:
解答:①N2中N原子之间只存在共价键,属于单质;
②Na2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
(1)只由离子键构成的物质是②⑥,故答案为:②⑥;
(2)只由极性键构成的物质是④⑤,故答案为:④⑤;
(3)只由非极性键构成的物质是①,故答案为:①;
(4)只由非金属元素组成的离子化合物是⑦,故答案为:⑦;
(5)②Na2O的电子式为,CH4的电子式为故答案为:;;
(6)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
故答案为:;
.
分析:①N2中N原子之间只存在共价键,属于单质;
②Na2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;结合电子式的书写特点、物质的性质过程等知识点来分析解答.
+17
2
8
7
+17
2
8
8
+16
2
8
8
+16
2
8
8
