新课标人教版高中化学必修2第二章第二节《化学能与电能》同步练习.doc
文档属性
| 名称 | 新课标人教版高中化学必修2第二章第二节《化学能与电能》同步练习.doc |  | |
| 格式 | doc | ||
| 文件大小 | 314.5KB | ||
| 资源类型 | 素材 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-17 09:06:25 | ||
图片预览

文档简介
登陆21世纪教育 助您教考全无忧
人教版化学高一必修2第二章第二节化学能与电能同步练习
一、选择题
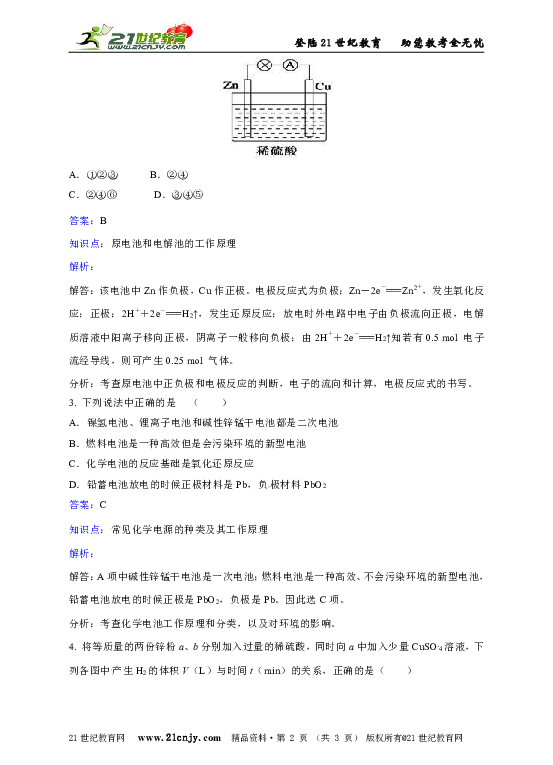
1. 某原电池的总反应离子方程式为:Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是下列的( )
答案:C
知识点:原电池和电解池的工作原理
解析:
解答:该原电池负极为锌,正极是比锌稳定的金属/导电的非金属,电解质溶液中含有Cu2+。
分析:考查原电池正负极材料和电解质溶液的选择,根据原电池的组成进行判断。
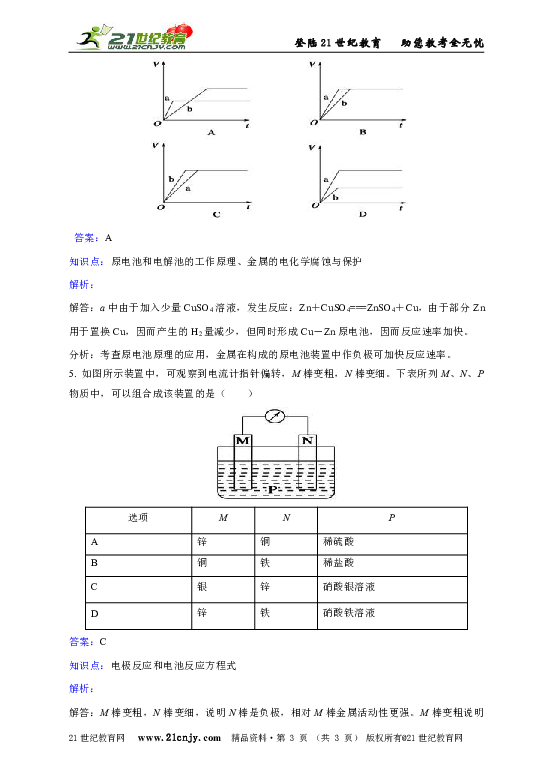
2. 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
A.①②③ B.②④
C.②④⑥ D.③④⑤
答案:B
知识点:原电池和电解池的工作原理
解析:
解答:该电池中Zn作负极,Cu作正极。电极反应式为负极:Zn-2e-===Zn2+,发生氧化反应;正极:2H++2e-===H2↑,发生还原反应;放电时外电路中电子由负极流向正极,电解质溶液中阳离子移向正极,阴离子一般移向负极;由2H++2e-===H2↑知若有0.5 mol 电子流经导线,则可产生0.25 mol 气体。
分析:考查原电池中正负极和电极反应的判断,电子的流向和计算,电极反应式的书写。
3. 下列说法中正确的是 ( )
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料PbO2
答案:C
知识点:常见化学电源的种类及其工作原理
解析:
解答:A项中碱性锌锰干电池是一次电池;燃料电池是一种高效、不会污染环境的新型电池,铅蓄电池放电的时候正极是PbO2,负极是Pb。因此选C项。
分析:考查化学电池工作原理和分类,以及对环境的影响。
4. 将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量CuSO4溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
答案:A
知识点:原电池和电解池的工作原理、金属的电化学腐蚀与保护
解析:
解答:a中由于加入少量CuSO4溶液,发生反应:Zn+CuSO4===ZnSO4+Cu,由于部分Zn用于置换Cu,因而产生的H2量减少,但同时形成Cu-Zn原电池,因而反应速率加快。
分析:考查原电池原理的应用,金属在构成的原电池装置中作负极可加快反应速率。
5. 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
答案:C[
知识点:电极反应和电池反应方程式
解析:
解答:M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活动性更强。M棒变粗说明M棒上有金属析出。
分析:考查原电池正负极的判断以及原电池的组成,根据电极现象判断电极反应是解题的关键 。
6. 据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn+2e-===Zn2+
C.正极发生氧化反应 D.电解液肯定不是强酸
答案:D
知识点:原电池和电解池的工作原理
解析:
解答:根据原电池反应的原理,负极发生氧化反应,较活泼的金属作负极,因此Zn-2e-===Zn2+是负极反应,正极发生还原反应。再根据电池总反应式,生成物是ZnO,ZnO能与强酸溶液反应,所以D项正确。
分析:考查锌电池的工作原理,考查学生对原电池原理的掌握情况。
7. 下列叙述正确的是( )
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应,通过原电池的装置可以实现
④碳棒不能用来作原电池的正极
⑤反应Cu+2Ag+===Cu2++2Ag可以进行
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
答案:A
知识点:电极反应和电池反应方程式、常见的能量转化形式
解析:
解答:原电池中正极发生还原反应,负极发生氧化反应,碳棒可以作原电池的正极。
分析:考查原电池原理的理解和原电池的电极判断以及电极反应的分析。
8. 对于锌—铜—稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出1g H2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
答案:A
知识点:电极反应和电池反应方程式
解析:
解答:当导线中有1 mol电子通过时,溶解了0.5 mol锌,质量是32.5g;在铜片上析出0.5 mol氢气,质量是1g。
分析:考查原电池正负极现象的变化,以及根据电子转移物质的量计算电极反应。
9. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
答案:C
知识点:电极反应和电池反应方程式、原电池和电解池的工作原理
解析:
解答:甲烧杯中铜片上有气泡冒出,乙烧杯中铜片上没有气泡产生;电化学反应速率比一般的化学反应速率快,甲装置是原电池装置,乙装置不是,所以化学反应速率甲比乙快。
分析:考查原电池形成的条件及原电池的电极反应知识,熟练掌握原电池的形成条件是解题的关键 。
10. 氢氧燃料电池以氢气为燃料,氧气为氧化剂,电极是多孔镍电极,电解质溶液为质量分数30%的KOH溶液,有关叙述正确的是 ( )
①负极反应为2H2-4e-===4H+
②负极反应为2H2+4OH--4e-===4H2O
③工作时正极pH增大,而负极pH减小
④工作时负极pH增大,而正极pH减小
⑤工作时溶液中阴离子移向正极
⑥使用一段时间,KOH溶液质量分数仍为30%
A.①②③ B.②③ C.②③⑥ D.④⑤
答案:B
知识点:常见化学电源的种类及其工作原理
解析:
解答:氢氧燃料电池在碱性条件下,负极:2H2-4e-===4H+和4H++4OH-===4H2O(即2H2+4OH--4e-===4H2O),pH减小;正极:O2+4e-+2H2O===4OH-,pH增大。工作时溶液中OH-移向负极。使用一段时间,电解质的物质的量保持不变,由于生成了H2O,KOH浓度变小。
分析:考查燃烧电池的工作原理,考查学生不同条件下电极反应式的书写,PH大小变化的判断。
11. 2010年上海世博会,上海将有千辆氢燃料电池车上路,关于氢燃料电池下列说法不正确的是( )
A.氢燃料电池是一种具有应用前景的绿色电源
B.氢燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
C.氢燃料电池能量转换率比氢气直接燃烧高
D.氢燃料电池工作时,发出淡蓝色火焰
答案:D
知识点:常见化学电源的种类及其工作原理
解析:
解答:氢资源丰富,热值高,燃烧性能好,用于发电时,能量转换率高并实现零排放,若用可再生能源制氢,并形成循环,很有发展远景。使用时,可将氢气储存在储氢罐中。选项D错在,氢气没有燃烧,而是在负极上失电子,对于氢燃料电池电解质不同,负极发生的反应也不同,如强酸型介质时,负极发生H2-2e-===2H+;强碱性溶液中,负极发生:H2+2OH--2e-===2H2O。
分析:考查氢燃料电池的工作原理、应用和优点,需要注意的是燃料电池的电极方程式和总反应方程式的书写。
12. 关于原电池的叙述中正确的是( )
A.构成原电池的两个电极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂发生反应,总是溶液中的阳离子在此被还原
答案:B
知识点:原电池和电解池的工作原理
解析:
解答:构成原电池电极的也可以是非金属导体,A项错;燃料电池中负极不溶解,C项错;D项应是氧化剂在原电池的正极上发生还原反应。
分析:根据原电池装置是将化学能转化为电能的装置,反应的实质是氧化还原反应进行解答。
13. 在理论上不能用于设计原电池的化学反应的是( )
A.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O(l) ΔH<0
B.CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3 ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
答案:A
知识点:原电池和电解池的工作原理
解析:
解答:只有氧化还原反应才能设计成原电池,A项不是氧化还原反应,不能设计成原电池。
分析:考查能设计成原电池的化学反应满足的条件,原电池发生的是氧化还原反应。
14. 如图为番茄电池,下列说法正确的是( )
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极
答案:A
知识点:原电池和电解池的工作原理
解析:
解答:番茄电池中锌是负极,铜是正极,负极锌会失去电子溶解,质量减小,A正确、D错误;铜极是正极,电子由负极锌移向正极铜,C错误;铜电极不会出现蓝色,B错误。
分析:根据构成原电池装置的条件进行分析判断即可。
15. A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B
C.B>A>C D.B>C>A
答案:C
知识点:原电池和电解池的工作原理
解析:
解答:A能从C的盐溶液中置换出C金属,活动性:A>C。A与B组成原电池时,B为负极,则金属活动性:B>A。
分析:根据原电池中金属性活泼的做原电池的负极进行判断金属的活泼性饥渴。
16. 如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
答案:D
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,Cu在铁球表面析出,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,Cu在铜球表面析出,A端下沉。
分析:考查原电池原理和形成的条件,根据能否形成原电池以及电极反应进行分析判断即可。
17. 将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大
答案:D
知识点:电极反应和电池反应方程式
解析:
解答:根据图示可知甲构成原电池,乙未构成原电池,所以甲中Zn作负极,被氧化,Cu作正极,H+在铜片上被还原产生H2,而乙中Cu不与稀硫酸作用,Zn与稀硫酸发生氧化还原反应,因甲构成原电池而加大反应速率。故只有D正确。
分析:根据原电池的构成条件和电极反应进行分析即可。
18. 控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中的石墨电极为负极
答案:D
知识点:原电池和电解池的工作原理
解析:
解答:由反应2Fe3++2I- 2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;当电流计读数为零时,则反应达到平衡状态,此时在甲中加入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极,故选D。
分析:考查原电池相关知识的理解,同时也考查考生的读图能力。
19. 有一种新型的碱性锌锰电池,它是在酸性锌锰电池的基础上改进的。下列对于碱性锌锰电池的叙述中不正确的是( )
A.碱性锌锰电池工作时,电子由Zn极经外电路流向碳极
B.这种电池较酸性锌锰电池使用寿命长
C.碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D.这种电池的电解质由传统的NH4Cl换成湿的KOH
答案:C
知识点:常见化学电源的种类及其工作原理 、化学电源新型电池
解析:
解答:该新型的锌锰电池也是一次电池(即干电池)不是二次电池(即充电电池),它只能实现化学能转化为电能,而不能实现电能转化为化学能,故C错。
分析:本题考查新型的碱性锌锰电池的工作原理,熟练掌握原电池原理是解题的关键 。
20. 根据下列事实:
①A+B2+═A2++B;
②D+2H2O═D(OH)2↓+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-= B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+[]
B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
答案:D
知识点:氧化性、还原性强弱的比较
解析:
解答:由①知氧化性B2+>A2+;由②知D为活泼性很强的金属,则D2+的氧化性很弱;根据原电池原理,由③知原电池反应为E2++B═E+ B2+,则氧化性E2+>B2+,故氧化性E2+>B2+>A2+>D2+。
分析:在原电池中负极发生氧化反应,正极发生还原反应,判断离子的氧化性强弱即可。
二.非选择题
21. 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属 电子流动方向 电压(V)
D D→Cu +0.78
C Cu→C -0.15
B B→Cu +1.35
A A→Cu +0.30
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)最活泼金属为 (填字母序号,下同)。
(2)若滤纸改用NaOH溶液浸润,则在滤纸上能看到蓝色沉淀析出的是 金属,其负极的电极反应为 。
(3)若(2)中滤纸上析出沉淀为9.8 g,则转移电子为 mol。
答案:(1)B
(2)C Cu-2e-+2OH-═Cu(OH)2
(3)0.2
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:(1)由电子流动的方向可知,A、B、D的活动性皆强于Cu,根据构成两电极的金属活动性相差越大,电压表的读数越大,可知B的金属活动性最大,为最强的还原剂,C的金属活动性弱于Cu,不能从CuSO4溶液中置换出铜。
(2)由(1)的分析可知,只有C金属与Cu组成的原电池,铜失电子生成Cu2+,进而与OH-结合产生蓝色沉淀。负极反应式为Cu+2OH--2e-═Cu(OH)2。
(3)因蓝色沉淀为Cu(OH)2,所以当析出9.8 g Cu(OH)2时,转移电子为×2=0.2 mol。
分析:本题考查原电池的构成条件和电极反应,熟练掌握金属的活泼性与原电池的关系是解题的关键 。
22. 为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
回答下列问题:
(1)根据原电池原理填写下表:
装置序号 正极 负极反应式 阳离子移动方向
甲
乙
丙
丁
戊
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?________(填“是”“否”或“不一定”),请举例说明:_______________________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_________,丙________,戊________。(填酸性或碱性增强或减弱)
答案:(1)
装置序号 正极 负极反应式 阳离子移动方向
甲 Al Mg-2e-===Mg2+ 铝极
乙 Pt Fe-2e-===Fe2+ 铂极
丙 Mg Al-3e-+4OH-===AlO+2H2O 镁极
丁 Al Cu-2e-=== Cu2+ 铝极
戊 石墨 CH4-8e-+10OH-=== CO+7H2O 石墨
(2)电解质溶液的性质;
(3)不一定 上述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极发生了氧化反应;
(4)酸性减弱 碱性减弱 碱性减弱
知识点:电极反应和电池反应方程式 、原电池和电解池的工作原理
解析:
解答:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;
乙电池:铁比铂活泼,铁为负极;
丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;
丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极;
戊电池是燃料电池,甲烷与氧气反应,甲烷发生氧化反应,在碱中生成碳酸盐和水,氧气发生还原反应。所以,在负极区通入甲烷,在正极区通入空气。
(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。
(3)大多数电池的负极材料参与反应发生氧化反应,燃料电池的负极材料不参与反应,可燃物如氢气、一氧化碳、甲烷、乙醇等在负极区发生氧化反应。
(4)根据溶液中离子参加反应情况判断溶液酸碱性的变化。
分析:考查原电池正负极的判断和材料的选择,电极反应式的书写、阴阳离子移动方向的判断及相关原电池知识,意在考查学生分析实验的能力。
23. 航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-===CO+3H2O。
(1)负极上的电极反应为______________________________。
(2)消耗标准状况下的5.6L O2时,有________mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
答案:(1)CH4+10OH--8e-===CO+7H2O;(2)1 ;(3)增大
知识点:化学电源新型电池
解析:
解答:由总反应式知CH4失电子被氧化生成CO,一定有OH-参与反应,负极反应为CH4+10OH--8e-===CO+7H2O,正极反应为O2+2H2O+4e-===4OH-。根据正极反应式知1mol O2消耗时,转移4mol e-,n(O2)=0.25mol,故有1mol电子转移。放电时,正极产生OH-,故溶液的pH增大。
分析:考查燃烧电池在航天飞机中的应用,考查学生对原电池原理和电极反应式的掌握情况。
24. 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为_______;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
答案:(1)铜(或Cu);AgNO3溶液;(2)正, Ag++e- = Ag; Cu-2e- = Cu2+。
(3)负(Cu);正(Ag)。
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:将氧化还原反应拆成两个半反应:一个是在负极发生的氧化反应,一个是在正极发生的还原反应;铜片失去电子被氧化,而失去电子即流出电子的一极为负极,所以铜片为负极,发生的反应为:Cu(s) -2e- = Cu2+(aq) ;电极X的材料是铜,电解质溶液是可溶性的银盐,可熔性的银盐只有硝酸银溶液;电子流入的一极为正极,银电极为电池的正极,发生的反应为:Ag++e- = Ag,外电路中的电子是从X(铜片、负极)电极流向Ag(正极)电极。
分析:考查原电池的工作原理和电极反应式书写的掌握情况。
25. 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+====2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是 ,发生 反应(填“氧化”或“还原”),电解质溶液是 ;
(2)正极上出现的现象是
;
(3)若导线上转移电子1 mol,则生成银 克。
答案:(1)Cu 氧化 AgNO3溶液
(2)碳棒上出现银白色物质
(3)108
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:(1)根据电池的总反应,可知负极一般是失电子的物质作电源的负极,所以负极材料应该是铜电极,发生氧化反应,负极铜电极应该与电解质溶液反应,所以根据反应,电解质溶液应该是一种可溶性的银盐溶液,所以是AgNO3溶液。
(2)正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。
(3)当导线上转移1 mol电子的时候,正极上会析出1 mol银单质,所以正极上生成的银的质量是108 g。
分析:根据原电池的电极反应判断电极材料以及发生的反应,然后计算生成的银的质量即可。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 16 页 (共 16 页) 版权所有@21世纪教育网
人教版化学高一必修2第二章第二节化学能与电能同步练习
一、选择题
1. 某原电池的总反应离子方程式为:Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是下列的( )
答案:C
知识点:原电池和电解池的工作原理
解析:
解答:该原电池负极为锌,正极是比锌稳定的金属/导电的非金属,电解质溶液中含有Cu2+。
分析:考查原电池正负极材料和电解质溶液的选择,根据原电池的组成进行判断。
2. 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
A.①②③ B.②④
C.②④⑥ D.③④⑤
答案:B
知识点:原电池和电解池的工作原理
解析:
解答:该电池中Zn作负极,Cu作正极。电极反应式为负极:Zn-2e-===Zn2+,发生氧化反应;正极:2H++2e-===H2↑,发生还原反应;放电时外电路中电子由负极流向正极,电解质溶液中阳离子移向正极,阴离子一般移向负极;由2H++2e-===H2↑知若有0.5 mol 电子流经导线,则可产生0.25 mol 气体。
分析:考查原电池中正负极和电极反应的判断,电子的流向和计算,电极反应式的书写。
3. 下列说法中正确的是 ( )
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料PbO2
答案:C
知识点:常见化学电源的种类及其工作原理
解析:
解答:A项中碱性锌锰干电池是一次电池;燃料电池是一种高效、不会污染环境的新型电池,铅蓄电池放电的时候正极是PbO2,负极是Pb。因此选C项。
分析:考查化学电池工作原理和分类,以及对环境的影响。
4. 将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量CuSO4溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
答案:A
知识点:原电池和电解池的工作原理、金属的电化学腐蚀与保护
解析:
解答:a中由于加入少量CuSO4溶液,发生反应:Zn+CuSO4===ZnSO4+Cu,由于部分Zn用于置换Cu,因而产生的H2量减少,但同时形成Cu-Zn原电池,因而反应速率加快。
分析:考查原电池原理的应用,金属在构成的原电池装置中作负极可加快反应速率。
5. 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
答案:C[
知识点:电极反应和电池反应方程式
解析:
解答:M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活动性更强。M棒变粗说明M棒上有金属析出。
分析:考查原电池正负极的判断以及原电池的组成,根据电极现象判断电极反应是解题的关键 。
6. 据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn+2e-===Zn2+
C.正极发生氧化反应 D.电解液肯定不是强酸
答案:D
知识点:原电池和电解池的工作原理
解析:
解答:根据原电池反应的原理,负极发生氧化反应,较活泼的金属作负极,因此Zn-2e-===Zn2+是负极反应,正极发生还原反应。再根据电池总反应式,生成物是ZnO,ZnO能与强酸溶液反应,所以D项正确。
分析:考查锌电池的工作原理,考查学生对原电池原理的掌握情况。
7. 下列叙述正确的是( )
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应,通过原电池的装置可以实现
④碳棒不能用来作原电池的正极
⑤反应Cu+2Ag+===Cu2++2Ag可以进行
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
答案:A
知识点:电极反应和电池反应方程式、常见的能量转化形式
解析:
解答:原电池中正极发生还原反应,负极发生氧化反应,碳棒可以作原电池的正极。
分析:考查原电池原理的理解和原电池的电极判断以及电极反应的分析。
8. 对于锌—铜—稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出1g H2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
答案:A
知识点:电极反应和电池反应方程式
解析:
解答:当导线中有1 mol电子通过时,溶解了0.5 mol锌,质量是32.5g;在铜片上析出0.5 mol氢气,质量是1g。
分析:考查原电池正负极现象的变化,以及根据电子转移物质的量计算电极反应。
9. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
答案:C
知识点:电极反应和电池反应方程式、原电池和电解池的工作原理
解析:
解答:甲烧杯中铜片上有气泡冒出,乙烧杯中铜片上没有气泡产生;电化学反应速率比一般的化学反应速率快,甲装置是原电池装置,乙装置不是,所以化学反应速率甲比乙快。
分析:考查原电池形成的条件及原电池的电极反应知识,熟练掌握原电池的形成条件是解题的关键 。
10. 氢氧燃料电池以氢气为燃料,氧气为氧化剂,电极是多孔镍电极,电解质溶液为质量分数30%的KOH溶液,有关叙述正确的是 ( )
①负极反应为2H2-4e-===4H+
②负极反应为2H2+4OH--4e-===4H2O
③工作时正极pH增大,而负极pH减小
④工作时负极pH增大,而正极pH减小
⑤工作时溶液中阴离子移向正极
⑥使用一段时间,KOH溶液质量分数仍为30%
A.①②③ B.②③ C.②③⑥ D.④⑤
答案:B
知识点:常见化学电源的种类及其工作原理
解析:
解答:氢氧燃料电池在碱性条件下,负极:2H2-4e-===4H+和4H++4OH-===4H2O(即2H2+4OH--4e-===4H2O),pH减小;正极:O2+4e-+2H2O===4OH-,pH增大。工作时溶液中OH-移向负极。使用一段时间,电解质的物质的量保持不变,由于生成了H2O,KOH浓度变小。
分析:考查燃烧电池的工作原理,考查学生不同条件下电极反应式的书写,PH大小变化的判断。
11. 2010年上海世博会,上海将有千辆氢燃料电池车上路,关于氢燃料电池下列说法不正确的是( )
A.氢燃料电池是一种具有应用前景的绿色电源
B.氢燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
C.氢燃料电池能量转换率比氢气直接燃烧高
D.氢燃料电池工作时,发出淡蓝色火焰
答案:D
知识点:常见化学电源的种类及其工作原理
解析:
解答:氢资源丰富,热值高,燃烧性能好,用于发电时,能量转换率高并实现零排放,若用可再生能源制氢,并形成循环,很有发展远景。使用时,可将氢气储存在储氢罐中。选项D错在,氢气没有燃烧,而是在负极上失电子,对于氢燃料电池电解质不同,负极发生的反应也不同,如强酸型介质时,负极发生H2-2e-===2H+;强碱性溶液中,负极发生:H2+2OH--2e-===2H2O。
分析:考查氢燃料电池的工作原理、应用和优点,需要注意的是燃料电池的电极方程式和总反应方程式的书写。
12. 关于原电池的叙述中正确的是( )
A.构成原电池的两个电极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂发生反应,总是溶液中的阳离子在此被还原
答案:B
知识点:原电池和电解池的工作原理
解析:
解答:构成原电池电极的也可以是非金属导体,A项错;燃料电池中负极不溶解,C项错;D项应是氧化剂在原电池的正极上发生还原反应。
分析:根据原电池装置是将化学能转化为电能的装置,反应的实质是氧化还原反应进行解答。
13. 在理论上不能用于设计原电池的化学反应的是( )
A.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O(l) ΔH<0
B.CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3 ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
答案:A
知识点:原电池和电解池的工作原理
解析:
解答:只有氧化还原反应才能设计成原电池,A项不是氧化还原反应,不能设计成原电池。
分析:考查能设计成原电池的化学反应满足的条件,原电池发生的是氧化还原反应。
14. 如图为番茄电池,下列说法正确的是( )
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极
答案:A
知识点:原电池和电解池的工作原理
解析:
解答:番茄电池中锌是负极,铜是正极,负极锌会失去电子溶解,质量减小,A正确、D错误;铜极是正极,电子由负极锌移向正极铜,C错误;铜电极不会出现蓝色,B错误。
分析:根据构成原电池装置的条件进行分析判断即可。
15. A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B
C.B>A>C D.B>C>A
答案:C
知识点:原电池和电解池的工作原理
解析:
解答:A能从C的盐溶液中置换出C金属,活动性:A>C。A与B组成原电池时,B为负极,则金属活动性:B>A。
分析:根据原电池中金属性活泼的做原电池的负极进行判断金属的活泼性饥渴。
16. 如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
答案:D
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,Cu在铁球表面析出,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,Cu在铜球表面析出,A端下沉。
分析:考查原电池原理和形成的条件,根据能否形成原电池以及电极反应进行分析判断即可。
17. 将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大
答案:D
知识点:电极反应和电池反应方程式
解析:
解答:根据图示可知甲构成原电池,乙未构成原电池,所以甲中Zn作负极,被氧化,Cu作正极,H+在铜片上被还原产生H2,而乙中Cu不与稀硫酸作用,Zn与稀硫酸发生氧化还原反应,因甲构成原电池而加大反应速率。故只有D正确。
分析:根据原电池的构成条件和电极反应进行分析即可。
18. 控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中的石墨电极为负极
答案:D
知识点:原电池和电解池的工作原理
解析:
解答:由反应2Fe3++2I- 2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;当电流计读数为零时,则反应达到平衡状态,此时在甲中加入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极,故选D。
分析:考查原电池相关知识的理解,同时也考查考生的读图能力。
19. 有一种新型的碱性锌锰电池,它是在酸性锌锰电池的基础上改进的。下列对于碱性锌锰电池的叙述中不正确的是( )
A.碱性锌锰电池工作时,电子由Zn极经外电路流向碳极
B.这种电池较酸性锌锰电池使用寿命长
C.碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D.这种电池的电解质由传统的NH4Cl换成湿的KOH
答案:C
知识点:常见化学电源的种类及其工作原理 、化学电源新型电池
解析:
解答:该新型的锌锰电池也是一次电池(即干电池)不是二次电池(即充电电池),它只能实现化学能转化为电能,而不能实现电能转化为化学能,故C错。
分析:本题考查新型的碱性锌锰电池的工作原理,熟练掌握原电池原理是解题的关键 。
20. 根据下列事实:
①A+B2+═A2++B;
②D+2H2O═D(OH)2↓+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-= B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+[]
B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
答案:D
知识点:氧化性、还原性强弱的比较
解析:
解答:由①知氧化性B2+>A2+;由②知D为活泼性很强的金属,则D2+的氧化性很弱;根据原电池原理,由③知原电池反应为E2++B═E+ B2+,则氧化性E2+>B2+,故氧化性E2+>B2+>A2+>D2+。
分析:在原电池中负极发生氧化反应,正极发生还原反应,判断离子的氧化性强弱即可。
二.非选择题
21. 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属 电子流动方向 电压(V)
D D→Cu +0.78
C Cu→C -0.15
B B→Cu +1.35
A A→Cu +0.30
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)最活泼金属为 (填字母序号,下同)。
(2)若滤纸改用NaOH溶液浸润,则在滤纸上能看到蓝色沉淀析出的是 金属,其负极的电极反应为 。
(3)若(2)中滤纸上析出沉淀为9.8 g,则转移电子为 mol。
答案:(1)B
(2)C Cu-2e-+2OH-═Cu(OH)2
(3)0.2
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:(1)由电子流动的方向可知,A、B、D的活动性皆强于Cu,根据构成两电极的金属活动性相差越大,电压表的读数越大,可知B的金属活动性最大,为最强的还原剂,C的金属活动性弱于Cu,不能从CuSO4溶液中置换出铜。
(2)由(1)的分析可知,只有C金属与Cu组成的原电池,铜失电子生成Cu2+,进而与OH-结合产生蓝色沉淀。负极反应式为Cu+2OH--2e-═Cu(OH)2。
(3)因蓝色沉淀为Cu(OH)2,所以当析出9.8 g Cu(OH)2时,转移电子为×2=0.2 mol。
分析:本题考查原电池的构成条件和电极反应,熟练掌握金属的活泼性与原电池的关系是解题的关键 。
22. 为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
回答下列问题:
(1)根据原电池原理填写下表:
装置序号 正极 负极反应式 阳离子移动方向
甲
乙
丙
丁
戊
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?________(填“是”“否”或“不一定”),请举例说明:_______________________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_________,丙________,戊________。(填酸性或碱性增强或减弱)
答案:(1)
装置序号 正极 负极反应式 阳离子移动方向
甲 Al Mg-2e-===Mg2+ 铝极
乙 Pt Fe-2e-===Fe2+ 铂极
丙 Mg Al-3e-+4OH-===AlO+2H2O 镁极
丁 Al Cu-2e-=== Cu2+ 铝极
戊 石墨 CH4-8e-+10OH-=== CO+7H2O 石墨
(2)电解质溶液的性质;
(3)不一定 上述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极发生了氧化反应;
(4)酸性减弱 碱性减弱 碱性减弱
知识点:电极反应和电池反应方程式 、原电池和电解池的工作原理
解析:
解答:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;
乙电池:铁比铂活泼,铁为负极;
丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;
丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极;
戊电池是燃料电池,甲烷与氧气反应,甲烷发生氧化反应,在碱中生成碳酸盐和水,氧气发生还原反应。所以,在负极区通入甲烷,在正极区通入空气。
(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。
(3)大多数电池的负极材料参与反应发生氧化反应,燃料电池的负极材料不参与反应,可燃物如氢气、一氧化碳、甲烷、乙醇等在负极区发生氧化反应。
(4)根据溶液中离子参加反应情况判断溶液酸碱性的变化。
分析:考查原电池正负极的判断和材料的选择,电极反应式的书写、阴阳离子移动方向的判断及相关原电池知识,意在考查学生分析实验的能力。
23. 航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-===CO+3H2O。
(1)负极上的电极反应为______________________________。
(2)消耗标准状况下的5.6L O2时,有________mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
答案:(1)CH4+10OH--8e-===CO+7H2O;(2)1 ;(3)增大
知识点:化学电源新型电池
解析:
解答:由总反应式知CH4失电子被氧化生成CO,一定有OH-参与反应,负极反应为CH4+10OH--8e-===CO+7H2O,正极反应为O2+2H2O+4e-===4OH-。根据正极反应式知1mol O2消耗时,转移4mol e-,n(O2)=0.25mol,故有1mol电子转移。放电时,正极产生OH-,故溶液的pH增大。
分析:考查燃烧电池在航天飞机中的应用,考查学生对原电池原理和电极反应式的掌握情况。
24. 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为_______;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
答案:(1)铜(或Cu);AgNO3溶液;(2)正, Ag++e- = Ag; Cu-2e- = Cu2+。
(3)负(Cu);正(Ag)。
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:将氧化还原反应拆成两个半反应:一个是在负极发生的氧化反应,一个是在正极发生的还原反应;铜片失去电子被氧化,而失去电子即流出电子的一极为负极,所以铜片为负极,发生的反应为:Cu(s) -2e- = Cu2+(aq) ;电极X的材料是铜,电解质溶液是可溶性的银盐,可熔性的银盐只有硝酸银溶液;电子流入的一极为正极,银电极为电池的正极,发生的反应为:Ag++e- = Ag,外电路中的电子是从X(铜片、负极)电极流向Ag(正极)电极。
分析:考查原电池的工作原理和电极反应式书写的掌握情况。
25. 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+====2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是 ,发生 反应(填“氧化”或“还原”),电解质溶液是 ;
(2)正极上出现的现象是
;
(3)若导线上转移电子1 mol,则生成银 克。
答案:(1)Cu 氧化 AgNO3溶液
(2)碳棒上出现银白色物质
(3)108
知识点:原电池和电解池的工作原理、电极反应和电池反应方程式
解析:
解答:(1)根据电池的总反应,可知负极一般是失电子的物质作电源的负极,所以负极材料应该是铜电极,发生氧化反应,负极铜电极应该与电解质溶液反应,所以根据反应,电解质溶液应该是一种可溶性的银盐溶液,所以是AgNO3溶液。
(2)正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。
(3)当导线上转移1 mol电子的时候,正极上会析出1 mol银单质,所以正极上生成的银的质量是108 g。
分析:根据原电池的电极反应判断电极材料以及发生的反应,然后计算生成的银的质量即可。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 16 页 (共 16 页) 版权所有@21世纪教育网
