2025人教版新教材化学高考第一轮基础练--第32讲 电解池 金属的腐蚀与防护(含答案)
文档属性
| 名称 | 2025人教版新教材化学高考第一轮基础练--第32讲 电解池 金属的腐蚀与防护(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 647.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 11:15:34 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2025人教版新教材化学高考第一轮
第32讲 电解池 金属的腐蚀与防护
层次1基础性
1.下面有关电化学图示完全正确的是( )
2.四个电解装置都以Pt作电极,它们分别装有如下电解质溶液,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
选项 A B C D
电解质溶液 HCl AgNO3 KOH BaCl2
pH变化 减小 增大 增大 不变
3.(2023·广东茂名二模)将裹有锌片的铁钉放入含有酚酞-饱和NaCl的琼脂溶液中,滴加少量酚酞溶液,下列说法不正确的是( )
A.a处溶液会变红
B.b处c(Zn2+)增大
C.c处产生较多无色气泡
D.该实验说明Fe受到保护
4.(2023·浙江杭州检测)若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是Cu+2H+Cu2++H2↑,则关于该装置的说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是电解池,电解质溶液不可能是硝酸
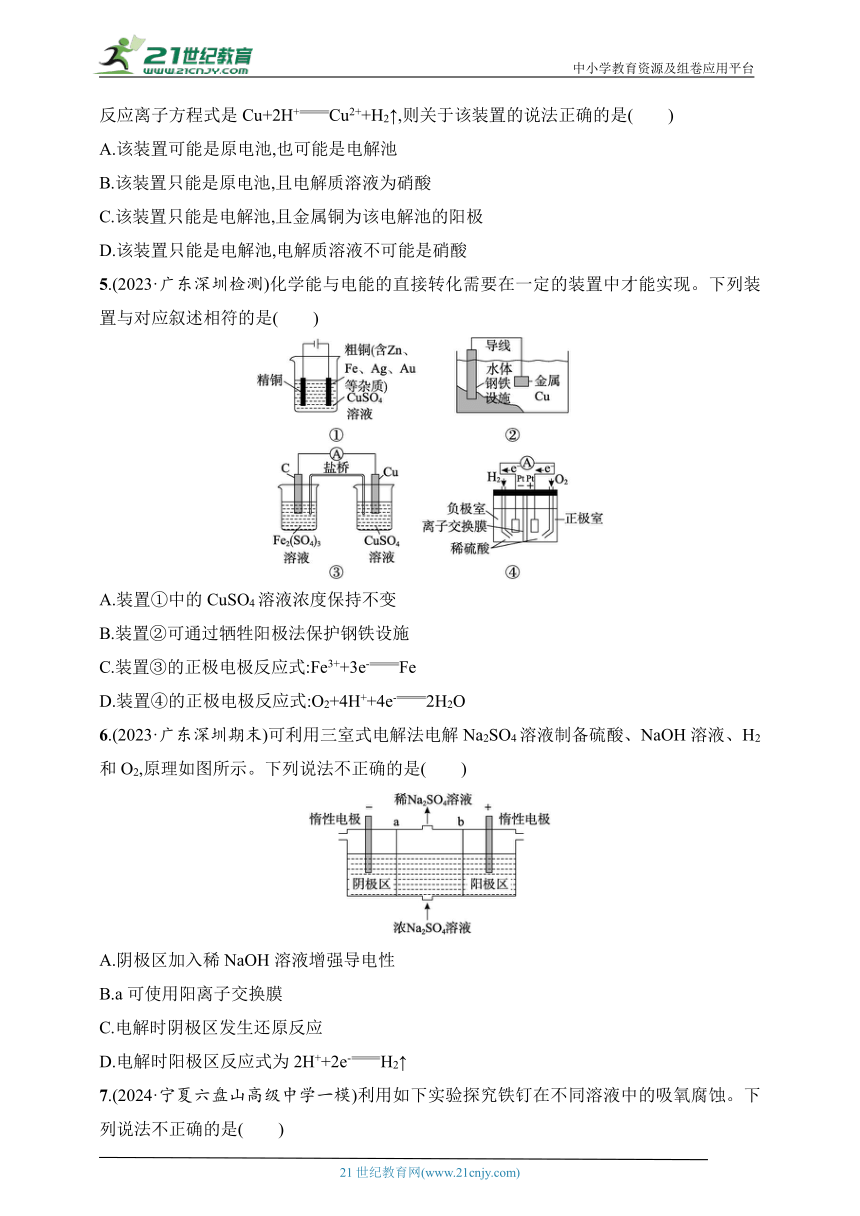
5.(2023·广东深圳检测)化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是( )
A.装置①中的CuSO4溶液浓度保持不变
B.装置②可通过牺牲阳极法保护钢铁设施
C.装置③的正极电极反应式:Fe3++3e-Fe
D.装置④的正极电极反应式:O2+4H++4e-2H2O
6.(2023·广东深圳期末)可利用三室式电解法电解Na2SO4溶液制备硫酸、NaOH溶液、H2和O2,原理如图所示。下列说法不正确的是( )
A.阴极区加入稀NaOH溶液增强导电性
B.a可使用阳离子交换膜
C.电解时阴极区发生还原反应
D.电解时阳极区反应式为2H++2e-H2↑
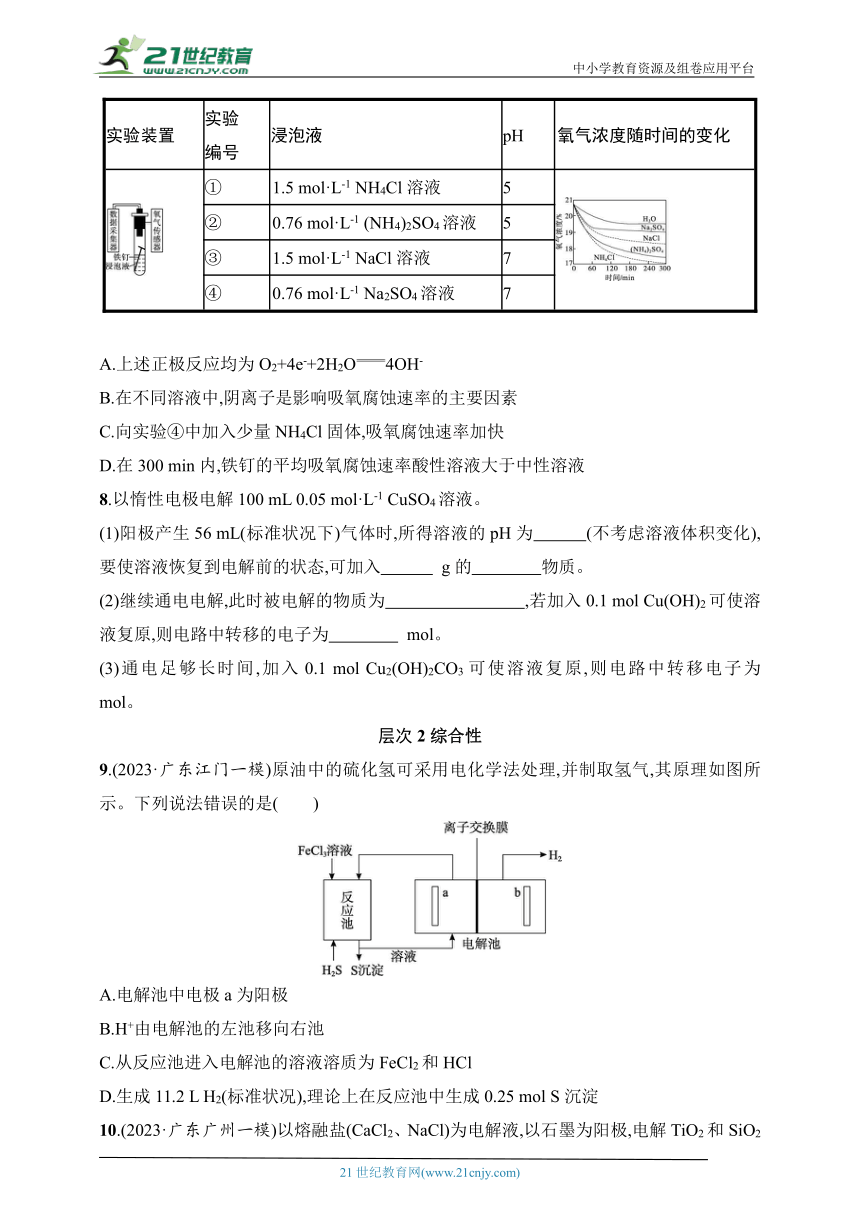
7.(2024·宁夏六盘山高级中学一模)利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是( )
实验装置 实验 编号 浸泡液 pH 氧气浓度随时间的变化
① 1.5 mol·L-1 NH4Cl溶液 5
② 0.76 mol·L-1 (NH4)2SO4溶液 5
③ 1.5 mol·L-1 NaCl溶液 7
④ 0.76 mol·L-1 Na2SO4溶液 7
A.上述正极反应均为O2+4e-+2H2O4OH-
B.在不同溶液中,阴离子是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量NH4Cl固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
8.以惰性电极电解100 mL 0.05 mol·L-1 CuSO4溶液。
(1)阳极产生56 mL(标准状况下)气体时,所得溶液的pH为 (不考虑溶液体积变化),要使溶液恢复到电解前的状态,可加入 g的 物质。
(2)继续通电电解,此时被电解的物质为 ,若加入0.1 mol Cu(OH)2可使溶液复原,则电路中转移的电子为 mol。
(3)通电足够长时间,加入0.1 mol Cu2(OH)2CO3可使溶液复原,则电路中转移电子为 mol。
层次2综合性
9.(2023·广东江门一模)原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。下列说法错误的是( )
A.电解池中电极a为阳极
B.H+由电解池的左池移向右池
C.从反应池进入电解池的溶液溶质为FeCl2和HCl
D.生成11.2 L H2(标准状况),理论上在反应池中生成0.25 mol S沉淀
10.(2023·广东广州一模)以熔融盐(CaCl2、NaCl)为电解液,以石墨为阳极,电解TiO2和SiO2获取电池材料TiSi,下列说法正确的是( )
A.阳极上SiO2被还原
B.阴极发生的反应为2Cl--2e-Cl2↑
C.电解时,阳离子向阳极移动
D.理论上每生成1 mol TiSi,电路中转移8 mol电子
11.(2023·河南平顶山联考)如图是CO2催化还原为CH4示意图。下列说法不正确的是( )
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
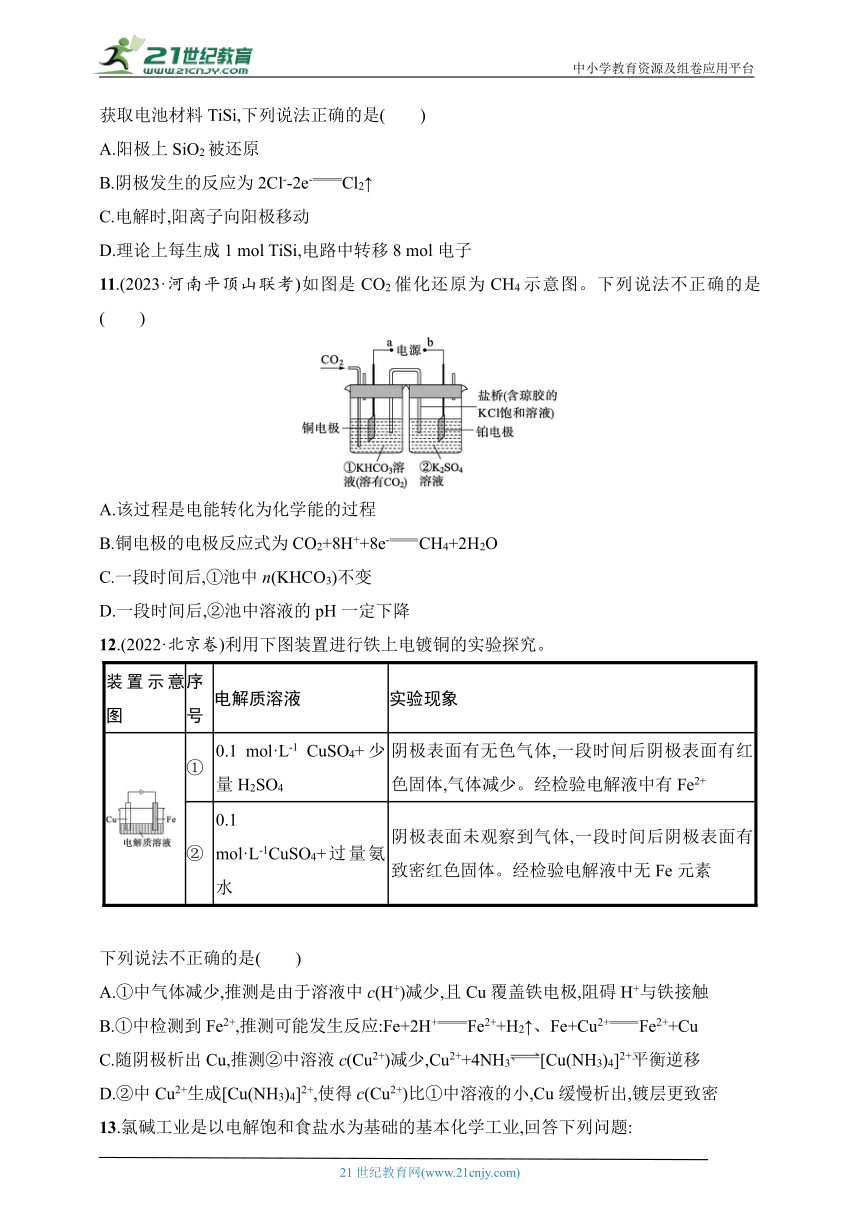
12.(2022·北京卷)利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是( )
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+Fe2++H2↑、Fe+Cu2+Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3[Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
13.氯碱工业是以电解饱和食盐水为基础的基本化学工业,回答下列问题:
(1)工业电解饱和NaCl溶液的化学方程式为 。
(2)氯碱工业中采取膜技术,若阳离子交换膜损伤会造成阳极能检测到O2,产生O2的电极反应式为 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是 (填字母)。
a.定期检查并更换阳离子交换膜
b.向阳极区加入适量盐酸
c.使用Cl-浓度高的精制饱和食盐水为原料
d.停产一段时间后,继续生产
(3)氯碱工业是高耗能产业,按如图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示(电极未标出)。
①图中装置Ⅰ和装置Ⅱ中属于原电池的是 (填装置编号)。
②X的化学式为 ;Y在装置Ⅱ中发生的电极反应为 。
③图中氢氧化钠质量分数大小关系为a% (填“>”“=”或“<”)b%。
层次3创新性
14.电化学方法是化工生产及生活中常用的一种方法。回答下列问题:
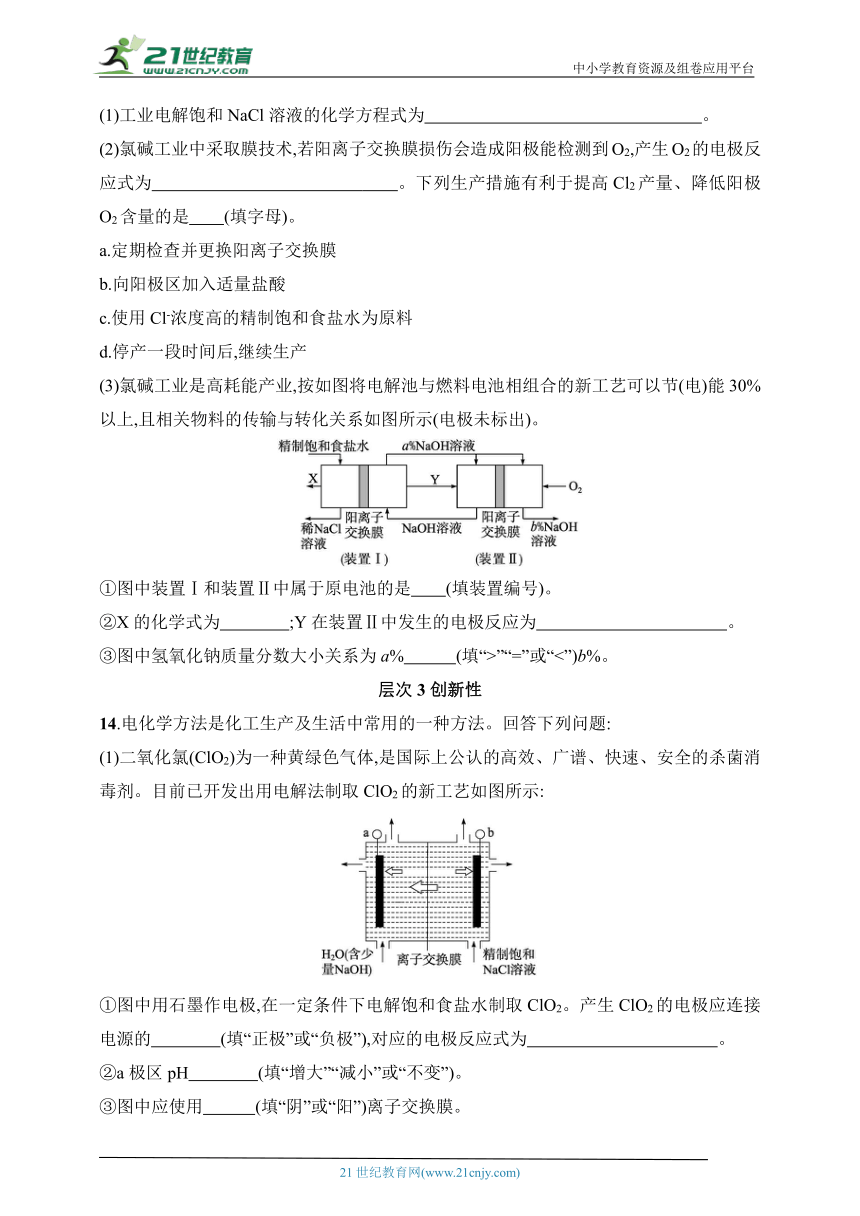
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺如图所示:
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极应连接电源的 (填“正极”或“负极”),对应的电极反应式为 。
②a极区pH (填“增大”“减小”或“不变”)。
③图中应使用 (填“阴”或“阳”)离子交换膜。
(2)电解K2MnO4溶液可制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,其化学方程式为 。
用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:
则D的化学式为 ;阳极的电极反应式为 ;阳离子迁移方向是 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示:
阴极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
第32讲 电解池 金属的腐蚀与防护
1.C 解析 锌比铜活泼,锌做负极,铜做正极,A错误;精炼铜的装置中,粗铜连接电源的正极做阳极,B错误;与电源正极连接的电极为阳极,与电源负极连接的电极为阴极,C正确;铁片上镀锌,铁做阴极,连接电源的负极,锌做阳极,连接电源的正极,D错误。
2.C 解析 电解盐酸,溶质HCl的量减少,溶剂的量不变,所以酸性减弱,pH增大,A项错误;电解硝酸银溶液生成硝酸、金属银和氧气,溶液酸性增强,pH减小,B项错误;电解氢氧化钾溶液的实质是电解水,溶质的量不变,溶剂的量减少,溶液碱性增强,pH增大,C项正确;电解氯化钡溶液得到氢氧化钡、氢气和氯气,溶液碱性增强,pH增大,D项错误。
3.C 解析 裹有锌片的铁钉放入含有酚酞-饱和NaCl的琼脂溶液中,发生原电池腐蚀,锌片为负极,发生反应Zn-2e-Zn2+,铁钉为正极:O2+4e-+2H2O4OH-,铁钉附近酚酞溶液变红。a为铁钉,为原电池正极,发生反应O2+4e-+2H2O4OH-,产生OH-,酚酞溶液变红,A正确;b处为锌片,锌片为负极,发生反应Zn-2e-Zn2+,所以b处c(Zn2+)增大,B正确;c处为铁钉,发生反应O2+4e-+2H2O4OH-,不会产生气泡,C错误;铁为正极,不发生反应,被保护起来,D正确。
4.C 解析 由于铜和盐酸、硫酸不反应,说明Cu+2H+Cu2++H2↑是非自发反应,则不能为原电池,只能为电解池,铜作电解池的阳极,盐酸或稀硫酸作电解液,不能用硝酸,硝酸作电解液时反应生成氮的氧化物,故C符合题意。
5.D 解析 装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此CuSO4溶液浓度会降低,A错误;装置②可通过牺牲阳极法保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,B错误;装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:Fe3++e-Fe2+,C错误;装置④是氢氧酸性燃料电池,则正极电极反应式:O2+4H++4e-2H2O,D正确。
6.D 解析 该装置为电解池,与电源正极相连的电极为阳极,阳极反应为2H2O-4e-O2↑+4H+,b为阴离子交换膜,阳极区制备硫酸和氧气;与电源负极相连的电极为阴极,电极反应为2H2O+2e-H2↑+2OH-,a为阳离子交换膜,阴极区制备氢氧化钠和氢气,所以为了增强溶液导电性,电解开始前阴极区中加入的溶液为NaOH溶液,A正确;Na+需要进入阴极区,S需要进入阳极区,所以a可使用阳离子交换膜,B正确;电解时阴极区得到电子,发生还原反应,C正确;电解时阳极区反应式为2H2O-4e-O2↑+4H+,D错误。
7.B 解析 根据图像可知,实验探究铁钉在不同溶液中的吸氧腐蚀,正极上氧气得到电子,其正极反应式为O2+4e-+2H2O4OH-,A正确;根据图像可知,①②的反应速率接近,③④的反应速率接近,且①远大于③,②远大于④,因此,阴离子对反应速率影响不大,N是影响吸氧腐蚀速率的主要因素,B错误;N是影响吸氧腐蚀速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,所以向实验④中加入少量NH4Cl固体,吸氧腐蚀速率加快,C正确;①②溶液显酸性,③④溶液显中性,根据图像可知,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液,D正确。
8.答案 (1)1 0.4 CuO(或0.62 CuCO3)
(2)水(或H2O) 0.4 (3)0.6
解析 (1)阳极生成O2 56 mL(标准状况)即0.002 5 mol,依据总反应式:2CuSO4+2H2O2Cu+O2↑+2H2SO4,溶液中生成0.01 mol H+,c(H+)=0.1 mol·L-1,pH=1;电解生成0.002 5 mol O2和0.005 mol Cu,故要使溶液复原可加0.005 mol CuO,质量为0.4 g,或加0.005 mol CuCO3,质量为0.62 g。
(2)继续通电电解,电解质为H2SO4溶液,故实际被电解的物质为H2O;加入0.1 mol Cu(OH)2可使溶液复原,相当于加入0.1 mol CuO和0.1 mol H2O,故转移电子为(0.1×2+0.1×2)mol=0.4 mol。
(3)Cu2(OH)2CO3相当于2CuO·H2O·CO2,故转移电子为0.2 mol×2+0.1 mol×2=0.6 mol。
9.D 解析 从图分析,FeCl3经H2S还原为FeCl2进入a极再循环使用,那么a极Fe2+变为Fe3+,发生氧化反应,为阳极,而b极产生H2,发生还原反应,为阴极。由以上分析,a极为阳极,A项正确;H+通过交换膜移向阴极,即从左池经交换膜移向右池,B项正确;反应池的反应为2FeCl3+H2SS↓+2FeCl2+2HCl,所以进入电解池的溶质有FeCl2和HCl,C项正确;电子守恒关系:H2~2e-~S,即每产生1 mol H2可以产生1 mol S沉淀,那么标准状况下11.2 L H2即为0.5 mol H2,产生0.5 mol S,D项错误。
10.D 解析 石墨为阳极,电解池阳极发生氧化反应,A错误;TiO2和SiO2为电解池阴极,发生还原反应,反应式为TiO2+SiO2+8e-TiSi+4O2-,B错误;电解时阳离子向阴极移动,阴离子向阳极移动,C错误;由阴极电极反应式可知,每生成1 mol TiSi,电路中转移8 mol电子,D正确。
11.C 解析 该装置是一个电解池,电解池是将电能转化为化学能的装置,A正确;CO2电催化还原为CH4的过程是一个还原反应过程,所以铜电极是电解池的阴极,铜电极的电极反应式为CO2+8H++8e-CH4+2H2O,B正确;在电解池的阴极上发生CO2得电子的还原反应,即CO2+8H++8e-CH4+2H2O,一段时间后,氢离子减少,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小,C错误;在电解池的阳极上,是阴离子OH-发生失电子的氧化反应,所以碱性减弱,pH一定下降,D正确。
12.C 解析 由实验现象可知,实验①时,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,A正确;由A项分析可知,实验①时,可能发生的反应为Fe+2H+Fe2++H2↑、Fe+Cu2+Fe2++Cu,B正确;四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,随阴极析出铜,四氯合铜离子浓度减小,Cu2++4NH3[Cu(NH3)4]2+平衡向正反应方向移动,C错误;实验②中铜离子与过量氨水反应生成四氨合铜离子,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,D正确。
13.答案 (1)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)4OH--4e-O2↑+2H2O abc
(3)①装置Ⅱ ②Cl2 H2-2e-+2OH-2H2O ③<
解析 (1)工业电解饱和NaCl溶液生成氢氧化钠、氯气、氢气,化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(2)氯碱工业中采取膜技术,若阳离子交换膜损伤会造成阳极能检测到O2,在阳极氢氧根离子失电子得到氧气,产生O2的电极反应式为4OH--4e-2H2O+O2↑。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是:a.定期检查并更换阳离子交换膜,减少阳极产生氧气的机会,故a选;b.向阳极区加入适量盐酸,降低氢氧根离子的浓度,故b选;c.使用Cl-浓度高的精制饱和食盐水为原料,提高氯离子浓度,故c选;d.停产一段时间后,继续生产,对产物没有影响,故d不选。
(3)①图中装置Ⅰ是电解池,电解饱和食盐水,装置Ⅱ是燃料电池,Y是氢气,属于原电池的是装置Ⅱ;②装置Ⅰ的左端是阳极,发生反应:2Cl--2e-Cl2↑,X的化学式为Cl2;装置Ⅱ是燃料电池,Y是氢气,氢气在装置Ⅱ中发生氧化反应生成水,电极反应为H2-2e-+2OH-2H2O;③装置Ⅱ中通氧气的一极为正极,环境是NaOH溶液,因此正极反应式为O2+2H2O+4e-4OH-,产生NaOH浓溶液,图中氢氧化钠质量分数大小关系为a%14.答案 (1)①正极 Cl--5e-+2H2OClO2↑+4H+ ②增大 ③阳
(2)2MnO2+4KOH+O22K2MnO4+2H2O KOH Mn-e-Mn K+通过阳离子交换膜由左侧向右侧迁移
(3)①NO+5e-+6H+N+H2O ②1∶4
解析 (1)①根据题意可知,Cl-放电生成ClO2的电极为阳极,接电源的正极。根据元素守恒,有水参加反应,同时生成H+,电极反应式为Cl--5e-+2H2OClO2↑+4H+;②a极区为阴极区,电极反应式为2H2O+2e-H2↑+2OH-,阴极区OH-浓度增大,溶液的pH增大;③根据溶液中电荷守恒的规律,图中应使用阳离子交换膜。
(2)软锰矿(主要成分是MnO2)与KOH小火加热至熔融,得到K2MnO4,Mn元素化合价由+4价升为+6价,则空气中的O2作氧化剂,化学方程式为2MnO2+4KOH+O22K2MnO4+2H2O;电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-H2↑+2OH-,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上Mn失电子生成Mn,电极反应式为Mn-e-Mn。
(3)①由题图可知,NO在阴极上得电子生成N,电极反应式为NO+5e-+6H+N+H2O。②NO在阳极上失电子生成N,电极反应式为NO-3e-+2H2ON+4H+,电解总反应式为8NO+7H2O3NH4NO3+2HNO3,故当实际参加反应的NO为8 mol时,要将电解生成的HNO3全部转化为NH4NO3,还应通入2 mol NH3,则n(NH3)∶n(NO)=2 mol∶8 mol=1∶4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版新教材化学高考第一轮
第32讲 电解池 金属的腐蚀与防护
层次1基础性
1.下面有关电化学图示完全正确的是( )
2.四个电解装置都以Pt作电极,它们分别装有如下电解质溶液,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
选项 A B C D
电解质溶液 HCl AgNO3 KOH BaCl2
pH变化 减小 增大 增大 不变
3.(2023·广东茂名二模)将裹有锌片的铁钉放入含有酚酞-饱和NaCl的琼脂溶液中,滴加少量酚酞溶液,下列说法不正确的是( )
A.a处溶液会变红
B.b处c(Zn2+)增大
C.c处产生较多无色气泡
D.该实验说明Fe受到保护
4.(2023·浙江杭州检测)若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是Cu+2H+Cu2++H2↑,则关于该装置的说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是电解池,电解质溶液不可能是硝酸
5.(2023·广东深圳检测)化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是( )
A.装置①中的CuSO4溶液浓度保持不变
B.装置②可通过牺牲阳极法保护钢铁设施
C.装置③的正极电极反应式:Fe3++3e-Fe
D.装置④的正极电极反应式:O2+4H++4e-2H2O
6.(2023·广东深圳期末)可利用三室式电解法电解Na2SO4溶液制备硫酸、NaOH溶液、H2和O2,原理如图所示。下列说法不正确的是( )
A.阴极区加入稀NaOH溶液增强导电性
B.a可使用阳离子交换膜
C.电解时阴极区发生还原反应
D.电解时阳极区反应式为2H++2e-H2↑
7.(2024·宁夏六盘山高级中学一模)利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是( )
实验装置 实验 编号 浸泡液 pH 氧气浓度随时间的变化
① 1.5 mol·L-1 NH4Cl溶液 5
② 0.76 mol·L-1 (NH4)2SO4溶液 5
③ 1.5 mol·L-1 NaCl溶液 7
④ 0.76 mol·L-1 Na2SO4溶液 7
A.上述正极反应均为O2+4e-+2H2O4OH-
B.在不同溶液中,阴离子是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量NH4Cl固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
8.以惰性电极电解100 mL 0.05 mol·L-1 CuSO4溶液。
(1)阳极产生56 mL(标准状况下)气体时,所得溶液的pH为 (不考虑溶液体积变化),要使溶液恢复到电解前的状态,可加入 g的 物质。
(2)继续通电电解,此时被电解的物质为 ,若加入0.1 mol Cu(OH)2可使溶液复原,则电路中转移的电子为 mol。
(3)通电足够长时间,加入0.1 mol Cu2(OH)2CO3可使溶液复原,则电路中转移电子为 mol。
层次2综合性
9.(2023·广东江门一模)原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。下列说法错误的是( )
A.电解池中电极a为阳极
B.H+由电解池的左池移向右池
C.从反应池进入电解池的溶液溶质为FeCl2和HCl
D.生成11.2 L H2(标准状况),理论上在反应池中生成0.25 mol S沉淀
10.(2023·广东广州一模)以熔融盐(CaCl2、NaCl)为电解液,以石墨为阳极,电解TiO2和SiO2获取电池材料TiSi,下列说法正确的是( )
A.阳极上SiO2被还原
B.阴极发生的反应为2Cl--2e-Cl2↑
C.电解时,阳离子向阳极移动
D.理论上每生成1 mol TiSi,电路中转移8 mol电子
11.(2023·河南平顶山联考)如图是CO2催化还原为CH4示意图。下列说法不正确的是( )
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
12.(2022·北京卷)利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是( )
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+Fe2++H2↑、Fe+Cu2+Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3[Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
13.氯碱工业是以电解饱和食盐水为基础的基本化学工业,回答下列问题:
(1)工业电解饱和NaCl溶液的化学方程式为 。
(2)氯碱工业中采取膜技术,若阳离子交换膜损伤会造成阳极能检测到O2,产生O2的电极反应式为 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是 (填字母)。
a.定期检查并更换阳离子交换膜
b.向阳极区加入适量盐酸
c.使用Cl-浓度高的精制饱和食盐水为原料
d.停产一段时间后,继续生产
(3)氯碱工业是高耗能产业,按如图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示(电极未标出)。
①图中装置Ⅰ和装置Ⅱ中属于原电池的是 (填装置编号)。
②X的化学式为 ;Y在装置Ⅱ中发生的电极反应为 。
③图中氢氧化钠质量分数大小关系为a% (填“>”“=”或“<”)b%。
层次3创新性
14.电化学方法是化工生产及生活中常用的一种方法。回答下列问题:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺如图所示:
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极应连接电源的 (填“正极”或“负极”),对应的电极反应式为 。
②a极区pH (填“增大”“减小”或“不变”)。
③图中应使用 (填“阴”或“阳”)离子交换膜。
(2)电解K2MnO4溶液可制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,其化学方程式为 。
用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:
则D的化学式为 ;阳极的电极反应式为 ;阳离子迁移方向是 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示:
阴极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
第32讲 电解池 金属的腐蚀与防护
1.C 解析 锌比铜活泼,锌做负极,铜做正极,A错误;精炼铜的装置中,粗铜连接电源的正极做阳极,B错误;与电源正极连接的电极为阳极,与电源负极连接的电极为阴极,C正确;铁片上镀锌,铁做阴极,连接电源的负极,锌做阳极,连接电源的正极,D错误。
2.C 解析 电解盐酸,溶质HCl的量减少,溶剂的量不变,所以酸性减弱,pH增大,A项错误;电解硝酸银溶液生成硝酸、金属银和氧气,溶液酸性增强,pH减小,B项错误;电解氢氧化钾溶液的实质是电解水,溶质的量不变,溶剂的量减少,溶液碱性增强,pH增大,C项正确;电解氯化钡溶液得到氢氧化钡、氢气和氯气,溶液碱性增强,pH增大,D项错误。
3.C 解析 裹有锌片的铁钉放入含有酚酞-饱和NaCl的琼脂溶液中,发生原电池腐蚀,锌片为负极,发生反应Zn-2e-Zn2+,铁钉为正极:O2+4e-+2H2O4OH-,铁钉附近酚酞溶液变红。a为铁钉,为原电池正极,发生反应O2+4e-+2H2O4OH-,产生OH-,酚酞溶液变红,A正确;b处为锌片,锌片为负极,发生反应Zn-2e-Zn2+,所以b处c(Zn2+)增大,B正确;c处为铁钉,发生反应O2+4e-+2H2O4OH-,不会产生气泡,C错误;铁为正极,不发生反应,被保护起来,D正确。
4.C 解析 由于铜和盐酸、硫酸不反应,说明Cu+2H+Cu2++H2↑是非自发反应,则不能为原电池,只能为电解池,铜作电解池的阳极,盐酸或稀硫酸作电解液,不能用硝酸,硝酸作电解液时反应生成氮的氧化物,故C符合题意。
5.D 解析 装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此CuSO4溶液浓度会降低,A错误;装置②可通过牺牲阳极法保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,B错误;装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:Fe3++e-Fe2+,C错误;装置④是氢氧酸性燃料电池,则正极电极反应式:O2+4H++4e-2H2O,D正确。
6.D 解析 该装置为电解池,与电源正极相连的电极为阳极,阳极反应为2H2O-4e-O2↑+4H+,b为阴离子交换膜,阳极区制备硫酸和氧气;与电源负极相连的电极为阴极,电极反应为2H2O+2e-H2↑+2OH-,a为阳离子交换膜,阴极区制备氢氧化钠和氢气,所以为了增强溶液导电性,电解开始前阴极区中加入的溶液为NaOH溶液,A正确;Na+需要进入阴极区,S需要进入阳极区,所以a可使用阳离子交换膜,B正确;电解时阴极区得到电子,发生还原反应,C正确;电解时阳极区反应式为2H2O-4e-O2↑+4H+,D错误。
7.B 解析 根据图像可知,实验探究铁钉在不同溶液中的吸氧腐蚀,正极上氧气得到电子,其正极反应式为O2+4e-+2H2O4OH-,A正确;根据图像可知,①②的反应速率接近,③④的反应速率接近,且①远大于③,②远大于④,因此,阴离子对反应速率影响不大,N是影响吸氧腐蚀速率的主要因素,B错误;N是影响吸氧腐蚀速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,所以向实验④中加入少量NH4Cl固体,吸氧腐蚀速率加快,C正确;①②溶液显酸性,③④溶液显中性,根据图像可知,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液,D正确。
8.答案 (1)1 0.4 CuO(或0.62 CuCO3)
(2)水(或H2O) 0.4 (3)0.6
解析 (1)阳极生成O2 56 mL(标准状况)即0.002 5 mol,依据总反应式:2CuSO4+2H2O2Cu+O2↑+2H2SO4,溶液中生成0.01 mol H+,c(H+)=0.1 mol·L-1,pH=1;电解生成0.002 5 mol O2和0.005 mol Cu,故要使溶液复原可加0.005 mol CuO,质量为0.4 g,或加0.005 mol CuCO3,质量为0.62 g。
(2)继续通电电解,电解质为H2SO4溶液,故实际被电解的物质为H2O;加入0.1 mol Cu(OH)2可使溶液复原,相当于加入0.1 mol CuO和0.1 mol H2O,故转移电子为(0.1×2+0.1×2)mol=0.4 mol。
(3)Cu2(OH)2CO3相当于2CuO·H2O·CO2,故转移电子为0.2 mol×2+0.1 mol×2=0.6 mol。
9.D 解析 从图分析,FeCl3经H2S还原为FeCl2进入a极再循环使用,那么a极Fe2+变为Fe3+,发生氧化反应,为阳极,而b极产生H2,发生还原反应,为阴极。由以上分析,a极为阳极,A项正确;H+通过交换膜移向阴极,即从左池经交换膜移向右池,B项正确;反应池的反应为2FeCl3+H2SS↓+2FeCl2+2HCl,所以进入电解池的溶质有FeCl2和HCl,C项正确;电子守恒关系:H2~2e-~S,即每产生1 mol H2可以产生1 mol S沉淀,那么标准状况下11.2 L H2即为0.5 mol H2,产生0.5 mol S,D项错误。
10.D 解析 石墨为阳极,电解池阳极发生氧化反应,A错误;TiO2和SiO2为电解池阴极,发生还原反应,反应式为TiO2+SiO2+8e-TiSi+4O2-,B错误;电解时阳离子向阴极移动,阴离子向阳极移动,C错误;由阴极电极反应式可知,每生成1 mol TiSi,电路中转移8 mol电子,D正确。
11.C 解析 该装置是一个电解池,电解池是将电能转化为化学能的装置,A正确;CO2电催化还原为CH4的过程是一个还原反应过程,所以铜电极是电解池的阴极,铜电极的电极反应式为CO2+8H++8e-CH4+2H2O,B正确;在电解池的阴极上发生CO2得电子的还原反应,即CO2+8H++8e-CH4+2H2O,一段时间后,氢离子减少,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小,C错误;在电解池的阳极上,是阴离子OH-发生失电子的氧化反应,所以碱性减弱,pH一定下降,D正确。
12.C 解析 由实验现象可知,实验①时,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,A正确;由A项分析可知,实验①时,可能发生的反应为Fe+2H+Fe2++H2↑、Fe+Cu2+Fe2++Cu,B正确;四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,随阴极析出铜,四氯合铜离子浓度减小,Cu2++4NH3[Cu(NH3)4]2+平衡向正反应方向移动,C错误;实验②中铜离子与过量氨水反应生成四氨合铜离子,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,D正确。
13.答案 (1)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)4OH--4e-O2↑+2H2O abc
(3)①装置Ⅱ ②Cl2 H2-2e-+2OH-2H2O ③<
解析 (1)工业电解饱和NaCl溶液生成氢氧化钠、氯气、氢气,化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(2)氯碱工业中采取膜技术,若阳离子交换膜损伤会造成阳极能检测到O2,在阳极氢氧根离子失电子得到氧气,产生O2的电极反应式为4OH--4e-2H2O+O2↑。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是:a.定期检查并更换阳离子交换膜,减少阳极产生氧气的机会,故a选;b.向阳极区加入适量盐酸,降低氢氧根离子的浓度,故b选;c.使用Cl-浓度高的精制饱和食盐水为原料,提高氯离子浓度,故c选;d.停产一段时间后,继续生产,对产物没有影响,故d不选。
(3)①图中装置Ⅰ是电解池,电解饱和食盐水,装置Ⅱ是燃料电池,Y是氢气,属于原电池的是装置Ⅱ;②装置Ⅰ的左端是阳极,发生反应:2Cl--2e-Cl2↑,X的化学式为Cl2;装置Ⅱ是燃料电池,Y是氢气,氢气在装置Ⅱ中发生氧化反应生成水,电极反应为H2-2e-+2OH-2H2O;③装置Ⅱ中通氧气的一极为正极,环境是NaOH溶液,因此正极反应式为O2+2H2O+4e-4OH-,产生NaOH浓溶液,图中氢氧化钠质量分数大小关系为a%
(2)2MnO2+4KOH+O22K2MnO4+2H2O KOH Mn-e-Mn K+通过阳离子交换膜由左侧向右侧迁移
(3)①NO+5e-+6H+N+H2O ②1∶4
解析 (1)①根据题意可知,Cl-放电生成ClO2的电极为阳极,接电源的正极。根据元素守恒,有水参加反应,同时生成H+,电极反应式为Cl--5e-+2H2OClO2↑+4H+;②a极区为阴极区,电极反应式为2H2O+2e-H2↑+2OH-,阴极区OH-浓度增大,溶液的pH增大;③根据溶液中电荷守恒的规律,图中应使用阳离子交换膜。
(2)软锰矿(主要成分是MnO2)与KOH小火加热至熔融,得到K2MnO4,Mn元素化合价由+4价升为+6价,则空气中的O2作氧化剂,化学方程式为2MnO2+4KOH+O22K2MnO4+2H2O;电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-H2↑+2OH-,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上Mn失电子生成Mn,电极反应式为Mn-e-Mn。
(3)①由题图可知,NO在阴极上得电子生成N,电极反应式为NO+5e-+6H+N+H2O。②NO在阳极上失电子生成N,电极反应式为NO-3e-+2H2ON+4H+,电解总反应式为8NO+7H2O3NH4NO3+2HNO3,故当实际参加反应的NO为8 mol时,要将电解生成的HNO3全部转化为NH4NO3,还应通入2 mol NH3,则n(NH3)∶n(NO)=2 mol∶8 mol=1∶4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
