2025人教版新教材化学高考第一轮基础练--第34讲 化学反应速率及影响因素(含答案)
文档属性
| 名称 | 2025人教版新教材化学高考第一轮基础练--第34讲 化学反应速率及影响因素(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 425.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 11:16:07 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版新教材化学高考第一轮
第34讲 化学反应速率及影响因素
层次1基础性
1.(2023·广东深圳检测)小朋友们玩的荧光棒的发光原理是:化学物质相互反应过程中,能量以光的形式释放出来。使用一段时间已经变暗的荧光棒放在热水中,荧光棒会短时间内重新变亮,下列解释错误的是( )
A.荧光棒发光——化学能转化为光能
B.荧光棒变暗——反应物浓度减小,反应速率减小
C.放在热水中短暂变亮——温度升高,反应速率增加
D.放在热水中变亮——热水对反应起催化作用,从而加快了反应速率
2.在反应2HIH2+2I中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.加入适宜的催化剂,可降低反应的活化能
B.增大c(HI),单位体积内活化分子数增多
C.升高温度,单位时间内有效碰撞次数增加
D.增大压强,活化分子的百分数增大
3.2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前与2 s后容器的压强比为4∶3
4.对于反应2N2(g)+6H2O(g)4NH3(g)+3O2(g),在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是( )
A.v(NH3)=1.5 mol·L-1·min-1
B.v(N2)=1.2 mol·L-1·min-1
C.v(H2O)=1.67 mol·L-1·min-1
D.v(O2)=1.5 mol·L-1·min-1
5.(2023·广东广州期末)在2 L密闭容器中投入一定量A、B,发生反应:3A(g)+bB(g)cC(g) ΔH>0。12 s时反应达到平衡,生成C的物质的量为1.6 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是( )
A.方程式中b=4,c=1
B.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1
C.12 s后,A的消耗速率等于B的生成速率
D.单位时间内生成0.3 mol A的同时,生成0.4 mol C,则反应达到平衡状态
6.(2023·广东深圳检测)少量铁粉与100 mL 1.0 mol·L-1的稀盐酸反应,为了加快此反应速率且不改变生成H2的总量,以下方法可行的是( )
①加入NaCl溶液 ②再加入100 mL 1.0 mol·L-1的稀盐酸 ③加几滴浓硫酸 ④加入少量醋酸钠固体 ⑤适当升高温度 ⑥滴入几滴硫酸铜溶液
A.③⑤ B.②③ C.①④ D.②⑥
7.(2023·陕西西安期末)Ⅰ.将等物质的量A、B混合于2 L的密闭容器中,发生反应:3A(g)+B(g)xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。
(1)经5 min后A的浓度为 。
(2)反应开始前充入容器中B的物质的量为 。
(3)B的平均反应速率为 。
(4)x的值为 。
Ⅱ.对于反应A(g)+3B(g)2C(g)+2D(g),下列分别表示不同条件下的反应速率,则反应速率大小关系是 。
①v(A)=0.01 mol·L-1·s-1
②v(B)=1.20 mol·L-1·min-1
③v(C)=2.40 mol·L-1·min-1
④v(D)=0.02 mol·L-1·s-1
层次2综合性
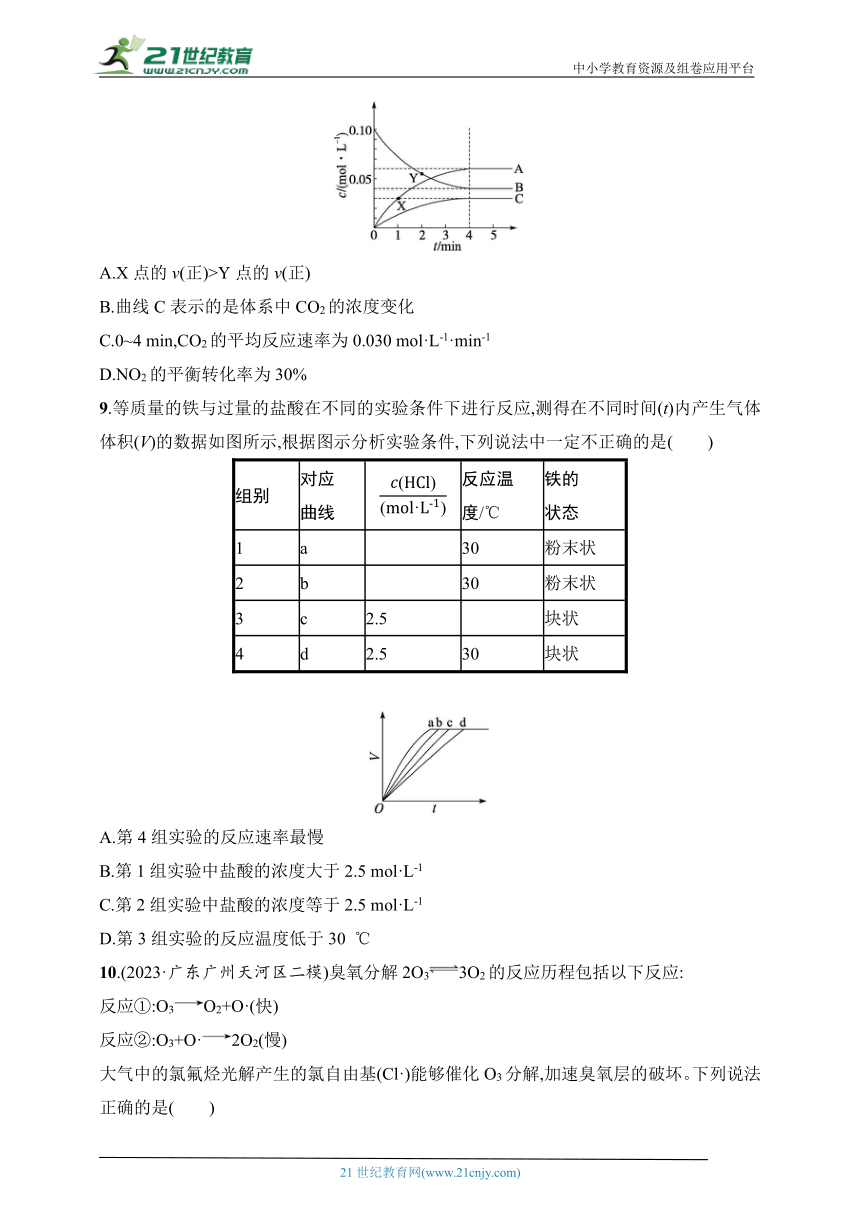
8.(2023·广东深圳检测)用活性炭可还原NO2防止空气污染,其反应原理为2C(s)+2NO2(g)N2(g)+2CO2(g)。一定温度下,向2 L恒容密闭容器中加入足量的C(s)和0.200 mol NO2,体系中物质浓度变化曲线如图所示。下列说法正确的是 ( )
A.X点的v(正)>Y点的v(正)
B.曲线C表示的是体系中CO2的浓度变化
C.0~4 min,CO2的平均反应速率为0.030 mol·L-1·min-1
D.NO2的平衡转化率为30%
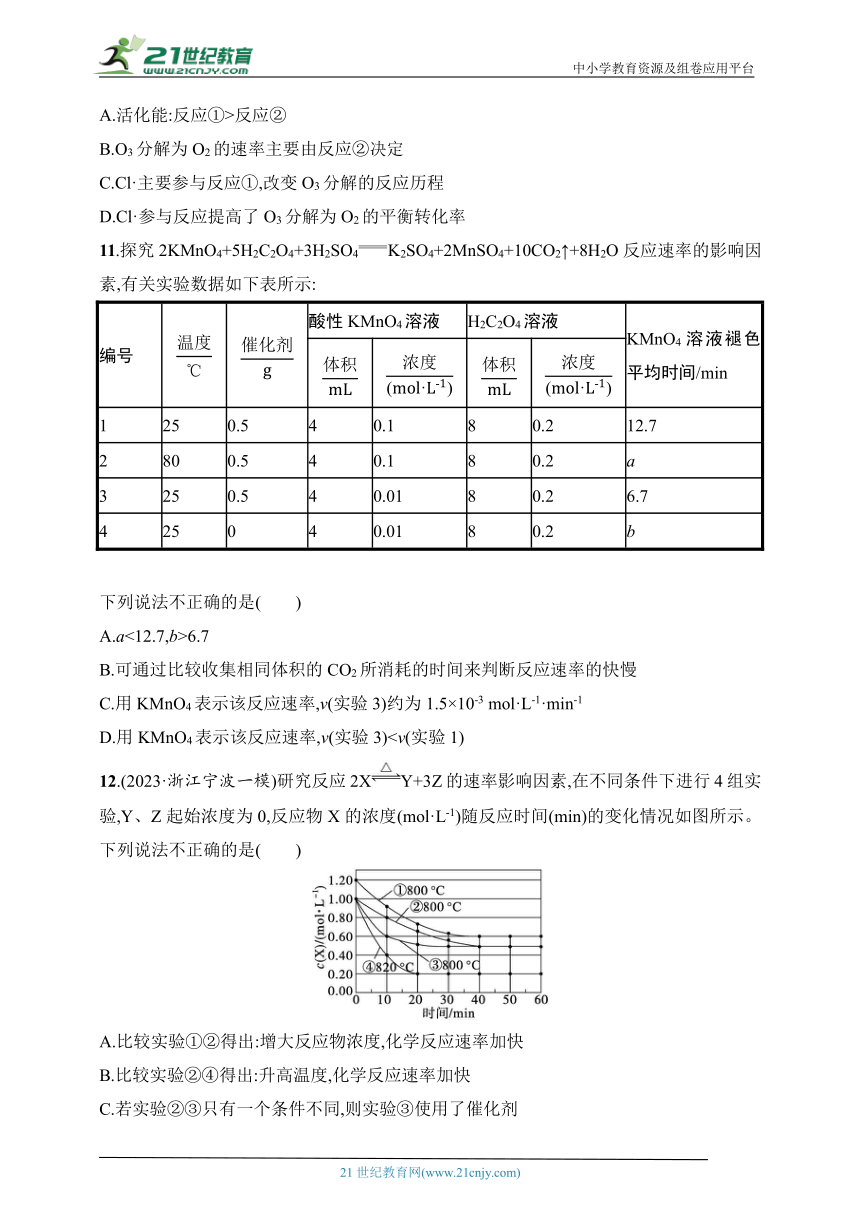
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 对应 曲线 反应温 度/℃ 铁的 状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol·L-1
C.第2组实验中盐酸的浓度等于2.5 mol·L-1
D.第3组实验的反应温度低于30 ℃
10.(2023·广东广州天河区二模)臭氧分解2O33O2的反应历程包括以下反应:
反应①:O3O2+O·(快)
反应②:O3+O·2O2(慢)
大气中的氯氟烃光解产生的氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
A.活化能:反应①>反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl·主要参与反应①,改变O3分解的反应历程
D.Cl·参与反应提高了O3分解为O2的平衡转化率
11.探究2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
编号 酸性KMnO4溶液 H2C2O4溶液 KMnO4溶液褪色平均时间/min
1 25 0.5 4 0.1 8 0.2 12.7
2 80 0.5 4 0.1 8 0.2 a
3 25 0.5 4 0.01 8 0.2 6.7
4 25 0 4 0.01 8 0.2 b
下列说法不正确的是( )
A.a<12.7,b>6.7
B.可通过比较收集相同体积的CO2所消耗的时间来判断反应速率的快慢
C.用KMnO4表示该反应速率,v(实验3)约为1.5×10-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)12.(2023·浙江宁波一模)研究反应2XY+3Z的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.比较实验②④得出:升高温度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min之间,实验④的平均速率v(Y)=0.06 mol·L-1·min-1
13.(2023·湖北十堰一模)某酸性工业废水中含有K2Cr2O7,草酸(H2C2O4)能将其中的Cr2转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表。
实验 编号 初始 pH 废水样 品体积/mL 草酸溶液 体积/mL 蒸馏水 体积/mL
① 4 60 10 30
② 5 60 10 30
③ 5 60 a b
测得实验①和②溶液中的Cr2浓度随时间变化关系如图所示。下列叙述不正确的是( )
A.上述反应后草酸被氧化为CO2
B.实验③中a和b如果是20和20,则反应速率③>②
C.由曲线①可知,0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
D.实验①和②的结果表明,其他条件相同时,pH越小,该反应速率越快
14.(2023·广东广州期末)某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验。
【实验原理】
2Mn+5H2C2O4+6H+10CO2↑+2Mn2++8H2O
【实验内容及记录】
实验 序号 试管中所加试剂及其用量/mL 溶液紫色褪至无色时所需时间/min
0.04 mol·L-1 KMnO4溶液 0.36 mol·L-1 稀硫酸 0.2 mol·L-1 H2C2O4溶液 H2O
① 20 1.0 1.0 2.0 2.0 4.0
② 20 1.0 1.0 3.0 Vx 3.6
③ 40 1.0 1.0 2.0 2.0 0.92
(1)实验原理中,1 mol KMnO4参加反应时,转移电子的物质的量为 mol。
(2)实验①、②探究的是 对反应速率的影响,表中Vx= 。
(3)由实验①、③可得出的结论是 。
(4)实验①中,4.0 min内,v(Mn)= mol·L-1·min-1。
(5)反应过程中,反应速率随时间的变化趋势如图所示。
其中,因反应放热导致温度升高对速率影响不大,试推测t1~t2速率迅速增大的主要原因是 。若用实验证明你的推测,除了表中试剂外,还需向试管中加入少量固体,该固体应为 (填字母)。
A.K2SO4 B.MnSO4
C.MnO2
层次3创新性
15.(1)已知:2N2O5(g)2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3× kPa·min-1。t=62 min时,测得体系中=2.9 kPa,则此时的= kPa,v= kPa·min-1。
(2)一定条件下测得反应2HCl(g)+O2(g)Cl2(g)+H2O(g)的反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10-3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程): 。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
上述反应中,正反应速率为v(正)=k正x2(HI),逆反应速率为v(逆)=k逆x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v(正)= min-1。
第34讲 化学反应速率及影响因素
1.D 解析 荧光棒发光过程中涉及化学能到光能的转化,A正确;荧光棒变暗,说明反应物减少,故反应物浓度减小,反应速率减小,B正确;在热水中,温度升高,单位体积内活化分子数目增加,反应速率加快,C正确;荧光棒中的物质不能接触到热水,起不到催化作用,D错误。
2.D 解析 加入合适的催化剂,能降低反应的活化能,反应速率增大,A正确;增大碘化氢的浓度,单位体积内活化分子数增多,反应速率增大,B正确;升高温度,单位时间内有效碰撞次数增加,反应速率增大,C正确;增大压强,单位体积内活化分子数增多,反应速率增大,但活化分子的百分数不变,D错误。
3.C 解析 2 s后A的转化率为50%,则反应的A为2 mol×50%=1 mol,则
2A(g) + 3B(g) 2C(g) + zD(g)
起始量/mol 2 2 0 0
变化量/mol 1 1.5 1 0.5z
平衡量/mol 1 0.5 1 0.5z
v(C)==0.25 mol·L-1·s-1,A错误;v(D)=0.25 mol·L-1·s-1,v(C)=v(D),z=2,B错误;B的转化率为×100%=75%,C正确;反应前与2 s后容器的压强比等于气体物质的量之比=4∶(1+0.5+1+0.5×2)=4∶3.5,D错误。
4.B 解析 对同一反应而言,比较化学反应进行的快慢时需用同一种物质表示不同条件下的反应速率,依据速率之比等于化学计量数之比进行换算,将各项速率转化为v(N2)进行比较。v(N2)=v(NH3)=×1.5 mol·L-1·min-1=0.75 mol·L-1·min-1;v(N2)=1.2 mol·L-1·min-1;v(N2)=v(H2O)=×1.67 mol·L-1·min-1≈0.56 mol·L-1·min-1;v(N2)=v(O2)=×1.5 mol·L-1·min-1=1.0 mol·L-1·min-1,则反应速率最快的为B。
5.D 解析 前12 s内,A的浓度变化量为(0.8-0.2) mol·L-1=0.6 mol·L-1,A反应的物质的量为0.6 mol·L-1×2 L=1.2 mol,生成C的物质的量为1.6 mol,故A、C的计量数比为1.2 mol∶1.6 mol=3∶4,故c=4,B的浓度变化量为(0.5-0.3) mol·L-1=0.2 mol·L-1,故A、B的计量数比为0.6 mol·L-1∶0.2 mol·L-1=3∶1,故b=1,A错误;前12 s内,A的浓度变化量为(0.8-0.2) mol·L-1=0.6 mol·L-1,A的平均反应速率为=0.05 mol·L-1·s-1,B错误;由分析知,12 s后反应达到平衡状态,A的消耗速率与B的生成速率比为3∶1,C错误;由分析知,单位时间内生成0.3 mol A的同时,生成0.4 mol C,正、逆反应速率相等,化学反应达到平衡状态,D正确。
6.A 解析 ①加入NaCl溶液,盐酸浓度降低,反应速率减慢;②再加入100 mL 1.0 mol·L-1的稀盐酸,浓度未变,速率不变;③加几滴浓硫酸,氢离子浓度增大,反应速率加快,由于铁粉未变,产生氢气量不变;④加入少量醋酸钠固体,醋酸根和氢离子反应,氢离子浓度降低,反应速率减小;⑤适当升高温度,速率加快,铁的质量未变,产生氢气总量未变;⑥滴入几滴硫酸铜溶液,铁和铜离子反应生成铜单质和亚铁离子,形成Fe-Cu-HCl原电池,加快反应速率,但由于铁有一定量的消耗,产生氢气的总量减少。因此可能的是③⑤,故A符合题意。
7.答案 Ⅰ.(1)0.75 mol·L-1 (2)3 mol
(3)0.05 mol·L-1·min-1 (4)2
Ⅱ.③>①=④>②
解析 Ⅰ.由方程式可知Δc(A)=1.5Δc(D)=1.5×0.5 mol·L-1=0.75 mol·L-1,Δc(B)=0.5Δc(D)=0.25 mol·L-1,A、B起始浓度相等,设为c mol·L-1,则(c-0.75)∶(c-0.25)=3∶5,解得c=1.5。开始时容器中A、B的物质的量为n=1.5 mol·L-1×2 L=3 mol。
(1)由分析可知,开始A的浓度为1.5 mol·L-1,Δc(A)=1.5Δc(D)=1.5×0.5 mol·L-1=0.75 mol·L-1,则5 min后A的浓度为0.75 mol·L-1。
(2)根据分析可知,反应开始前充入容器中的B的物质的量为3 mol。
(3)浓度变化量之比等于化学计量数之比,则x∶2=(0.1 mol·L-1·min-1×5 min)∶0.5 mol·L-1,解得x=2,速率之比等于化学计量数之比,则v(B)=0.5v(C)=0.05 mol·L-1·min-1。
Ⅱ.①v(A)=0.01 mol·L-1·s-1时,v(A)=v(A)×60=0.6 mol·L-1·min-1;②v(B)=1.20 mol·L-1·min-1时,v(A)=v(B)=0.40 mol·L-1·min-1;③v(C)=2.40 mol·L-1·min-1时,v(A)=v(C)=1.20 mol·L-1·min-1;④v(D)=0.02 mol·L-1·s-1时,v(A)=v(D)×60=0.6 mol·L-1·min-1;
故速率大小关系为③>①=④>②。
8.A 解析 由图可知,X点后反应继续正向进行,则X点的v(正)>Y点的v(正),A正确;由图可知,A、B、C浓度变化之比为0.06∶0.06∶0.03=2∶2∶1,结合化学方程式可知,曲线C表示的是体系中N2的浓度变化,曲线A表示的是体系中CO2的浓度变化,B错误;结合B项分析,0~4 min,CO2的平均反应速率为 mol·L-1·min-1=0.015 mol·L-1·min-1,C错误;曲线B表示的是体系中NO2的浓度变化,NO2的平衡转化率为×100%=60%,D错误。
9.D 解析 由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验,反应所用时间最长,故反应速率最慢,A正确;第1组实验,反应所用时间最短,故反应速率最快,根据控制变量法原则知,盐酸浓度应大于2.5 mol·L-1,B正确;第2组实验,铁是粉末状,与3、4组块状铁相区别,根据控制变量法原则知,盐酸的浓度应等于2.5 mol·L-1,C正确;由3、4组实验并结合图像知,第3组实验中反应温度应高于30 ℃,D错误。
10.B 解析 活化能越大,反应速率越慢,由反应②速率慢,则②活化能大,活化能:反应②>反应①,A错误;化学反应由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,B正确;氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl·主要参与反应②,C错误;Cl·是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,D错误。
11.C 解析 实验1和实验2中各反应物的浓度都相同,但实验2的温度比实验1高,所以反应速率快,KMnO4溶液褪色的时间短,a<12.7,实验3与实验4比较,实验4未使用催化剂,KMnO4溶液褪色的时间长,b>6.7,A正确;比较反应速率快慢,既可以利用KMnO4溶液褪色的时间判断,也可以通过比较产生相同体积CO2所消耗的时间来判断,B正确;用KMnO4表示该反应速率,v(实验3)=≈5.0×10-4 mol·L-1·min-1,C不正确;通过计算,用KMnO4表示该反应速率,v(实验3)12.D 解析 实验①②温度相同,但浓度不同,①浓度较大,可得出增大反应物浓度,化学反应速率加快,A正确;实验②④起始浓度相同,但温度不同,④反应速率较大,可得出:升高温度,化学反应速率加快,B正确;实验②③温度、浓度相同,③反应速率较大,应为加入催化剂,C正确;在0~10 min之间,实验④X的浓度变化为0.60 mol·L-1,则v(Y)=v(X)==0.03 mol·L-1·min-1,D错误。
13.C 解析 草酸中C元素为+3价,则被氧化后为+4价,生成CO2,A正确;实验③中a和b如果是20和20,则实验③中所用草酸浓度较大,反应速率更快,B正确;反应过程中发生的反应为3H2C2O4+Cr2+8H+6CO2↑+2Cr3++7H2O,结合图像可知,实验①中0~t1时段反应速率v(Cr3+)= mol·L-1·min-1×2= mol·L-1·min-1,C错误;实验①和②中不同条件只有初始pH,而据图可知实验①反应速率更快,说明其他条件相同时,pH越小,该反应速率越快,D正确。
14.答案 (1)5 (2)浓度 1.0
(3)升高温度,化学反应速率加快 (4)1.67×10-3
(5)反应产生的Mn2+对化学反应起了催化作用 B
解析 KMnO4具有强氧化性,H2C2O4具有还原性,二者发生氧化还原反应,根据元素化合价升降总数等于反应过程中电子转移总数,可计算1 mol KMnO4反应时电子转移的物质的量。在测定反应速率时,通常采用控制变量方法进行研究。根据单位时间内物质浓度改变值计算反应速率,且外界条件对化学反应速率的影响因素中,影响大小关系为催化剂>温度>浓度。
(1)根据反应的离子方程式可知:KMnO4反应后变为Mn2+,Mn元素化合价从+7价变为+2价,降低了5价,则根据元素化合价改变数值等于反应过程中电子转移的物质的量,可知:1 mol KMnO4参加反应时转移了5 mol电子。
(2)在进行实验时,要采用控制变量方法进行研究,根据表格中实验①可知混合溶液总体积是6.0 mL,则Vx=1.0;结合实验①、②数据可知,只有H2C2O4溶液浓度不同,其他外界条件都相同,因此实验①、②探究的是浓度对化学反应速率的影响。
(3)结合实验①、③数据可知,二者不同之处是反应温度,因此是探究温度对化学反应速率的影响,可见:升高温度会使溶液褪色时间缩短,故升高温度,会使化学反应速率加快。
(4)n(KMnO4)=0.04 mol·L-1×10-3 L=4.0×10-5 mol,混合溶液总体积是V=6.0×10-3 L,则Δc(KMnO4)=×10-2 mol·L-1,则在实验①中,4.0 min内,v(Mn)=≈1.67×10-3 mol·L-1·min-1。
(5)影响化学反应速率的因素有催化剂、温度、浓度等,根据题意可知,因反应放热导致温度升高对速率影响不大,在时间t1~t2过程中,随着反应的进行,反应物浓度逐渐减小,但反应速率却逐渐增大,可推知反应速率迅速增大的主要原因是反应产生了Mn2+,Mn2+对化学反应起了催化作用。
若用实验证明你的推测,除了表中试剂外,还需向试管中加入少量固体,该固体中应该含有Mn2+,加入的固体物质应为MnSO4,故合理选项是B。
15.答案 (1)30.0 6.0×10-2
(2)v(HCl)=2v(Cl2)=2×=2×=1.8×10-3mol·min-1
(3) 1.95×10-3
解析 (1)由题意,列三段式:
2N2O5(g) 2N2O4(g) + O2(g)
起始/kPa 35.8 0 0
变化/kPa 2.9×2 2.9×2 2.9
62 min时/kPa 35.8-2.9×2 2.9×2 2.9
所以=30.0 kPa;v=2×10-3×30.0 kPa·min-1=6.0×10-2 kPa·min-1。
(3)平衡时,v(正)=v(逆),即k正x2(HI)=k逆x(H2)·x(I2),则=K,k逆=;v(正)=k正x2(HI)=0.002 7 min-1×0.852≈1.95×10-3 min-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版新教材化学高考第一轮
第34讲 化学反应速率及影响因素
层次1基础性
1.(2023·广东深圳检测)小朋友们玩的荧光棒的发光原理是:化学物质相互反应过程中,能量以光的形式释放出来。使用一段时间已经变暗的荧光棒放在热水中,荧光棒会短时间内重新变亮,下列解释错误的是( )
A.荧光棒发光——化学能转化为光能
B.荧光棒变暗——反应物浓度减小,反应速率减小
C.放在热水中短暂变亮——温度升高,反应速率增加
D.放在热水中变亮——热水对反应起催化作用,从而加快了反应速率
2.在反应2HIH2+2I中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.加入适宜的催化剂,可降低反应的活化能
B.增大c(HI),单位体积内活化分子数增多
C.升高温度,单位时间内有效碰撞次数增加
D.增大压强,活化分子的百分数增大
3.2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前与2 s后容器的压强比为4∶3
4.对于反应2N2(g)+6H2O(g)4NH3(g)+3O2(g),在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是( )
A.v(NH3)=1.5 mol·L-1·min-1
B.v(N2)=1.2 mol·L-1·min-1
C.v(H2O)=1.67 mol·L-1·min-1
D.v(O2)=1.5 mol·L-1·min-1
5.(2023·广东广州期末)在2 L密闭容器中投入一定量A、B,发生反应:3A(g)+bB(g)cC(g) ΔH>0。12 s时反应达到平衡,生成C的物质的量为1.6 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是( )
A.方程式中b=4,c=1
B.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1
C.12 s后,A的消耗速率等于B的生成速率
D.单位时间内生成0.3 mol A的同时,生成0.4 mol C,则反应达到平衡状态
6.(2023·广东深圳检测)少量铁粉与100 mL 1.0 mol·L-1的稀盐酸反应,为了加快此反应速率且不改变生成H2的总量,以下方法可行的是( )
①加入NaCl溶液 ②再加入100 mL 1.0 mol·L-1的稀盐酸 ③加几滴浓硫酸 ④加入少量醋酸钠固体 ⑤适当升高温度 ⑥滴入几滴硫酸铜溶液
A.③⑤ B.②③ C.①④ D.②⑥
7.(2023·陕西西安期末)Ⅰ.将等物质的量A、B混合于2 L的密闭容器中,发生反应:3A(g)+B(g)xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。
(1)经5 min后A的浓度为 。
(2)反应开始前充入容器中B的物质的量为 。
(3)B的平均反应速率为 。
(4)x的值为 。
Ⅱ.对于反应A(g)+3B(g)2C(g)+2D(g),下列分别表示不同条件下的反应速率,则反应速率大小关系是 。
①v(A)=0.01 mol·L-1·s-1
②v(B)=1.20 mol·L-1·min-1
③v(C)=2.40 mol·L-1·min-1
④v(D)=0.02 mol·L-1·s-1
层次2综合性
8.(2023·广东深圳检测)用活性炭可还原NO2防止空气污染,其反应原理为2C(s)+2NO2(g)N2(g)+2CO2(g)。一定温度下,向2 L恒容密闭容器中加入足量的C(s)和0.200 mol NO2,体系中物质浓度变化曲线如图所示。下列说法正确的是 ( )
A.X点的v(正)>Y点的v(正)
B.曲线C表示的是体系中CO2的浓度变化
C.0~4 min,CO2的平均反应速率为0.030 mol·L-1·min-1
D.NO2的平衡转化率为30%
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 对应 曲线 反应温 度/℃ 铁的 状态
1 a 30 粉末状
2 b 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol·L-1
C.第2组实验中盐酸的浓度等于2.5 mol·L-1
D.第3组实验的反应温度低于30 ℃
10.(2023·广东广州天河区二模)臭氧分解2O33O2的反应历程包括以下反应:
反应①:O3O2+O·(快)
反应②:O3+O·2O2(慢)
大气中的氯氟烃光解产生的氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
A.活化能:反应①>反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl·主要参与反应①,改变O3分解的反应历程
D.Cl·参与反应提高了O3分解为O2的平衡转化率
11.探究2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
编号 酸性KMnO4溶液 H2C2O4溶液 KMnO4溶液褪色平均时间/min
1 25 0.5 4 0.1 8 0.2 12.7
2 80 0.5 4 0.1 8 0.2 a
3 25 0.5 4 0.01 8 0.2 6.7
4 25 0 4 0.01 8 0.2 b
下列说法不正确的是( )
A.a<12.7,b>6.7
B.可通过比较收集相同体积的CO2所消耗的时间来判断反应速率的快慢
C.用KMnO4表示该反应速率,v(实验3)约为1.5×10-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.比较实验②④得出:升高温度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min之间,实验④的平均速率v(Y)=0.06 mol·L-1·min-1
13.(2023·湖北十堰一模)某酸性工业废水中含有K2Cr2O7,草酸(H2C2O4)能将其中的Cr2转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表。
实验 编号 初始 pH 废水样 品体积/mL 草酸溶液 体积/mL 蒸馏水 体积/mL
① 4 60 10 30
② 5 60 10 30
③ 5 60 a b
测得实验①和②溶液中的Cr2浓度随时间变化关系如图所示。下列叙述不正确的是( )
A.上述反应后草酸被氧化为CO2
B.实验③中a和b如果是20和20,则反应速率③>②
C.由曲线①可知,0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
D.实验①和②的结果表明,其他条件相同时,pH越小,该反应速率越快
14.(2023·广东广州期末)某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验。
【实验原理】
2Mn+5H2C2O4+6H+10CO2↑+2Mn2++8H2O
【实验内容及记录】
实验 序号 试管中所加试剂及其用量/mL 溶液紫色褪至无色时所需时间/min
0.04 mol·L-1 KMnO4溶液 0.36 mol·L-1 稀硫酸 0.2 mol·L-1 H2C2O4溶液 H2O
① 20 1.0 1.0 2.0 2.0 4.0
② 20 1.0 1.0 3.0 Vx 3.6
③ 40 1.0 1.0 2.0 2.0 0.92
(1)实验原理中,1 mol KMnO4参加反应时,转移电子的物质的量为 mol。
(2)实验①、②探究的是 对反应速率的影响,表中Vx= 。
(3)由实验①、③可得出的结论是 。
(4)实验①中,4.0 min内,v(Mn)= mol·L-1·min-1。
(5)反应过程中,反应速率随时间的变化趋势如图所示。
其中,因反应放热导致温度升高对速率影响不大,试推测t1~t2速率迅速增大的主要原因是 。若用实验证明你的推测,除了表中试剂外,还需向试管中加入少量固体,该固体应为 (填字母)。
A.K2SO4 B.MnSO4
C.MnO2
层次3创新性
15.(1)已知:2N2O5(g)2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3× kPa·min-1。t=62 min时,测得体系中=2.9 kPa,则此时的= kPa,v= kPa·min-1。
(2)一定条件下测得反应2HCl(g)+O2(g)Cl2(g)+H2O(g)的反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10-3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程): 。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
上述反应中,正反应速率为v(正)=k正x2(HI),逆反应速率为v(逆)=k逆x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v(正)= min-1。
第34讲 化学反应速率及影响因素
1.D 解析 荧光棒发光过程中涉及化学能到光能的转化,A正确;荧光棒变暗,说明反应物减少,故反应物浓度减小,反应速率减小,B正确;在热水中,温度升高,单位体积内活化分子数目增加,反应速率加快,C正确;荧光棒中的物质不能接触到热水,起不到催化作用,D错误。
2.D 解析 加入合适的催化剂,能降低反应的活化能,反应速率增大,A正确;增大碘化氢的浓度,单位体积内活化分子数增多,反应速率增大,B正确;升高温度,单位时间内有效碰撞次数增加,反应速率增大,C正确;增大压强,单位体积内活化分子数增多,反应速率增大,但活化分子的百分数不变,D错误。
3.C 解析 2 s后A的转化率为50%,则反应的A为2 mol×50%=1 mol,则
2A(g) + 3B(g) 2C(g) + zD(g)
起始量/mol 2 2 0 0
变化量/mol 1 1.5 1 0.5z
平衡量/mol 1 0.5 1 0.5z
v(C)==0.25 mol·L-1·s-1,A错误;v(D)=0.25 mol·L-1·s-1,v(C)=v(D),z=2,B错误;B的转化率为×100%=75%,C正确;反应前与2 s后容器的压强比等于气体物质的量之比=4∶(1+0.5+1+0.5×2)=4∶3.5,D错误。
4.B 解析 对同一反应而言,比较化学反应进行的快慢时需用同一种物质表示不同条件下的反应速率,依据速率之比等于化学计量数之比进行换算,将各项速率转化为v(N2)进行比较。v(N2)=v(NH3)=×1.5 mol·L-1·min-1=0.75 mol·L-1·min-1;v(N2)=1.2 mol·L-1·min-1;v(N2)=v(H2O)=×1.67 mol·L-1·min-1≈0.56 mol·L-1·min-1;v(N2)=v(O2)=×1.5 mol·L-1·min-1=1.0 mol·L-1·min-1,则反应速率最快的为B。
5.D 解析 前12 s内,A的浓度变化量为(0.8-0.2) mol·L-1=0.6 mol·L-1,A反应的物质的量为0.6 mol·L-1×2 L=1.2 mol,生成C的物质的量为1.6 mol,故A、C的计量数比为1.2 mol∶1.6 mol=3∶4,故c=4,B的浓度变化量为(0.5-0.3) mol·L-1=0.2 mol·L-1,故A、B的计量数比为0.6 mol·L-1∶0.2 mol·L-1=3∶1,故b=1,A错误;前12 s内,A的浓度变化量为(0.8-0.2) mol·L-1=0.6 mol·L-1,A的平均反应速率为=0.05 mol·L-1·s-1,B错误;由分析知,12 s后反应达到平衡状态,A的消耗速率与B的生成速率比为3∶1,C错误;由分析知,单位时间内生成0.3 mol A的同时,生成0.4 mol C,正、逆反应速率相等,化学反应达到平衡状态,D正确。
6.A 解析 ①加入NaCl溶液,盐酸浓度降低,反应速率减慢;②再加入100 mL 1.0 mol·L-1的稀盐酸,浓度未变,速率不变;③加几滴浓硫酸,氢离子浓度增大,反应速率加快,由于铁粉未变,产生氢气量不变;④加入少量醋酸钠固体,醋酸根和氢离子反应,氢离子浓度降低,反应速率减小;⑤适当升高温度,速率加快,铁的质量未变,产生氢气总量未变;⑥滴入几滴硫酸铜溶液,铁和铜离子反应生成铜单质和亚铁离子,形成Fe-Cu-HCl原电池,加快反应速率,但由于铁有一定量的消耗,产生氢气的总量减少。因此可能的是③⑤,故A符合题意。
7.答案 Ⅰ.(1)0.75 mol·L-1 (2)3 mol
(3)0.05 mol·L-1·min-1 (4)2
Ⅱ.③>①=④>②
解析 Ⅰ.由方程式可知Δc(A)=1.5Δc(D)=1.5×0.5 mol·L-1=0.75 mol·L-1,Δc(B)=0.5Δc(D)=0.25 mol·L-1,A、B起始浓度相等,设为c mol·L-1,则(c-0.75)∶(c-0.25)=3∶5,解得c=1.5。开始时容器中A、B的物质的量为n=1.5 mol·L-1×2 L=3 mol。
(1)由分析可知,开始A的浓度为1.5 mol·L-1,Δc(A)=1.5Δc(D)=1.5×0.5 mol·L-1=0.75 mol·L-1,则5 min后A的浓度为0.75 mol·L-1。
(2)根据分析可知,反应开始前充入容器中的B的物质的量为3 mol。
(3)浓度变化量之比等于化学计量数之比,则x∶2=(0.1 mol·L-1·min-1×5 min)∶0.5 mol·L-1,解得x=2,速率之比等于化学计量数之比,则v(B)=0.5v(C)=0.05 mol·L-1·min-1。
Ⅱ.①v(A)=0.01 mol·L-1·s-1时,v(A)=v(A)×60=0.6 mol·L-1·min-1;②v(B)=1.20 mol·L-1·min-1时,v(A)=v(B)=0.40 mol·L-1·min-1;③v(C)=2.40 mol·L-1·min-1时,v(A)=v(C)=1.20 mol·L-1·min-1;④v(D)=0.02 mol·L-1·s-1时,v(A)=v(D)×60=0.6 mol·L-1·min-1;
故速率大小关系为③>①=④>②。
8.A 解析 由图可知,X点后反应继续正向进行,则X点的v(正)>Y点的v(正),A正确;由图可知,A、B、C浓度变化之比为0.06∶0.06∶0.03=2∶2∶1,结合化学方程式可知,曲线C表示的是体系中N2的浓度变化,曲线A表示的是体系中CO2的浓度变化,B错误;结合B项分析,0~4 min,CO2的平均反应速率为 mol·L-1·min-1=0.015 mol·L-1·min-1,C错误;曲线B表示的是体系中NO2的浓度变化,NO2的平衡转化率为×100%=60%,D错误。
9.D 解析 由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验,反应所用时间最长,故反应速率最慢,A正确;第1组实验,反应所用时间最短,故反应速率最快,根据控制变量法原则知,盐酸浓度应大于2.5 mol·L-1,B正确;第2组实验,铁是粉末状,与3、4组块状铁相区别,根据控制变量法原则知,盐酸的浓度应等于2.5 mol·L-1,C正确;由3、4组实验并结合图像知,第3组实验中反应温度应高于30 ℃,D错误。
10.B 解析 活化能越大,反应速率越慢,由反应②速率慢,则②活化能大,活化能:反应②>反应①,A错误;化学反应由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,B正确;氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl·主要参与反应②,C错误;Cl·是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,D错误。
11.C 解析 实验1和实验2中各反应物的浓度都相同,但实验2的温度比实验1高,所以反应速率快,KMnO4溶液褪色的时间短,a<12.7,实验3与实验4比较,实验4未使用催化剂,KMnO4溶液褪色的时间长,b>6.7,A正确;比较反应速率快慢,既可以利用KMnO4溶液褪色的时间判断,也可以通过比较产生相同体积CO2所消耗的时间来判断,B正确;用KMnO4表示该反应速率,v(实验3)=≈5.0×10-4 mol·L-1·min-1,C不正确;通过计算,用KMnO4表示该反应速率,v(实验3)
13.C 解析 草酸中C元素为+3价,则被氧化后为+4价,生成CO2,A正确;实验③中a和b如果是20和20,则实验③中所用草酸浓度较大,反应速率更快,B正确;反应过程中发生的反应为3H2C2O4+Cr2+8H+6CO2↑+2Cr3++7H2O,结合图像可知,实验①中0~t1时段反应速率v(Cr3+)= mol·L-1·min-1×2= mol·L-1·min-1,C错误;实验①和②中不同条件只有初始pH,而据图可知实验①反应速率更快,说明其他条件相同时,pH越小,该反应速率越快,D正确。
14.答案 (1)5 (2)浓度 1.0
(3)升高温度,化学反应速率加快 (4)1.67×10-3
(5)反应产生的Mn2+对化学反应起了催化作用 B
解析 KMnO4具有强氧化性,H2C2O4具有还原性,二者发生氧化还原反应,根据元素化合价升降总数等于反应过程中电子转移总数,可计算1 mol KMnO4反应时电子转移的物质的量。在测定反应速率时,通常采用控制变量方法进行研究。根据单位时间内物质浓度改变值计算反应速率,且外界条件对化学反应速率的影响因素中,影响大小关系为催化剂>温度>浓度。
(1)根据反应的离子方程式可知:KMnO4反应后变为Mn2+,Mn元素化合价从+7价变为+2价,降低了5价,则根据元素化合价改变数值等于反应过程中电子转移的物质的量,可知:1 mol KMnO4参加反应时转移了5 mol电子。
(2)在进行实验时,要采用控制变量方法进行研究,根据表格中实验①可知混合溶液总体积是6.0 mL,则Vx=1.0;结合实验①、②数据可知,只有H2C2O4溶液浓度不同,其他外界条件都相同,因此实验①、②探究的是浓度对化学反应速率的影响。
(3)结合实验①、③数据可知,二者不同之处是反应温度,因此是探究温度对化学反应速率的影响,可见:升高温度会使溶液褪色时间缩短,故升高温度,会使化学反应速率加快。
(4)n(KMnO4)=0.04 mol·L-1×10-3 L=4.0×10-5 mol,混合溶液总体积是V=6.0×10-3 L,则Δc(KMnO4)=×10-2 mol·L-1,则在实验①中,4.0 min内,v(Mn)=≈1.67×10-3 mol·L-1·min-1。
(5)影响化学反应速率的因素有催化剂、温度、浓度等,根据题意可知,因反应放热导致温度升高对速率影响不大,在时间t1~t2过程中,随着反应的进行,反应物浓度逐渐减小,但反应速率却逐渐增大,可推知反应速率迅速增大的主要原因是反应产生了Mn2+,Mn2+对化学反应起了催化作用。
若用实验证明你的推测,除了表中试剂外,还需向试管中加入少量固体,该固体中应该含有Mn2+,加入的固体物质应为MnSO4,故合理选项是B。
15.答案 (1)30.0 6.0×10-2
(2)v(HCl)=2v(Cl2)=2×=2×=1.8×10-3mol·min-1
(3) 1.95×10-3
解析 (1)由题意,列三段式:
2N2O5(g) 2N2O4(g) + O2(g)
起始/kPa 35.8 0 0
变化/kPa 2.9×2 2.9×2 2.9
62 min时/kPa 35.8-2.9×2 2.9×2 2.9
所以=30.0 kPa;v=2×10-3×30.0 kPa·min-1=6.0×10-2 kPa·min-1。
(3)平衡时,v(正)=v(逆),即k正x2(HI)=k逆x(H2)·x(I2),则=K,k逆=;v(正)=k正x2(HI)=0.002 7 min-1×0.852≈1.95×10-3 min-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
