化学计算
图片预览






文档简介
课件23张PPT。专题三 化学计算考 点 管 理【命题重点】
1.根据化学式计算。
2.根据化学方程式计算。
3.关于溶质质量分数的计算。
【命题题型】
1.简答题。
2.分析与计算题。
【答题注意】
1.按计算格式规范解答。
2.计算过程确保计算结果正确。
3.注意根据化学方程式计算时反应物、生成物的质量的纯净量计算。
归 类 探 究类型之一 根据化学式计算
器 [2013·宜宾]下列有关计算结果错误的是( )
A.K2Cr2O7中Cr元素的化合价为+6价
B.NH4NO3中氮元素的质量分数为35%
C.C2H4与C4H8中碳元素和氢元素的质量比相同,均为6∶2
D.已知20 ℃时,NaCl的溶解度为36克,据此计算出该温度下其饱和溶液的质量分数为26.5%
C类型之二 有关溶质质量分数计算
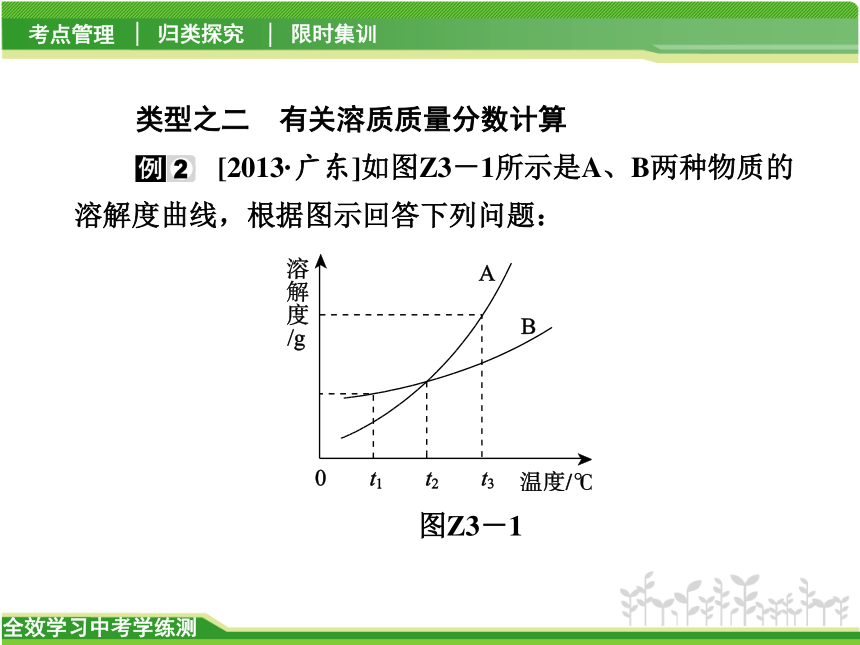
[2013·广东]如图Z3-1所示是A、B两种物质的溶解度曲线,根据图示回答下列问题:
图Z3-1
(1)t1℃时,A、B两种物质的溶解度是A______B(填“>” “<”或“=”,下同)。
(2)将t3℃的A、B两种物质的饱和溶液各200 g,降温至t1℃,析出晶体的质量关系是A______B。
(3)t2℃时,100 g水中溶解50 g A刚好饱和,那么50 g水中溶解______g B也刚好达饱和,此时溶液的质量分数是__________(精确到0.1%)。
【解析】 比较不同物质的溶解度必须在相同温度下才能比较。将t3℃的A、B两种物质的饱和溶液各200g,降温至t1℃时由于两个温度下溶解度差值A大于B,所以析出晶体A大于B。
<>2533.3%类型之三 根据化学方程式计算
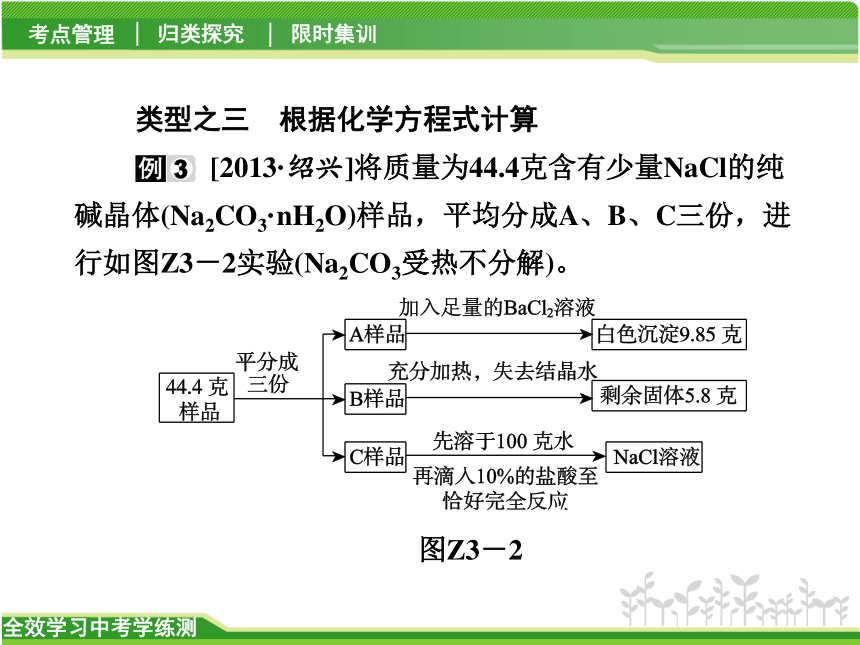
[2013·绍兴]将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图Z3-2实验(Na2CO3受热不分解)。
图Z3-2
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是________。
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是_______克。
(3)B样品中含有结晶水的质量是______克。
(4)化学式Na2CO3·nH2O中n是多少?_______
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)_________
【解析】 (4)由于B样品中Na2CO3的质量与A相等,也为5.3克,结晶水的质量为9克。
过滤5.39104.26%n=10
(5)设与样品C反应的盐酸的质量为a,生成氯化钠的质量为b,生成二氯化碳的质量为c。
Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
106 73 117 44
5.3克 10%a b c
a=36.5克 b=5.85克 c=2.2克
氯化钠溶液的质量为:
14.8克+100克+36.5克-2.2克=149.1克
溶质氯化钠的质量为:
5.85克+14.8克-5.3克-9克=6.35克
氯化钠溶液中溶质的质量分数
[2012·泰安]小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0 g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)
【答案】 96.4%
(2)在如图Z3-3中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
图Z3-3
【答案】 如图所示
【解析】 由实验数据可知,11.0 g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0 g碳酸钙。
(1)设生成10.0 g碳酸钙需要碳酸钠的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100
x 10.0 g
解得:x=10.6 g
样品中碳酸钠的质量分数为:
(2)根据图表信息,比较烧杯Ⅰ和烧杯Ⅱ中的数据可以知道,55.5 g氯化钙溶液可以和碳酸钠反应生成5.0 g沉淀,那么产生10.0 g沉淀,所需氯化钙溶液的质量为111.0 g。
类型之四 综合计算
[2013·雅安]课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87 g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)经多次实验测定,该溶液的溶质质量分数为10%。
_________
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
1.17 g若化学方法测定结果准确,则物理方法测定结果产生误差的原因是 ( )
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿
12%C【解析】 (1)设生成氯化钠质量为x。
NaCl+AgNO3===AgCl↓+NaNO3
58.5 143.5
x 2.8 7 g
x=1.17g
[2012·潍坊]某同学模拟工业炼铁原理,用如图Z3-4所示装置进行实验。取8 g氧化铁,通入足量一氧化碳,充分反应后,冷却,将玻璃管中的固体移入盛有49 g硫酸溶液的烧杯中,恰好完全反应。
(1)该同学首先按如图Z3-4所示装配好仪器,检查了气密性并装好仪器,接下来的操作是__________________ ______(只写一步即可)。
(2)计算硫酸溶液的溶质质量分数。
先通一段时间一氧化碳 图Z3-4
【答案】 20%
【解析】 设8g氧化铁完全反应后生铁的质量为x。
160 112
8 g x
设5.6 g铁消耗硫酸的质量为y。
Fe+H2SO4===FeSO4+H2↑
56 98
5.6g y
限 时 集 训
1.根据化学式计算。
2.根据化学方程式计算。
3.关于溶质质量分数的计算。
【命题题型】
1.简答题。
2.分析与计算题。
【答题注意】
1.按计算格式规范解答。
2.计算过程确保计算结果正确。
3.注意根据化学方程式计算时反应物、生成物的质量的纯净量计算。
归 类 探 究类型之一 根据化学式计算
器 [2013·宜宾]下列有关计算结果错误的是( )
A.K2Cr2O7中Cr元素的化合价为+6价
B.NH4NO3中氮元素的质量分数为35%
C.C2H4与C4H8中碳元素和氢元素的质量比相同,均为6∶2
D.已知20 ℃时,NaCl的溶解度为36克,据此计算出该温度下其饱和溶液的质量分数为26.5%
C类型之二 有关溶质质量分数计算
[2013·广东]如图Z3-1所示是A、B两种物质的溶解度曲线,根据图示回答下列问题:
图Z3-1
(1)t1℃时,A、B两种物质的溶解度是A______B(填“>” “<”或“=”,下同)。
(2)将t3℃的A、B两种物质的饱和溶液各200 g,降温至t1℃,析出晶体的质量关系是A______B。
(3)t2℃时,100 g水中溶解50 g A刚好饱和,那么50 g水中溶解______g B也刚好达饱和,此时溶液的质量分数是__________(精确到0.1%)。
【解析】 比较不同物质的溶解度必须在相同温度下才能比较。将t3℃的A、B两种物质的饱和溶液各200g,降温至t1℃时由于两个温度下溶解度差值A大于B,所以析出晶体A大于B。
<>2533.3%类型之三 根据化学方程式计算
[2013·绍兴]将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图Z3-2实验(Na2CO3受热不分解)。
图Z3-2
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是________。
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是_______克。
(3)B样品中含有结晶水的质量是______克。
(4)化学式Na2CO3·nH2O中n是多少?_______
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)_________
【解析】 (4)由于B样品中Na2CO3的质量与A相等,也为5.3克,结晶水的质量为9克。
过滤5.39104.26%n=10
(5)设与样品C反应的盐酸的质量为a,生成氯化钠的质量为b,生成二氯化碳的质量为c。
Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
106 73 117 44
5.3克 10%a b c
a=36.5克 b=5.85克 c=2.2克
氯化钠溶液的质量为:
14.8克+100克+36.5克-2.2克=149.1克
溶质氯化钠的质量为:
5.85克+14.8克-5.3克-9克=6.35克
氯化钠溶液中溶质的质量分数
[2012·泰安]小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0 g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)
【答案】 96.4%
(2)在如图Z3-3中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
图Z3-3
【答案】 如图所示
【解析】 由实验数据可知,11.0 g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0 g碳酸钙。
(1)设生成10.0 g碳酸钙需要碳酸钠的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100
x 10.0 g
解得:x=10.6 g
样品中碳酸钠的质量分数为:
(2)根据图表信息,比较烧杯Ⅰ和烧杯Ⅱ中的数据可以知道,55.5 g氯化钙溶液可以和碳酸钠反应生成5.0 g沉淀,那么产生10.0 g沉淀,所需氯化钙溶液的质量为111.0 g。
类型之四 综合计算
[2013·雅安]课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87 g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)经多次实验测定,该溶液的溶质质量分数为10%。
_________
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
1.17 g若化学方法测定结果准确,则物理方法测定结果产生误差的原因是 ( )
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿
12%C【解析】 (1)设生成氯化钠质量为x。
NaCl+AgNO3===AgCl↓+NaNO3
58.5 143.5
x 2.8 7 g
x=1.17g
[2012·潍坊]某同学模拟工业炼铁原理,用如图Z3-4所示装置进行实验。取8 g氧化铁,通入足量一氧化碳,充分反应后,冷却,将玻璃管中的固体移入盛有49 g硫酸溶液的烧杯中,恰好完全反应。
(1)该同学首先按如图Z3-4所示装配好仪器,检查了气密性并装好仪器,接下来的操作是__________________ ______(只写一步即可)。
(2)计算硫酸溶液的溶质质量分数。
先通一段时间一氧化碳 图Z3-4
【答案】 20%
【解析】 设8g氧化铁完全反应后生铁的质量为x。
160 112
8 g x
设5.6 g铁消耗硫酸的质量为y。
Fe+H2SO4===FeSO4+H2↑
56 98
5.6g y
限 时 集 训
