2025浙江专版新教材化学高考第一轮基础练--常考点7 膜在电化学中的应用(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--常考点7 膜在电化学中的应用(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 428.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:03:02 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
常考点7膜在电化学中的应用
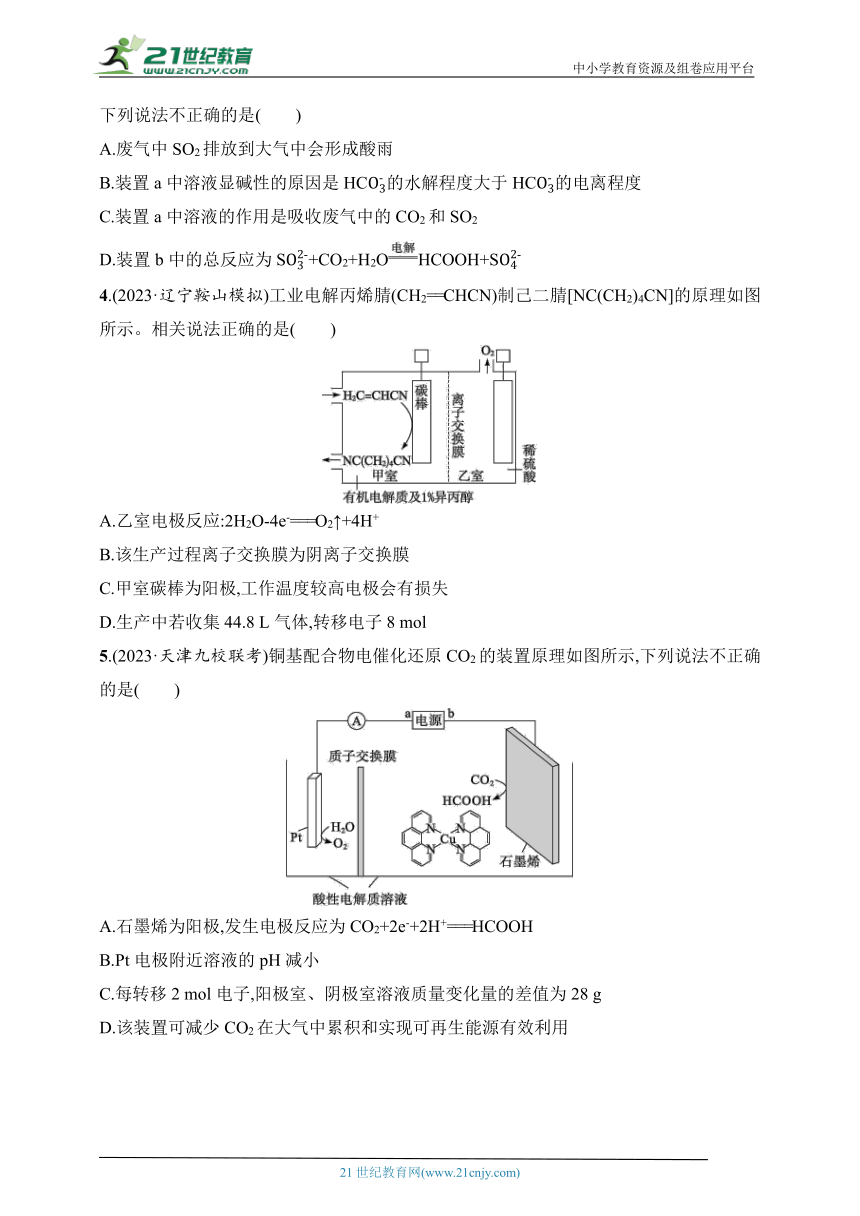
1.某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①Zn-2e-===Zn2+;②Zn2++4OH-=== [Zn(OH)4]2-;③[Zn(OH)4]2-===ZnO+2OH-+H2O。下列说法不正确的是( )
A.电极a的电势高于电极b的电势
B.放电过程中正极区KOH溶液浓度保持不变
C.电极a上发生的电极反应式为C2H2+2H2O+2e-===C2H4+2OH-
D.电解足量CuSO4溶液,理论上消耗2.24 L(标准状况)C2H2时,生成6.4 g Cu
2.(2023·广东卷)用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是( )
A.电解总反应:KNO3+3H2O===NH3·H2O+2O2↑+KOH
B.每生成1 mol NH3·H2O,双极膜处有9 mol的H2O解离
C.电解过程中,阳极室中KOH的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
3.(2023·北京卷)回收利用工业废气中的CO2和SO2,实验原理示意图如下。
下列说法不正确的是( )
A.废气中SO2排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是HC的水解程度大于HC的电离程度
C.装置a中溶液的作用是吸收废气中的CO2和SO2
D.装置b中的总反应为S+CO2+H2OHCOOH+S
4.(2023·辽宁鞍山模拟)工业电解丙烯腈(CH2==CHCN)制己二腈[NC(CH2)4CN]的原理如图所示。相关说法正确的是( )
A.乙室电极反应:2H2O-4e-===O2↑+4H+
B.该生产过程离子交换膜为阴离子交换膜
C.甲室碳棒为阳极,工作温度较高电极会有损失
D.生产中若收集44.8 L气体,转移电子8 mol
5.(2023·天津九校联考)铜基配合物电催化还原CO2的装置原理如图所示,下列说法不正确的是( )
A.石墨烯为阳极,发生电极反应为CO2+2e-+2H+===HCOOH
B.Pt电极附近溶液的pH减小
C.每转移2 mol电子,阳极室、阴极室溶液质量变化量的差值为28 g
D.该装置可减少CO2在大气中累积和实现可再生能源有效利用
常考点7 膜在电化学中的应用
1.B 由图可知锌板为负极,所以电极a的电势高于电极b的电势,A正确;放电过程中正极区消耗水,导致KOH溶液浓度增大,B错误;电极a上发生的电极反应式为C2H2+2H2O+2e-===C2H4+2OH-,C正确;电解硫酸铜时,生成铜的电极反应为Cu2++2e-===Cu,理论上消耗2.24 L C2H2(标准状况),即0.1 mol,对应电子转移0.2 mol,可生成铜6.4 g,D正确。
2.B 由信息大电流催化电解KNO3溶液制氨可知,在电极a处KNO3放电生成NH3,发生还原反应,故电极a为阴极,电极反应为N+8e-+7H2O===NH3·H2O+9OH-,电极b为阳极,电极反应为4OH--4e-===O2↑+2H2O,“卯榫”结构的双极膜中的H+移向电极a,OH-移向电极b。由分析中阴阳极电极反应可知,电解总反应为KNO3+3H2O===NH3·H2O+2O2↑+KOH,故A正确;每生成1 mol NH3·H2O,阴极得8 mol e-,同时双极膜处有8 mol H+进入阴极室,即有8 mol的H2O解离,故B错误;电解过程中,阳极室每消耗4 mol OH-,同时有4 mol OH-通过双极膜进入阳极室,KOH的物质的量不因反应而改变,故C正确;相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于H2O被催化解离成H+和OH-,可提高氨生成速率,故D正确。
3.C SO2是酸性氧化物,废气中SO2排放到空气中会形成硫酸型酸雨,A正确;装置a中溶液的溶质为NaHCO3,溶液显碱性,说明HC的水解程度大于电离程度,B正确;装置a中NaHCO3溶液的作用是吸收SO2气体,CO2与NaHCO3溶液不反应,不能吸收CO2,C错误;由示意图可知,装置b中总反应为S+CO2+H2OHCOOH+S,D正确。
4.A 该装置为电解池装置,依据装置图,乙室中有氧气产生,该电极为阳极,碳棒为阴极。乙室中有氧气产生,电极反应为2H2O-4e-===O2↑+4H+,A正确;丙烯腈转化成己二腈,其电极反应式为2CH2==CHCN+2H++2e-===NC(CH2)4CN,根据电解原理,H+由乙室向甲室移动,因此离子交换膜为质子交换膜,B错误;根据上述分析,碳棒为阴极,C错误;题中没有指明是否为标准状况,不能直接运用22.4 L·mol-1进行计算,D错误。
5.A CO2在石墨烯上发生还原反应,所以石墨烯为阴极,A错误。Pt电极上电极反应为2H2O-4e-===4H++O2↑,所以电极附近溶液的pH减小,B正确。每转移2 mol电子,由阴极电极反应式可知生成1 mol HCOOH,质量增加46 g;根据阳极室反应可知每转移2 mol电子阳极消耗1 mol水,生成0.5 mol氧气,同时有2 mol H+转移至阴极室,阳极质量减少18 g,46 g-18 g=28 g,C正确。该装置可减少CO2在大气中累积和实现可再生能源有效利用,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
常考点7膜在电化学中的应用
1.某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①Zn-2e-===Zn2+;②Zn2++4OH-=== [Zn(OH)4]2-;③[Zn(OH)4]2-===ZnO+2OH-+H2O。下列说法不正确的是( )
A.电极a的电势高于电极b的电势
B.放电过程中正极区KOH溶液浓度保持不变
C.电极a上发生的电极反应式为C2H2+2H2O+2e-===C2H4+2OH-
D.电解足量CuSO4溶液,理论上消耗2.24 L(标准状况)C2H2时,生成6.4 g Cu
2.(2023·广东卷)用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是( )
A.电解总反应:KNO3+3H2O===NH3·H2O+2O2↑+KOH
B.每生成1 mol NH3·H2O,双极膜处有9 mol的H2O解离
C.电解过程中,阳极室中KOH的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
3.(2023·北京卷)回收利用工业废气中的CO2和SO2,实验原理示意图如下。
下列说法不正确的是( )
A.废气中SO2排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是HC的水解程度大于HC的电离程度
C.装置a中溶液的作用是吸收废气中的CO2和SO2
D.装置b中的总反应为S+CO2+H2OHCOOH+S
4.(2023·辽宁鞍山模拟)工业电解丙烯腈(CH2==CHCN)制己二腈[NC(CH2)4CN]的原理如图所示。相关说法正确的是( )
A.乙室电极反应:2H2O-4e-===O2↑+4H+
B.该生产过程离子交换膜为阴离子交换膜
C.甲室碳棒为阳极,工作温度较高电极会有损失
D.生产中若收集44.8 L气体,转移电子8 mol
5.(2023·天津九校联考)铜基配合物电催化还原CO2的装置原理如图所示,下列说法不正确的是( )
A.石墨烯为阳极,发生电极反应为CO2+2e-+2H+===HCOOH
B.Pt电极附近溶液的pH减小
C.每转移2 mol电子,阳极室、阴极室溶液质量变化量的差值为28 g
D.该装置可减少CO2在大气中累积和实现可再生能源有效利用
常考点7 膜在电化学中的应用
1.B 由图可知锌板为负极,所以电极a的电势高于电极b的电势,A正确;放电过程中正极区消耗水,导致KOH溶液浓度增大,B错误;电极a上发生的电极反应式为C2H2+2H2O+2e-===C2H4+2OH-,C正确;电解硫酸铜时,生成铜的电极反应为Cu2++2e-===Cu,理论上消耗2.24 L C2H2(标准状况),即0.1 mol,对应电子转移0.2 mol,可生成铜6.4 g,D正确。
2.B 由信息大电流催化电解KNO3溶液制氨可知,在电极a处KNO3放电生成NH3,发生还原反应,故电极a为阴极,电极反应为N+8e-+7H2O===NH3·H2O+9OH-,电极b为阳极,电极反应为4OH--4e-===O2↑+2H2O,“卯榫”结构的双极膜中的H+移向电极a,OH-移向电极b。由分析中阴阳极电极反应可知,电解总反应为KNO3+3H2O===NH3·H2O+2O2↑+KOH,故A正确;每生成1 mol NH3·H2O,阴极得8 mol e-,同时双极膜处有8 mol H+进入阴极室,即有8 mol的H2O解离,故B错误;电解过程中,阳极室每消耗4 mol OH-,同时有4 mol OH-通过双极膜进入阳极室,KOH的物质的量不因反应而改变,故C正确;相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于H2O被催化解离成H+和OH-,可提高氨生成速率,故D正确。
3.C SO2是酸性氧化物,废气中SO2排放到空气中会形成硫酸型酸雨,A正确;装置a中溶液的溶质为NaHCO3,溶液显碱性,说明HC的水解程度大于电离程度,B正确;装置a中NaHCO3溶液的作用是吸收SO2气体,CO2与NaHCO3溶液不反应,不能吸收CO2,C错误;由示意图可知,装置b中总反应为S+CO2+H2OHCOOH+S,D正确。
4.A 该装置为电解池装置,依据装置图,乙室中有氧气产生,该电极为阳极,碳棒为阴极。乙室中有氧气产生,电极反应为2H2O-4e-===O2↑+4H+,A正确;丙烯腈转化成己二腈,其电极反应式为2CH2==CHCN+2H++2e-===NC(CH2)4CN,根据电解原理,H+由乙室向甲室移动,因此离子交换膜为质子交换膜,B错误;根据上述分析,碳棒为阴极,C错误;题中没有指明是否为标准状况,不能直接运用22.4 L·mol-1进行计算,D错误。
5.A CO2在石墨烯上发生还原反应,所以石墨烯为阴极,A错误。Pt电极上电极反应为2H2O-4e-===4H++O2↑,所以电极附近溶液的pH减小,B正确。每转移2 mol电子,由阴极电极反应式可知生成1 mol HCOOH,质量增加46 g;根据阳极室反应可知每转移2 mol电子阳极消耗1 mol水,生成0.5 mol氧气,同时有2 mol H+转移至阴极室,阳极质量减少18 g,46 g-18 g=28 g,C正确。该装置可减少CO2在大气中累积和实现可再生能源有效利用,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
