2025浙江专版新教材化学高考第一轮基础练--非选择题增分练(三) 化学反应原理(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--非选择题增分练(三) 化学反应原理(含答案) | 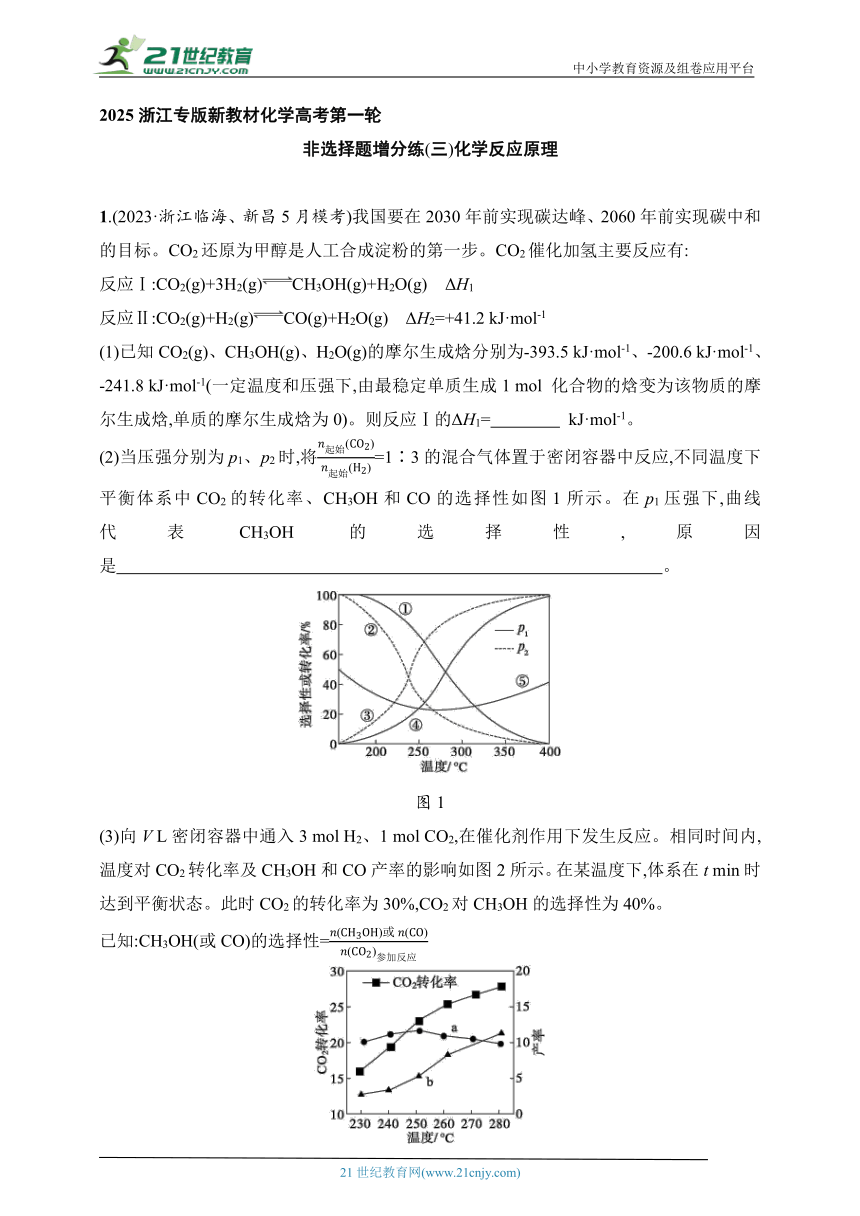 | |
| 格式 | docx | ||
| 文件大小 | 670.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:08:10 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
非选择题增分练(三)化学反应原理
1.(2023·浙江临海、新昌5月模考)我国要在2030年前实现碳达峰、2060年前实现碳中和的目标。CO2还原为甲醇是人工合成淀粉的第一步。CO2催化加氢主要反应有:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-393.5 kJ·mol-1、-200.6 kJ·mol-1、-241.8 kJ·mol-1(一定温度和压强下,由最稳定单质生成1 mol 化合物的焓变为该物质的摩尔生成焓,单质的摩尔生成焓为0)。则反应Ⅰ的ΔH1= kJ·mol-1。
(2)当压强分别为p1、p2时,将=1∶3的混合气体置于密闭容器中反应,不同温度下平衡体系中CO2的转化率、CH3OH和CO的选择性如图1所示。在p1压强下,曲线 代表CH3OH的选择性,原因是 。
图1
(3)向V L密闭容器中通入3 mol H2、1 mol CO2,在催化剂作用下发生反应。相同时间内,温度对CO2转化率及CH3OH和CO产率的影响如图2所示。在某温度下,体系在t min时达到平衡状态。此时CO2的转化率为30%,CO2对CH3OH的选择性为40%。
已知:CH3OH(或CO)的选择性=
图2
下列说法正确的是 (填字母)。
A.CO2的转化率随温度升高而增大的原因可能是温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应Ⅱ为主,CO2转化率增大
B.反应Ⅱ的平衡常数为0.031
C.0~t min内H2的反应速率为 mol·L-1·min-1
D.曲线b表示CH3OH的产率
(4)Cu/ZnO纳米片可以提高对CH3OH的选择性,图3为合成CH3OH在无催化剂时,CH3OH的物质的量与时间的关系,请在图3中画出CH3OH在Cu/ZnO纳米片存在下,CH3OH物质的量的变化曲线。
图3
2.(2023·浙江宁波镇海中学5月模考)利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
(1)已知一定条件下反应R1、R2、R3的焓变分别为ΔH1、ΔH2、ΔH3,则反应R4的焓变ΔH4= (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
图甲
①下列说法不正确的是 (填字母)。
A.上述四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成MTLs
D.由图甲可知,500 K前,曲线a对应的反应速率最大
②若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,则表示反应R2的平衡常数随温度变化的曲线为 。
(3)某温度下,将一定量的1-MN投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
图乙
图丙
①请解释1-MTL的物质的量随时间呈现先上升后下降的原因 ;
②若1-MTL(g) ===5-MTL(g) ΔH<0,请在图丙绘制反应R1、R3的“能量-反应过程”示意图。
3.(2023·浙江重点中学培优6月考试)工业上,以C3H8为原料,通过不同反应生产更高价值的C3H6。
Ⅰ.C3H8直接分解生产C3H6:
反应①:C3H8(g)C3H6(g)+H2(g) ΔH1=+124 kJ·mol-1
反应②:C3H8(g)3C(s)+4H2(g) ΔH2
请回答:
(1)恒温下,往恒容(10 L)反应釜中通入4 mol C3H8(g)(仅考虑发生上述反应)。某时刻C3H8转化率为20%,C3H6选择性为40%,则该时刻反应①的浓度商Qc= 。
(2)下列说法正确的是 (填字母,下同)。
A.反应①能自发进行的条件是低温
B.温度升高,反应②的平衡常数增大
C.压强增大,活化分子百分数增多,导致反应①速率加快
D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态
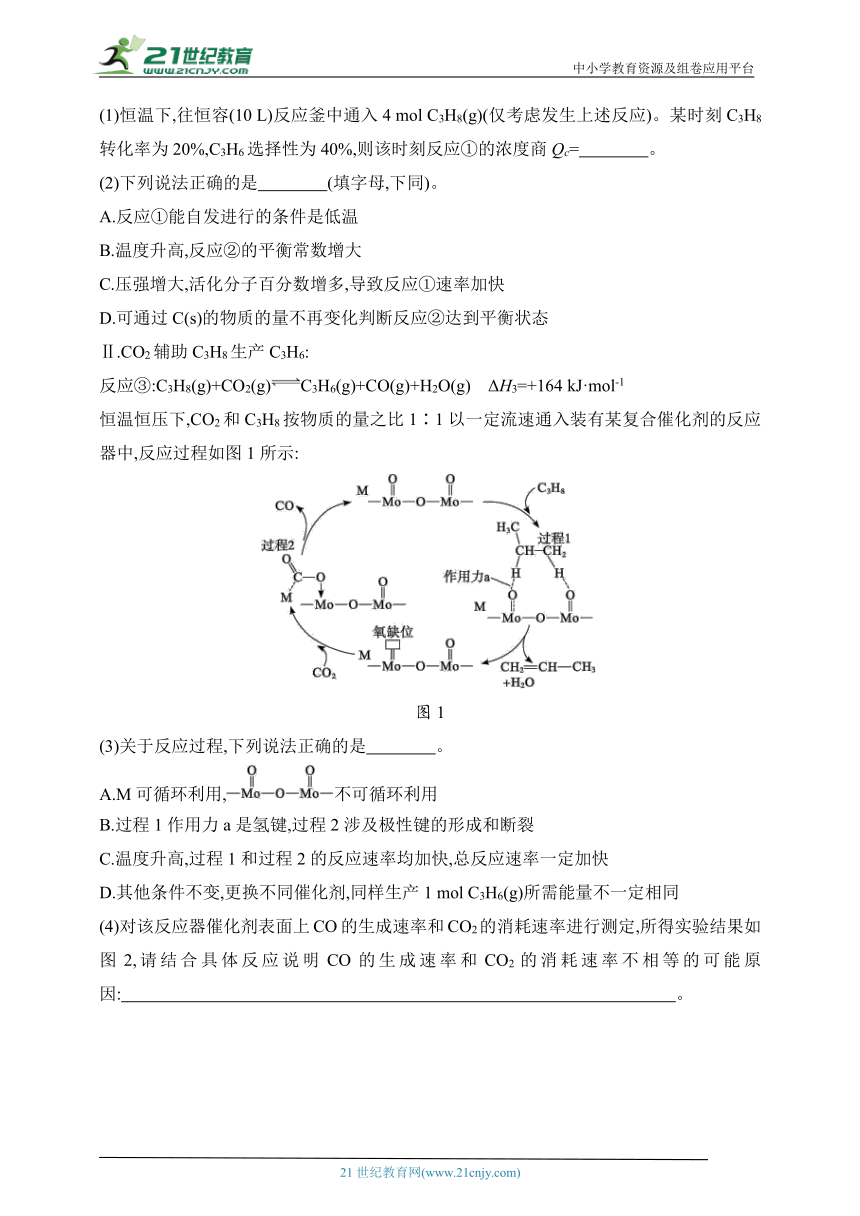
Ⅱ.CO2辅助C3H8生产C3H6:
反应③:C3H8(g)+CO2(g)C3H6(g)+CO(g)+H2O(g) ΔH3=+164 kJ·mol-1
恒温恒压下,CO2和C3H8按物质的量之比1∶1以一定流速通入装有某复合催化剂的反应器中,反应过程如图1所示:
图1
(3)关于反应过程,下列说法正确的是 。
A.M可循环利用,不可循环利用
B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂
C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快
D.其他条件不变,更换不同催化剂,同样生产1 mol C3H6(g)所需能量不一定相同
(4)对该反应器催化剂表面上CO的生成速率和CO2的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和CO2的消耗速率不相等的可能原因: 。
催化剂上CO2的消耗速率(m)和CO的
生成速率(A)随反应时间变化的曲线
图2
4.(2023·浙江温州高三三模)某些有机物在氧载体Fe2O3的作用下部分氧化,反应混合气可制备合成气(CO、H2)。反应体系中主要反应有:
反应ⅰ CO(g)+3H2(g)CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1
反应ⅱ CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1
反应ⅲ CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1
反应ⅳ CO2(g)+H2(g)CO(g)+H2O(g) ΔH4
请回答:
(1)H表示25 ℃、101 kPa下的焓。则H(CO2)+H(H2) (填“大于”“小于”或“等于”)H(H2O)+H(CO)。
(2)①反应ⅲ的平衡常数Kx(ⅲ)=[x(B)表示组分B平衡时的物质的量分数]。其他条件不变,会导致反应ⅲ的Kx减小的条件是 (填字母)。
A.升温 B.降温
C.加压 D.减压
E.恒容容器中再通入一定量H2(g)
②T ℃下,测定上述所有反应达平衡时的体系中,反应ⅳ的平衡常数Kx(ⅳ)=1.00,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,忽略其他反应。则反应ⅲ的平衡常数Kx(ⅲ)= (用含a、b的最简式子表示)。
(3)恒压多组分混合气体的平衡体系中,气体组分的物质的量分数与温度的关系如图所示,用虚线划分为Ⅰ、Ⅱ、Ⅲ三个平衡区域,可推断出合成气的最佳形成条件。
①下列说法正确的是 (填字母)。
A.平衡区域Ⅰ显示,CO2被还原的反应为放热反应
B.平衡区域Ⅰ,CH4的物质的量分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生
C.平衡区域Ⅱ,H2O的物质的量分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ
D.平衡区域Ⅰ与平衡区域Ⅱ,CO2参与了不同的反应
②平衡区域Ⅲ,基于上述的主要反应,趋近于1的可能原因是 。
(4)通过测定固体中,可判断氧载体Fe2O3参与有机物氧化的主要反应及原理。证据显示,氧载体Fe2O3参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。
温度/℃ 200 400 600 1 000
6.25 3.26 2.58 ∞
依据表格中的数据,在图中画出200~1 000 ℃之间的FeO的物质的量分数(%)变化趋势,并标注起点值:
5.(2023·浙江十校10月联考)工业合成氨原理:N2(g)+3H2(g)2NH3(g) ΔH<0。
(1)下列关于合成氨的说法正确的是 (填字母)。
A.合成氨是目前自然固氮最重要的途径
B.合成氨反应的ΔH与温度有关,而ΔS与温度无关
C.合成氨反应常采用400~500 ℃是综合考虑了反应速率与平衡产率的矛盾
D.将原料气加压至10 MPa~30 MPa,是为了保证尽可能高的平衡转化率和快的反应速率
E.合成氨生产过程中将NH3液化分离,是为了加快正反应速率,提高N2、H2的转化率
(2)已知某温度下合成氨反应达平衡时各物质均为a mol,容器容积为V L,保持温度和压强不变,又充入3a mol N2后,平衡 (填“向左”“向右”或“不”)移动。
(3)p1压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
①N2的体积分数随温度升高先减小后增大的原因是
。
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出p2压强下(p2>p1)N2的体积分数与温度(T)的关系趋势图。
(4)LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2===Li2NH+LiNH2,用一个化学方程式表示H2被吸附发生的反应: 。
非选择题增分练(三) 化学反应原理
1.答案 (1)-48.9
(2)① 反应Ⅰ是生成CH3OH的反应,该反应是放热反应,温度越高,平衡逆向移动,CH3OH的选择性越低 (3)AB
(4)
解析 (1)已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-393.5 kJ·mol-1、-200.6 kJ·mol-1、-241.8 kJ·mol-1,单质的摩尔生成焓为0,ΔH=生成物的生成焓-反应物的生成焓,反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的ΔH1=-200.6 kJ·mol-1+(-241.8 kJ·mol-1)-[0+(-393.5 kJ·mol-1)]=-48.9 kJ·mol-1。(2)反应Ⅰ是生成CH3OH的反应,该反应是放热反应,温度升高,平衡逆向移动,CH3OH的选择性越低,反应Ⅱ是生成CO的反应,该反应是吸热反应,温度升高,平衡正向移动,则CO的选择性越高,因此①、②表示CH3OH的选择性,图中实线①表示p1压强下CH3OH的选择性,虚线②表示p2压强下CH3OH的选择性,③表示p2压强下CO的选择性,④表示p1压强下CO的选择性,⑤为CO2的平衡转化率曲线。(3)反应Ⅰ是放热反应,温度升高,平衡逆向移动,CO2转化率降低,反应Ⅱ是吸热反应,温度升高,平衡正向移动,CO2转化率增大。图中显示随温度升高,CO2的转化率增大,其原因可能是温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应Ⅱ为主,导致CO2转化率增大,A正确;由题目信息可知,转化的CO2为1 mol×30%=0.3 mol,反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g),生成CH3OH为0.3 mol×40%=0.12 mol,消耗CO2 0.12 mol,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g),消耗CO2 0.18 mol生成CO 0.18 mol,所以达平衡时CO2:(1-0.3) mol=0.7 mol,CO:0.18 mol,H2O:0.12 mol+0.18 mol=0.3 mol,H2:3 mol-0.18 mol-3×0.12 mol=2.46 mol,反应Ⅱ的平衡常数K==0.031,B正确;由选项B分析可知:达平衡时H2转化0.18 mol+3×0.12 mol=0.54 mol,则0~t min内H2的反应速率为 mol·L-1·min-1,C错误;反应Ⅰ为放热反应,升高温度,平衡向逆反应方向移动,二氧化碳的转化率减小,甲醇的产率减小,反应Ⅱ为吸热反应,升高温度,二氧化碳的转化率增大,一氧化碳的产率增大,所以表示甲醇产率随温度变化的曲线是a,表示一氧化碳产率随温度变化的曲线是b,D错误。
(4)在Cu/ZnO纳米片存在下,反应速率加快,达平衡时间变短,Cu/ZnO纳米片可以提高对CH3OH的选择性,平衡时CH3OH物质的量增多。
2.答案 (1)ΔH1+ΔH2-ΔH3 (2)①CD ②b
(3)①反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减小,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降
②
解析 (1)由盖斯定律可知,R1+R2=R3+R4,已知一定条件下反应R1、R2、R3的焓变分别为ΔH1、ΔH2、ΔH3,R4的焓变为ΔH4,则ΔH1+ΔH2=ΔH3+ΔH4,故反应R4的焓变ΔH4=ΔH1+ΔH2-ΔH3。
(2)①由图知,温度升高,上述四个反应的平衡常数都变小,则升温平衡左移,故四个反应均为放热反应,A正确;能量越低越稳定,结合A选项可知,1-MD的能量最低,则反应体系中1-MD最稳定,B正确;生成四氢萘类反应(MTLs,包括1-MTL和5-MTL)、生成十氢萘(1-MD)的反应均为气体分子总数减小的放热反应,则压强越大,温度越低越有利于生成十氢萘(1-MD),C不正确;由图甲可知,500 K前,曲线a对应的平衡常数最大,但平衡常数大时反应速率不一定也大,则不能判断曲线a对应的反应速率最大,D不正确。②由(1)可知R1+R2=R3+R4,则K1·K2=K3·K4,若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,>1,则表示反应R2的平衡常数随温度变化的曲线为b。
(3)①1-MTL的物质的量随时间呈现先上升后下降的原因:反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减小,相应地生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降。
②若1-MTL(g) ===5-MTL(g) ΔH<0,则1-MTL(g)的总能量大于5-MTL(g)的总能量,由图乙可知,1-MTL(g)的物质的量大于5-MTL(g)的物质的量,则1-MTL(g)的生成速率大于5-MTL(g)的生成速率,生成1-MTL(g)的活化能小于生成5-MTL(g)的活化能。
3.答案 (1)0.022 4 (2)BD (3)B
(4)依据反应③过程,CO的生成速率和CO2的消耗速率应相等,但还会发生反应②,有积碳生成,且CO2+C2CO
解析 (1)根据已知条件列出“三段式”
C3H8(g)C3H6(g)+H2(g)
起始/mol 4 0 0
转化/mol x x x
平衡/mol 4-x x x C3H8(g)3C(s)+4H2(g)
起始/mol 4-x 0 x
转化/mol y 3y 4y
平衡/mol 4-x-y 3y x+4y
某时刻C3H8转化率为20%,C3H6选择性为40%,则=0.2,=0.4,解得x=0.32,y=0.48,则该时刻反应①的浓度商Qc==0.022 4。
(2)反应①是吸热的熵增的反应,自发进行的条件是高温,故A错误;反应②C3H8分解生产C和H2的反应是吸热反应,升高温度,平衡正向移动,平衡常数增大,故B正确;增大压强,活化分子数不一定增多,所以反应速率不一定加快,如恒温恒容条件下加入惰性气体,体系压强增大但反应物浓度不变,反应速率不变,故C错误;C(s)的物质的量不再变化,说明反应②的正逆反应速率相等,反应达到平衡,故D正确。
(3)由图可知,M和在过程1中被消耗,在过程2中又生成,二者都可循环利用,A错误;过程1作用力a是H原子和O原子之间形成的氢键,过程2涉及极性键的形成(H—O)和断裂(C—H),B正确;温度升高,可能导致催化剂活性降低,总反应速率不一定加快,C错误;催化剂不改变反应热,其他条件不变,更换不同催化剂,同样生产1 mol C3H6(g)所需能量相同,D错误。
(4)依据反应③过程,CO的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO。
4.答案 (1)小于 (2)①BCE ②
(3)①CD ②平衡区域Ⅲ温度较高,反应ⅲ吸热,正向反应程度最大,为主要影响的反应,趋近于1
(4)
解析 (1)由盖斯定律可知,反应ⅱ-反应ⅰ可以得到CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=ΔH2-ΔH1=-164.7 kJ·mol-1+205.9 kJ·mol-1=+41.2 kJ·mol-1,该反应是吸热反应,则H(CO2)+H(H2)小于H(H2O)+H(CO)。
(2)①反应ⅲCH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1是气体体积增大的吸热反应,平衡常数Kx(ⅲ)=,则升高温度,加压、恒容容器中再通入一定量H2(g)都可以使平衡正向移动,Kx(ⅲ)=减小,故选BCE。
②T ℃下,测定上述所有反应达平衡时的体系中,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,反应ⅳ的平衡常数Kx(ⅳ)=1.00,则=1.00,x(CO)=a,x(CO2)=x(H2O)=,Kx(ⅲ)=。
(3)①平衡区域Ⅰ显示,温度升高,CO2的物质的量分数减小,说明平衡正向移动,则CO2被还原的反应为吸热反应,故A错误;平衡区域Ⅰ,随着温度升高,反应ⅲ、ⅳ正向移动,消耗CH4、生成CO,CO物质的量的增多使反应ⅰ正向移动,生成CH4,两种移动使得CH4的物质的量分数基本保持不变,故B错误;反应ⅳ是吸热反应,平衡区域Ⅱ,H2O的物质的量分数先增大的同时CO的物质的量分数增大,CH4的物质的量分数减小,可能的原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ,故C正确;平衡区域Ⅰ显示CH4的物质的量分数基本不变,CO2参与反应ⅱ和ⅲ,平衡区域Ⅱ,H2O的物质的量分数先增大,CO2主要参与反应ⅳ,故D正确。②平衡区域Ⅲ,基于上述的主要反应,趋近于1的可能原因:平衡区域Ⅲ温度较高,反应ⅲ吸热,正向反应程度最大,为影响的主要反应。
(4)氧载体Fe2O3参与反应后的铁氧固体混合物中只存在FeO一种氧化物,200 ℃时,=6.25=,则铁氧固体混合物可以表示为4FeO·21Fe,FeO的物质的量分数为×100%=16%,同理600 ℃时,FeO的物质的量分数为44.4%,1 000 ℃时趋近于无穷大,FeO的物质的量分数趋近于0,依此结果画图。
5.答案 (1)CD (2)不
(3)①T0之前未平衡,随温度升高反应速率加快,N2的体积分数减小;T0之后达到平衡状态,温度升高平衡逆向移动,N2的体积分数增大 ②
(4)Li2NH+LiNH2+3H2===3LiH+2NH3
解析 (1)合成氨用于工业生产,是目前人工固氮最重要的途径,A不正确;合成氨反应的ΔH、ΔS都与温度有关,但受温度的影响不大,B不正确;400~500 ℃是合成氨反应催化剂的活性温度,同时反应速率比较快,此温度的选择是综合考虑了反应速率与平衡产率的矛盾,C正确;合成氨反应的反应物气体分子数大于生成物气体分子数,将原料气加压至10 MPa~30 MPa,有利于提高原料气的平衡转化率,同时加快反应速率,D正确;合成氨生产过程中将NH3液化分离,是为了提高N2、H2的转化率,但不能加快正反应速率,E不正确。
(2)已知某温度下合成氨反应达平衡时各物质均为a mol,容器容积为V L,此时平衡常数K=;保持温度和压强不变,又充入3a mol N2后,则气体的体积变为2V L,此时浓度商Q==K,所以平衡不移动。
(3)①N2的体积分数随温度升高先减小后增大,原因:T0之前未平衡,随温度升高反应速率加快,N2的体积分数减小;T0之后达到平衡状态,温度升高平衡逆向移动,N2的体积分数增大。②因为p2>p1,所以相同温度下φ(N2):p2(4)LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2===Li2NH+LiNH2,则H2被吸附时,H2与N2被吸附时的产物发生反应又将生成LiH,反应方程式为Li2NH+LiNH2+3H2===3LiH+2NH3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
非选择题增分练(三)化学反应原理
1.(2023·浙江临海、新昌5月模考)我国要在2030年前实现碳达峰、2060年前实现碳中和的目标。CO2还原为甲醇是人工合成淀粉的第一步。CO2催化加氢主要反应有:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-393.5 kJ·mol-1、-200.6 kJ·mol-1、-241.8 kJ·mol-1(一定温度和压强下,由最稳定单质生成1 mol 化合物的焓变为该物质的摩尔生成焓,单质的摩尔生成焓为0)。则反应Ⅰ的ΔH1= kJ·mol-1。
(2)当压强分别为p1、p2时,将=1∶3的混合气体置于密闭容器中反应,不同温度下平衡体系中CO2的转化率、CH3OH和CO的选择性如图1所示。在p1压强下,曲线 代表CH3OH的选择性,原因是 。
图1
(3)向V L密闭容器中通入3 mol H2、1 mol CO2,在催化剂作用下发生反应。相同时间内,温度对CO2转化率及CH3OH和CO产率的影响如图2所示。在某温度下,体系在t min时达到平衡状态。此时CO2的转化率为30%,CO2对CH3OH的选择性为40%。
已知:CH3OH(或CO)的选择性=
图2
下列说法正确的是 (填字母)。
A.CO2的转化率随温度升高而增大的原因可能是温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应Ⅱ为主,CO2转化率增大
B.反应Ⅱ的平衡常数为0.031
C.0~t min内H2的反应速率为 mol·L-1·min-1
D.曲线b表示CH3OH的产率
(4)Cu/ZnO纳米片可以提高对CH3OH的选择性,图3为合成CH3OH在无催化剂时,CH3OH的物质的量与时间的关系,请在图3中画出CH3OH在Cu/ZnO纳米片存在下,CH3OH物质的量的变化曲线。
图3
2.(2023·浙江宁波镇海中学5月模考)利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
(1)已知一定条件下反应R1、R2、R3的焓变分别为ΔH1、ΔH2、ΔH3,则反应R4的焓变ΔH4= (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
图甲
①下列说法不正确的是 (填字母)。
A.上述四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成MTLs
D.由图甲可知,500 K前,曲线a对应的反应速率最大
②若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,则表示反应R2的平衡常数随温度变化的曲线为 。
(3)某温度下,将一定量的1-MN投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
图乙
图丙
①请解释1-MTL的物质的量随时间呈现先上升后下降的原因 ;
②若1-MTL(g) ===5-MTL(g) ΔH<0,请在图丙绘制反应R1、R3的“能量-反应过程”示意图。
3.(2023·浙江重点中学培优6月考试)工业上,以C3H8为原料,通过不同反应生产更高价值的C3H6。
Ⅰ.C3H8直接分解生产C3H6:
反应①:C3H8(g)C3H6(g)+H2(g) ΔH1=+124 kJ·mol-1
反应②:C3H8(g)3C(s)+4H2(g) ΔH2
请回答:
(1)恒温下,往恒容(10 L)反应釜中通入4 mol C3H8(g)(仅考虑发生上述反应)。某时刻C3H8转化率为20%,C3H6选择性为40%,则该时刻反应①的浓度商Qc= 。
(2)下列说法正确的是 (填字母,下同)。
A.反应①能自发进行的条件是低温
B.温度升高,反应②的平衡常数增大
C.压强增大,活化分子百分数增多,导致反应①速率加快
D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态
Ⅱ.CO2辅助C3H8生产C3H6:
反应③:C3H8(g)+CO2(g)C3H6(g)+CO(g)+H2O(g) ΔH3=+164 kJ·mol-1
恒温恒压下,CO2和C3H8按物质的量之比1∶1以一定流速通入装有某复合催化剂的反应器中,反应过程如图1所示:
图1
(3)关于反应过程,下列说法正确的是 。
A.M可循环利用,不可循环利用
B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂
C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快
D.其他条件不变,更换不同催化剂,同样生产1 mol C3H6(g)所需能量不一定相同
(4)对该反应器催化剂表面上CO的生成速率和CO2的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和CO2的消耗速率不相等的可能原因: 。
催化剂上CO2的消耗速率(m)和CO的
生成速率(A)随反应时间变化的曲线
图2
4.(2023·浙江温州高三三模)某些有机物在氧载体Fe2O3的作用下部分氧化,反应混合气可制备合成气(CO、H2)。反应体系中主要反应有:
反应ⅰ CO(g)+3H2(g)CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1
反应ⅱ CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1
反应ⅲ CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1
反应ⅳ CO2(g)+H2(g)CO(g)+H2O(g) ΔH4
请回答:
(1)H表示25 ℃、101 kPa下的焓。则H(CO2)+H(H2) (填“大于”“小于”或“等于”)H(H2O)+H(CO)。
(2)①反应ⅲ的平衡常数Kx(ⅲ)=[x(B)表示组分B平衡时的物质的量分数]。其他条件不变,会导致反应ⅲ的Kx减小的条件是 (填字母)。
A.升温 B.降温
C.加压 D.减压
E.恒容容器中再通入一定量H2(g)
②T ℃下,测定上述所有反应达平衡时的体系中,反应ⅳ的平衡常数Kx(ⅳ)=1.00,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,忽略其他反应。则反应ⅲ的平衡常数Kx(ⅲ)= (用含a、b的最简式子表示)。
(3)恒压多组分混合气体的平衡体系中,气体组分的物质的量分数与温度的关系如图所示,用虚线划分为Ⅰ、Ⅱ、Ⅲ三个平衡区域,可推断出合成气的最佳形成条件。
①下列说法正确的是 (填字母)。
A.平衡区域Ⅰ显示,CO2被还原的反应为放热反应
B.平衡区域Ⅰ,CH4的物质的量分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生
C.平衡区域Ⅱ,H2O的物质的量分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ
D.平衡区域Ⅰ与平衡区域Ⅱ,CO2参与了不同的反应
②平衡区域Ⅲ,基于上述的主要反应,趋近于1的可能原因是 。
(4)通过测定固体中,可判断氧载体Fe2O3参与有机物氧化的主要反应及原理。证据显示,氧载体Fe2O3参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。
温度/℃ 200 400 600 1 000
6.25 3.26 2.58 ∞
依据表格中的数据,在图中画出200~1 000 ℃之间的FeO的物质的量分数(%)变化趋势,并标注起点值:
5.(2023·浙江十校10月联考)工业合成氨原理:N2(g)+3H2(g)2NH3(g) ΔH<0。
(1)下列关于合成氨的说法正确的是 (填字母)。
A.合成氨是目前自然固氮最重要的途径
B.合成氨反应的ΔH与温度有关,而ΔS与温度无关
C.合成氨反应常采用400~500 ℃是综合考虑了反应速率与平衡产率的矛盾
D.将原料气加压至10 MPa~30 MPa,是为了保证尽可能高的平衡转化率和快的反应速率
E.合成氨生产过程中将NH3液化分离,是为了加快正反应速率,提高N2、H2的转化率
(2)已知某温度下合成氨反应达平衡时各物质均为a mol,容器容积为V L,保持温度和压强不变,又充入3a mol N2后,平衡 (填“向左”“向右”或“不”)移动。
(3)p1压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
①N2的体积分数随温度升高先减小后增大的原因是
。
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出p2压强下(p2>p1)N2的体积分数与温度(T)的关系趋势图。
(4)LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2===Li2NH+LiNH2,用一个化学方程式表示H2被吸附发生的反应: 。
非选择题增分练(三) 化学反应原理
1.答案 (1)-48.9
(2)① 反应Ⅰ是生成CH3OH的反应,该反应是放热反应,温度越高,平衡逆向移动,CH3OH的选择性越低 (3)AB
(4)
解析 (1)已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-393.5 kJ·mol-1、-200.6 kJ·mol-1、-241.8 kJ·mol-1,单质的摩尔生成焓为0,ΔH=生成物的生成焓-反应物的生成焓,反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的ΔH1=-200.6 kJ·mol-1+(-241.8 kJ·mol-1)-[0+(-393.5 kJ·mol-1)]=-48.9 kJ·mol-1。(2)反应Ⅰ是生成CH3OH的反应,该反应是放热反应,温度升高,平衡逆向移动,CH3OH的选择性越低,反应Ⅱ是生成CO的反应,该反应是吸热反应,温度升高,平衡正向移动,则CO的选择性越高,因此①、②表示CH3OH的选择性,图中实线①表示p1压强下CH3OH的选择性,虚线②表示p2压强下CH3OH的选择性,③表示p2压强下CO的选择性,④表示p1压强下CO的选择性,⑤为CO2的平衡转化率曲线。(3)反应Ⅰ是放热反应,温度升高,平衡逆向移动,CO2转化率降低,反应Ⅱ是吸热反应,温度升高,平衡正向移动,CO2转化率增大。图中显示随温度升高,CO2的转化率增大,其原因可能是温度升高,CO2的反应速率加快,反应Ⅱ为吸热反应,温度升高有利于反应正向进行且以反应Ⅱ为主,导致CO2转化率增大,A正确;由题目信息可知,转化的CO2为1 mol×30%=0.3 mol,反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g),生成CH3OH为0.3 mol×40%=0.12 mol,消耗CO2 0.12 mol,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g),消耗CO2 0.18 mol生成CO 0.18 mol,所以达平衡时CO2:(1-0.3) mol=0.7 mol,CO:0.18 mol,H2O:0.12 mol+0.18 mol=0.3 mol,H2:3 mol-0.18 mol-3×0.12 mol=2.46 mol,反应Ⅱ的平衡常数K==0.031,B正确;由选项B分析可知:达平衡时H2转化0.18 mol+3×0.12 mol=0.54 mol,则0~t min内H2的反应速率为 mol·L-1·min-1,C错误;反应Ⅰ为放热反应,升高温度,平衡向逆反应方向移动,二氧化碳的转化率减小,甲醇的产率减小,反应Ⅱ为吸热反应,升高温度,二氧化碳的转化率增大,一氧化碳的产率增大,所以表示甲醇产率随温度变化的曲线是a,表示一氧化碳产率随温度变化的曲线是b,D错误。
(4)在Cu/ZnO纳米片存在下,反应速率加快,达平衡时间变短,Cu/ZnO纳米片可以提高对CH3OH的选择性,平衡时CH3OH物质的量增多。
2.答案 (1)ΔH1+ΔH2-ΔH3 (2)①CD ②b
(3)①反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减小,相应地使生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降
②
解析 (1)由盖斯定律可知,R1+R2=R3+R4,已知一定条件下反应R1、R2、R3的焓变分别为ΔH1、ΔH2、ΔH3,R4的焓变为ΔH4,则ΔH1+ΔH2=ΔH3+ΔH4,故反应R4的焓变ΔH4=ΔH1+ΔH2-ΔH3。
(2)①由图知,温度升高,上述四个反应的平衡常数都变小,则升温平衡左移,故四个反应均为放热反应,A正确;能量越低越稳定,结合A选项可知,1-MD的能量最低,则反应体系中1-MD最稳定,B正确;生成四氢萘类反应(MTLs,包括1-MTL和5-MTL)、生成十氢萘(1-MD)的反应均为气体分子总数减小的放热反应,则压强越大,温度越低越有利于生成十氢萘(1-MD),C不正确;由图甲可知,500 K前,曲线a对应的平衡常数最大,但平衡常数大时反应速率不一定也大,则不能判断曲线a对应的反应速率最大,D不正确。②由(1)可知R1+R2=R3+R4,则K1·K2=K3·K4,若曲线c、d分别代表反应R1、R3的平衡常数随温度的变化,>1,则表示反应R2的平衡常数随温度变化的曲线为b。
(3)①1-MTL的物质的量随时间呈现先上升后下降的原因:反应前期,反应1-MN的浓度较大,生成1-MTL的速率较快,1-MTL的物质的量不断增加。但是随着反应进行,1-MN的浓度逐渐减小,相应地生成1-MTL的速率减慢,进一步生成1-MD的速率不断加快,使1-MTL大量消耗,1-MTL的物质的量下降。
②若1-MTL(g) ===5-MTL(g) ΔH<0,则1-MTL(g)的总能量大于5-MTL(g)的总能量,由图乙可知,1-MTL(g)的物质的量大于5-MTL(g)的物质的量,则1-MTL(g)的生成速率大于5-MTL(g)的生成速率,生成1-MTL(g)的活化能小于生成5-MTL(g)的活化能。
3.答案 (1)0.022 4 (2)BD (3)B
(4)依据反应③过程,CO的生成速率和CO2的消耗速率应相等,但还会发生反应②,有积碳生成,且CO2+C2CO
解析 (1)根据已知条件列出“三段式”
C3H8(g)C3H6(g)+H2(g)
起始/mol 4 0 0
转化/mol x x x
平衡/mol 4-x x x C3H8(g)3C(s)+4H2(g)
起始/mol 4-x 0 x
转化/mol y 3y 4y
平衡/mol 4-x-y 3y x+4y
某时刻C3H8转化率为20%,C3H6选择性为40%,则=0.2,=0.4,解得x=0.32,y=0.48,则该时刻反应①的浓度商Qc==0.022 4。
(2)反应①是吸热的熵增的反应,自发进行的条件是高温,故A错误;反应②C3H8分解生产C和H2的反应是吸热反应,升高温度,平衡正向移动,平衡常数增大,故B正确;增大压强,活化分子数不一定增多,所以反应速率不一定加快,如恒温恒容条件下加入惰性气体,体系压强增大但反应物浓度不变,反应速率不变,故C错误;C(s)的物质的量不再变化,说明反应②的正逆反应速率相等,反应达到平衡,故D正确。
(3)由图可知,M和在过程1中被消耗,在过程2中又生成,二者都可循环利用,A错误;过程1作用力a是H原子和O原子之间形成的氢键,过程2涉及极性键的形成(H—O)和断裂(C—H),B正确;温度升高,可能导致催化剂活性降低,总反应速率不一定加快,C错误;催化剂不改变反应热,其他条件不变,更换不同催化剂,同样生产1 mol C3H6(g)所需能量相同,D错误。
(4)依据反应③过程,CO的生成速率和CO2的消耗速率应相等,但还会发生反应②有积碳生成,且CO2+C2CO。
4.答案 (1)小于 (2)①BCE ②
(3)①CD ②平衡区域Ⅲ温度较高,反应ⅲ吸热,正向反应程度最大,为主要影响的反应,趋近于1
(4)
解析 (1)由盖斯定律可知,反应ⅱ-反应ⅰ可以得到CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=ΔH2-ΔH1=-164.7 kJ·mol-1+205.9 kJ·mol-1=+41.2 kJ·mol-1,该反应是吸热反应,则H(CO2)+H(H2)小于H(H2O)+H(CO)。
(2)①反应ⅲCH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1是气体体积增大的吸热反应,平衡常数Kx(ⅲ)=,则升高温度,加压、恒容容器中再通入一定量H2(g)都可以使平衡正向移动,Kx(ⅲ)=减小,故选BCE。
②T ℃下,测定上述所有反应达平衡时的体系中,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,反应ⅳ的平衡常数Kx(ⅳ)=1.00,则=1.00,x(CO)=a,x(CO2)=x(H2O)=,Kx(ⅲ)=。
(3)①平衡区域Ⅰ显示,温度升高,CO2的物质的量分数减小,说明平衡正向移动,则CO2被还原的反应为吸热反应,故A错误;平衡区域Ⅰ,随着温度升高,反应ⅲ、ⅳ正向移动,消耗CH4、生成CO,CO物质的量的增多使反应ⅰ正向移动,生成CH4,两种移动使得CH4的物质的量分数基本保持不变,故B错误;反应ⅳ是吸热反应,平衡区域Ⅱ,H2O的物质的量分数先增大的同时CO的物质的量分数增大,CH4的物质的量分数减小,可能的原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ,故C正确;平衡区域Ⅰ显示CH4的物质的量分数基本不变,CO2参与反应ⅱ和ⅲ,平衡区域Ⅱ,H2O的物质的量分数先增大,CO2主要参与反应ⅳ,故D正确。②平衡区域Ⅲ,基于上述的主要反应,趋近于1的可能原因:平衡区域Ⅲ温度较高,反应ⅲ吸热,正向反应程度最大,为影响的主要反应。
(4)氧载体Fe2O3参与反应后的铁氧固体混合物中只存在FeO一种氧化物,200 ℃时,=6.25=,则铁氧固体混合物可以表示为4FeO·21Fe,FeO的物质的量分数为×100%=16%,同理600 ℃时,FeO的物质的量分数为44.4%,1 000 ℃时趋近于无穷大,FeO的物质的量分数趋近于0,依此结果画图。
5.答案 (1)CD (2)不
(3)①T0之前未平衡,随温度升高反应速率加快,N2的体积分数减小;T0之后达到平衡状态,温度升高平衡逆向移动,N2的体积分数增大 ②
(4)Li2NH+LiNH2+3H2===3LiH+2NH3
解析 (1)合成氨用于工业生产,是目前人工固氮最重要的途径,A不正确;合成氨反应的ΔH、ΔS都与温度有关,但受温度的影响不大,B不正确;400~500 ℃是合成氨反应催化剂的活性温度,同时反应速率比较快,此温度的选择是综合考虑了反应速率与平衡产率的矛盾,C正确;合成氨反应的反应物气体分子数大于生成物气体分子数,将原料气加压至10 MPa~30 MPa,有利于提高原料气的平衡转化率,同时加快反应速率,D正确;合成氨生产过程中将NH3液化分离,是为了提高N2、H2的转化率,但不能加快正反应速率,E不正确。
(2)已知某温度下合成氨反应达平衡时各物质均为a mol,容器容积为V L,此时平衡常数K=;保持温度和压强不变,又充入3a mol N2后,则气体的体积变为2V L,此时浓度商Q==K,所以平衡不移动。
(3)①N2的体积分数随温度升高先减小后增大,原因:T0之前未平衡,随温度升高反应速率加快,N2的体积分数减小;T0之后达到平衡状态,温度升高平衡逆向移动,N2的体积分数增大。②因为p2>p1,所以相同温度下φ(N2):p2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
