2025浙江专版新教材化学高考第一轮基础练--非选择题增分练(四) 综合实验(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--非选择题增分练(四) 综合实验(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 451.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:08:49 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
非选择题增分练(四)综合实验
1.连二亚硫酸钠(Na2S2O4)俗称保险粉,是印染工业中常用的漂白剂。具有以下性质:
Ⅰ.易溶于水且随温度升高溶解度增大,难溶于酒精;
Ⅱ.酸性条件下易分解、碱性条件下稳定,固态时Na2S2O4相对Na2S2O4·2H2O较稳定;
Ⅲ.水溶液中低于52 ℃以Na2S2O4·2H2O形态结晶,碱性溶液中高于52 ℃脱水成无水盐。
工业中经典的制取方法是以SO2、Zn、NaOH为原料,主要反应及实验室模拟流程如下:SO2+H2O===H2SO3;Zn+2H2SO3===ZnS2O4+2H2O;ZnS2O4+2NaOH===Na2S2O4+Zn(OH)2↓
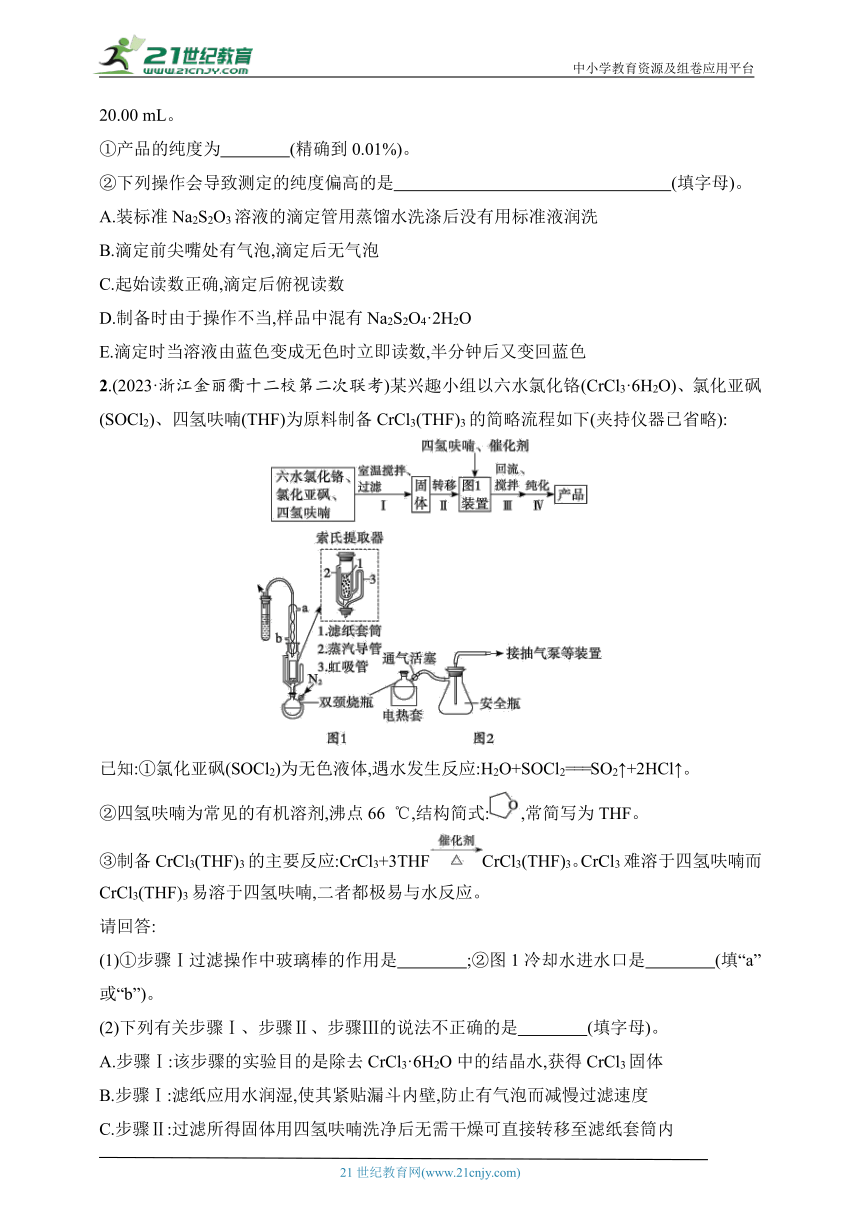
(1)步骤①的反应装置如图。
制备SO2选用的最佳试剂组合为 (填字母)。
A.70%硫酸+Na2SO3固体
B.10%硫酸+Na2SO3固体
C.70%硫酸+饱和Na2SO3溶液
D.稀硝酸+饱和NaHSO3溶液
虚线方框内仪器的作用是 。反应控制在35~45 ℃的原因是 。
(2)步骤②加过量NaOH溶液的作用除了使ZnS2O4充分生成Na2S2O4外,还有一个作用是 。
(3)产品纯度测定。取1.280 0 g产品与足量甲醛水溶液混合于锥形瓶中,生成甲醛亚硫酸氢钠与甲醛次硫酸氢钠:H2O+Na2S2O4+2CH2O===NaHSO3·CH2O+NaHSO2·CH2O,在所得的混合溶液中加入3.810 0 g I2、轻轻振荡,发生反应:2I2+NaHSO2·CH2O+2H2O===NaHSO4+CH2O+4HI。过量的I2以淀粉为指示剂,用0.100 0 mol·L-1的标准Na2S2O3溶液滴定:I2+2Na2S2O3===Na2S4O6+2NaI。消耗标准Na2S2O3溶液20.00 mL。
①产品的纯度为 (精确到0.01%)。
②下列操作会导致测定的纯度偏高的是 (填字母)。
A.装标准Na2S2O3溶液的滴定管用蒸馏水洗涤后没有用标准液润洗
B.滴定前尖嘴处有气泡,滴定后无气泡
C.起始读数正确,滴定后俯视读数
D.制备时由于操作不当,样品中混有Na2S2O4·2H2O
E.滴定时当溶液由蓝色变成无色时立即读数,半分钟后又变回蓝色
2.(2023·浙江金丽衢十二校第二次联考)某兴趣小组以六水氯化铬(CrCl3·6H2O)、氯化亚砜(SOCl2)、四氢呋喃(THF)为原料制备CrCl3(THF)3的简略流程如下(夹持仪器已省略):
已知:①氯化亚砜(SOCl2)为无色液体,遇水发生反应:H2O+SOCl2===SO2↑+2HCl↑。
②四氢呋喃为常见的有机溶剂,沸点66 ℃,结构简式:,常简写为THF。
③制备CrCl3(THF)3的主要反应:CrCl3+3THFCrCl3(THF)3。CrCl3难溶于四氢呋喃而CrCl3(THF)3易溶于四氢呋喃,二者都极易与水反应。
请回答:
(1)①步骤Ⅰ过滤操作中玻璃棒的作用是 ;②图1冷却水进水口是 (填“a”或“b”)。
(2)下列有关步骤Ⅰ、步骤Ⅱ、步骤Ⅲ的说法不正确的是 (填字母)。
A.步骤Ⅰ:该步骤的实验目的是除去CrCl3·6H2O中的结晶水,获得CrCl3固体
B.步骤Ⅰ:滤纸应用水润湿,使其紧贴漏斗内壁,防止有气泡而减慢过滤速度
C.步骤Ⅱ:过滤所得固体用四氢呋喃洗净后无需干燥可直接转移至滤纸套筒内
D.步骤Ⅲ:组装好图1装置,加入四氢呋喃后持续通入氮气,打开冷凝水,加热回流
(3)步骤Ⅲ:①双颈烧瓶中四氢呋喃除作为反应物外还有一个用途: 。
②本实验使用索氏提取器的优点: 。
(4)步骤Ⅳ:将装有粗产品的双颈烧瓶接到纯化装置(图2)上纯化,打开抽气泵,缓慢打开通气活塞,开启加热器,进行纯化。请给出纯化完成后的合理的操作排序:
纯化完成→( )→( )→( )→( )→f。
a.关闭抽气泵
b.关闭通气活塞
c.拔去橡皮管,打开通气活塞,充入氮气
d.待烧瓶冷却至室温,关闭加热器
e.关闭加热器,待烧瓶冷却至室温
f.放入干燥器中保存
(5)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是 (填字母)。
A.金属钠
B.无水硫酸铜
C.孔径大小与水分子大小相近的分子筛
D.浓硫酸
3.(2023·浙江杭州高三期中)某研究小组制备配合物顺式-二甘氨酸合铜[(H2NCH2COO)2Cu],结构简式为,流程如下:
CuSO4溶液深蓝色溶液Cu(OH)2收集滤液
冷却结晶产品
已知:Cu(OH)2与甘氨酸反应还可能生成反式-二甘氨酸合铜。
请回答:
(1)写出Cu(OH)2与甘氨酸反应的化学方程式: 。
(2)下列说法正确的是 (填字母)。
A.流程中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
B.步骤Ⅱ中,温度过高会导致产率降低
C.步骤Ⅲ中,趁热过滤的目的是除去Cu(OH)2同时减少产物的析出
D.步骤Ⅳ中,加入乙醇能增大溶剂极性,促进顺式-二甘氨酸合铜析出
(3)可用碘量法测定产品中Cu元素的含量,进而测定产品纯度,已知:
ⅰ.2Cu2++4I-===2CuI+I2
ⅱ.I2+2S2===2I-+S4
ⅲ.CuI固体能吸附溶液中的少量碘单质,
Ksp(CuSCN)实验流程如下(碘量瓶示意如图):
用分析天平称量产品x g→在烧杯中用水溶解,再加入适量硫酸→用容量瓶配制100 mL样品溶液→用移液管移取20.00 mL溶液到碘量瓶→加入过量KI固体→塞上碘量瓶的塞子、用少量水封→在暗处静置5分钟→打开塞子,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液→剧烈振荡碘量瓶→加入淀粉溶液→用标准Na2S2O3溶液滴定至终点,再取20.00 mL溶液进行一次平行实验。
①溶解时加入硫酸的作用是 。
②滴定终点的现象是 。
③若两次平行实验,平均消耗0.105 0 mol·L-1 Na2S2O3溶液20.00 mL,则x g产品中含Cu的质量为 g。
非选择题增分练(四) 综合实验
1.答案 (1)A 防止倒吸 若温度过高则SO2溶解度低,浪费多;若温度过低,反应速率太慢
(2)使溶液处于碱性环境,保证Na2S2O4稳定存在
(3)①95.16% ②CE
解析 本实验制备连二亚硫酸钠,根据制备步骤,锌粉水悬浊液与SO2反应生成ZnS2O4,加入过量的NaOH溶液,ZnS2O4与NaOH反应生成Na2S2O4和氢氧化锌沉淀,过滤得到Na2S2O4溶液,因为Na2S2O4在碱性条件下稳定,因此需要加入NaOH溶液的量应过量,然后从溶液中获得连二亚硫酸钠,据此分析。
(1)因为SO2易溶于水,且亚硫酸为中强酸,因此实验室常用70%的硫酸和Na2SO3固体反应得到SO2,故A符合题意;10%硫酸中含有大量水,Na2SO3与硫酸反应生成SO2,SO2易溶于水,不利于SO2的逸出,故B不符合题意;饱和Na2SO3溶液中有大量水,不利于SO2逸出,故C不符合题意;稀硝酸具有强氧化性,能将SO2氧化,故D不符合题意。虚线框中仪器是倒置的漏斗,其作用是防止倒吸。制备Zn2S2O4利用Zn和H2SO3的反应,温度过高,则SO2溶解度低,浪费多;若温度过低,反应速率太慢。(2)根据题中所给信息Ⅱ,步骤②加过量NaOH溶液,除生成Na2S2O4外,确保溶液显碱性,防止Na2S2O4分解。(3)①根据I2与Na2S2O3的反应,得出过量I2的物质的量为20.00×10-3 L×0.100 0 mol·L-1×,则与NaHSO2·CH2O反应的I2的物质的量为(-20.00×10-3 L×0.100 0 mol·L-1×),从而计算出NaHSO2·CH2O的物质的量为(-20.00×10-3 L×0.100 0 mol·L-1×)×,根据H2O+Na2S2O4+2CH2O===NaHSO3·CH2O+NaHSO2·CH2O,计算出Na2S2O4的物质的量为(-20.00×10-3L×0.100 0 mol·L-1×)×,产品的纯度是
×100%=95.16%;②未用标准液润洗滴定管,消耗Na2S2O3溶液的体积增多,与NaHSO2·CH2O反应的I2的量减少,从而导致测定的纯度偏低,A不符合题意;滴定前尖嘴处有气泡,滴定后无气泡,消耗Na2S2O3溶液的体积增多,与NaHSO2·CH2O反应的I2的量减少,从而导致测定的纯度偏低,B不符合题意;起始读数正确,滴定后俯视读数,消耗Na2S2O3溶液的体积减小,与NaHSO2·CH2O反应的I2的量增多,从而导致测定的纯度偏高,C符合题意;制备时由于操作不当,样品中混有Na2S2O4·2H2O,造成测定纯度偏低,D不符合题意;滴定时,半分钟后又变回蓝色,所加标准液的体积减小,与NaHSO2·CH2O反应的I2的量增多,从而导致测定的纯度偏高,E符合题意。
2.答案 (1)①引流 ②b (2)BD (3)①萃取剂 ②溶剂可循环使用,使用量减少;生成物溶于THF被分离,可提高转化率
(4)e b a c (5)AC
解析 六水氯化铬与氯化亚砜、THF在室温下搅拌、过滤后得到CrCl3固体,转移到图1装置中加入THF和催化剂进行回流、搅拌、纯化后得到产品。
(1)①步骤Ⅰ过滤操作中玻璃棒的作用是引流;②图1冷却水应下进上出,故进水口是b。
(2)经过步骤Ⅰ后得到CrCl3固体,故该步骤的实验目的是除去CrCl3·6H2O中的结晶水,获得CrCl3固体,A正确;经过步骤Ⅰ得到CrCl3固体,该固体极易溶于水,滤纸不能用水润湿,B错误;加热回流时用到的有机溶剂仍为THF,故步骤Ⅱ过滤所得固体用四氢呋喃洗净后无需干燥可直接转移至滤纸套筒内,C正确;步骤Ⅲ:组装好图1装置,加入四氢呋喃后通入氮气,将装置中的空气排干净,打开冷凝水,加热回流,D错误。
(3)①CrCl3(THF)3易溶于四氢呋喃,故双颈烧瓶中四氢呋喃除作为反应物外还有一个用途是萃取剂;②本实验使用索氏提取器的优点:溶剂可循环使用,使用量减少;生成物溶于THF被分离,可提高转化率。
(4)纯化完成后,关闭加热器,待烧瓶冷却至室温,关闭通气活塞,关闭抽气泵,拔去橡皮管,打开通气活塞,充入氮气,放入干燥器中保存,故正确顺序是ebacf。
(5)钠与水反应,与THF不反应,可用于除去THF中的水,A正确;无水硫酸铜用于检验水,除去水不用,B错误;孔径大小与水分子大小相近的分子筛可以除水,C正确;浓硫酸具有腐蚀性,本实验不用其除水,D错误。
3.答案 (1)Cu(OH)2+2H2NCH2COOH===
(H2NCH2COO)2Cu+2H2O (2)ABC (3)①破坏配合物结构,解离出铜离子,有利于与I-反应 ②滴入最后半滴标准溶液后溶液蓝色褪去,且30 s不恢复 ③0.672 0
解析 某研究小组制备配合物顺式-二甘氨酸合铜[(H2NCH2COO)2Cu],向硫酸铜溶液中加入过量氨水至溶液呈深蓝色,再加入氢氧化钠溶液得到氢氧化铜沉淀,过滤后得到的固体加入甘氨酸溶液,在加热的条件下发生反应生成顺式-二甘氨酸合铜,乙醇的极性较水更小,加入乙醇后使得溶液整体极性下降,促进顺式-二甘氨酸合铜析出,以此解答。
(1)Cu(OH)2与甘氨酸反应生成二甘氨酸合铜和水,化学方程式为Cu(OH)2+2H2NCH2COOH=== (H2NCH2COO)2Cu+2H2O。(2)NaOH溶液碱性太强,流程中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀,A正确;步骤Ⅱ中,温度过高会使甘氨酸的溶解度降低或失去稳定性转化成其他化合物,导致产率降低,B正确;步骤Ⅲ中,趁热过滤的目的是除去Cu(OH)2同时减少产物的析出,C正确;乙醇的极性较水更小,加入乙醇后使得溶液整体极性下降,D错误。(3)①顺式-二甘氨酸合铜是配合物,溶解时加入硫酸的作用是破坏配合物结构,解离出铜离子,有利于与I-反应;②用碘量法测定产品中Cu元素的含量,以淀粉为指示剂,反应ⅰ:2Cu2++4I-===2CuI+I2,生成的碘单质使淀粉变蓝,用标准Na2S2O3溶液滴定至终点,发生反应I2+2S2===2I-+S4,蓝色褪去,滴定终点现象为滴入最后半滴标准溶液后溶液蓝色褪去,且30 s不恢复;③若两次平行实验,平均消耗0.105 0 mol·L-1 Na2S2O3溶液20.00 mL,消耗n(Na2S2O3)=0.02 L×0.105 0 mol·L-1=0.002 1 mol,由方程式可知2Cu2+~I2~2S2,20.00 mL溶液中n(Cu2+)=n(Na2S2O3)=0.002 1 mol,则x g产品中含Cu的质量为0.002 1 mol×64 g·mol-1×=0.672 0 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
非选择题增分练(四)综合实验
1.连二亚硫酸钠(Na2S2O4)俗称保险粉,是印染工业中常用的漂白剂。具有以下性质:
Ⅰ.易溶于水且随温度升高溶解度增大,难溶于酒精;
Ⅱ.酸性条件下易分解、碱性条件下稳定,固态时Na2S2O4相对Na2S2O4·2H2O较稳定;
Ⅲ.水溶液中低于52 ℃以Na2S2O4·2H2O形态结晶,碱性溶液中高于52 ℃脱水成无水盐。
工业中经典的制取方法是以SO2、Zn、NaOH为原料,主要反应及实验室模拟流程如下:SO2+H2O===H2SO3;Zn+2H2SO3===ZnS2O4+2H2O;ZnS2O4+2NaOH===Na2S2O4+Zn(OH)2↓
(1)步骤①的反应装置如图。
制备SO2选用的最佳试剂组合为 (填字母)。
A.70%硫酸+Na2SO3固体
B.10%硫酸+Na2SO3固体
C.70%硫酸+饱和Na2SO3溶液
D.稀硝酸+饱和NaHSO3溶液
虚线方框内仪器的作用是 。反应控制在35~45 ℃的原因是 。
(2)步骤②加过量NaOH溶液的作用除了使ZnS2O4充分生成Na2S2O4外,还有一个作用是 。
(3)产品纯度测定。取1.280 0 g产品与足量甲醛水溶液混合于锥形瓶中,生成甲醛亚硫酸氢钠与甲醛次硫酸氢钠:H2O+Na2S2O4+2CH2O===NaHSO3·CH2O+NaHSO2·CH2O,在所得的混合溶液中加入3.810 0 g I2、轻轻振荡,发生反应:2I2+NaHSO2·CH2O+2H2O===NaHSO4+CH2O+4HI。过量的I2以淀粉为指示剂,用0.100 0 mol·L-1的标准Na2S2O3溶液滴定:I2+2Na2S2O3===Na2S4O6+2NaI。消耗标准Na2S2O3溶液20.00 mL。
①产品的纯度为 (精确到0.01%)。
②下列操作会导致测定的纯度偏高的是 (填字母)。
A.装标准Na2S2O3溶液的滴定管用蒸馏水洗涤后没有用标准液润洗
B.滴定前尖嘴处有气泡,滴定后无气泡
C.起始读数正确,滴定后俯视读数
D.制备时由于操作不当,样品中混有Na2S2O4·2H2O
E.滴定时当溶液由蓝色变成无色时立即读数,半分钟后又变回蓝色
2.(2023·浙江金丽衢十二校第二次联考)某兴趣小组以六水氯化铬(CrCl3·6H2O)、氯化亚砜(SOCl2)、四氢呋喃(THF)为原料制备CrCl3(THF)3的简略流程如下(夹持仪器已省略):
已知:①氯化亚砜(SOCl2)为无色液体,遇水发生反应:H2O+SOCl2===SO2↑+2HCl↑。
②四氢呋喃为常见的有机溶剂,沸点66 ℃,结构简式:,常简写为THF。
③制备CrCl3(THF)3的主要反应:CrCl3+3THFCrCl3(THF)3。CrCl3难溶于四氢呋喃而CrCl3(THF)3易溶于四氢呋喃,二者都极易与水反应。
请回答:
(1)①步骤Ⅰ过滤操作中玻璃棒的作用是 ;②图1冷却水进水口是 (填“a”或“b”)。
(2)下列有关步骤Ⅰ、步骤Ⅱ、步骤Ⅲ的说法不正确的是 (填字母)。
A.步骤Ⅰ:该步骤的实验目的是除去CrCl3·6H2O中的结晶水,获得CrCl3固体
B.步骤Ⅰ:滤纸应用水润湿,使其紧贴漏斗内壁,防止有气泡而减慢过滤速度
C.步骤Ⅱ:过滤所得固体用四氢呋喃洗净后无需干燥可直接转移至滤纸套筒内
D.步骤Ⅲ:组装好图1装置,加入四氢呋喃后持续通入氮气,打开冷凝水,加热回流
(3)步骤Ⅲ:①双颈烧瓶中四氢呋喃除作为反应物外还有一个用途: 。
②本实验使用索氏提取器的优点: 。
(4)步骤Ⅳ:将装有粗产品的双颈烧瓶接到纯化装置(图2)上纯化,打开抽气泵,缓慢打开通气活塞,开启加热器,进行纯化。请给出纯化完成后的合理的操作排序:
纯化完成→( )→( )→( )→( )→f。
a.关闭抽气泵
b.关闭通气活塞
c.拔去橡皮管,打开通气活塞,充入氮气
d.待烧瓶冷却至室温,关闭加热器
e.关闭加热器,待烧瓶冷却至室温
f.放入干燥器中保存
(5)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是 (填字母)。
A.金属钠
B.无水硫酸铜
C.孔径大小与水分子大小相近的分子筛
D.浓硫酸
3.(2023·浙江杭州高三期中)某研究小组制备配合物顺式-二甘氨酸合铜[(H2NCH2COO)2Cu],结构简式为,流程如下:
CuSO4溶液深蓝色溶液Cu(OH)2收集滤液
冷却结晶产品
已知:Cu(OH)2与甘氨酸反应还可能生成反式-二甘氨酸合铜。
请回答:
(1)写出Cu(OH)2与甘氨酸反应的化学方程式: 。
(2)下列说法正确的是 (填字母)。
A.流程中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
B.步骤Ⅱ中,温度过高会导致产率降低
C.步骤Ⅲ中,趁热过滤的目的是除去Cu(OH)2同时减少产物的析出
D.步骤Ⅳ中,加入乙醇能增大溶剂极性,促进顺式-二甘氨酸合铜析出
(3)可用碘量法测定产品中Cu元素的含量,进而测定产品纯度,已知:
ⅰ.2Cu2++4I-===2CuI+I2
ⅱ.I2+2S2===2I-+S4
ⅲ.CuI固体能吸附溶液中的少量碘单质,
Ksp(CuSCN)
用分析天平称量产品x g→在烧杯中用水溶解,再加入适量硫酸→用容量瓶配制100 mL样品溶液→用移液管移取20.00 mL溶液到碘量瓶→加入过量KI固体→塞上碘量瓶的塞子、用少量水封→在暗处静置5分钟→打开塞子,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液→剧烈振荡碘量瓶→加入淀粉溶液→用标准Na2S2O3溶液滴定至终点,再取20.00 mL溶液进行一次平行实验。
①溶解时加入硫酸的作用是 。
②滴定终点的现象是 。
③若两次平行实验,平均消耗0.105 0 mol·L-1 Na2S2O3溶液20.00 mL,则x g产品中含Cu的质量为 g。
非选择题增分练(四) 综合实验
1.答案 (1)A 防止倒吸 若温度过高则SO2溶解度低,浪费多;若温度过低,反应速率太慢
(2)使溶液处于碱性环境,保证Na2S2O4稳定存在
(3)①95.16% ②CE
解析 本实验制备连二亚硫酸钠,根据制备步骤,锌粉水悬浊液与SO2反应生成ZnS2O4,加入过量的NaOH溶液,ZnS2O4与NaOH反应生成Na2S2O4和氢氧化锌沉淀,过滤得到Na2S2O4溶液,因为Na2S2O4在碱性条件下稳定,因此需要加入NaOH溶液的量应过量,然后从溶液中获得连二亚硫酸钠,据此分析。
(1)因为SO2易溶于水,且亚硫酸为中强酸,因此实验室常用70%的硫酸和Na2SO3固体反应得到SO2,故A符合题意;10%硫酸中含有大量水,Na2SO3与硫酸反应生成SO2,SO2易溶于水,不利于SO2的逸出,故B不符合题意;饱和Na2SO3溶液中有大量水,不利于SO2逸出,故C不符合题意;稀硝酸具有强氧化性,能将SO2氧化,故D不符合题意。虚线框中仪器是倒置的漏斗,其作用是防止倒吸。制备Zn2S2O4利用Zn和H2SO3的反应,温度过高,则SO2溶解度低,浪费多;若温度过低,反应速率太慢。(2)根据题中所给信息Ⅱ,步骤②加过量NaOH溶液,除生成Na2S2O4外,确保溶液显碱性,防止Na2S2O4分解。(3)①根据I2与Na2S2O3的反应,得出过量I2的物质的量为20.00×10-3 L×0.100 0 mol·L-1×,则与NaHSO2·CH2O反应的I2的物质的量为(-20.00×10-3 L×0.100 0 mol·L-1×),从而计算出NaHSO2·CH2O的物质的量为(-20.00×10-3 L×0.100 0 mol·L-1×)×,根据H2O+Na2S2O4+2CH2O===NaHSO3·CH2O+NaHSO2·CH2O,计算出Na2S2O4的物质的量为(-20.00×10-3L×0.100 0 mol·L-1×)×,产品的纯度是
×100%=95.16%;②未用标准液润洗滴定管,消耗Na2S2O3溶液的体积增多,与NaHSO2·CH2O反应的I2的量减少,从而导致测定的纯度偏低,A不符合题意;滴定前尖嘴处有气泡,滴定后无气泡,消耗Na2S2O3溶液的体积增多,与NaHSO2·CH2O反应的I2的量减少,从而导致测定的纯度偏低,B不符合题意;起始读数正确,滴定后俯视读数,消耗Na2S2O3溶液的体积减小,与NaHSO2·CH2O反应的I2的量增多,从而导致测定的纯度偏高,C符合题意;制备时由于操作不当,样品中混有Na2S2O4·2H2O,造成测定纯度偏低,D不符合题意;滴定时,半分钟后又变回蓝色,所加标准液的体积减小,与NaHSO2·CH2O反应的I2的量增多,从而导致测定的纯度偏高,E符合题意。
2.答案 (1)①引流 ②b (2)BD (3)①萃取剂 ②溶剂可循环使用,使用量减少;生成物溶于THF被分离,可提高转化率
(4)e b a c (5)AC
解析 六水氯化铬与氯化亚砜、THF在室温下搅拌、过滤后得到CrCl3固体,转移到图1装置中加入THF和催化剂进行回流、搅拌、纯化后得到产品。
(1)①步骤Ⅰ过滤操作中玻璃棒的作用是引流;②图1冷却水应下进上出,故进水口是b。
(2)经过步骤Ⅰ后得到CrCl3固体,故该步骤的实验目的是除去CrCl3·6H2O中的结晶水,获得CrCl3固体,A正确;经过步骤Ⅰ得到CrCl3固体,该固体极易溶于水,滤纸不能用水润湿,B错误;加热回流时用到的有机溶剂仍为THF,故步骤Ⅱ过滤所得固体用四氢呋喃洗净后无需干燥可直接转移至滤纸套筒内,C正确;步骤Ⅲ:组装好图1装置,加入四氢呋喃后通入氮气,将装置中的空气排干净,打开冷凝水,加热回流,D错误。
(3)①CrCl3(THF)3易溶于四氢呋喃,故双颈烧瓶中四氢呋喃除作为反应物外还有一个用途是萃取剂;②本实验使用索氏提取器的优点:溶剂可循环使用,使用量减少;生成物溶于THF被分离,可提高转化率。
(4)纯化完成后,关闭加热器,待烧瓶冷却至室温,关闭通气活塞,关闭抽气泵,拔去橡皮管,打开通气活塞,充入氮气,放入干燥器中保存,故正确顺序是ebacf。
(5)钠与水反应,与THF不反应,可用于除去THF中的水,A正确;无水硫酸铜用于检验水,除去水不用,B错误;孔径大小与水分子大小相近的分子筛可以除水,C正确;浓硫酸具有腐蚀性,本实验不用其除水,D错误。
3.答案 (1)Cu(OH)2+2H2NCH2COOH===
(H2NCH2COO)2Cu+2H2O (2)ABC (3)①破坏配合物结构,解离出铜离子,有利于与I-反应 ②滴入最后半滴标准溶液后溶液蓝色褪去,且30 s不恢复 ③0.672 0
解析 某研究小组制备配合物顺式-二甘氨酸合铜[(H2NCH2COO)2Cu],向硫酸铜溶液中加入过量氨水至溶液呈深蓝色,再加入氢氧化钠溶液得到氢氧化铜沉淀,过滤后得到的固体加入甘氨酸溶液,在加热的条件下发生反应生成顺式-二甘氨酸合铜,乙醇的极性较水更小,加入乙醇后使得溶液整体极性下降,促进顺式-二甘氨酸合铜析出,以此解答。
(1)Cu(OH)2与甘氨酸反应生成二甘氨酸合铜和水,化学方程式为Cu(OH)2+2H2NCH2COOH=== (H2NCH2COO)2Cu+2H2O。(2)NaOH溶液碱性太强,流程中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀,A正确;步骤Ⅱ中,温度过高会使甘氨酸的溶解度降低或失去稳定性转化成其他化合物,导致产率降低,B正确;步骤Ⅲ中,趁热过滤的目的是除去Cu(OH)2同时减少产物的析出,C正确;乙醇的极性较水更小,加入乙醇后使得溶液整体极性下降,D错误。(3)①顺式-二甘氨酸合铜是配合物,溶解时加入硫酸的作用是破坏配合物结构,解离出铜离子,有利于与I-反应;②用碘量法测定产品中Cu元素的含量,以淀粉为指示剂,反应ⅰ:2Cu2++4I-===2CuI+I2,生成的碘单质使淀粉变蓝,用标准Na2S2O3溶液滴定至终点,发生反应I2+2S2===2I-+S4,蓝色褪去,滴定终点现象为滴入最后半滴标准溶液后溶液蓝色褪去,且30 s不恢复;③若两次平行实验,平均消耗0.105 0 mol·L-1 Na2S2O3溶液20.00 mL,消耗n(Na2S2O3)=0.02 L×0.105 0 mol·L-1=0.002 1 mol,由方程式可知2Cu2+~I2~2S2,20.00 mL溶液中n(Cu2+)=n(Na2S2O3)=0.002 1 mol,则x g产品中含Cu的质量为0.002 1 mol×64 g·mol-1×=0.672 0 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
