2025浙江专版新教材化学高考第一轮基础练--微专题(六)重要含氯化合物制备探究(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--微专题(六)重要含氯化合物制备探究(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 451.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:12:24 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
微专题(六)重要含氯化合物制备探究
1.(2023·江苏高三百校二联)AlCl3在有机化学中有很广泛的应用。实验室制备干燥的AlCl3的装置如下:
回答下列问题:
(1)确定装置气密性良好后,滴入浓盐酸直至 ;开始点燃酒精灯。
(2)装置A中生成Cl2的离子方程式为 。
(3)试剂X为 ,装置B中长颈漏斗的作用是 ,
装置I的作用是 。
(4)当制备好AlCl3后,停止加热,关闭漏斗活塞,接下来的操作是 。
(5)请设计一个测定无水AlCl3产率的方案: 。
2.(2023·浙江北仑中学段考)三氯氧磷(POCl3)是一种重要的化工原料,常作为半导体掺杂剂及光导纤维原料。在实验室利用PCl3、SO2、Cl2在60~65 ℃时反应制备POCl3和SOCl2,所用实验装置和相关物质的性质如下所示(气体制备装置、夹持、加热及搅拌装置略):
相关性质如表:
物质 熔点/ ℃ 沸点/ ℃ 其他
PCl3 -93.6 76.1 遇水强烈水解,易与O2反应
POCl3 1.25 105.8 遇水强烈水解,能溶于PCl3
SOCl2 -105 78.8 遇水强烈水解,受热易分解
回答下列问题:
(1)氯气可由重铬酸钾与浓盐酸反应制备,该反应的离子方程式为 。
(2)A、B装置中的试剂分别是 、 。
(3)装置C中发生反应的化学方程式为 。
(4)反应装置的虚线框中未画出的仪器最好选用 (填仪器名称);装置E的作用是 。
(5)反应结束后应采用 (填操作名称)提纯POCl3产品。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取5.000 g样品在水解瓶中摇动至完全水解,将水解液配成250 mL溶液,取25.00 mL置于锥形瓶中,加入0.400 0 mol·L-1的AgNO3溶液25.00 mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.100 0 mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液22.00 mL。[已知:AgCl和AgSCN均为难溶于水的白色固体,Ag3PO4可溶于硝酸,M(POCl3)=153.5 g· mol-1]
①说明滴定到达终点的实验现象为 。
②产品中POCl3的质量分数约为 (保留三位有效数字)。
3.(2023·浙江义乌中学月考)CuCl广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
[资料查阅]
[实验探究]
Ⅰ.氯气的制备
实验室用二氧化锰和浓盐酸制氯气选用上述装置 (填“A”或“B”),检验装置气密性的操作: ,
反应的离子方程式为 。
Ⅱ.用下图所示装置进行实验(夹持仪器已省略),制备CuCl。
请回答下列问题:
(1)实验操作的先后顺序是a→ →e(填字母)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到C中试纸的颜色变化是先变红后褪色。通过C中的现象,一定可以证明新制氯水具有的性质有 (填字母)。
A.酸性 B.漂白性
C.酸性、漂白性 D.前面性质均无法证明
(3)装置D中发生的氧化还原反应的离子方程式是 。
[探究反思]
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:若杂质是CuCl2,则产生的原因是 。
若杂质是CuO,则产生的原因是 。
4.(2023·浙江当湖高级中学段考)TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
物质 熔点/ ℃ 沸点/ ℃ 密度/(g·cm-3) 水溶性
TiCl4 -24 136.4 1.7 易水解生成白 色沉淀,能溶于 有机溶剂
CCl4 -23 76.8 1.6 难溶于水
回答下列问题:
(1)A装置仪器b的名称是 ,
E装置中的试剂是 。
(2)装置A中发生反应的离子方程式为 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是 。
(6)利用如图装置测定所得TiCl4的纯度:取w g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1 mol·L-1K2CrO4溶液作指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液V mL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O===TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有 ;
②滴定终点的判断方法是 ;
③产品的纯度为 (用含w、c和V的代数式表示)。
微专题(六) 重要含氯化合物制备探究
1.答案 (1)黄绿色气体(或氯气)充满整个装置
(2)Cl+5Cl-+6H+===3H2O+3Cl2↑
(3)无水CaCl2 平衡气压,以防发生堵塞 防止J中的水蒸气进入装置H
(4)将盛有碳酸钙颗粒的玻璃管插入含有盐酸的溶液中
(5)准确称取铝粉的质量,然后称量D、E、F、G、H的总质量,反应后再次称量D、E、F、G、H的总质量,反应前后质量之差为参加反应的氯气的质量,从而得到生成的无水氯化铝的质量
解析 (1)确定装置气密性良好后,由于需要排尽装置中的空气,防止生成氧化铝,则滴入浓盐酸直至黄绿色气体(或氯气)充满整个装置,然后开始点燃酒精灯。(2)装置A中氯酸钾氧化浓盐酸生成Cl2的离子方程式为Cl+5Cl-+6H+===3H2O+3Cl2↑。(3)装置C干燥氯气,则试剂X为无水CaCl2,装置B中的长颈漏斗与空气相通,其作用是平衡气压,以防发生堵塞,生成的氯化铝应该避免和水蒸气接触,则装置I的作用是防止J中的水蒸气进入装置H。(4)当制备好AlCl3后,停止加热,关闭漏斗活塞,为防止装置A中继续产生氯气,接下来的操作是将盛有碳酸钙颗粒的玻璃管插入含有盐酸的溶液中。(5)由于生成的氯化铝分布在D、E、F、G、H中,则测定无水AlCl3产率的方案为准确称取铝粉的质量,然后称量D、E、F、G、H的总质量,反应后再次称量D、E、F、G、H的总质量,反应前后质量之差为参加反应的氯气的质量,从而得到生成的无水氯化铝的质量。
2.答案 (1)Cr2+14H++6Cl-===2Cr3++3Cl2↑+7H2O
(2)饱和食盐水 P2O5或无水氯化钙
(3)PCl3+SO2+Cl2POCl3+SOCl2
(4)(球形)冷凝管 干燥SO2,通过观察产生气泡的速率控制通入气体的速率
(5)蒸馏
(6)①当最后半滴KSCN标准液滴入锥形瓶中,溶液颜色由浅黄色变为红色,且半分钟内红色不褪去 ②79.8%
解析 本题考查PCl3、SO2、Cl2在60~65 ℃时反应制备POCl3和SOCl2的实验,根据题表信息,本实验必须在无水条件下反应,所以装置A用饱和食盐水除去氯气中的氯化氢,B用P2O5或无水CaCl2除去氯气中的水蒸气,E用浓硫酸除去二氧化硫中的水蒸气,且A和E都可以通过观察产生气泡的速率控制通入气体的流速,D用无水CaCl2防止空气中的水蒸气进入,用球形冷凝管进行冷凝回流,使PCl3充分反应,提高产率。(2)A装置用饱和食盐水除去氯气中的氯化氢,B装置用P2O5或无水CaCl2除去氯气中的水蒸气,所以A、B装置中的试剂分别是饱和食盐水、P2O5或无水CaCl2。(3)由题意可知装置C中二氧化硫、氯气和三氯化磷反应生成POCl3和SOCl2,方程式为PCl3+SO2+Cl2POCl3+SOCl2。(4)球形冷凝管与直形冷凝管最大区别是球形冷凝管接触面积大,冷凝效果更好,能将反应物和生成物充分冷凝回流,增加产率,所以虚线框中用球形冷凝管;装置E用浓硫酸除去二氧化硫中的水蒸气,且控制产生气泡的速率以控制反应速率,所以E的作用是干燥SO2,通过观察产生气泡的速率控制通入气体的流速。(5)POCl3和SOCl2的沸点不同,所以提纯POCl3的操作是蒸馏。(6)①用KSCN滴定过量的硝酸银,用NH4Fe(SO4)2作指示剂,当硝酸银反应完后,KSCN和NH4Fe(SO4)2中的三价铁反应,溶液显红色,故滴定终点的现象是:当最后半滴KSCN标准液滴入锥形瓶中,溶液由浅黄色变为红色,且半分钟内不复原。②根据条件可知:AgNO3的总物质的量为0.400 0 mol·L-1×0.025 L=0.01 mol,KSCN的物质的量为0.100 0 mol·L-1×0.022 L=0.002 2 mol,SCN-反应的Ag+为0.002 2 mol,Cl-反应的Ag+为0.01 mol-0.002 2 mol=0.007 8 mol,Cl-的物质的量是0.007 8 mol,根据元素守恒则25.00 mL水解液中POCl3物质的量是0.007 8 mol×=0.002 6 mol,则5.000 g样品中POCl3物质的量是0.002 6 mol×=0.026 mol,产品中POCl3的质量分数为×100%≈79.8%。
3.答案 Ⅰ.A 封闭a处导气管,打开分液漏斗旋塞,向漏斗中加蒸馏水,一段时间后,漏斗下端水不再滴落,并形成一段液柱,证明该装置气密性良好 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
Ⅱ.(1)c→d→b
(2)B
(3)Cl2+2OH-===Cl-+ClO-+H2O
(4)加热时间不足或温度偏低 通入HCl的量不足
解析 Ⅱ.(1)由所给资料信息知,制备过程中,需在HCl气流中加热,防止生成CuO,同时为了防止产品被空气中氧气氧化,故先通HCl,再加热,实验结束时,应先停止加热,再停止通HCl,故操作顺序为a→c→d→b→e。(2)由资料知,CuCl2分解产生Cl2,Cl2遇到湿润的石蕊试纸,与水反应生成HCl和HClO,HClO有漂白性,试纸变色后又褪色,由于实验过程中通HCl气体,故试纸变红不能说明新制氯水中含有HCl,故此处选B。(3)装置D为尾气处理装置,吸收Cl2,对应离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。(4)由资料知,CuCl2在300 ℃以上才分解成CuCl,若产品中含有CuCl2,可能原因是加热时间不足或温度偏低;若含有CuO,则可能原因是HCl通入量不足,导致部分原料转化为Cu2(OH)2Cl2,加热分解产生CuO。
4.答案 (1)蒸馏烧瓶 浓硫酸
(2)2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)排除装置中的空气,防止TiCl4和O2反应
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)蒸馏
(6)①液封,吸收挥发的HCl气体 ②当加入最后半滴AgNO3标准溶液时,恰好出现砖红色沉淀,且半分钟不消失
③×100%或%
解析 A为制备Cl2的装置,C、D分别为制备、收集TiCl4的装置,因TiCl4易水解,要求制备和收集过程无水,故在C前、D后都要加干燥装置,所以B、E中试剂为浓硫酸;F中盛放NaOH溶液,目的是除去未反应的Cl2。
(1)E装置中的试剂是浓硫酸,防止F中的水蒸气进入D装置中,使TiCl4水解。(3)TiCl4高温时能与O2反应,在通入Cl2前,从侧管持续通入一段时间CO2的目的是排除装置中的空气,防止TiCl4和O2反应。(4)一种气态不成盐氧化物是CO,反应的化学方程式为TiO2+2C+2Cl2TiCl4+2CO。(5)TiCl4和CCl4互溶,但沸点差异比较大,故从混合液中分离出TiCl4的操作为蒸馏。(6)①安全漏斗在本实验中的作用除加水外,还有液封,吸收挥发的HCl气体,避免HCl的损失;②滴定终点的判断方法是:当加入最后半滴AgNO3标准溶液时,恰好出现砖红色沉淀,且半分钟不消失;③根据关系TiCl4~4HCl~4AgNO3,n(TiCl4)=n(AgNO3)=cV×10-3 mol,TiCl4的纯度为×100%=×100%或%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
微专题(六)重要含氯化合物制备探究
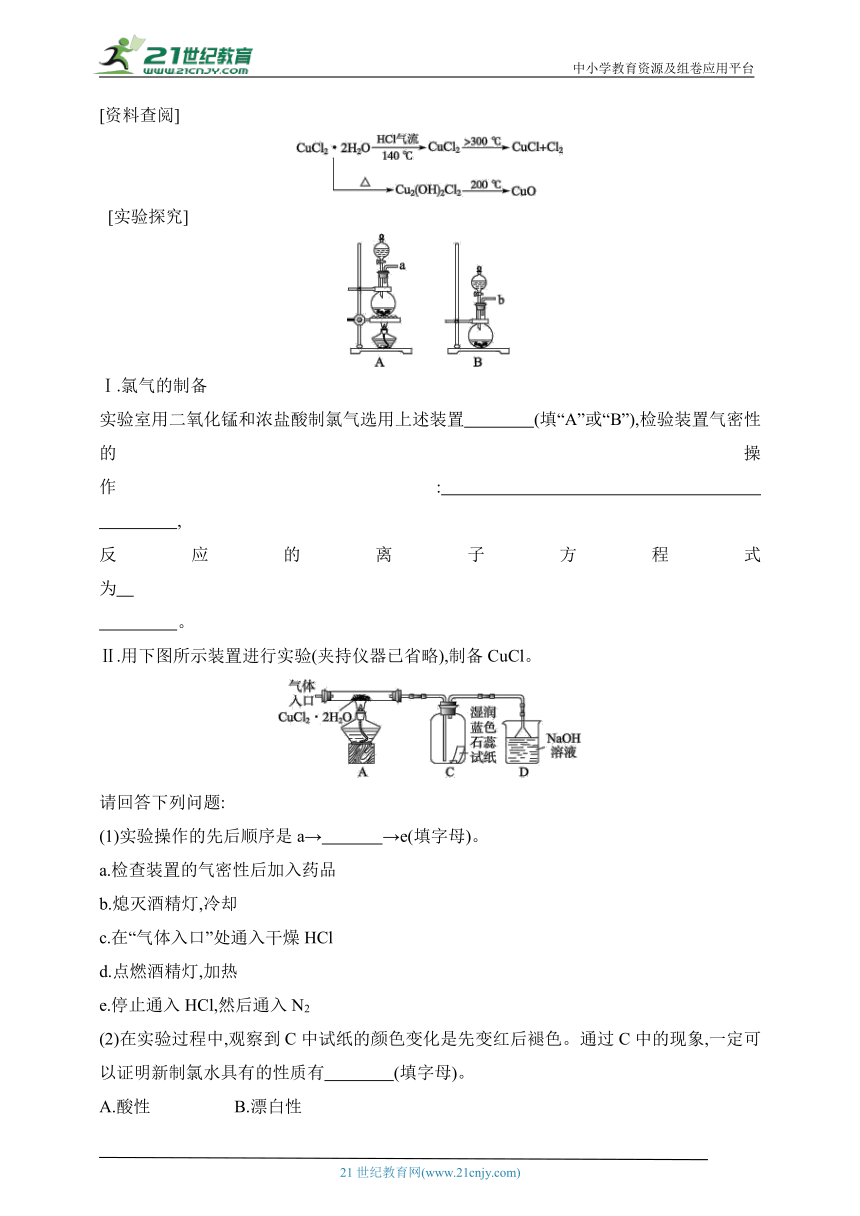
1.(2023·江苏高三百校二联)AlCl3在有机化学中有很广泛的应用。实验室制备干燥的AlCl3的装置如下:
回答下列问题:
(1)确定装置气密性良好后,滴入浓盐酸直至 ;开始点燃酒精灯。
(2)装置A中生成Cl2的离子方程式为 。
(3)试剂X为 ,装置B中长颈漏斗的作用是 ,
装置I的作用是 。
(4)当制备好AlCl3后,停止加热,关闭漏斗活塞,接下来的操作是 。
(5)请设计一个测定无水AlCl3产率的方案: 。
2.(2023·浙江北仑中学段考)三氯氧磷(POCl3)是一种重要的化工原料,常作为半导体掺杂剂及光导纤维原料。在实验室利用PCl3、SO2、Cl2在60~65 ℃时反应制备POCl3和SOCl2,所用实验装置和相关物质的性质如下所示(气体制备装置、夹持、加热及搅拌装置略):
相关性质如表:
物质 熔点/ ℃ 沸点/ ℃ 其他
PCl3 -93.6 76.1 遇水强烈水解,易与O2反应
POCl3 1.25 105.8 遇水强烈水解,能溶于PCl3
SOCl2 -105 78.8 遇水强烈水解,受热易分解
回答下列问题:
(1)氯气可由重铬酸钾与浓盐酸反应制备,该反应的离子方程式为 。
(2)A、B装置中的试剂分别是 、 。
(3)装置C中发生反应的化学方程式为 。
(4)反应装置的虚线框中未画出的仪器最好选用 (填仪器名称);装置E的作用是 。
(5)反应结束后应采用 (填操作名称)提纯POCl3产品。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取5.000 g样品在水解瓶中摇动至完全水解,将水解液配成250 mL溶液,取25.00 mL置于锥形瓶中,加入0.400 0 mol·L-1的AgNO3溶液25.00 mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.100 0 mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液22.00 mL。[已知:AgCl和AgSCN均为难溶于水的白色固体,Ag3PO4可溶于硝酸,M(POCl3)=153.5 g· mol-1]
①说明滴定到达终点的实验现象为 。
②产品中POCl3的质量分数约为 (保留三位有效数字)。
3.(2023·浙江义乌中学月考)CuCl广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
[资料查阅]
[实验探究]
Ⅰ.氯气的制备
实验室用二氧化锰和浓盐酸制氯气选用上述装置 (填“A”或“B”),检验装置气密性的操作: ,
反应的离子方程式为 。
Ⅱ.用下图所示装置进行实验(夹持仪器已省略),制备CuCl。
请回答下列问题:
(1)实验操作的先后顺序是a→ →e(填字母)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到C中试纸的颜色变化是先变红后褪色。通过C中的现象,一定可以证明新制氯水具有的性质有 (填字母)。
A.酸性 B.漂白性
C.酸性、漂白性 D.前面性质均无法证明
(3)装置D中发生的氧化还原反应的离子方程式是 。
[探究反思]
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:若杂质是CuCl2,则产生的原因是 。
若杂质是CuO,则产生的原因是 。
4.(2023·浙江当湖高级中学段考)TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
物质 熔点/ ℃ 沸点/ ℃ 密度/(g·cm-3) 水溶性
TiCl4 -24 136.4 1.7 易水解生成白 色沉淀,能溶于 有机溶剂
CCl4 -23 76.8 1.6 难溶于水
回答下列问题:
(1)A装置仪器b的名称是 ,
E装置中的试剂是 。
(2)装置A中发生反应的离子方程式为 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是 。
(6)利用如图装置测定所得TiCl4的纯度:取w g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1 mol·L-1K2CrO4溶液作指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液V mL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O===TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有 ;
②滴定终点的判断方法是 ;
③产品的纯度为 (用含w、c和V的代数式表示)。
微专题(六) 重要含氯化合物制备探究
1.答案 (1)黄绿色气体(或氯气)充满整个装置
(2)Cl+5Cl-+6H+===3H2O+3Cl2↑
(3)无水CaCl2 平衡气压,以防发生堵塞 防止J中的水蒸气进入装置H
(4)将盛有碳酸钙颗粒的玻璃管插入含有盐酸的溶液中
(5)准确称取铝粉的质量,然后称量D、E、F、G、H的总质量,反应后再次称量D、E、F、G、H的总质量,反应前后质量之差为参加反应的氯气的质量,从而得到生成的无水氯化铝的质量
解析 (1)确定装置气密性良好后,由于需要排尽装置中的空气,防止生成氧化铝,则滴入浓盐酸直至黄绿色气体(或氯气)充满整个装置,然后开始点燃酒精灯。(2)装置A中氯酸钾氧化浓盐酸生成Cl2的离子方程式为Cl+5Cl-+6H+===3H2O+3Cl2↑。(3)装置C干燥氯气,则试剂X为无水CaCl2,装置B中的长颈漏斗与空气相通,其作用是平衡气压,以防发生堵塞,生成的氯化铝应该避免和水蒸气接触,则装置I的作用是防止J中的水蒸气进入装置H。(4)当制备好AlCl3后,停止加热,关闭漏斗活塞,为防止装置A中继续产生氯气,接下来的操作是将盛有碳酸钙颗粒的玻璃管插入含有盐酸的溶液中。(5)由于生成的氯化铝分布在D、E、F、G、H中,则测定无水AlCl3产率的方案为准确称取铝粉的质量,然后称量D、E、F、G、H的总质量,反应后再次称量D、E、F、G、H的总质量,反应前后质量之差为参加反应的氯气的质量,从而得到生成的无水氯化铝的质量。
2.答案 (1)Cr2+14H++6Cl-===2Cr3++3Cl2↑+7H2O
(2)饱和食盐水 P2O5或无水氯化钙
(3)PCl3+SO2+Cl2POCl3+SOCl2
(4)(球形)冷凝管 干燥SO2,通过观察产生气泡的速率控制通入气体的速率
(5)蒸馏
(6)①当最后半滴KSCN标准液滴入锥形瓶中,溶液颜色由浅黄色变为红色,且半分钟内红色不褪去 ②79.8%
解析 本题考查PCl3、SO2、Cl2在60~65 ℃时反应制备POCl3和SOCl2的实验,根据题表信息,本实验必须在无水条件下反应,所以装置A用饱和食盐水除去氯气中的氯化氢,B用P2O5或无水CaCl2除去氯气中的水蒸气,E用浓硫酸除去二氧化硫中的水蒸气,且A和E都可以通过观察产生气泡的速率控制通入气体的流速,D用无水CaCl2防止空气中的水蒸气进入,用球形冷凝管进行冷凝回流,使PCl3充分反应,提高产率。(2)A装置用饱和食盐水除去氯气中的氯化氢,B装置用P2O5或无水CaCl2除去氯气中的水蒸气,所以A、B装置中的试剂分别是饱和食盐水、P2O5或无水CaCl2。(3)由题意可知装置C中二氧化硫、氯气和三氯化磷反应生成POCl3和SOCl2,方程式为PCl3+SO2+Cl2POCl3+SOCl2。(4)球形冷凝管与直形冷凝管最大区别是球形冷凝管接触面积大,冷凝效果更好,能将反应物和生成物充分冷凝回流,增加产率,所以虚线框中用球形冷凝管;装置E用浓硫酸除去二氧化硫中的水蒸气,且控制产生气泡的速率以控制反应速率,所以E的作用是干燥SO2,通过观察产生气泡的速率控制通入气体的流速。(5)POCl3和SOCl2的沸点不同,所以提纯POCl3的操作是蒸馏。(6)①用KSCN滴定过量的硝酸银,用NH4Fe(SO4)2作指示剂,当硝酸银反应完后,KSCN和NH4Fe(SO4)2中的三价铁反应,溶液显红色,故滴定终点的现象是:当最后半滴KSCN标准液滴入锥形瓶中,溶液由浅黄色变为红色,且半分钟内不复原。②根据条件可知:AgNO3的总物质的量为0.400 0 mol·L-1×0.025 L=0.01 mol,KSCN的物质的量为0.100 0 mol·L-1×0.022 L=0.002 2 mol,SCN-反应的Ag+为0.002 2 mol,Cl-反应的Ag+为0.01 mol-0.002 2 mol=0.007 8 mol,Cl-的物质的量是0.007 8 mol,根据元素守恒则25.00 mL水解液中POCl3物质的量是0.007 8 mol×=0.002 6 mol,则5.000 g样品中POCl3物质的量是0.002 6 mol×=0.026 mol,产品中POCl3的质量分数为×100%≈79.8%。
3.答案 Ⅰ.A 封闭a处导气管,打开分液漏斗旋塞,向漏斗中加蒸馏水,一段时间后,漏斗下端水不再滴落,并形成一段液柱,证明该装置气密性良好 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
Ⅱ.(1)c→d→b
(2)B
(3)Cl2+2OH-===Cl-+ClO-+H2O
(4)加热时间不足或温度偏低 通入HCl的量不足
解析 Ⅱ.(1)由所给资料信息知,制备过程中,需在HCl气流中加热,防止生成CuO,同时为了防止产品被空气中氧气氧化,故先通HCl,再加热,实验结束时,应先停止加热,再停止通HCl,故操作顺序为a→c→d→b→e。(2)由资料知,CuCl2分解产生Cl2,Cl2遇到湿润的石蕊试纸,与水反应生成HCl和HClO,HClO有漂白性,试纸变色后又褪色,由于实验过程中通HCl气体,故试纸变红不能说明新制氯水中含有HCl,故此处选B。(3)装置D为尾气处理装置,吸收Cl2,对应离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。(4)由资料知,CuCl2在300 ℃以上才分解成CuCl,若产品中含有CuCl2,可能原因是加热时间不足或温度偏低;若含有CuO,则可能原因是HCl通入量不足,导致部分原料转化为Cu2(OH)2Cl2,加热分解产生CuO。
4.答案 (1)蒸馏烧瓶 浓硫酸
(2)2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)排除装置中的空气,防止TiCl4和O2反应
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)蒸馏
(6)①液封,吸收挥发的HCl气体 ②当加入最后半滴AgNO3标准溶液时,恰好出现砖红色沉淀,且半分钟不消失
③×100%或%
解析 A为制备Cl2的装置,C、D分别为制备、收集TiCl4的装置,因TiCl4易水解,要求制备和收集过程无水,故在C前、D后都要加干燥装置,所以B、E中试剂为浓硫酸;F中盛放NaOH溶液,目的是除去未反应的Cl2。
(1)E装置中的试剂是浓硫酸,防止F中的水蒸气进入D装置中,使TiCl4水解。(3)TiCl4高温时能与O2反应,在通入Cl2前,从侧管持续通入一段时间CO2的目的是排除装置中的空气,防止TiCl4和O2反应。(4)一种气态不成盐氧化物是CO,反应的化学方程式为TiO2+2C+2Cl2TiCl4+2CO。(5)TiCl4和CCl4互溶,但沸点差异比较大,故从混合液中分离出TiCl4的操作为蒸馏。(6)①安全漏斗在本实验中的作用除加水外,还有液封,吸收挥发的HCl气体,避免HCl的损失;②滴定终点的判断方法是:当加入最后半滴AgNO3标准溶液时,恰好出现砖红色沉淀,且半分钟不消失;③根据关系TiCl4~4HCl~4AgNO3,n(TiCl4)=n(AgNO3)=cV×10-3 mol,TiCl4的纯度为×100%=×100%或%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
