2025浙江专版新教材化学高考第一轮基础练--微专题(七)硫及其化合物的相互转化(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--微专题(七)硫及其化合物的相互转化(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 477.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:12:55 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
微专题(七)硫及其化合物的相互转化
1.(2023·江西赣州二模)硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是( )
A.硫在过量的氧气中燃烧直接生成Y
B.将X通入BaCl2溶液中有白色沉淀生成
C.M的无水固体粉末显蓝色
D.N与Z反应可生成X
2.(2023·湖南长沙炎德英才月考)天然气是一种重要的化工原料和燃料。常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( )
A.整个脱硫过程中Fe2(SO4)3溶液并未参与反应
B.整个脱硫过程中参加反应的n(H2S)∶n(O2)=2∶1
C.脱硫过程需不断补充FeSO4
D.CH4是天然气脱硫过程的催化剂
3.(2023·浙江绍兴鲁迅中学段考)已知反应S2(aq)+2I-(aq)2S(aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是( )
A.S2中硫元素显+7价
B.反应速率与Fe3+浓度无关
C.由图可知氧化性:Fe3+>S2
D.若不加Fe3+,正反应的活化能比逆反应的小
4.(2023·江苏南通新高考模拟)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种Na2S2O4的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法正确的是( )
A.可用银氨溶液检验甲酸中是否含有甲醛
B.NaCl溶解度大于Na2S2O4·2H2O的溶解度
C.过滤操作中需要用的玻璃仪器只有漏斗、烧杯
D.由溶液A制备Na2S2O4溶液过程中,氧化剂与还原剂物质的量之比为1∶2
5.(2023·湖南五市十校联考)硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,S8环状分子的结构为。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是( )
A.硫单质呈黄色,可用作橡胶硫化剂
B.SO2具有氧化性,可用于漂白草编织物
C.Na2SO3具有还原性,可用于处理自来水中残留的Cl2
D.浓硫酸具有强氧化性,可用作酯化反应的催化剂
6.(2023·浙江义乌中学月考)工业上制备硫酸的流程:FeS2SO2SO3H2SO4,设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.FeS2中Fe2+的未成对电子数目为6
B.SO2的中心原子孤电子对数为1,其空间结构为V形
C.标准状况下,22.4 L SO3中含有氧原子数目为3NA
D.V2O5作催化剂,能降低该反应的活化能,提高SO2的平衡转化率
7.(2023·浙江越州中学段考)工业上可用克劳斯工艺处理含H2S的尾气获得硫黄,工艺流程如下。
含H2S的尾气、空气反应炉
(高温)催化转化器
(高温) 硫冷凝器
(130~200 ℃)排放
已知反应炉中部分H2S发生反应:2H2S+3O22SO2+2H2O。下列说法错误的是( )
A.可用品红溶液检验排放的气体中是否含有二氧化硫
B.每回收32 g单质硫,理论上消耗氧气的体积为33.6 L(标准状况)
C.催化转化器中发生的反应为SO2+2H2S3S+2H2O
D.为提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率约为33.3%
8.(2023·浙江青田中学月考)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式: 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为
①pH=4.1时,Ⅰ中为 (写化学式)溶液。
②工艺中加入Na2CO3固体,并再次充入SO2的目的是 。
9.(2023·浙江金华外国语学校段考)物质类别和核心元素的化合价是研究物质性质的两个重要视角。以硫及其化合物与化合价变化为坐标的二维转化关系如图所示。
回答下列问题:
(1)图中X的电子式为 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式: 。该变化说明S的非金属性比O的 (填“强”或“弱”)。
(2)下列物质用于Na2S2O3的制备,从氧化还原反应的角度考虑,理论上有可能的是 (填字母)。
a.Na2S+S b.Z+S
c.Na2SO3+Y d.NaHS+NaHSO3
(3)治理含CO、SO2的烟道气,以Fe2O3为催化剂,将CO、SO2在380 ℃时转化为S和一种无毒气体,写出该反应的化学方程式: 。
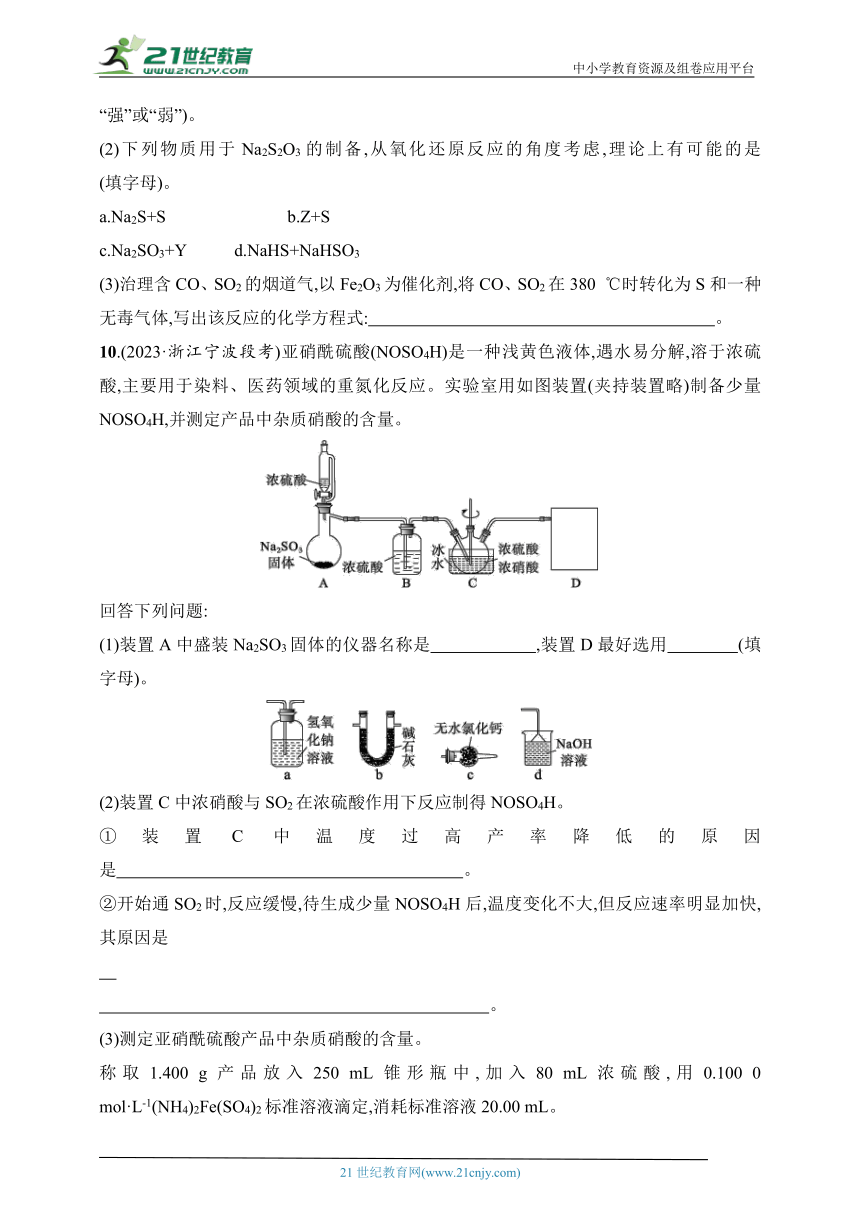
10.(2023·浙江宁波段考)亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是 ,装置D最好选用 (填字母)。
(2)装置C中浓硝酸与SO2在浓硫酸作用下反应制得NOSO4H。
①装置C中温度过高产率降低的原因是 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250 mL锥形瓶中,加入80 mL浓硫酸,用0.100 0 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00 mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①锥形瓶中加入浓硫酸的作用是 。
②判断滴定达到终点的现象是 。
③亚硝酰硫酸中硝酸的含量为 。
微专题(七) 硫及其化合物的相互转化
1.D 硫燃烧只能得到SO2,A项错误;盐酸的酸性大于亚硫酸的酸性,故SO2不与BaCl2溶液反应,B项错误;无水CuSO4为白色,C项错误;Na2S2O3与H2SO4反应可生成SO2,D项正确。
2.B 在脱硫过程中Fe2(SO4)3与H2S发生反应:Fe2(SO4)3+H2S===2FeSO4+H2SO4+S↓,A错误;脱硫过程中Fe2(SO4)3与H2S发生反应:Fe2(SO4)3+H2S===2FeSO4+H2SO4+S↓,然后发生反应:4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O,总反应方程式为2H2S+O2===2S↓+2H2O,故参加反应的n(H2S)∶n(O2)=2∶1,B正确;脱硫过程产生中间产物FeSO4,后该物质又被消耗,FeSO4的物质的量不变,其在流程中循环利用,因此不需补充FeSO4,C错误;CH4在反应过程中没有参加反应,因此不是天然气脱硫过程的催化剂,D错误。
3.D 硫原子最外层只有6个电子,不会显+7价;S2中含有过氧键,存在-1价氧,使得硫元素显+6价,A项错误;铁离子参与反应生成亚铁离子,亚铁离子又转化为铁离子,则铁离子为催化剂,改变反应速率,故反应速率与Fe3+浓度有关,B项错误;氧化剂的氧化性大于氧化产物,由图示第二步反应可知,氧化性:Fe3+4.B 甲酸和甲醛都含有醛基,则用银氨溶液不能检验甲酸中是否含有甲醛,A项错误;Na2S2O4溶液中加入NaCl晶体冷却,过滤可以得到Na2S2O4·2H2O,说明NaCl溶解度大于Na2S2O4·2H2O溶解度,B项正确;过滤操作中需要用的玻璃仪器有漏斗、烧杯和玻璃棒,C项错误;氧化剂是SO2,还原剂是HCOONa,根据得失电子守恒可得氧化剂与还原剂物质的量之比为2∶1,D项错误。
5.C 硫单质可用作橡胶硫化剂,体现的是硫的化学性质,与颜色无关,A不符合题意;SO2用于漂白草编织物,发生非氧化还原反应,体现SO2的漂白性,B不符合题意;Na2SO3具有还原性,与自来水中残留的Cl2发生氧化还原反应,从而去除Cl2,C符合题意;浓硫酸用作酯化反应的催化剂和吸水剂,与氧化性无关,D不符合题意。
6.B Fe2+的电子排布式为1s22s22p63s23p63d6,未成对电子数目为4,故A错误;SO2的中心原子价层电子对数为2+=3,孤电子对数为1,其空间结构为V形,故B正确;标准状况下SO3为固态,所以22.4 L SO3的物质的量大于1 mol,含有氧原子数目大于3NA,故C错误;V2O5作催化剂,能降低该反应的活化能,但不能提高SO2的平衡转化率,故D错误。
7.B 由题干信息可知,反应炉中部分H2S发生反应:2H2S+3O22SO2+2H2O,催化转化器中发生反应:SO2+2H2S3S+2H2O,生成的硫蒸气经硫冷凝器可将硫冷凝下来,变为固体和气体分离。利用SO2可使品红溶液褪色的特性,可用品红溶液检验排放的气体中是否含有二氧化硫,A正确;32 g单质硫的物质的量为=1 mol,由得失电子守恒得2H2S~2S~O2~4e-,故理论上消耗氧气的体积为1 mol××22.4 L·mol-1=11.2 L(标准状况),B错误;由分析可知,催化转化器中发生的反应为SO2+2H2S3S+2H2O,C正确;根据化学方程式2SO2+2H2O、SO2+2H2S3S+2H2O可知,为提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率约为33.3%,D正确。
8.答案 (1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
解析 (1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。(2)①由pH=4.1知,SO2与Na2CO3溶液反应生成NaHSO3。
9.答案 (1)H 2H2S+O2===2S↓+2H2O 弱
(2)bd
(3)2CO+SO2S+2CO2
解析 (1)X为H2S,其电子式为H;H2S水溶液在空气中变浑浊是因为H2S被氧气氧化为S,反应的化学方程式为2H2S+O2===2S↓+2H2O,该变化说明S的非金属性比O的弱。(2)Na2S2O3中S为+2价,从氧化还原反应的角度分析,反应物中S元素化合价必须分别大于+2价和小于+2价。a中S的化合价都小于+2价,c中S的化合价都大于+2价,b、d符合题意。
10.答案 (1)蒸馏烧瓶 b
(2)①浓硝酸分解,二氧化硫逸出 ②生成的NOSO4H为该反应的催化剂
(3)①作溶剂,同时作吸水剂,防止亚硝酰硫酸遇水分解 ②滴入最后半滴(NH4)2Fe(SO4)2标准溶液,溶液突变为粉红色,且半分钟内不恢复原色 3%
解析 装置A中Na2SO3固体与浓硫酸反应产生SO2,经过装置B干燥SO2,SO2进入C中与浓硝酸、浓硫酸反应生成亚硝酰硫酸,装置D为尾气处理装置,且由于亚硝酰硫酸遇水易分解,装置D还需防止水蒸气进入C中,故装置D可以为盛有碱石灰的装置。(1)盛装Na2SO3固体的仪器为蒸馏烧瓶;装置D的作用是吸收尾气,同时防止水蒸气进入C中,故选择b。(2)①由于反应物浓硝酸受热易挥发、易分解,且温度高不利于SO2溶解,装置C中温度过高产率降低。②开始通入SO2时反应缓慢,生成少量NOSO4H后,温度变化不大,但反应速率明显加快,说明生成的NOSO4H对反应起催化作用。(3)①浓硫酸可将NOSO4H溶解,同时起吸水的作用,防止加入标准溶液时NOSO4H遇水分解。②当滴定达终点时,再加入标准溶液,此时过量的Fe2+会与反应生成的NO结合生成粉红色的FeSO4·NO。③根据得失电子守恒,可得关系式:3(NH4)2Fe(SO4)2~HNO3,故n(HNO3)=n[(NH4)2Fe(SO4)2]=×0.100 0 mol·L-1×0.02 L=×10-3 mol,则产品中HNO3的含量为×100%=3%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
微专题(七)硫及其化合物的相互转化
1.(2023·江西赣州二模)硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是( )
A.硫在过量的氧气中燃烧直接生成Y
B.将X通入BaCl2溶液中有白色沉淀生成
C.M的无水固体粉末显蓝色
D.N与Z反应可生成X
2.(2023·湖南长沙炎德英才月考)天然气是一种重要的化工原料和燃料。常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( )
A.整个脱硫过程中Fe2(SO4)3溶液并未参与反应
B.整个脱硫过程中参加反应的n(H2S)∶n(O2)=2∶1
C.脱硫过程需不断补充FeSO4
D.CH4是天然气脱硫过程的催化剂
3.(2023·浙江绍兴鲁迅中学段考)已知反应S2(aq)+2I-(aq)2S(aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是( )
A.S2中硫元素显+7价
B.反应速率与Fe3+浓度无关
C.由图可知氧化性:Fe3+>S2
D.若不加Fe3+,正反应的活化能比逆反应的小
4.(2023·江苏南通新高考模拟)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种Na2S2O4的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法正确的是( )
A.可用银氨溶液检验甲酸中是否含有甲醛
B.NaCl溶解度大于Na2S2O4·2H2O的溶解度
C.过滤操作中需要用的玻璃仪器只有漏斗、烧杯
D.由溶液A制备Na2S2O4溶液过程中,氧化剂与还原剂物质的量之比为1∶2
5.(2023·湖南五市十校联考)硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,S8环状分子的结构为。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是( )
A.硫单质呈黄色,可用作橡胶硫化剂
B.SO2具有氧化性,可用于漂白草编织物
C.Na2SO3具有还原性,可用于处理自来水中残留的Cl2
D.浓硫酸具有强氧化性,可用作酯化反应的催化剂
6.(2023·浙江义乌中学月考)工业上制备硫酸的流程:FeS2SO2SO3H2SO4,设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.FeS2中Fe2+的未成对电子数目为6
B.SO2的中心原子孤电子对数为1,其空间结构为V形
C.标准状况下,22.4 L SO3中含有氧原子数目为3NA
D.V2O5作催化剂,能降低该反应的活化能,提高SO2的平衡转化率
7.(2023·浙江越州中学段考)工业上可用克劳斯工艺处理含H2S的尾气获得硫黄,工艺流程如下。
含H2S的尾气、空气反应炉
(高温)催化转化器
(高温) 硫冷凝器
(130~200 ℃)排放
已知反应炉中部分H2S发生反应:2H2S+3O22SO2+2H2O。下列说法错误的是( )
A.可用品红溶液检验排放的气体中是否含有二氧化硫
B.每回收32 g单质硫,理论上消耗氧气的体积为33.6 L(标准状况)
C.催化转化器中发生的反应为SO2+2H2S3S+2H2O
D.为提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率约为33.3%
8.(2023·浙江青田中学月考)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式: 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为
①pH=4.1时,Ⅰ中为 (写化学式)溶液。
②工艺中加入Na2CO3固体,并再次充入SO2的目的是 。
9.(2023·浙江金华外国语学校段考)物质类别和核心元素的化合价是研究物质性质的两个重要视角。以硫及其化合物与化合价变化为坐标的二维转化关系如图所示。
回答下列问题:
(1)图中X的电子式为 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式: 。该变化说明S的非金属性比O的 (填“强”或“弱”)。
(2)下列物质用于Na2S2O3的制备,从氧化还原反应的角度考虑,理论上有可能的是 (填字母)。
a.Na2S+S b.Z+S
c.Na2SO3+Y d.NaHS+NaHSO3
(3)治理含CO、SO2的烟道气,以Fe2O3为催化剂,将CO、SO2在380 ℃时转化为S和一种无毒气体,写出该反应的化学方程式: 。
10.(2023·浙江宁波段考)亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是 ,装置D最好选用 (填字母)。
(2)装置C中浓硝酸与SO2在浓硫酸作用下反应制得NOSO4H。
①装置C中温度过高产率降低的原因是 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250 mL锥形瓶中,加入80 mL浓硫酸,用0.100 0 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00 mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①锥形瓶中加入浓硫酸的作用是 。
②判断滴定达到终点的现象是 。
③亚硝酰硫酸中硝酸的含量为 。
微专题(七) 硫及其化合物的相互转化
1.D 硫燃烧只能得到SO2,A项错误;盐酸的酸性大于亚硫酸的酸性,故SO2不与BaCl2溶液反应,B项错误;无水CuSO4为白色,C项错误;Na2S2O3与H2SO4反应可生成SO2,D项正确。
2.B 在脱硫过程中Fe2(SO4)3与H2S发生反应:Fe2(SO4)3+H2S===2FeSO4+H2SO4+S↓,A错误;脱硫过程中Fe2(SO4)3与H2S发生反应:Fe2(SO4)3+H2S===2FeSO4+H2SO4+S↓,然后发生反应:4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O,总反应方程式为2H2S+O2===2S↓+2H2O,故参加反应的n(H2S)∶n(O2)=2∶1,B正确;脱硫过程产生中间产物FeSO4,后该物质又被消耗,FeSO4的物质的量不变,其在流程中循环利用,因此不需补充FeSO4,C错误;CH4在反应过程中没有参加反应,因此不是天然气脱硫过程的催化剂,D错误。
3.D 硫原子最外层只有6个电子,不会显+7价;S2中含有过氧键,存在-1价氧,使得硫元素显+6价,A项错误;铁离子参与反应生成亚铁离子,亚铁离子又转化为铁离子,则铁离子为催化剂,改变反应速率,故反应速率与Fe3+浓度有关,B项错误;氧化剂的氧化性大于氧化产物,由图示第二步反应可知,氧化性:Fe3+
5.C 硫单质可用作橡胶硫化剂,体现的是硫的化学性质,与颜色无关,A不符合题意;SO2用于漂白草编织物,发生非氧化还原反应,体现SO2的漂白性,B不符合题意;Na2SO3具有还原性,与自来水中残留的Cl2发生氧化还原反应,从而去除Cl2,C符合题意;浓硫酸用作酯化反应的催化剂和吸水剂,与氧化性无关,D不符合题意。
6.B Fe2+的电子排布式为1s22s22p63s23p63d6,未成对电子数目为4,故A错误;SO2的中心原子价层电子对数为2+=3,孤电子对数为1,其空间结构为V形,故B正确;标准状况下SO3为固态,所以22.4 L SO3的物质的量大于1 mol,含有氧原子数目大于3NA,故C错误;V2O5作催化剂,能降低该反应的活化能,但不能提高SO2的平衡转化率,故D错误。
7.B 由题干信息可知,反应炉中部分H2S发生反应:2H2S+3O22SO2+2H2O,催化转化器中发生反应:SO2+2H2S3S+2H2O,生成的硫蒸气经硫冷凝器可将硫冷凝下来,变为固体和气体分离。利用SO2可使品红溶液褪色的特性,可用品红溶液检验排放的气体中是否含有二氧化硫,A正确;32 g单质硫的物质的量为=1 mol,由得失电子守恒得2H2S~2S~O2~4e-,故理论上消耗氧气的体积为1 mol××22.4 L·mol-1=11.2 L(标准状况),B错误;由分析可知,催化转化器中发生的反应为SO2+2H2S3S+2H2O,C正确;根据化学方程式2SO2+2H2O、SO2+2H2S3S+2H2O可知,为提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率约为33.3%,D正确。
8.答案 (1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
解析 (1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。(2)①由pH=4.1知,SO2与Na2CO3溶液反应生成NaHSO3。
9.答案 (1)H 2H2S+O2===2S↓+2H2O 弱
(2)bd
(3)2CO+SO2S+2CO2
解析 (1)X为H2S,其电子式为H;H2S水溶液在空气中变浑浊是因为H2S被氧气氧化为S,反应的化学方程式为2H2S+O2===2S↓+2H2O,该变化说明S的非金属性比O的弱。(2)Na2S2O3中S为+2价,从氧化还原反应的角度分析,反应物中S元素化合价必须分别大于+2价和小于+2价。a中S的化合价都小于+2价,c中S的化合价都大于+2价,b、d符合题意。
10.答案 (1)蒸馏烧瓶 b
(2)①浓硝酸分解,二氧化硫逸出 ②生成的NOSO4H为该反应的催化剂
(3)①作溶剂,同时作吸水剂,防止亚硝酰硫酸遇水分解 ②滴入最后半滴(NH4)2Fe(SO4)2标准溶液,溶液突变为粉红色,且半分钟内不恢复原色 3%
解析 装置A中Na2SO3固体与浓硫酸反应产生SO2,经过装置B干燥SO2,SO2进入C中与浓硝酸、浓硫酸反应生成亚硝酰硫酸,装置D为尾气处理装置,且由于亚硝酰硫酸遇水易分解,装置D还需防止水蒸气进入C中,故装置D可以为盛有碱石灰的装置。(1)盛装Na2SO3固体的仪器为蒸馏烧瓶;装置D的作用是吸收尾气,同时防止水蒸气进入C中,故选择b。(2)①由于反应物浓硝酸受热易挥发、易分解,且温度高不利于SO2溶解,装置C中温度过高产率降低。②开始通入SO2时反应缓慢,生成少量NOSO4H后,温度变化不大,但反应速率明显加快,说明生成的NOSO4H对反应起催化作用。(3)①浓硫酸可将NOSO4H溶解,同时起吸水的作用,防止加入标准溶液时NOSO4H遇水分解。②当滴定达终点时,再加入标准溶液,此时过量的Fe2+会与反应生成的NO结合生成粉红色的FeSO4·NO。③根据得失电子守恒,可得关系式:3(NH4)2Fe(SO4)2~HNO3,故n(HNO3)=n[(NH4)2Fe(SO4)2]=×0.100 0 mol·L-1×0.02 L=×10-3 mol,则产品中HNO3的含量为×100%=3%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
