2025浙江专版新教材化学高考第一轮基础练--微专题(十四) 四大平衡常数的相互关系及应用(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--微专题(十四) 四大平衡常数的相互关系及应用(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 488.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:15:18 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
微专题(十四)四大平衡常数的相互关系及应用
1.(2024·浙江衢州、丽水、湖州高三一模)用钛铁矿(主要成分为FeTiO3,含有少量MgO、SiO2等杂质)制备LiFePO4的工艺流程如图所示:
已知:钛铁矿经盐酸浸取后钛主要以TiOC形式存在;Ksp(FePO4)=1.0×10-22,Ksp[Mg3(PO4)2]=1.0×10-24。下列说法不正确的是( )
A.滤液①中含有Fe2+、Mg2+
B.相同温度下溶解度:Mg3(PO4)2>FePO4
C.煅烧的主要反应为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O↑
D.为保证水解过滤时能完全除钛,需调pH至溶液呈碱性
2.常温下,可用下图所示的方法制备FeCO3。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.1×10-11,Ksp[Fe(OH)2]=8.0×10-16。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.反应2HCH2CO3+C的平衡常数K约为1.04×10-4
D.当混合液中c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
3.(2023·浙江嘉兴高三二模)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
物质 Ka或Ksp
CH3COOH 1.75×10-5
H3PO4 =6.9×10-3 =4.8×10-13
Ca5(PO4)3OH 8.0×10-30
Ca5(PO4)3F 4.0×10-60
CaCO3 3.4×10-9
下列说法正确的是( )
A.CH3COOH溶解Ca5(PO4)3OH的离子方程式为Ca5(PO4)3OH+10CH3COOH===5Ca2++10CH3COO-+3H3PO4+H2O
B.牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀
C.当>5.0×10-31时,Ca5(PO4)3OH可与F-反应转化为Ca5(PO4)3F
D.向牙膏中添加NaHCO3、NaF均可增强护齿效果,二者原理相同
4.(2023·浙江6月选考)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。]
下列说法正确的是( )
A.实验 Ⅰ 可选用甲基橙作指示剂,指示反应终点
B.实验 Ⅰ 中V(NaOH)=10 mL时,存在c(C2)C.实验 Ⅱ 中发生反应HC2+Ca2+===CaC2O4↓+H+
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
5.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
6.(2023·全国新课标卷)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3[Ag(NH3)]+和[Ag(NH3)]++NH3
[Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与
lg[c(NH3)/(mol·L-1)]的关系如图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3[Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
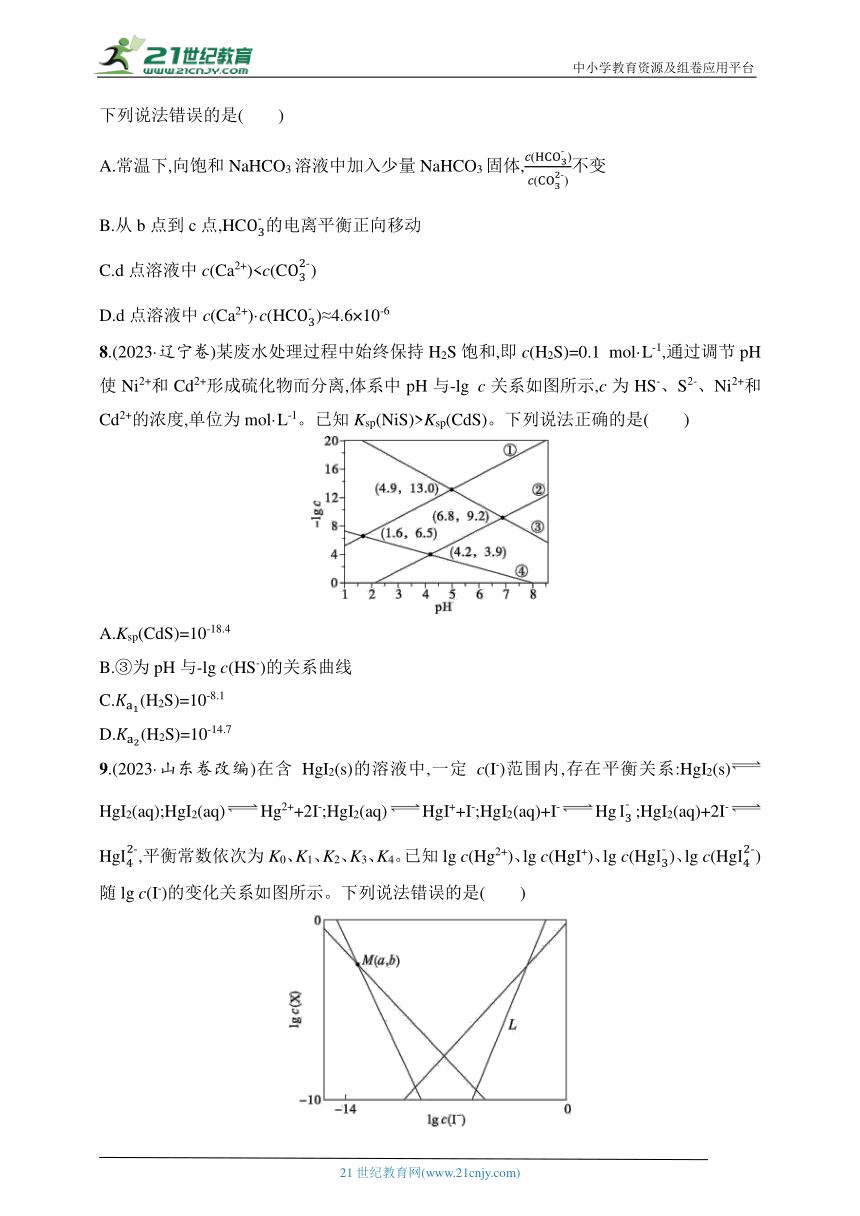
7.常温下,用0.5 mol·L-1 NaHCO3溶液滴定25.00 mL 0.25 mol·L-1 CaCl2溶液,测得混合溶液的pH随滴加NaHCO3溶液体积的变化如图所示,当滴加25.00 mL NaHCO3溶液时出现较为明显的白色沉淀。[已知:常温下,Ksp(CaCO3)=3.4×10-9、(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11,100.8≈6.3。]
下列说法错误的是( )
A.常温下,向饱和NaHCO3溶液中加入少量NaHCO3固体,不变
B.从b点到c点,HC的电离平衡正向移动
C.d点溶液中c(Ca2+)D.d点溶液中c(Ca2+)·c(HC)≈4.6×10-6
8.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS)。下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
9.(2023·山东卷改编)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s)HgI2(aq);HgI2(aq)Hg2++2I-;HgI2(aq)HgI++I-;HgI2(aq)+I-Hg;HgI2(aq)+2I-Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lg c(Hg2+)、lg c(HgI+)、lg c(Hg)、lg c(Hg)随lg c(I-)的变化关系如图所示。下列说法错误的是( )
A.线L表示lg c(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]始终不变
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
微专题(十四) 四大平衡常数的相互关系及应用
1.D 向钛铁矿(主要成分为FeTiO3,含有少量MgO、SiO2等杂质)中加入盐酸,SiO2与盐酸不反应,FeTiO3、MgO分别转化为TiOC、Fe2+、Mg2+,TiOC水解生成TiO2·xH2O,将其过滤后向滤液②中加入双氧水将Fe2+氧化生成Fe3+,加入H3PO4将Fe3+转化成FePO4沉淀,FePO4与Li2CO3、草酸在高温条件下煅烧得到LiFePO4。由以上分析可知,滤液①中含有Fe2+、Mg2+,故A正确;FePO4的溶解度(以浓度表示)为S= mol·L-1=1.0×10-11 mol·L-1,Ksp[Mg3(PO4)2]=(3S)3×(2S)2=1.0×10-24,Mg3(PO4)2的溶解度(以浓度表示)为S= mol·L-1=×10-5 mol·L-1,则相同温度下溶解度:Mg3(PO4)2>FePO4,故B正确;高温煅烧过程中Fe元素化合价由+3价降低至+2价被还原,因此草酸被氧化生成CO2,C元素化合价由+3价升高至+4价,根据氧化还原反应得失电子守恒以及原子守恒可知反应的化学方程式为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O↑,故C正确;若调pH至溶液呈碱性,Fe2+也会形成氢氧化亚铁沉淀,故D错误。
2.C Kb(NH3·H2O)=1.8×10-5、(H2CO3)=4.5×10-7,故0.1 mol·L-1 NH4HCO3溶液中HC的水解程度更大,则c(NH3·H2O)≈1.04×10-4,故C正确;当混合液中c(Fe2+)=0.08 mol·L-1时,c(OH-)= mol·L-1=10-7 mol·L-1,则pH=7,故应控制pH≤7,故D错误。
3.C 醋酸电离平衡常数小于磷酸第一步电离平衡常数,则醋酸酸性小于磷酸,根据强酸制取弱酸原理知,醋酸不能制取磷酸,A错误;牙膏中经常添加碳酸钙,主要是碳酸钙难溶于水,用其作为摩擦剂,而不是增加Ca2+浓度,抑制牙齿腐蚀,B错误;存在Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq),K==2.0×1030,当>5.0×10-31时,Q==2.0×1030=K,则平衡正向移动,所以Ca5(PO4)3OH与F-反应生成Ca5(PO4)3F,C正确;向牙膏中添加NaF可增强护齿效果,是由于Ca5(PO4)3F的溶解度小于Ca5(PO4)3OH,羟基磷酸钙在水中存在溶解平衡:Ca5(PO4)3OH5Ca2++3P+OH-,当F-与Ca2+、P结合生成了更难溶于水的Ca5(PO4)3F时,起到保护牙齿的作用,而NaHCO3可使口腔内的细菌发酵产生的酸性物质逐渐地减少,有助于保护牙齿,减少对牙釉质的损伤,二者原理不相同,D错误。
4.D H2C2O4是一种弱酸,NaHC2O4溶液用NaOH溶液滴定,产物Na2C2O4的溶液呈碱性,应选择酚酞作指示剂,A错误;加入10 mL NaOH溶液时,溶质为等物质的量的NaHC2O4和Na2C2O4,≈1.9×10-10<=5.4×10-5,则HC2的电离程度大于C2的水解程度,溶液中存在:c(C2)>c(HC2),B错误;HC2与H+不能共存,实验Ⅱ中,开始发生反应的化学方程式为Ca2++2HC2===CaC2O4↓+H2C2O4,C错误;当Ca2+过量时,发生反应Ca2++H2C2O4===CaC2O4↓+2H+,加入V(CaCl2)=80 mL时,c(Ca2+)==0.06 mol·L-1,结合Ksp(CaC2O4),即可求出c(C2)==4.0×10-8 mol·L-1,D正确。
5.C 根据图中已知坐标点可知,Ksp(Ag2CrO4)=c2(Ag+)·c(Cr)=(10-5)2×10-1.7=1×10-11.7,Ksp(AgCl)=c(Ag+)·c(Cl-)=10-5×10-4.8=1×10-9.8。a点在Ag2CrO4、AgCl的沉淀溶解平衡曲线上方,对应的离子浓度小,二者均不会生成沉淀,A错误;b点时c(Cl-)=c(Cr),但Ksp只与温度有关,温度不变,Ksp不变,B错误;反应Ag2CrO4+2Cl-2AgCl+Cr的平衡常数K==107.9,C正确;分别计算浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液开始产生沉淀时Ag+的浓度,NaCl溶液中c(Ag+)==1×10-8.8 mol·L-1,Na2CrO4溶液中c(Ag+)= mol·L-1=1×10-5.35 mol·L-1,故向浓度均为0.1 mol·L-1的二者的混合溶液中滴加AgNO3溶液,AgCl先沉淀,D错误。
6.A 溶液中存在足量的AgCl固体,根据平衡移动原理,随着氨水的滴加AgCl溶解度逐渐增大,则Cl-浓度增大、Ag+浓度减小,[Ag(NH3)]+开始占优势,而随着氨水的滴加[Ag(NH3)2]+浓度会逐渐超过[Ag(NH3)]+,结合图像可知,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-。
曲线Ⅰ代表[Ag(NH3)2]+浓度随NH3浓度变化曲线,A错误;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-7.40×10-2.35=10-9.75,B正确;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算反应[Ag(NH3)]++NH3[Ag(NH3)2]+的平衡常数,可得K==103.81,C正确;c(NH3)=0.01 mol·L-1时,lg[c(NH3)/(mol·L-1)]=-2,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确。
7.C 常温下,向饱和NaHCO3溶液中加入少量NaHCO3固体,则溶液仍然为NaHCO3饱和溶液,温度不变NaHCO3的浓度不变,溶液pH值不变,(H2CO3)也不变,不变,A正确;由题干图示信息可知,从b点到c点,溶液的pH一直在降低,说明HC的电离平衡正向移动,B正确;由题干图示信息可知,当滴加25.00 mL NaHCO3溶液时出现较为明显的白色沉淀,说明Ca2+剩余较多,故d点溶液中c(Ca2+)>c(C),C错误;由题干图示信息可知,d点溶液中的pH=7.20,则有c(Ca2+)·c(HC)=
≈4.6×10-6,D正确。
8.D H2S为弱电解质,分步电离,随pH增大,c(HS-)、c(S2-)均应逐渐增大,且pH较小范围内-lg c(S2-)比-lg c(HS-)大,故③为pH与-lg c(S2-)的关系曲线,④为pH与-lg c(HS-)的关系曲线;已知Ksp(NiS)>Ksp(CdS),则①②分别为pH与-lg c(Cd2+)、-lg c(Ni2+)的关系曲线;根据(4.9,13.0)点可知,Ksp(CdS)=c2(Cd2+)=(1×10-13)2=1×10-26,A项错误;根据上述分析③为pH与-lg c(S2-)的关系,B项错误;根据图中(4.2,3.9),可知=10-7.1,C项错误;由曲线上(6.8,9.2)列式可得:=10-14.7,D项正确。
9.D 根据电离平衡可知,I-浓度越大,Hg、Hg的浓度越大,对Hg的形成越有利,因此线L代表的是lg c(Hg)的变化情况,A项正确;已知HgI2(s)HgI2(aq)的化学平衡常数K0=c[HgI2(aq)],温度不变,平衡常数不变,故随c(I-)增大,c[HgI2(aq)]始终不变,B项正确;M点处,lg c(Hg2+)=lg c(HgI+),K1=,K2=,则=c(I-),M点lg c(I-)=a,因此a=lg ,C项正确;HgI2中I元素与Hg元素的物质的量之比为2∶1,该过程中改变I-浓度,故I元素与Hg元素的物质的量之比发生改变,D项错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
微专题(十四)四大平衡常数的相互关系及应用
1.(2024·浙江衢州、丽水、湖州高三一模)用钛铁矿(主要成分为FeTiO3,含有少量MgO、SiO2等杂质)制备LiFePO4的工艺流程如图所示:
已知:钛铁矿经盐酸浸取后钛主要以TiOC形式存在;Ksp(FePO4)=1.0×10-22,Ksp[Mg3(PO4)2]=1.0×10-24。下列说法不正确的是( )
A.滤液①中含有Fe2+、Mg2+
B.相同温度下溶解度:Mg3(PO4)2>FePO4
C.煅烧的主要反应为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O↑
D.为保证水解过滤时能完全除钛,需调pH至溶液呈碱性
2.常温下,可用下图所示的方法制备FeCO3。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.1×10-11,Ksp[Fe(OH)2]=8.0×10-16。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.反应2HCH2CO3+C的平衡常数K约为1.04×10-4
D.当混合液中c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
3.(2023·浙江嘉兴高三二模)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
物质 Ka或Ksp
CH3COOH 1.75×10-5
H3PO4 =6.9×10-3 =4.8×10-13
Ca5(PO4)3OH 8.0×10-30
Ca5(PO4)3F 4.0×10-60
CaCO3 3.4×10-9
下列说法正确的是( )
A.CH3COOH溶解Ca5(PO4)3OH的离子方程式为Ca5(PO4)3OH+10CH3COOH===5Ca2++10CH3COO-+3H3PO4+H2O
B.牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀
C.当>5.0×10-31时,Ca5(PO4)3OH可与F-反应转化为Ca5(PO4)3F
D.向牙膏中添加NaHCO3、NaF均可增强护齿效果,二者原理相同
4.(2023·浙江6月选考)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。]
下列说法正确的是( )
A.实验 Ⅰ 可选用甲基橙作指示剂,指示反应终点
B.实验 Ⅰ 中V(NaOH)=10 mL时,存在c(C2)
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
5.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
6.(2023·全国新课标卷)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3[Ag(NH3)]+和[Ag(NH3)]++NH3
[Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与
lg[c(NH3)/(mol·L-1)]的关系如图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3[Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
7.常温下,用0.5 mol·L-1 NaHCO3溶液滴定25.00 mL 0.25 mol·L-1 CaCl2溶液,测得混合溶液的pH随滴加NaHCO3溶液体积的变化如图所示,当滴加25.00 mL NaHCO3溶液时出现较为明显的白色沉淀。[已知:常温下,Ksp(CaCO3)=3.4×10-9、(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11,100.8≈6.3。]
下列说法错误的是( )
A.常温下,向饱和NaHCO3溶液中加入少量NaHCO3固体,不变
B.从b点到c点,HC的电离平衡正向移动
C.d点溶液中c(Ca2+)
8.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS)。下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
9.(2023·山东卷改编)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s)HgI2(aq);HgI2(aq)Hg2++2I-;HgI2(aq)HgI++I-;HgI2(aq)+I-Hg;HgI2(aq)+2I-Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lg c(Hg2+)、lg c(HgI+)、lg c(Hg)、lg c(Hg)随lg c(I-)的变化关系如图所示。下列说法错误的是( )
A.线L表示lg c(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]始终不变
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
微专题(十四) 四大平衡常数的相互关系及应用
1.D 向钛铁矿(主要成分为FeTiO3,含有少量MgO、SiO2等杂质)中加入盐酸,SiO2与盐酸不反应,FeTiO3、MgO分别转化为TiOC、Fe2+、Mg2+,TiOC水解生成TiO2·xH2O,将其过滤后向滤液②中加入双氧水将Fe2+氧化生成Fe3+,加入H3PO4将Fe3+转化成FePO4沉淀,FePO4与Li2CO3、草酸在高温条件下煅烧得到LiFePO4。由以上分析可知,滤液①中含有Fe2+、Mg2+,故A正确;FePO4的溶解度(以浓度表示)为S= mol·L-1=1.0×10-11 mol·L-1,Ksp[Mg3(PO4)2]=(3S)3×(2S)2=1.0×10-24,Mg3(PO4)2的溶解度(以浓度表示)为S= mol·L-1=×10-5 mol·L-1,则相同温度下溶解度:Mg3(PO4)2>FePO4,故B正确;高温煅烧过程中Fe元素化合价由+3价降低至+2价被还原,因此草酸被氧化生成CO2,C元素化合价由+3价升高至+4价,根据氧化还原反应得失电子守恒以及原子守恒可知反应的化学方程式为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O↑,故C正确;若调pH至溶液呈碱性,Fe2+也会形成氢氧化亚铁沉淀,故D错误。
2.C Kb(NH3·H2O)=1.8×10-5、(H2CO3)=4.5×10-7,故0.1 mol·L-1 NH4HCO3溶液中HC的水解程度更大,则c(NH3·H2O)
3.C 醋酸电离平衡常数小于磷酸第一步电离平衡常数,则醋酸酸性小于磷酸,根据强酸制取弱酸原理知,醋酸不能制取磷酸,A错误;牙膏中经常添加碳酸钙,主要是碳酸钙难溶于水,用其作为摩擦剂,而不是增加Ca2+浓度,抑制牙齿腐蚀,B错误;存在Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq),K==2.0×1030,当>5.0×10-31时,Q==2.0×1030=K,则平衡正向移动,所以Ca5(PO4)3OH与F-反应生成Ca5(PO4)3F,C正确;向牙膏中添加NaF可增强护齿效果,是由于Ca5(PO4)3F的溶解度小于Ca5(PO4)3OH,羟基磷酸钙在水中存在溶解平衡:Ca5(PO4)3OH5Ca2++3P+OH-,当F-与Ca2+、P结合生成了更难溶于水的Ca5(PO4)3F时,起到保护牙齿的作用,而NaHCO3可使口腔内的细菌发酵产生的酸性物质逐渐地减少,有助于保护牙齿,减少对牙釉质的损伤,二者原理不相同,D错误。
4.D H2C2O4是一种弱酸,NaHC2O4溶液用NaOH溶液滴定,产物Na2C2O4的溶液呈碱性,应选择酚酞作指示剂,A错误;加入10 mL NaOH溶液时,溶质为等物质的量的NaHC2O4和Na2C2O4,≈1.9×10-10<=5.4×10-5,则HC2的电离程度大于C2的水解程度,溶液中存在:c(C2)>c(HC2),B错误;HC2与H+不能共存,实验Ⅱ中,开始发生反应的化学方程式为Ca2++2HC2===CaC2O4↓+H2C2O4,C错误;当Ca2+过量时,发生反应Ca2++H2C2O4===CaC2O4↓+2H+,加入V(CaCl2)=80 mL时,c(Ca2+)==0.06 mol·L-1,结合Ksp(CaC2O4),即可求出c(C2)==4.0×10-8 mol·L-1,D正确。
5.C 根据图中已知坐标点可知,Ksp(Ag2CrO4)=c2(Ag+)·c(Cr)=(10-5)2×10-1.7=1×10-11.7,Ksp(AgCl)=c(Ag+)·c(Cl-)=10-5×10-4.8=1×10-9.8。a点在Ag2CrO4、AgCl的沉淀溶解平衡曲线上方,对应的离子浓度小,二者均不会生成沉淀,A错误;b点时c(Cl-)=c(Cr),但Ksp只与温度有关,温度不变,Ksp不变,B错误;反应Ag2CrO4+2Cl-2AgCl+Cr的平衡常数K==107.9,C正确;分别计算浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液开始产生沉淀时Ag+的浓度,NaCl溶液中c(Ag+)==1×10-8.8 mol·L-1,Na2CrO4溶液中c(Ag+)= mol·L-1=1×10-5.35 mol·L-1,故向浓度均为0.1 mol·L-1的二者的混合溶液中滴加AgNO3溶液,AgCl先沉淀,D错误。
6.A 溶液中存在足量的AgCl固体,根据平衡移动原理,随着氨水的滴加AgCl溶解度逐渐增大,则Cl-浓度增大、Ag+浓度减小,[Ag(NH3)]+开始占优势,而随着氨水的滴加[Ag(NH3)2]+浓度会逐渐超过[Ag(NH3)]+,结合图像可知,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-。
曲线Ⅰ代表[Ag(NH3)2]+浓度随NH3浓度变化曲线,A错误;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-7.40×10-2.35=10-9.75,B正确;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算反应[Ag(NH3)]++NH3[Ag(NH3)2]+的平衡常数,可得K==103.81,C正确;c(NH3)=0.01 mol·L-1时,lg[c(NH3)/(mol·L-1)]=-2,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确。
7.C 常温下,向饱和NaHCO3溶液中加入少量NaHCO3固体,则溶液仍然为NaHCO3饱和溶液,温度不变NaHCO3的浓度不变,溶液pH值不变,(H2CO3)也不变,不变,A正确;由题干图示信息可知,从b点到c点,溶液的pH一直在降低,说明HC的电离平衡正向移动,B正确;由题干图示信息可知,当滴加25.00 mL NaHCO3溶液时出现较为明显的白色沉淀,说明Ca2+剩余较多,故d点溶液中c(Ca2+)>c(C),C错误;由题干图示信息可知,d点溶液中的pH=7.20,则有c(Ca2+)·c(HC)=
≈4.6×10-6,D正确。
8.D H2S为弱电解质,分步电离,随pH增大,c(HS-)、c(S2-)均应逐渐增大,且pH较小范围内-lg c(S2-)比-lg c(HS-)大,故③为pH与-lg c(S2-)的关系曲线,④为pH与-lg c(HS-)的关系曲线;已知Ksp(NiS)>Ksp(CdS),则①②分别为pH与-lg c(Cd2+)、-lg c(Ni2+)的关系曲线;根据(4.9,13.0)点可知,Ksp(CdS)=c2(Cd2+)=(1×10-13)2=1×10-26,A项错误;根据上述分析③为pH与-lg c(S2-)的关系,B项错误;根据图中(4.2,3.9),可知=10-7.1,C项错误;由曲线上(6.8,9.2)列式可得:=10-14.7,D项正确。
9.D 根据电离平衡可知,I-浓度越大,Hg、Hg的浓度越大,对Hg的形成越有利,因此线L代表的是lg c(Hg)的变化情况,A项正确;已知HgI2(s)HgI2(aq)的化学平衡常数K0=c[HgI2(aq)],温度不变,平衡常数不变,故随c(I-)增大,c[HgI2(aq)]始终不变,B项正确;M点处,lg c(Hg2+)=lg c(HgI+),K1=,K2=,则=c(I-),M点lg c(I-)=a,因此a=lg ,C项正确;HgI2中I元素与Hg元素的物质的量之比为2∶1,该过程中改变I-浓度,故I元素与Hg元素的物质的量之比发生改变,D项错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
