2025浙江专版新教材化学高考第一轮基础练--微专题(五)含铁物质的转化与制备(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--微专题(五)含铁物质的转化与制备(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 443.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:17:03 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
微专题(五)含铁物质的转化与制备
1.(2023·浙江嘉善第二高级中学段考)用含少量FeS的废铁屑为原料制备FeCO3的流程如图:
下列说法错误的是( )
A.“除油”中适当提高温度有利于去除油污
B.“浸出”中炭黑的作用是加快铁屑溶解
C.“浸出”产生的气体是H2S
D.“沉铁”发生反应的离子方程式为Fe2+↓+CO2↑+H2O
2.(2023·浙江磐安中学检测)在实验室和生活中高铁酸钾都是一种应用十分广泛的盐类,如下有几种制备方式,湿法:2Fe3++3ClO-+10OH-===2+3Cl-+5H2O
干法:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
电解法:Fe-6e-+8OH-+4H2O
下列选项中说法正确的是( )
A.实验室中常用钾盐而不是钠盐原因是钠盐易风化导致固体结块
B.物质的氧化性和还原性在水溶液中和非水体系中不一定相同
C.高铁酸钾在生活中可用于杀菌因为具有强氧化性;高铁酸钾不可用作净水剂,因为高铁酸根离子不能水解生成胶体
D.高铁酸根离子在酸性或中性溶液中分解,将生成的气体收集在试管中,点燃的小木条靠近可以听到轻微的爆鸣声,且该气体在能源方面有很广泛的发展前景,常用作清洁能源
3.(2023·浙江德清高级中学段考改编)FeOOH为一种不溶于水的黄色固体。某学校以Fe2O3废料(含少量SiO2、FeO等)为原料制备FeOOH,流程如图所示。
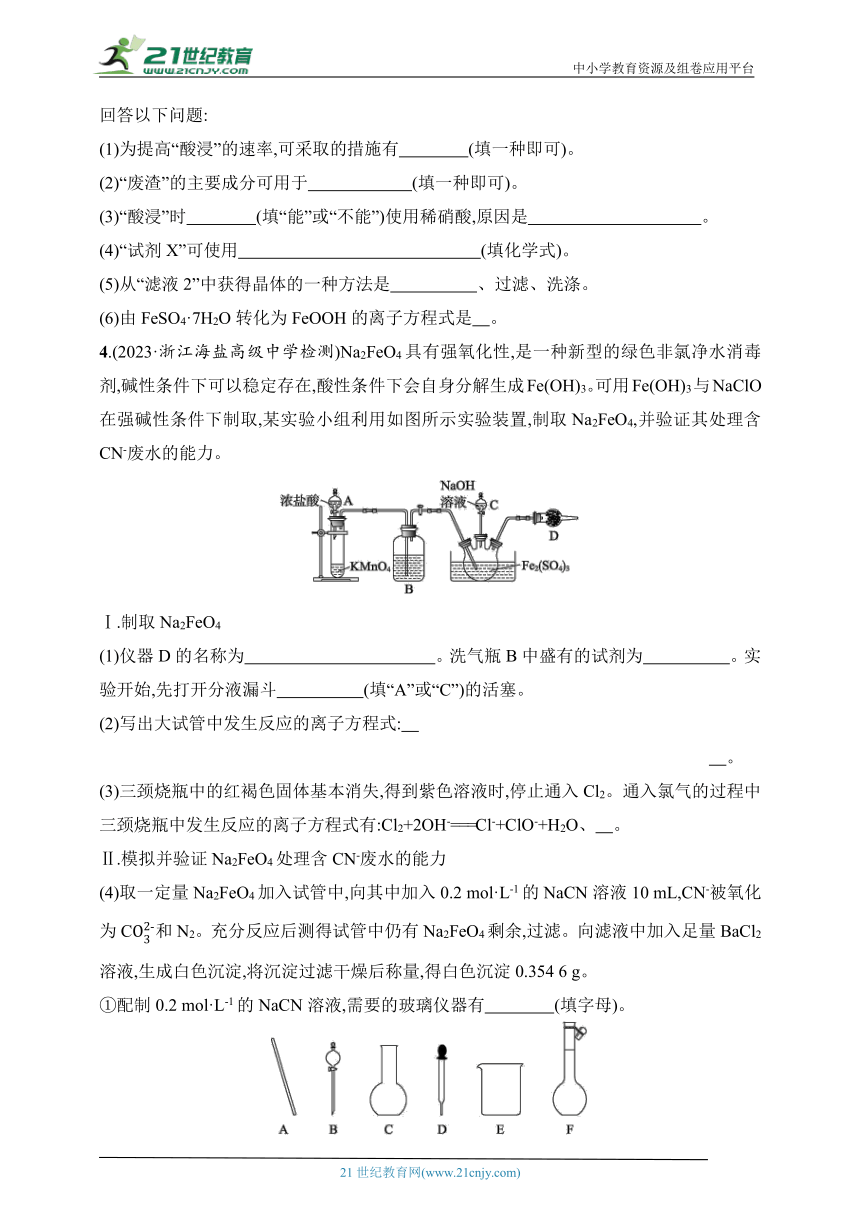
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有 (填一种即可)。
(2)“废渣”的主要成分可用于 (填一种即可)。
(3)“酸浸”时 (填“能”或“不能”)使用稀硝酸,原因是 。
(4)“试剂X”可使用 (填化学式)。
(5)从“滤液2”中获得晶体的一种方法是 、过滤、洗涤。
(6)由FeSO4·7H2O转化为FeOOH的离子方程式是 。
4.(2023·浙江海盐高级中学检测)Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4,并验证其处理含CN-废水的能力。
Ⅰ.制取Na2FeO4
(1)仪器D的名称为 。洗气瓶B中盛有的试剂为 。实验开始,先打开分液漏斗 (填“A”或“C”)的活塞。
(2)写出大试管中发生反应的离子方程式:
。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-===Cl-+ClO-+H2O、 。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2 mol·L-1的NaCN溶液10 mL,CN-被氧化为C和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.354 6 g。
①配制0.2 mol·L-1的NaCN溶液,需要的玻璃仪器有 (填字母)。
②计算NaCN溶液中CN-的去除率为 (保留两位有效数字)。
5.EDTA铁钠(用NaFeY·3H2O表示,摩尔质量为421 g· mol-1)为高效补血的新型铁强化剂,易溶于水,难溶于乙醇,与酸反应可解离出Fe3+。实验室制备少量EDTA铁钠原理为2Fe(OH)3+Na2CO3+2H4Y===2(NaFeY·3H2O)+CO2↑+H2O。
已知EDTA(乙二胺四乙酸,可表示为H4Y)熔点240 ℃,不溶于冷水、乙醇、酸和一般有机溶剂,溶于碳酸钠溶液。能与碱金属和过渡金属等形成极稳定的水溶性络合物。
实验步骤:
(ⅰ)制备Fe(OH)3:取一定量FeCl3·6H2O于烧杯中溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。
(ⅱ)制备EDTA铁钠:将Fe(OH)3、EDTA、H2O加入三颈烧瓶中(装置如图所示),搅拌,缓慢滴加Na2CO3溶液,控温80 ℃,反应60 min。经过蒸发浓缩,冷却结晶,过滤后先用冰水洗涤,再用乙醇洗涤,晾干得到产品。
请回答:
(1)步骤(ⅰ)溶解时,是否需要先将FeCl3·6H2O溶解于适量浓盐酸后再稀释 (填“是”或“否”)。
(2)下列有关过滤、洗涤的操作不正确的是 。
A.过滤需遵循“一贴、二低、三靠”原则,其中玻璃棒的下端需用力紧靠三层滤纸处
B.过滤前需将沉淀和溶液搅浑后一起转移到过滤器中,可缩短过滤时间
C.洗涤需遵循“少量多次”原则,既可将沉淀洗净,又尽可能减少沉淀的溶解损失
D.步骤(ⅰ)中可用AgNO3溶液验证沉淀是否已洗净
(3)装置中若恒压滴液漏斗替换为普通分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因是 。
(4)步骤(ⅱ)中用乙醇洗涤的目的是 。
(5)称取m g晶体样品,加稀硫酸溶解后配成100 mL溶液。取出10.00 mL该溶液,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,用c mol·L-1 Na2S2O3标准溶液滴定,重复操作2~3次,平均消耗Na2S2O3标准溶液V mL。
已知:I2+2Na2S2O3===2NaI+Na2S4O6。
①KI发生反应的离子方程式为
。
②样品中NaFeY·3H2O的质量分数是 %(用含m、c、V的代数式表示)。
③若滴定过程较缓慢,则测得样品中NaFeY·3H2O的质量分数 (填“偏小”“偏大”或“无影响”)。
6.(2022·天津卷节选)氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.FeCl3·6H2O的制备
制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为 。
含有少量铜的废铁屑比纯铁屑反应快,原因为 。
(2)操作①所必需的玻璃仪器中,除烧杯外还有 。
(3)检验FeCl3溶液中是否残留Fe2+的试剂是 。
(4)为增大FeCl3溶液的浓度,向稀FeCl3溶液中加入纯Fe粉后通入Cl2。此过程中发生的主要反应的离子方程式为 。
(5)操作②为 。
Ⅱ.由FeCl3·6H2O制备无水FeCl3
将FeCl3·6H2O与液体SOCl2混合并加热,制得无水FeCl3。已知SOCl2沸点为77 ℃,反应方程式为FeCl3·6H2O+6SOCl2FeCl3+6SO2↑+12HCl↑,装置如下图所示(夹持和加热装置略)。
(6)仪器A的作用为 。NaOH溶液的作用是 。
(7)干燥管中无水CaCl2不能换成碱石灰,原因是 。
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是 (填字母)。
a.ZnCl2·H2O b.CuSO4·5H2O
c.Na2S2O3·5H2O
微专题(五) 含铁物质的转化与制备
1.C “除油”中适当提高温度可促进碳酸钠的水解,使其溶液碱性增强,有利于油脂的水解除去,故A正确;“浸出”中炭黑、铁屑和硫酸溶液构成原电池,铁屑作负极,可加快铁屑溶解,故B正确;“浸出”时铁与硫酸反应生成氢气,故C错误;在硫酸亚铁溶液中加碳酸氢铵,两者反应生成碳酸亚铁,反应的离子方程式为Fe2++2HC↓+CO2↑+H2O,故D正确。
2.B 实验室中常用钾盐而不是钠盐原因是钠盐的吸湿能力比钾盐强,钠盐易出现固体结块,故A错误;溶剂的极性对氧化性和还原性产生较大的影响,因此物质的氧化性和还原性在水溶液中和非水体系中不一定相同,故B正确;高铁酸钾具有强氧化性,生成的还原产物铁离子水解生成胶体,具有吸附杂质的作用,因此高铁酸钾可用作净水剂,故C错误;根据化合价升降守恒,铁元素化合价降低,则应该是氧元素化合价升高,因此将分解生成的气体收集在试管中,点燃的小木条靠近,不会听到轻微的爆鸣声,故D错误。
3.答案 (1)废料粉碎、适当升高温度、适当增大硫酸浓度等(或其他合理答案,填一种即可)
(2)制取单晶硅(或其他合理答案,填一种即可)
(3)不能 反应放出有毒的一氧化氮等氮氧化物
(4)Fe (5)蒸发浓缩、降温结晶
(6)4Fe2++8OH-+O2===4FeOOH↓+2H2O
解析 Fe2O3废料,加入硫酸酸浸,二氧化硅不反应成为废渣,含铁氧化物转化为硫酸盐,加入过量铁,将三价铁转化为二价铁,加入乙醇促使硫酸亚铁晶体析出,晶体与氢氧化钠溶液、空气反应得到FeOOH。
(2)根据分析,废渣主要为二氧化硅,可以用于制取单晶硅。(3)硝酸与亚铁离子反应放出有毒的一氧化氮等气体,故“酸浸”时不能使用稀硝酸。(4)试剂X将三价铁转化为二价铁,且不引入新杂质,故为铁。(5)从“滤液2”中获得晶体,其方法可以为蒸发浓缩、降温结晶、过滤、洗涤。
4.答案 (1)球形干燥管 饱和食盐水 C
(2)2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)2Fe(OH)3+3ClO-+4OH-===2+3Cl-+5H2O
(4)①ADEF ②90%
解析 (1)仪器D为球形干燥管;洗气瓶B中盛有的试剂是饱和食盐水,用来除去混合气体中的氯化氢;因为实验中需要保持碱性环境,因此先向Fe2溶液中加入NaOH溶液,再通入Cl2,所以先打开C的活塞。(2)大试管中的KMnO4与浓盐酸反应的离子方程式为2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(3)结合化合价升降相等、原子守恒、电荷守恒的知识可写出制取Na2FeO4的离子方程式:2Fe(OH)3+3ClO-+4OH-===2+3Cl-+5H2O。(4)溶液配制需要胶头滴管、烧杯、250 mL容量瓶、玻璃棒;n(BaCO3)==0.001 8 mol,所以CN-的去除率为×100%=90%。
5.答案 (1)否 (2)AB
(3)体系密封,反应加热且产生气体,使得三颈烧瓶内压强增大
(4)洗去表面的水分,乙醇易挥发,有利于产品快速干燥
(5)①2Fe3++2I-===2Fe2++I2 ② ③偏大
解析 (1)FeCl3水解生成氢氧化铁和HCl,本题配制FeCl3溶液是为了制备氢氧化铁,故无需先将FeCl3·6H2O溶解于适量浓盐酸后再稀释。(2)过滤需遵循“一贴、二低、三靠”原则,其中玻璃棒的下端紧靠三层滤纸处,不能用力,否则可能戳破滤纸,A错误;过滤前将沉淀和溶液搅浑后一起转移到过滤器中会延长过滤时间,B错误;洗涤的目的是将沉淀洗净且尽可能减少沉淀的溶解损失,需遵循“少量多次”原则,即每次让洗涤液刚好浸没沉淀,然后让其自由流下,如此进行多次,C正确;步骤(ⅰ)中NH3·H2O与FeCl3反应生成Fe(OH)3和NH4Cl,洗涤时,若没有洗净则Fe(OH)3沉淀表面会有NH4Cl,可用AgNO3溶液检验沉淀表面是否有Cl-来验证沉淀是否已洗净,D正确。(3)恒压滴液漏斗比起普通分液漏斗来说有平衡气压、使液体顺利滴下的作用,装置中若恒压滴液漏斗替换为普通分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因是体系密封,反应加热且产生气体,使得三颈烧瓶内压强增大。(4)乙醇易挥发,容易带走水分,易干燥,故步骤(ⅱ)中用乙醇洗涤的目的是洗去表面的水分,乙醇易挥发,有利于产品快速干燥。(5)①由Na2S2O3标准溶液滴定I2可知KI被Fe3+氧化为I2,发生反应的离子方程式为2Fe3++2I-+I2;②由2Fe3++2I-===2Fe2++I2、I2+2Na2S2O3===2NaI+Na2S4O6可知存在2(NaFeY·3H2O)~I2~2Na2S2O3,平均消耗Na2S2O3标准溶液V mL,则n(Na2S2O3)=c×V×10-3 mol,样品中n(NaFeY·3H2O)=10n(Na2S2O3)=cV×10-2 mol,m(NaFeY·3H2O)=cV×10-2 mol×421 g· mol-1=4.21cV g,样品中NaFeY·3H2O的质量分数=×100%=%;③若滴定过程较缓慢,则过量的KI可能被空气中的氧气氧化为I2,则消耗Na2S2O3标准溶液体积偏大,测得样品中NaFeY·3H2O的质量分数偏大。
6.答案 (1)不再有气泡产生 Fe、Cu在稀盐酸中形成原电池,加快反应速率
(2)漏斗、玻璃棒 (3)K3[Fe(CN)6]溶液
(4)2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-
(5)在HCl气流中蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到FeCl3·6H2O晶体
(6)冷凝回流SOCl2 吸收SO2、HCl等尾气,防止污染
(7)碱石灰与SO2、HCl气体反应,失去干燥作用
(8)a
解析 稀盐酸中加入废铁屑,铜不与盐酸反应,过滤,向滤液中通入氯气反应生成氯化铁,稀氯化铁溶液再加入铁反应生成氯化亚铁,氯化亚铁和氯气反应生成氯化铁,由浓氯化铁溶液制备FeCl3·6H2O,稀氯化铁溶液在HCl气流中蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到FeCl3·6H2O晶体。将FeCl3·6H2O与液体SOCl2混合并加热来制备无水FeCl3。(1)含有少量铜的废铁屑比纯铁屑反应快,原因为Fe、Cu在稀盐酸中形成原电池,加快反应速率。(3)Fe2+和K3[Fe(CN)6]溶液反应生成蓝色沉淀,因此检验FeCl3溶液中是否残留Fe2+的试剂是K3[Fe(CN)6]溶液。(4)为增大FeCl3溶液的浓度,向稀FeCl3溶液中加入纯Fe粉后通入Cl2,先是铁和铁离子反应生成Fe2+,再是Fe2+被氯气氧化为铁离子,主要反应的离子方程式为2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-。(5)操作②是氯化铁溶液到FeCl3·6H2O晶体,由于铁离子加热时发生水解生成氢氧化铁,因此在整个过程中要通入HCl气体防止铁离子水解。(6)由于SOCl2沸点为77 ℃,为充分利用SOCl2,不能使其逸出,因此球形冷凝管的作用为冷凝回流SOCl2。由于二氧化硫、HCl逸出污染环境,因此NaOH溶液的作用是吸收SO2、HCl等尾气,防止污染。(7)无水CaCl2的作用是干燥气体,不是与二氧化硫、HCl气体反应,干燥管中无水CaCl2不能换成碱石灰,原因是碱石灰与SO2、HCl气体反应,失去干燥作用。(8)根据装置图信息,该装置可用于制取能水解的盐酸盐晶体,适宜使用上述方法的是a。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
微专题(五)含铁物质的转化与制备
1.(2023·浙江嘉善第二高级中学段考)用含少量FeS的废铁屑为原料制备FeCO3的流程如图:
下列说法错误的是( )
A.“除油”中适当提高温度有利于去除油污
B.“浸出”中炭黑的作用是加快铁屑溶解
C.“浸出”产生的气体是H2S
D.“沉铁”发生反应的离子方程式为Fe2+↓+CO2↑+H2O
2.(2023·浙江磐安中学检测)在实验室和生活中高铁酸钾都是一种应用十分广泛的盐类,如下有几种制备方式,湿法:2Fe3++3ClO-+10OH-===2+3Cl-+5H2O
干法:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
电解法:Fe-6e-+8OH-+4H2O
下列选项中说法正确的是( )
A.实验室中常用钾盐而不是钠盐原因是钠盐易风化导致固体结块
B.物质的氧化性和还原性在水溶液中和非水体系中不一定相同
C.高铁酸钾在生活中可用于杀菌因为具有强氧化性;高铁酸钾不可用作净水剂,因为高铁酸根离子不能水解生成胶体
D.高铁酸根离子在酸性或中性溶液中分解,将生成的气体收集在试管中,点燃的小木条靠近可以听到轻微的爆鸣声,且该气体在能源方面有很广泛的发展前景,常用作清洁能源
3.(2023·浙江德清高级中学段考改编)FeOOH为一种不溶于水的黄色固体。某学校以Fe2O3废料(含少量SiO2、FeO等)为原料制备FeOOH,流程如图所示。
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有 (填一种即可)。
(2)“废渣”的主要成分可用于 (填一种即可)。
(3)“酸浸”时 (填“能”或“不能”)使用稀硝酸,原因是 。
(4)“试剂X”可使用 (填化学式)。
(5)从“滤液2”中获得晶体的一种方法是 、过滤、洗涤。
(6)由FeSO4·7H2O转化为FeOOH的离子方程式是 。
4.(2023·浙江海盐高级中学检测)Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4,并验证其处理含CN-废水的能力。
Ⅰ.制取Na2FeO4
(1)仪器D的名称为 。洗气瓶B中盛有的试剂为 。实验开始,先打开分液漏斗 (填“A”或“C”)的活塞。
(2)写出大试管中发生反应的离子方程式:
。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-===Cl-+ClO-+H2O、 。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2 mol·L-1的NaCN溶液10 mL,CN-被氧化为C和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.354 6 g。
①配制0.2 mol·L-1的NaCN溶液,需要的玻璃仪器有 (填字母)。
②计算NaCN溶液中CN-的去除率为 (保留两位有效数字)。
5.EDTA铁钠(用NaFeY·3H2O表示,摩尔质量为421 g· mol-1)为高效补血的新型铁强化剂,易溶于水,难溶于乙醇,与酸反应可解离出Fe3+。实验室制备少量EDTA铁钠原理为2Fe(OH)3+Na2CO3+2H4Y===2(NaFeY·3H2O)+CO2↑+H2O。
已知EDTA(乙二胺四乙酸,可表示为H4Y)熔点240 ℃,不溶于冷水、乙醇、酸和一般有机溶剂,溶于碳酸钠溶液。能与碱金属和过渡金属等形成极稳定的水溶性络合物。
实验步骤:
(ⅰ)制备Fe(OH)3:取一定量FeCl3·6H2O于烧杯中溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。
(ⅱ)制备EDTA铁钠:将Fe(OH)3、EDTA、H2O加入三颈烧瓶中(装置如图所示),搅拌,缓慢滴加Na2CO3溶液,控温80 ℃,反应60 min。经过蒸发浓缩,冷却结晶,过滤后先用冰水洗涤,再用乙醇洗涤,晾干得到产品。
请回答:
(1)步骤(ⅰ)溶解时,是否需要先将FeCl3·6H2O溶解于适量浓盐酸后再稀释 (填“是”或“否”)。
(2)下列有关过滤、洗涤的操作不正确的是 。
A.过滤需遵循“一贴、二低、三靠”原则,其中玻璃棒的下端需用力紧靠三层滤纸处
B.过滤前需将沉淀和溶液搅浑后一起转移到过滤器中,可缩短过滤时间
C.洗涤需遵循“少量多次”原则,既可将沉淀洗净,又尽可能减少沉淀的溶解损失
D.步骤(ⅰ)中可用AgNO3溶液验证沉淀是否已洗净
(3)装置中若恒压滴液漏斗替换为普通分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因是 。
(4)步骤(ⅱ)中用乙醇洗涤的目的是 。
(5)称取m g晶体样品,加稀硫酸溶解后配成100 mL溶液。取出10.00 mL该溶液,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,用c mol·L-1 Na2S2O3标准溶液滴定,重复操作2~3次,平均消耗Na2S2O3标准溶液V mL。
已知:I2+2Na2S2O3===2NaI+Na2S4O6。
①KI发生反应的离子方程式为
。
②样品中NaFeY·3H2O的质量分数是 %(用含m、c、V的代数式表示)。
③若滴定过程较缓慢,则测得样品中NaFeY·3H2O的质量分数 (填“偏小”“偏大”或“无影响”)。
6.(2022·天津卷节选)氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.FeCl3·6H2O的制备
制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为 。
含有少量铜的废铁屑比纯铁屑反应快,原因为 。
(2)操作①所必需的玻璃仪器中,除烧杯外还有 。
(3)检验FeCl3溶液中是否残留Fe2+的试剂是 。
(4)为增大FeCl3溶液的浓度,向稀FeCl3溶液中加入纯Fe粉后通入Cl2。此过程中发生的主要反应的离子方程式为 。
(5)操作②为 。
Ⅱ.由FeCl3·6H2O制备无水FeCl3
将FeCl3·6H2O与液体SOCl2混合并加热,制得无水FeCl3。已知SOCl2沸点为77 ℃,反应方程式为FeCl3·6H2O+6SOCl2FeCl3+6SO2↑+12HCl↑,装置如下图所示(夹持和加热装置略)。
(6)仪器A的作用为 。NaOH溶液的作用是 。
(7)干燥管中无水CaCl2不能换成碱石灰,原因是 。
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是 (填字母)。
a.ZnCl2·H2O b.CuSO4·5H2O
c.Na2S2O3·5H2O
微专题(五) 含铁物质的转化与制备
1.C “除油”中适当提高温度可促进碳酸钠的水解,使其溶液碱性增强,有利于油脂的水解除去,故A正确;“浸出”中炭黑、铁屑和硫酸溶液构成原电池,铁屑作负极,可加快铁屑溶解,故B正确;“浸出”时铁与硫酸反应生成氢气,故C错误;在硫酸亚铁溶液中加碳酸氢铵,两者反应生成碳酸亚铁,反应的离子方程式为Fe2++2HC↓+CO2↑+H2O,故D正确。
2.B 实验室中常用钾盐而不是钠盐原因是钠盐的吸湿能力比钾盐强,钠盐易出现固体结块,故A错误;溶剂的极性对氧化性和还原性产生较大的影响,因此物质的氧化性和还原性在水溶液中和非水体系中不一定相同,故B正确;高铁酸钾具有强氧化性,生成的还原产物铁离子水解生成胶体,具有吸附杂质的作用,因此高铁酸钾可用作净水剂,故C错误;根据化合价升降守恒,铁元素化合价降低,则应该是氧元素化合价升高,因此将分解生成的气体收集在试管中,点燃的小木条靠近,不会听到轻微的爆鸣声,故D错误。
3.答案 (1)废料粉碎、适当升高温度、适当增大硫酸浓度等(或其他合理答案,填一种即可)
(2)制取单晶硅(或其他合理答案,填一种即可)
(3)不能 反应放出有毒的一氧化氮等氮氧化物
(4)Fe (5)蒸发浓缩、降温结晶
(6)4Fe2++8OH-+O2===4FeOOH↓+2H2O
解析 Fe2O3废料,加入硫酸酸浸,二氧化硅不反应成为废渣,含铁氧化物转化为硫酸盐,加入过量铁,将三价铁转化为二价铁,加入乙醇促使硫酸亚铁晶体析出,晶体与氢氧化钠溶液、空气反应得到FeOOH。
(2)根据分析,废渣主要为二氧化硅,可以用于制取单晶硅。(3)硝酸与亚铁离子反应放出有毒的一氧化氮等气体,故“酸浸”时不能使用稀硝酸。(4)试剂X将三价铁转化为二价铁,且不引入新杂质,故为铁。(5)从“滤液2”中获得晶体,其方法可以为蒸发浓缩、降温结晶、过滤、洗涤。
4.答案 (1)球形干燥管 饱和食盐水 C
(2)2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(3)2Fe(OH)3+3ClO-+4OH-===2+3Cl-+5H2O
(4)①ADEF ②90%
解析 (1)仪器D为球形干燥管;洗气瓶B中盛有的试剂是饱和食盐水,用来除去混合气体中的氯化氢;因为实验中需要保持碱性环境,因此先向Fe2溶液中加入NaOH溶液,再通入Cl2,所以先打开C的活塞。(2)大试管中的KMnO4与浓盐酸反应的离子方程式为2Mn+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(3)结合化合价升降相等、原子守恒、电荷守恒的知识可写出制取Na2FeO4的离子方程式:2Fe(OH)3+3ClO-+4OH-===2+3Cl-+5H2O。(4)溶液配制需要胶头滴管、烧杯、250 mL容量瓶、玻璃棒;n(BaCO3)==0.001 8 mol,所以CN-的去除率为×100%=90%。
5.答案 (1)否 (2)AB
(3)体系密封,反应加热且产生气体,使得三颈烧瓶内压强增大
(4)洗去表面的水分,乙醇易挥发,有利于产品快速干燥
(5)①2Fe3++2I-===2Fe2++I2 ② ③偏大
解析 (1)FeCl3水解生成氢氧化铁和HCl,本题配制FeCl3溶液是为了制备氢氧化铁,故无需先将FeCl3·6H2O溶解于适量浓盐酸后再稀释。(2)过滤需遵循“一贴、二低、三靠”原则,其中玻璃棒的下端紧靠三层滤纸处,不能用力,否则可能戳破滤纸,A错误;过滤前将沉淀和溶液搅浑后一起转移到过滤器中会延长过滤时间,B错误;洗涤的目的是将沉淀洗净且尽可能减少沉淀的溶解损失,需遵循“少量多次”原则,即每次让洗涤液刚好浸没沉淀,然后让其自由流下,如此进行多次,C正确;步骤(ⅰ)中NH3·H2O与FeCl3反应生成Fe(OH)3和NH4Cl,洗涤时,若没有洗净则Fe(OH)3沉淀表面会有NH4Cl,可用AgNO3溶液检验沉淀表面是否有Cl-来验证沉淀是否已洗净,D正确。(3)恒压滴液漏斗比起普通分液漏斗来说有平衡气压、使液体顺利滴下的作用,装置中若恒压滴液漏斗替换为普通分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因是体系密封,反应加热且产生气体,使得三颈烧瓶内压强增大。(4)乙醇易挥发,容易带走水分,易干燥,故步骤(ⅱ)中用乙醇洗涤的目的是洗去表面的水分,乙醇易挥发,有利于产品快速干燥。(5)①由Na2S2O3标准溶液滴定I2可知KI被Fe3+氧化为I2,发生反应的离子方程式为2Fe3++2I-+I2;②由2Fe3++2I-===2Fe2++I2、I2+2Na2S2O3===2NaI+Na2S4O6可知存在2(NaFeY·3H2O)~I2~2Na2S2O3,平均消耗Na2S2O3标准溶液V mL,则n(Na2S2O3)=c×V×10-3 mol,样品中n(NaFeY·3H2O)=10n(Na2S2O3)=cV×10-2 mol,m(NaFeY·3H2O)=cV×10-2 mol×421 g· mol-1=4.21cV g,样品中NaFeY·3H2O的质量分数=×100%=%;③若滴定过程较缓慢,则过量的KI可能被空气中的氧气氧化为I2,则消耗Na2S2O3标准溶液体积偏大,测得样品中NaFeY·3H2O的质量分数偏大。
6.答案 (1)不再有气泡产生 Fe、Cu在稀盐酸中形成原电池,加快反应速率
(2)漏斗、玻璃棒 (3)K3[Fe(CN)6]溶液
(4)2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-
(5)在HCl气流中蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到FeCl3·6H2O晶体
(6)冷凝回流SOCl2 吸收SO2、HCl等尾气,防止污染
(7)碱石灰与SO2、HCl气体反应,失去干燥作用
(8)a
解析 稀盐酸中加入废铁屑,铜不与盐酸反应,过滤,向滤液中通入氯气反应生成氯化铁,稀氯化铁溶液再加入铁反应生成氯化亚铁,氯化亚铁和氯气反应生成氯化铁,由浓氯化铁溶液制备FeCl3·6H2O,稀氯化铁溶液在HCl气流中蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到FeCl3·6H2O晶体。将FeCl3·6H2O与液体SOCl2混合并加热来制备无水FeCl3。(1)含有少量铜的废铁屑比纯铁屑反应快,原因为Fe、Cu在稀盐酸中形成原电池,加快反应速率。(3)Fe2+和K3[Fe(CN)6]溶液反应生成蓝色沉淀,因此检验FeCl3溶液中是否残留Fe2+的试剂是K3[Fe(CN)6]溶液。(4)为增大FeCl3溶液的浓度,向稀FeCl3溶液中加入纯Fe粉后通入Cl2,先是铁和铁离子反应生成Fe2+,再是Fe2+被氯气氧化为铁离子,主要反应的离子方程式为2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-。(5)操作②是氯化铁溶液到FeCl3·6H2O晶体,由于铁离子加热时发生水解生成氢氧化铁,因此在整个过程中要通入HCl气体防止铁离子水解。(6)由于SOCl2沸点为77 ℃,为充分利用SOCl2,不能使其逸出,因此球形冷凝管的作用为冷凝回流SOCl2。由于二氧化硫、HCl逸出污染环境,因此NaOH溶液的作用是吸收SO2、HCl等尾气,防止污染。(7)无水CaCl2的作用是干燥气体,不是与二氧化硫、HCl气体反应,干燥管中无水CaCl2不能换成碱石灰,原因是碱石灰与SO2、HCl气体反应,失去干燥作用。(8)根据装置图信息,该装置可用于制取能水解的盐酸盐晶体,适宜使用上述方法的是a。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
