2025浙江专版新教材化学高考第一轮基础练--选择题保分练(四)(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--选择题保分练(四)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 495.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:18:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
选择题保分练(四)
1.(2023·浙江金丽衢十二校第二次联考)下列物质中常用作耐高温材料的碱性氧化物是( )
A.K2O B.SiO2 C.Al2O3 D.MgO
2.(2023·浙江东阳5月模考)下列化学用语表示正确的是( )
A.2-甲基-1-丁烯的键线式:
B.乙醚的分子式:C2H6O
C.基态Mn2+的价层电子轨道表示式:
D.HBr的电子式为
3.(2023·浙江诸暨模考)硒元素与氧同主族,在人和动物体内起到抗氧化作用。下列说法不正确的是( )
A.Se元素位于周期表第四周期第Ⅵ族
B.单质硒难溶于水
C.亚硒酸钠溶液呈碱性
D.硒酸钠属于强电解质
4.(2023·浙江浙南名校二次联考)下列关于元素及其化合物的性质说法不正确的是( )
A.Mg与CO2反应可生成C
B.SO2与H2O2反应可生成H2SO4
C.可通过化合反应制取Fe
D.NaI固体与浓硫酸反应可制取HI
5.下列实验操作设计正确且能达到实验目的的是( )
A B
测稀硫酸pH 配制一定物质的量浓度 的NaOH溶液
C D
分离乙酸乙酯和碳酸钠溶液 制备氨水
6.(2023·浙江高三百校联考)连四硫酸钠(Na2S4O6)能延长血液凝结时间,是生物酶、肽键的修复剂。其合成的化学方程式为2Na2S2O3+I2===Na2S4O6+2NaI。下列说法不正确的是( )
A.还原产物是NaI
B.氧化剂与还原剂的物质的量之比为1∶2
C.Na2S4O6溶液应在阴凉处密封保存
D.Na2S4O6遇酸产生的气体不能与品红溶液反应
7.(2023·浙江9+1联盟高三期中)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.24 L Cl2与足量H2O反应转移的电子数为0.1 NA
B.9.2 g甲苯与丙三醇的混合液中所含的氢原子数目为0.8 NA
C.29 g C3H6O分子中含σ键数目为0.45 NA
D.0.1 mol·L-1的CH3COOH溶液中CH3COOH数目小于0.1 NA
8.下列说法正确的是( )
A.通过石油裂化和裂解可以得到乙烯、丙烯与甲烷等基本化工原料
B.葡萄糖分子中的醛基与分子内的羟基作用,形成两种五元环结构
C.蛋白质溶液中加入稀(NH4)2SO4溶液或AgNO3溶液,都能析出沉淀
D.酚醛树脂是在催化剂条件下,苯酚与甲醛先发生取代反应再缩合而成的高分子
9.(2023·浙江乐清知临中学二次仿真)下列反应的离子方程式不正确的是( )
A.少量CO2通入苯酚钠溶液:CO2+H2O+C6H5O-===HC+C6H5OH
B.向FeCl2溶液中加入Na2O2:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+8Na+
C.以铜为电极电解氯化铵溶液:Cu+2NCu2++2NH3↑+H2↑
D.氟化物能预防龋齿的化学原因:Ca5OH+F-Ca5+OH-
10.(2023·浙江四校联盟高三模拟)双氯芬酸属于非甾体抗炎药,具有抗炎、镇痛及解热作用,其结构如图。下列说法正确的是( )
A.分子中存在4种官能团
B.该物质有酸性但没有碱性
C.该分子与足量氢气加成,所得物质分子中有5个手性碳原子
D.1 mol该物质与足量NaOH溶液反应,最多可消耗3 mol NaOH
11.(2023·浙江十校联考)某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法不正确的是( )
A.该物质做焰色试验,透过蓝色钴玻璃观察到紫色火焰
B.Z的最高价氧化物的水化物的酸性比硫酸弱
C.X分别与Y、Z、W形成的简单化合物中均含有共价键
D.四种元素中电负性最大的是Y,第一电离能最小的是W
12.工业上以镉铁矿(主要成分为CdO2、Fe2O3、Fe和SiO2)为原料制备分析试剂Cd的流程如图[Cd可溶于水]:
下列说法不正确的是( )
A.“酸浸”过程既有氧化还原反应,也有非氧化还原反应
B.CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+可能将其氧化为CO2
C.若“氧化”步骤有气泡生成,说明酸性条件下H2O2也能氧化CH3OH
D.“沉镉”后的滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境
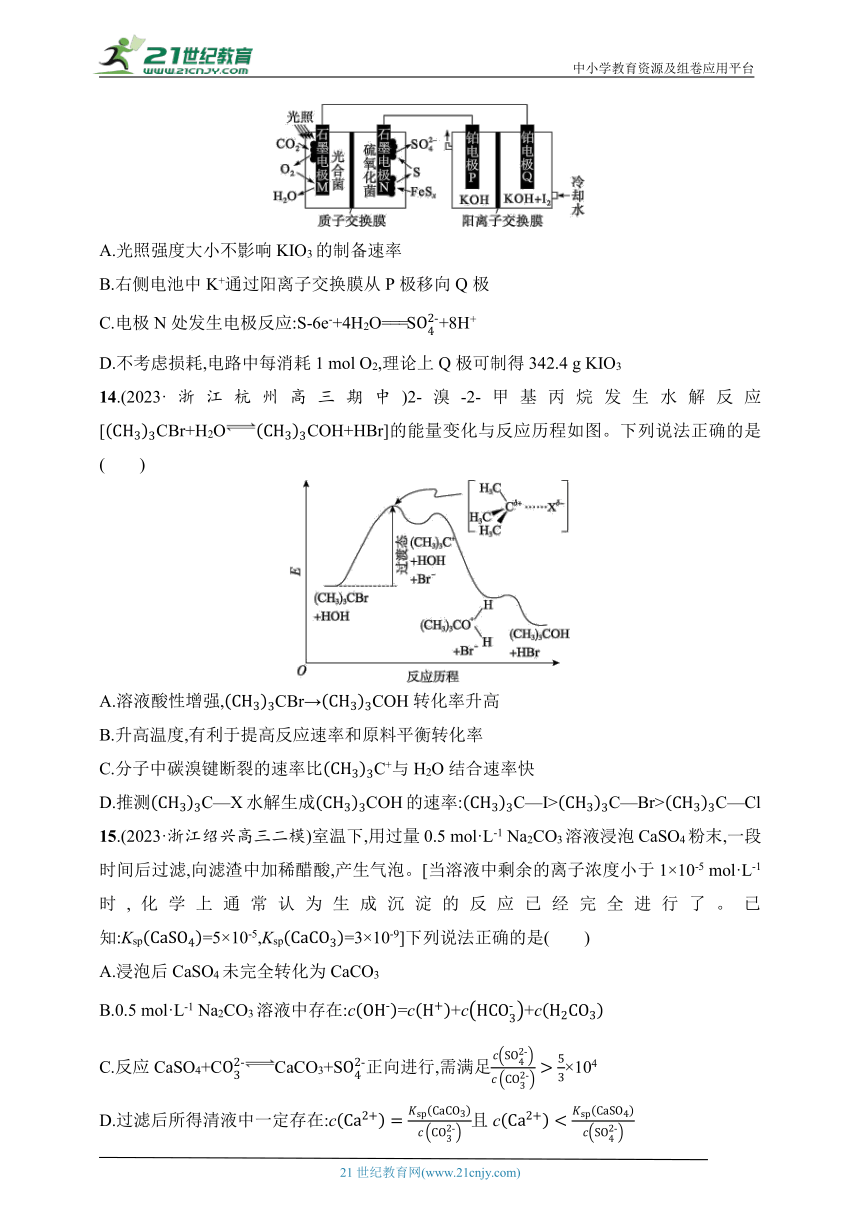
13.微生物燃料电池不仅可以获得高效能源,还能对工业污水等进行处理。利用微生物燃料电池处理含硫废水并电解制备KIO3的原理如图所示。下列说法正确的是( )
A.光照强度大小不影响KIO3的制备速率
B.右侧电池中K+通过阳离子交换膜从P极移向Q极
C.电极N处发生电极反应:S-6e-+4H2O===S+8H+
D.不考虑损耗,电路中每消耗1 mol O2,理论上Q极可制得342.4 g KIO3
14.(2023·浙江杭州高三期中)2-溴-2-甲基丙烷发生水解反应[CBr+H2OCOH+HBr]的能量变化与反应历程如图。下列说法正确的是( )
A.溶液酸性增强,CBr→COH转化率升高
B.升高温度,有利于提高反应速率和原料平衡转化率
C.分子中碳溴键断裂的速率比C+与H2O结合速率快
D.推测C—X水解生成COH的速率:C—I>C—Br>C—Cl
15.(2023·浙江绍兴高三二模)室温下,用过量0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。[当溶液中剩余的离子浓度小于1×10-5 mol·L-1时,化学上通常认为生成沉淀的反应已经完全进行了。已知:Ksp=5×10-5,Ksp=3×10-9]下列说法正确的是( )
A.浸泡后CaSO4未完全转化为CaCO3
B.0.5 mol·L-1 Na2CO3溶液中存在:c=c+c+c
C.反应CaSO4+CCaCO3+S正向进行,需满足×104
D.过滤后所得清液中一定存在:c且c
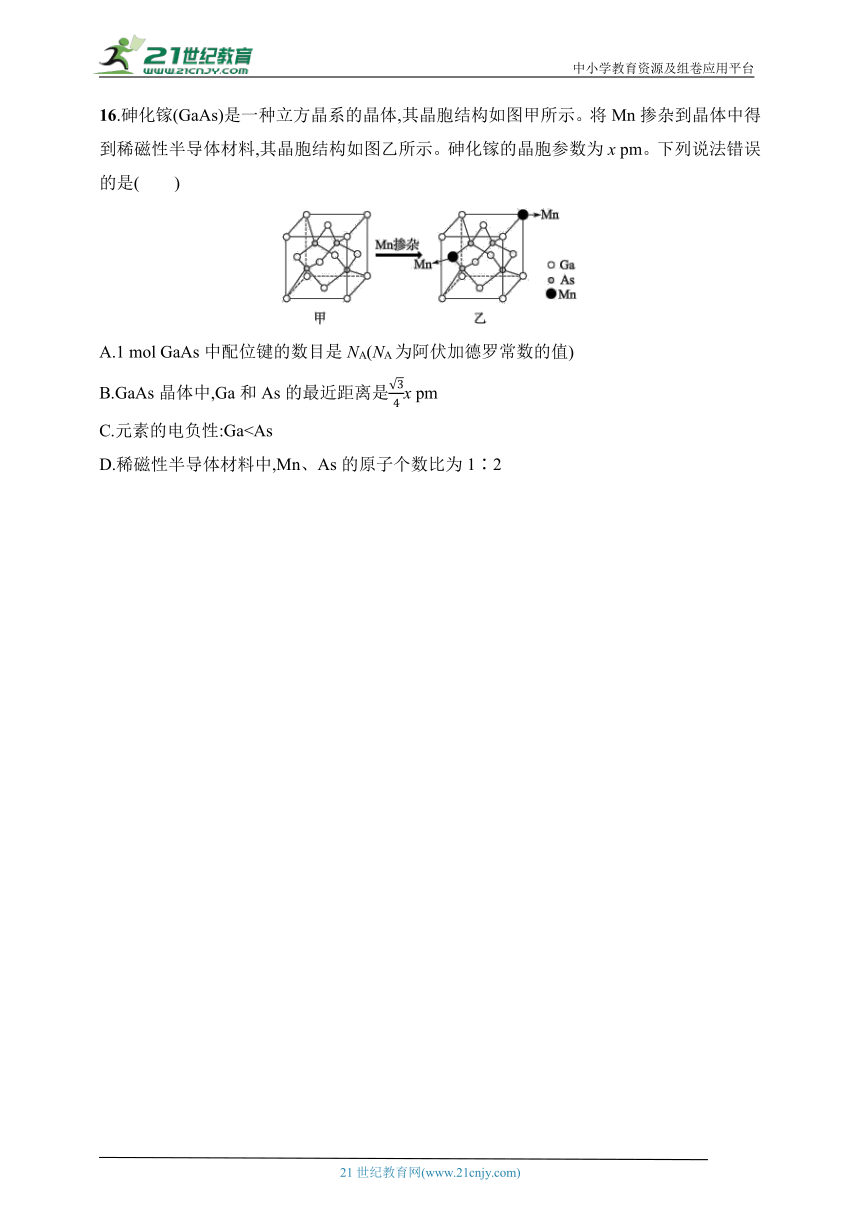
16.砷化镓(GaAs)是一种立方晶系的晶体,其晶胞结构如图甲所示。将Mn掺杂到晶体中得到稀磁性半导体材料,其晶胞结构如图乙所示。砷化镓的晶胞参数为x pm。下列说法错误的是( )
A.1 mol GaAs中配位键的数目是NA(NA为阿伏加德罗常数的值)
B.GaAs晶体中,Ga和As的最近距离是x pm
C.元素的电负性:GaD.稀磁性半导体材料中,Mn、As的原子个数比为1∶2
选择题保分练(四)
1.D MgO属于碱性氧化物,熔点高,可作耐高温材料,D符合题意。
2.C 根据烯烃的命名原则,2-甲基-1-丁烯的结构简式为,其键线式为,A错误;乙醚的结构简式为CH3CH2OCH2CH3,其分子式为C4H10O,甲醚分子式为C2H6O,B错误;基态Mn原子的价层电子排布式为3d54s2,基态Mn2+价层电子排布式为3d5,价层电子轨道表示式为,C正确;HBr属于共价化合物,电子式为,D错误。
3.A 硒元素与氧同主族,O位于第二周期第ⅥA族,则Se位于第四周期第ⅥA族,A错误;O、S、Se同主族,硫单质难溶于水,则单质硒难溶于水,B正确;硒元素与氧同主族,亚硒酸钠类似亚硫酸钠属于强碱弱酸盐,亚硒酸钠溶液中Se与水发生水解反应而使溶液呈碱性,C正确;硒酸钠Na2SeO4在水中能完全电离,属于强电解质,D正确。
4.D 浓硫酸可氧化NaI生成碘,不能制备HI,D错误。
5.C 用pH试纸测溶液pH的方法:将pH试纸放在干燥洁净的玻璃片上,用干燥洁净的玻璃棒蘸取溶液点在pH试纸上,与标准比色卡对比,A错误;容量瓶不能用于直接溶解氢氧化钠固体,B错误;乙酸乙酯和碳酸钠溶液为互不相溶的两种液体,能用分液漏斗分离,C正确;由于氨气极易溶于水,导管直接伸入水中容易发生倒吸,D错误。
6.D 由化学方程式可知,反应过程中碘的化合价降低,碘单质为氧化剂,碘化钠为还原产物,A正确;由化学方程式可知,反应过程中硫元素化合价升高,硫代硫酸钠为还原剂,则氧化剂与还原剂的物质的量之比为1∶2,B正确;连四硫酸钠中硫的价态较低具有还原性,受热易分解,因此要密封保存在阴凉处,C正确;连四硫酸钠遇酸发生歧化反应,生成二氧化硫,二氧化硫能使品红溶液褪色,D错误。
7.B 未指明气体所处状况,无法计算反应转移的电子数,A错误;甲苯(分子式为C7H8)和丙三醇(分子式为C3H8O3)的相对分子质量都为92,都含有8个氢原子,9.2 g甲苯和丙三醇的混合物的物质的量为0.1 mol,含氢原子数目为0.8NA,B正确;29 g C3H6O物质的量为0.5 mol,若C3H6O结构简式为,则分子中含σ键数目为5NA,C错误;溶液体积未知,无法计算溶液中CH3COOH数目,D错误。
8.A 石油是多种烷烃、环烷烃的混合物,通过石油裂化和裂解可以得到乙烯、丙烯与甲烷等基本化工原料,A正确。葡萄糖分子中的醛基与分子内的羟基作用,形成两种六元环结构,B错误。(NH4)2SO4属于轻金属盐,蛋白质溶液中加入稀(NH4)2SO4溶液,会促进蛋白质的溶解不会析出沉淀;AgNO3是重金属盐,能够使蛋白质发生变性而产生沉淀,C错误。酚醛树脂是在催化剂条件下,苯酚与甲醛先发生加成反应后再发生缩聚反应而生成的高分子,D错误。
9.B 少量CO2通入苯酚钠溶液中生成苯酚和碳酸氢钠,离子方程式为CO2+H2O+C6H5O-===HC+C6H5OH,A正确;向FeCl2溶液中加入Na2O2会生成O2,B错误;以铜为电极电解氯化铵溶液,Cu在阳极失电子生成Cu2+,H2O在阴极得电子生成H2和OH-,OH-和N反应生成氨气,离子方程式为Cu+2NCu2++2NH3↑+H2↑,C正确;氟是人体必需的一种微量元素,能有效预防龋齿,也能有效预防蛀牙,氟离子会与羟基磷灰石反应生成氟磷灰石,其离子方程式为Ca5OH+F-Ca5+OH-,D正确。
10.C 由结构简式可知,双氯芬酸的官能团为碳氯键、亚氨基和羧基,共有3种,A错误;双氯芬酸分子中含有的羧基表现酸性,含有的亚氨基表现碱性,B错误;由结构简式可知,双氯芬酸分子在一定条件下与足量氢气发生加成反应,所得物质分子中有5个连有不同原子或原子团的手性碳原子:,C正确;双氯芬酸分子中含有的碳氯键和羧基能与氢氧化钠溶液反应,其中碳氯键水解生成的酚羟基也能与氢氧化钠溶液反应,则1 mol双氯芬酸分子与足量氢氧化钠溶液反应,最多可消耗5 mol氢氧化钠,D错误。
11.C 已知X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,则X位于第一周期,为H元素;Y位于第二周期,Z位于第三周期,W位于第四周期,Z形成5个共价键,W形成+1价阳离子,则Z为P元素,W为K元素;Y为地壳中含量最高的元素,则Y为O元素。据分析可知,该物质含有钾元素,做焰色试验,透过蓝色钴玻璃观察到紫色火焰,A正确;Z为P元素,Z的最高价氧化物的水化物为H3PO4,H3PO4的酸性比硫酸弱,B正确;X分别与Y、Z、W形成的简单化合物分别为H2O、PH3、KH,H2O、PH3中均含有共价键,而KH中只含有离子键,C错误;元素非金属性越强,元素的电负性和第一电离能越大,H、O、P、K四种元素非金属性最强的为O元素,最弱的为K元素,则四种元素中电负性最大的是O,第一电离能最小的是K,D正确。
12.C 镉铁矿加入稀硫酸“酸浸”,得到滤渣1主要成分为SiO2,滤液中加入甲醇“还原镉”,再加入双氧水“氧化”Fe2+,“调pH”得到滤渣2,加入碳酸钾溶液“沉镉”,去掉滤液,得到的碳酸镉加入溴酸“转化”,蒸发结晶得到Cd。“酸浸”过程CdO2、Fe2O3与稀硫酸发生复分解反应生成盐和水,属于非氧化还原反应,Fe与硫酸反应生成硫酸亚铁和氢气,属于氧化还原反应,A正确;CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+可能将其氧化为CO2,Cd4+转化为Cd2+,B正确;气泡可能是在Cd2+等催化下H2O2分解产生的,C不正确;镉为重金属,“沉镉”后的滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境,D正确。
13.C 石墨电极M处,CO2在光合菌、光照条件下转化为O2,O2在M极放电生成H2O,发生还原反应,M为正极,电极反应为O2+4e-+4H+===2H2O;N极为负极,硫氧化菌将FeSx氧化为S,硫再放电生成S,电极反应为S-6e-+4H2O===S+8H+;铂电极P为阴极,铂电极Q为阳极。光照强度大小影响单位时间内生成氧气的量,会影响KIO3的制备速率,A错误;铂电极P为阴极,铂电极Q为阳极,阴极生成OH-,溶液中K+通过阳离子交换膜从Q极移向P极,B错误;N极为负极,电极反应为S-6e-+4H2O===S+8H+,C正确;不考虑损耗,电路中每消耗1 mol O2,转移电子为4 mol,阳极反应为I2+12OH--10e-===2I+6H2O,可知生成KIO3为4 mol×=0.8 mol,理论上Q极可制得KIO3的质量为0.8 mol×214 g·mol-1=171.2 g,D错误。
14.D 由题干可知,反应为CBr+H2OCOH+HBr,HBr===H++Br-,酸性增强导致反应CBr+H2OCOH+HBr逆向进行,使得CBr→COH转化率降低,A错误;反应物能量大于生成物能量,为放热反应,升高温度,平衡逆向移动,导致原料平衡转化率下降,B错误;过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大活化能越大,峰值越小活化能越小,活化能越小反应越快,活化能越大反应越慢;由图可知,分子中碳溴键断裂所需活化能更大,故分子中碳溴键断裂的速率比C+与H2O结合速率慢,C错误;碘原子半径>溴原子半径>氯原子半径,则C—I键能更小,利于C—I断裂发生反应,故C—X水解生成COH的速率:C—I>C—Br>C—Cl,D正确。
15.D 用过量0.5 mol·L-1Na2CO3溶液浸泡CaSO4粉末,则浸泡后c mol·L-1=6×10-9 mol·L-1<1×10-5 mol·L-1,可以认为浸泡后CaSO4完全转化为CaCO3,A错误;由质子守恒可知,0.5 mol·L-1 Na2CO3溶液中存在:c=c+c+2c,B错误;CaSO4+CCaCO3+S的K=×104,反应正向进行,需满足×104,C错误;过滤后所得清液为碳酸钙的饱和溶液,存在:c,且由于碳酸根离子浓度较大导致钙离子浓度很小,故存在c,D正确。
16.D GaAs中,砷提供孤电子对,镓提供空轨道,二者形成配位键,平均1个GaAs中配位键数目为1,则1 mol GaAs中配位键的数目是NA,A正确;由砷化镓晶胞结构可知,Ga和As的最近距离为晶胞体对角线长度,Ga和As的最近距离是x pm,B正确;元素的电负性:Ga21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
选择题保分练(四)
1.(2023·浙江金丽衢十二校第二次联考)下列物质中常用作耐高温材料的碱性氧化物是( )
A.K2O B.SiO2 C.Al2O3 D.MgO
2.(2023·浙江东阳5月模考)下列化学用语表示正确的是( )
A.2-甲基-1-丁烯的键线式:
B.乙醚的分子式:C2H6O
C.基态Mn2+的价层电子轨道表示式:
D.HBr的电子式为
3.(2023·浙江诸暨模考)硒元素与氧同主族,在人和动物体内起到抗氧化作用。下列说法不正确的是( )
A.Se元素位于周期表第四周期第Ⅵ族
B.单质硒难溶于水
C.亚硒酸钠溶液呈碱性
D.硒酸钠属于强电解质
4.(2023·浙江浙南名校二次联考)下列关于元素及其化合物的性质说法不正确的是( )
A.Mg与CO2反应可生成C
B.SO2与H2O2反应可生成H2SO4
C.可通过化合反应制取Fe
D.NaI固体与浓硫酸反应可制取HI
5.下列实验操作设计正确且能达到实验目的的是( )
A B
测稀硫酸pH 配制一定物质的量浓度 的NaOH溶液
C D
分离乙酸乙酯和碳酸钠溶液 制备氨水
6.(2023·浙江高三百校联考)连四硫酸钠(Na2S4O6)能延长血液凝结时间,是生物酶、肽键的修复剂。其合成的化学方程式为2Na2S2O3+I2===Na2S4O6+2NaI。下列说法不正确的是( )
A.还原产物是NaI
B.氧化剂与还原剂的物质的量之比为1∶2
C.Na2S4O6溶液应在阴凉处密封保存
D.Na2S4O6遇酸产生的气体不能与品红溶液反应
7.(2023·浙江9+1联盟高三期中)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.24 L Cl2与足量H2O反应转移的电子数为0.1 NA
B.9.2 g甲苯与丙三醇的混合液中所含的氢原子数目为0.8 NA
C.29 g C3H6O分子中含σ键数目为0.45 NA
D.0.1 mol·L-1的CH3COOH溶液中CH3COOH数目小于0.1 NA
8.下列说法正确的是( )
A.通过石油裂化和裂解可以得到乙烯、丙烯与甲烷等基本化工原料
B.葡萄糖分子中的醛基与分子内的羟基作用,形成两种五元环结构
C.蛋白质溶液中加入稀(NH4)2SO4溶液或AgNO3溶液,都能析出沉淀
D.酚醛树脂是在催化剂条件下,苯酚与甲醛先发生取代反应再缩合而成的高分子
9.(2023·浙江乐清知临中学二次仿真)下列反应的离子方程式不正确的是( )
A.少量CO2通入苯酚钠溶液:CO2+H2O+C6H5O-===HC+C6H5OH
B.向FeCl2溶液中加入Na2O2:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+8Na+
C.以铜为电极电解氯化铵溶液:Cu+2NCu2++2NH3↑+H2↑
D.氟化物能预防龋齿的化学原因:Ca5OH+F-Ca5+OH-
10.(2023·浙江四校联盟高三模拟)双氯芬酸属于非甾体抗炎药,具有抗炎、镇痛及解热作用,其结构如图。下列说法正确的是( )
A.分子中存在4种官能团
B.该物质有酸性但没有碱性
C.该分子与足量氢气加成,所得物质分子中有5个手性碳原子
D.1 mol该物质与足量NaOH溶液反应,最多可消耗3 mol NaOH
11.(2023·浙江十校联考)某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法不正确的是( )
A.该物质做焰色试验,透过蓝色钴玻璃观察到紫色火焰
B.Z的最高价氧化物的水化物的酸性比硫酸弱
C.X分别与Y、Z、W形成的简单化合物中均含有共价键
D.四种元素中电负性最大的是Y,第一电离能最小的是W
12.工业上以镉铁矿(主要成分为CdO2、Fe2O3、Fe和SiO2)为原料制备分析试剂Cd的流程如图[Cd可溶于水]:
下列说法不正确的是( )
A.“酸浸”过程既有氧化还原反应,也有非氧化还原反应
B.CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+可能将其氧化为CO2
C.若“氧化”步骤有气泡生成,说明酸性条件下H2O2也能氧化CH3OH
D.“沉镉”后的滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境
13.微生物燃料电池不仅可以获得高效能源,还能对工业污水等进行处理。利用微生物燃料电池处理含硫废水并电解制备KIO3的原理如图所示。下列说法正确的是( )
A.光照强度大小不影响KIO3的制备速率
B.右侧电池中K+通过阳离子交换膜从P极移向Q极
C.电极N处发生电极反应:S-6e-+4H2O===S+8H+
D.不考虑损耗,电路中每消耗1 mol O2,理论上Q极可制得342.4 g KIO3
14.(2023·浙江杭州高三期中)2-溴-2-甲基丙烷发生水解反应[CBr+H2OCOH+HBr]的能量变化与反应历程如图。下列说法正确的是( )
A.溶液酸性增强,CBr→COH转化率升高
B.升高温度,有利于提高反应速率和原料平衡转化率
C.分子中碳溴键断裂的速率比C+与H2O结合速率快
D.推测C—X水解生成COH的速率:C—I>C—Br>C—Cl
15.(2023·浙江绍兴高三二模)室温下,用过量0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。[当溶液中剩余的离子浓度小于1×10-5 mol·L-1时,化学上通常认为生成沉淀的反应已经完全进行了。已知:Ksp=5×10-5,Ksp=3×10-9]下列说法正确的是( )
A.浸泡后CaSO4未完全转化为CaCO3
B.0.5 mol·L-1 Na2CO3溶液中存在:c=c+c+c
C.反应CaSO4+CCaCO3+S正向进行,需满足×104
D.过滤后所得清液中一定存在:c且c
16.砷化镓(GaAs)是一种立方晶系的晶体,其晶胞结构如图甲所示。将Mn掺杂到晶体中得到稀磁性半导体材料,其晶胞结构如图乙所示。砷化镓的晶胞参数为x pm。下列说法错误的是( )
A.1 mol GaAs中配位键的数目是NA(NA为阿伏加德罗常数的值)
B.GaAs晶体中,Ga和As的最近距离是x pm
C.元素的电负性:Ga
选择题保分练(四)
1.D MgO属于碱性氧化物,熔点高,可作耐高温材料,D符合题意。
2.C 根据烯烃的命名原则,2-甲基-1-丁烯的结构简式为,其键线式为,A错误;乙醚的结构简式为CH3CH2OCH2CH3,其分子式为C4H10O,甲醚分子式为C2H6O,B错误;基态Mn原子的价层电子排布式为3d54s2,基态Mn2+价层电子排布式为3d5,价层电子轨道表示式为,C正确;HBr属于共价化合物,电子式为,D错误。
3.A 硒元素与氧同主族,O位于第二周期第ⅥA族,则Se位于第四周期第ⅥA族,A错误;O、S、Se同主族,硫单质难溶于水,则单质硒难溶于水,B正确;硒元素与氧同主族,亚硒酸钠类似亚硫酸钠属于强碱弱酸盐,亚硒酸钠溶液中Se与水发生水解反应而使溶液呈碱性,C正确;硒酸钠Na2SeO4在水中能完全电离,属于强电解质,D正确。
4.D 浓硫酸可氧化NaI生成碘,不能制备HI,D错误。
5.C 用pH试纸测溶液pH的方法:将pH试纸放在干燥洁净的玻璃片上,用干燥洁净的玻璃棒蘸取溶液点在pH试纸上,与标准比色卡对比,A错误;容量瓶不能用于直接溶解氢氧化钠固体,B错误;乙酸乙酯和碳酸钠溶液为互不相溶的两种液体,能用分液漏斗分离,C正确;由于氨气极易溶于水,导管直接伸入水中容易发生倒吸,D错误。
6.D 由化学方程式可知,反应过程中碘的化合价降低,碘单质为氧化剂,碘化钠为还原产物,A正确;由化学方程式可知,反应过程中硫元素化合价升高,硫代硫酸钠为还原剂,则氧化剂与还原剂的物质的量之比为1∶2,B正确;连四硫酸钠中硫的价态较低具有还原性,受热易分解,因此要密封保存在阴凉处,C正确;连四硫酸钠遇酸发生歧化反应,生成二氧化硫,二氧化硫能使品红溶液褪色,D错误。
7.B 未指明气体所处状况,无法计算反应转移的电子数,A错误;甲苯(分子式为C7H8)和丙三醇(分子式为C3H8O3)的相对分子质量都为92,都含有8个氢原子,9.2 g甲苯和丙三醇的混合物的物质的量为0.1 mol,含氢原子数目为0.8NA,B正确;29 g C3H6O物质的量为0.5 mol,若C3H6O结构简式为,则分子中含σ键数目为5NA,C错误;溶液体积未知,无法计算溶液中CH3COOH数目,D错误。
8.A 石油是多种烷烃、环烷烃的混合物,通过石油裂化和裂解可以得到乙烯、丙烯与甲烷等基本化工原料,A正确。葡萄糖分子中的醛基与分子内的羟基作用,形成两种六元环结构,B错误。(NH4)2SO4属于轻金属盐,蛋白质溶液中加入稀(NH4)2SO4溶液,会促进蛋白质的溶解不会析出沉淀;AgNO3是重金属盐,能够使蛋白质发生变性而产生沉淀,C错误。酚醛树脂是在催化剂条件下,苯酚与甲醛先发生加成反应后再发生缩聚反应而生成的高分子,D错误。
9.B 少量CO2通入苯酚钠溶液中生成苯酚和碳酸氢钠,离子方程式为CO2+H2O+C6H5O-===HC+C6H5OH,A正确;向FeCl2溶液中加入Na2O2会生成O2,B错误;以铜为电极电解氯化铵溶液,Cu在阳极失电子生成Cu2+,H2O在阴极得电子生成H2和OH-,OH-和N反应生成氨气,离子方程式为Cu+2NCu2++2NH3↑+H2↑,C正确;氟是人体必需的一种微量元素,能有效预防龋齿,也能有效预防蛀牙,氟离子会与羟基磷灰石反应生成氟磷灰石,其离子方程式为Ca5OH+F-Ca5+OH-,D正确。
10.C 由结构简式可知,双氯芬酸的官能团为碳氯键、亚氨基和羧基,共有3种,A错误;双氯芬酸分子中含有的羧基表现酸性,含有的亚氨基表现碱性,B错误;由结构简式可知,双氯芬酸分子在一定条件下与足量氢气发生加成反应,所得物质分子中有5个连有不同原子或原子团的手性碳原子:,C正确;双氯芬酸分子中含有的碳氯键和羧基能与氢氧化钠溶液反应,其中碳氯键水解生成的酚羟基也能与氢氧化钠溶液反应,则1 mol双氯芬酸分子与足量氢氧化钠溶液反应,最多可消耗5 mol氢氧化钠,D错误。
11.C 已知X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,则X位于第一周期,为H元素;Y位于第二周期,Z位于第三周期,W位于第四周期,Z形成5个共价键,W形成+1价阳离子,则Z为P元素,W为K元素;Y为地壳中含量最高的元素,则Y为O元素。据分析可知,该物质含有钾元素,做焰色试验,透过蓝色钴玻璃观察到紫色火焰,A正确;Z为P元素,Z的最高价氧化物的水化物为H3PO4,H3PO4的酸性比硫酸弱,B正确;X分别与Y、Z、W形成的简单化合物分别为H2O、PH3、KH,H2O、PH3中均含有共价键,而KH中只含有离子键,C错误;元素非金属性越强,元素的电负性和第一电离能越大,H、O、P、K四种元素非金属性最强的为O元素,最弱的为K元素,则四种元素中电负性最大的是O,第一电离能最小的是K,D正确。
12.C 镉铁矿加入稀硫酸“酸浸”,得到滤渣1主要成分为SiO2,滤液中加入甲醇“还原镉”,再加入双氧水“氧化”Fe2+,“调pH”得到滤渣2,加入碳酸钾溶液“沉镉”,去掉滤液,得到的碳酸镉加入溴酸“转化”,蒸发结晶得到Cd。“酸浸”过程CdO2、Fe2O3与稀硫酸发生复分解反应生成盐和水,属于非氧化还原反应,Fe与硫酸反应生成硫酸亚铁和氢气,属于氧化还原反应,A正确;CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+可能将其氧化为CO2,Cd4+转化为Cd2+,B正确;气泡可能是在Cd2+等催化下H2O2分解产生的,C不正确;镉为重金属,“沉镉”后的滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境,D正确。
13.C 石墨电极M处,CO2在光合菌、光照条件下转化为O2,O2在M极放电生成H2O,发生还原反应,M为正极,电极反应为O2+4e-+4H+===2H2O;N极为负极,硫氧化菌将FeSx氧化为S,硫再放电生成S,电极反应为S-6e-+4H2O===S+8H+;铂电极P为阴极,铂电极Q为阳极。光照强度大小影响单位时间内生成氧气的量,会影响KIO3的制备速率,A错误;铂电极P为阴极,铂电极Q为阳极,阴极生成OH-,溶液中K+通过阳离子交换膜从Q极移向P极,B错误;N极为负极,电极反应为S-6e-+4H2O===S+8H+,C正确;不考虑损耗,电路中每消耗1 mol O2,转移电子为4 mol,阳极反应为I2+12OH--10e-===2I+6H2O,可知生成KIO3为4 mol×=0.8 mol,理论上Q极可制得KIO3的质量为0.8 mol×214 g·mol-1=171.2 g,D错误。
14.D 由题干可知,反应为CBr+H2OCOH+HBr,HBr===H++Br-,酸性增强导致反应CBr+H2OCOH+HBr逆向进行,使得CBr→COH转化率降低,A错误;反应物能量大于生成物能量,为放热反应,升高温度,平衡逆向移动,导致原料平衡转化率下降,B错误;过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大活化能越大,峰值越小活化能越小,活化能越小反应越快,活化能越大反应越慢;由图可知,分子中碳溴键断裂所需活化能更大,故分子中碳溴键断裂的速率比C+与H2O结合速率慢,C错误;碘原子半径>溴原子半径>氯原子半径,则C—I键能更小,利于C—I断裂发生反应,故C—X水解生成COH的速率:C—I>C—Br>C—Cl,D正确。
15.D 用过量0.5 mol·L-1Na2CO3溶液浸泡CaSO4粉末,则浸泡后c mol·L-1=6×10-9 mol·L-1<1×10-5 mol·L-1,可以认为浸泡后CaSO4完全转化为CaCO3,A错误;由质子守恒可知,0.5 mol·L-1 Na2CO3溶液中存在:c=c+c+2c,B错误;CaSO4+CCaCO3+S的K=×104,反应正向进行,需满足×104,C错误;过滤后所得清液为碳酸钙的饱和溶液,存在:c,且由于碳酸根离子浓度较大导致钙离子浓度很小,故存在c,D正确。
16.D GaAs中,砷提供孤电子对,镓提供空轨道,二者形成配位键,平均1个GaAs中配位键数目为1,则1 mol GaAs中配位键的数目是NA,A正确;由砷化镓晶胞结构可知,Ga和As的最近距离为晶胞体对角线长度,Ga和As的最近距离是x pm,B正确;元素的电负性:Ga
21世纪教育网(www.21cnjy.com)
同课章节目录
