2025浙江专版新教材化学高考第一轮基础练--选择题保分练(三)(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--选择题保分练(三)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 502.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:18:22 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
选择题保分练(三)
1.(2023·浙江Z20名校联盟一联)化学是材料科学的基础。下列说法不正确的是( )
A.制造5G芯片的氮化铝晶圆属于无机非金属材料
B.La-Ni合金是一种新型储氢合金材料
C.高吸水性树脂聚丙烯酸钠是通过缩聚反应合成的
D.制造防弹装甲的芳纶纤维属于有机高分子材料
2.下列化学用语表示正确的是( )
A.中子数为10的氧原子O
B.1-丁醇的键线式:
C.C的空间结构为三角锥形
D.某激发态碳原子的轨道表示式:
3.(2023·浙江重点中学培优考试)硫酸钡(BaSO4)应用广泛。下列说法不正确的是( )
A.Ba元素位于周期表p区
B.硫酸钡常用于消化道造影
C.硫酸钡饱和溶液呈中性
D.与碳共热可生产硫化钡
4.(2023·浙江1月选考)物质的性质决定用途。下列二者对应关系不正确的是( )
A.SO2能使某些色素褪色,可用作漂白剂
B.金属钠导热性好,可用作传热介质
C.NaClO溶液呈碱性,可用作消毒剂
D.Fe2O3呈红色,可用作颜料
5.(2023·浙江乐清知临中学二次仿真) 已知反应:11P4+60CuSO4+96H2O===20Cu3P+60H2SO4+24H3PO4。下列说法正确的是( )
A.CuSO4是氧化剂,生成Cu3P过程中被氧化
B.Cu3P既是氧化产物又是还原产物
C.氧化剂与还原剂的物质的量之比为60∶11
D.反应中160 g CuSO4参加反应,共转移2 mol电子
6.(2023·浙江浙南名校二次联考)下列说法不正确的是( )
A.酰胺均能在碱性条件下水解得到氨气
B.聚乙炔可用于制备导电高分子材料
C.苯在一定条件可以与氯气发生加成反应和取代反应
D.二氧化碳和环氧丙烷()在一定条件下聚合生成一种可降解的塑料
7.(2023·浙江四校联盟高三模拟)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.60 g SiO2中的Si—O共价键的数目为NA
B.1 mol苯乙醛分子中含π键的数目为4NA
C.25 ℃时,1 L pH为12的氨水中含有OH-数目为0.01 NA
D.56 g铁发生吸氧腐蚀完全转化成铁锈,电极反应中转移电子数为3NA
8.下列反应的离子方程式不正确的是( )
A.将少量SO2通入NaClO溶液中:ClO-+SO2+H2O===S+Cl-+2H+
B.Cl2与冷的NaOH溶液反应:Cl2+2OH-===ClO-+Cl-+H2O
C.乙酰水杨酸()与过量NaOH溶液共热:+3OH-+CH3COO-+2H2O
D.向100 mL 0.1 mol·L-1 FeBr2溶液中通入0.012 mol Cl2:10Fe2++14Br-+12Cl2===10Fe3++7Br2+24Cl-
9.下列实验方案(图中部分夹持装置略),不能达到实验目的的是( )
选项 A B
目的 制取无水FeCl3固体 检验产生的SO2
实验 方案
选项 C D
目的 证明Ksp< Ksp 探究化学反应速 率的影响因素
实验 方案 (表面积大致相同)
10.(2023·浙江十校联考) 辅酶Q10具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶Q10的说法不正确的是( )
A.分子式为C59H90O4,存在3种官能团
B.分子中4个氧原子在同一平面
C.1 mol该物质与NaOH溶液反应,最多可消耗2 mol NaOH
D.1 mol该物质与足量H2反应,最多可消耗14 mol H2
11.中国地质科学院地质研究所对嫦娥五号月球玄武岩开展了分析,证明月球在19.6亿年前仍存在岩浆活动。X、Y、Z、V、W是月核中含有的五种原子序数依次增大的前20号元素,X原子的s能级电子数和p能级电子数相等,V的单质常在地球火山口附近沉积,Y的氧化物常用作耐高温材料。Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数。下列说法正确的是( )
A.Y的氧化物是两性氧化物
B.简单氢化物的稳定性:X>Z>V
C.简单离子半径:W>V>Y
D.第一电离能:W12.(2023·浙江四校高三联考)类推是化学学习和研究中常用的思维方法。下列类推合理的是( )
A.HF的热稳定性强于HCl,则NH4F的热稳定性强于NH4Cl
B.SO2是“V形”分子,则O3是“V形”分子
C.MgCl2溶液在空气中蒸干得到MgO固体,则SrCl2溶液在空气中蒸干得到SrO固体
D.若发生2CuS+3O22CuO+2SO2,则发生2HgS+3O22HgO+2SO2
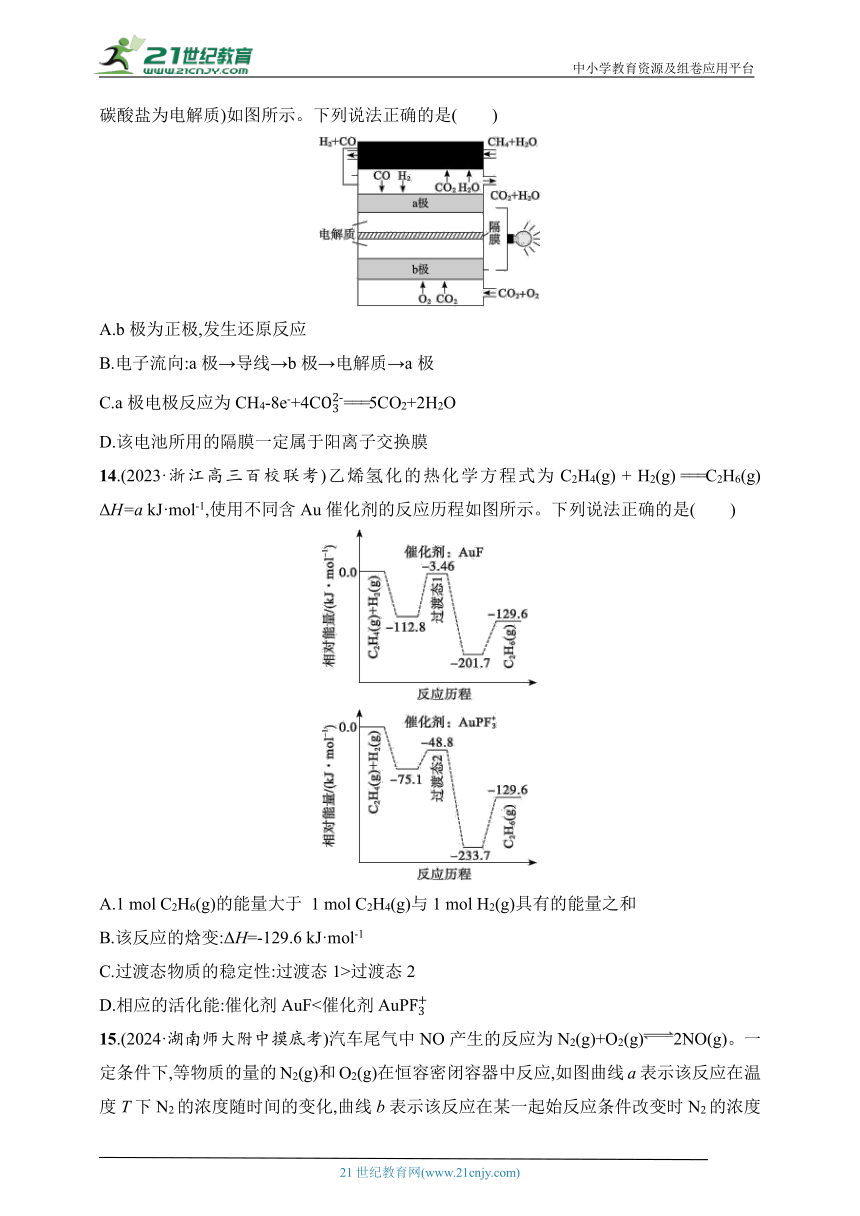
13.内部重整式高温燃料电池具有良好的商业化前景,其基本工作原理(以CH4为原料,熔融碳酸盐为电解质)如图所示。下列说法正确的是( )
A.b极为正极,发生还原反应
B.电子流向:a极→导线→b极→电解质→a极
C.a极电极反应为CH4-8e-+4C===5CO2+2H2O
D.该电池所用的隔膜一定属于阳离子交换膜
14.(2023·浙江高三百校联考)乙烯氢化的热化学方程式为C2H4(g) + H2(g) ===C2H6(g) ΔH=a kJ·mol-1,使用不同含Au催化剂的反应历程如图所示。下列说法正确的是( )
A.1 mol C2H6(g)的能量大于 1 mol C2H4(g)与1 mol H2(g)具有的能量之和
B.该反应的焓变:ΔH=-129.6 kJ·mol-1
C.过渡态物质的稳定性:过渡态1>过渡态2
D.相应的活化能:催化剂AuF<催化剂AuP
15.(2024·湖南师大附中摸底考)汽车尾气中NO产生的反应为N2(g)+O2(g)2NO(g)。一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A.温度T下,该反应的平衡常数K=
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH<0
16.(2023·浙江金丽衢十二校联考)草酸钙是常见的难溶物。将过量草酸钙粉末置于水中达到溶解平衡:CaC2O4Ca2++C2[已知Ksp=2.3×10-9,Ka=1.75×10-5,H2C2O4的电离常数=5.6×10-2,=1.5×10-4]。下列有关说法不正确的是( )
A.上层清液中含碳微粒主要以C2形式存在
B.上层清液中存在:c=c+c+c
C.H2C2O4加入CaCl2溶液时,加入适量醋酸钠粉末,有利于生成CaC2O4沉淀
D.向上层清液中通入HCl至pH=1,则:2c-2c-c-c=0.1 mol·L-1
选择题保分练(三)
1.C 高吸水性树脂聚丙烯酸钠是丙烯酸钠通过加聚反应合成的,C错误。
2.D 中子数为10的氧原子表示为O,A错误;是1-丙醇的键线式,1-丁醇的键线式为,B错误;C中心原子C原子的价层电子对数为3,其空间结构为平面三角形,C错误;基态碳原子电子排布式为1s22s22p2,故表示激发态碳原子,D正确。
3.A 钡元素位于元素周期表的s区,A错误。
4.C NaClO溶液用于杀菌消毒,不是由于其具有碱性,而是因为其具有强氧化性,C不正确。
5.D Cu元素的化合价降低,故CuSO4是氧化剂,生成Cu3P过程中被还原发生还原反应,A错误;Cu、P元素的化合价均降低,则生成的Cu3P是还原产物,B错误;11 mol P4参与反应时,则有5 mol P4、60 mol CuSO4是氧化剂,6 mol P4是还原剂,氧化剂与还原剂的物质的量之比为65∶6,C错误;消耗60 mol CuSO4,反应转移120 mol电子,消耗1 mol CuSO4,转移2 mol电子,D正确。
6.A 含有—CO—NH2的酰胺在碱性条件下水解才能得到氨气,A错误。
7.C 二氧化硅中每个硅原子与4个氧原子形成硅氧共价键,则60 g二氧化硅中含有硅氧键的数目为×4×NA mol-1=4NA,A错误;苯乙醛分子中苯环中含有1个大π键,醛基中含有1个π键,则1 mol苯乙醛分子中含π键的数目为1 mol×2×NA mol-1=2NA,B错误;25 ℃时,1 L pH为12的氨水中含有氢氧根离子的数目为0.01 mol·L-1×1 L×NA mol-1=0.01NA,C正确;铁发生吸氧腐蚀时,铁为负极,铁失去电子生成亚铁离子,则电极反应中转移电子数为 ×2×NA mol-1=2NA,D错误。
8.A SO2具有还原性,NaClO具有强氧化性,SO2与NaClO发生氧化还原反应,该反应的离子方程式为3ClO-+SO2+H2O===S+Cl-+2HClO,A错误;Cl2与冷的NaOH溶液反应生成氯化钠和次氯酸钠:Cl2+2OH-===ClO-+Cl-+H2O,B正确;乙酰水杨酸()与过量NaOH溶液共热:+3OH-+CH3COO-+2H2O,C正确;Fe2+的还原性强于Br-,因此Cl2先将Fe2+氧化,根据电子守恒,完全氧化0.01 mol Fe2+应消耗0.005 mol Cl2,剩余0.007 mol Cl2氧化0.014 mol Br-,因此参与反应的Fe2+和Br-的物质的量之比为0.01 mol∶0.014 mol=10∶14,离子方程式为12Cl2+10Fe2++14Br-===7Br2+10Fe3++24Cl-,D正确。
9.A 氯化铁固体加热过程中发生水解,应该在氯化氢的气流中进行,故该实验不能达到实验目的,A符合题意;铜和浓硫酸在加热的条件下反应生成SO2,SO2能使品红褪色,多余的SO2用氢氧化钠溶液吸收,防止污染,该实验能达到实验目的,B不符合题意;硫酸锌和硫化钠反应生成硫化锌沉淀,再加入硫酸铜溶液,硫化锌转化为黑色的硫化铜沉淀,说明硫化铜的溶度积小于硫化锌,该实验能达到实验目的,C不符合题意;该实验中只有盐酸的浓度不同,可以根据产生气泡的快慢分析浓度对反应速率的影响,能达到实验目的,D不符合题意。
10.C 该物质分子式为C59H90O4,含醚键、羰基和碳碳双键三种官能团,A正确;双键碳以及与其相连的4个原子共平面,羰基碳原子和与其相连的氧原子及另外2个原子共平面,所以4个氧原子在同一平面上,B正确;该物质不与氢氧化钠溶液反应,C错误;该物质的1个分子有12个碳碳双键和2个碳氧双键,则1 mol该物质可与14 mol氢气发生加成反应,D正确。
11.D X、Y、Z、V、W是原子序数依次增大的前20号元素,X原子的s能级电子数和p能级电子数相等,则X的电子排布式为1s22s22p4,X为O元素;V的单质常在地球火山口附近沉积,则V为S元素;Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数,Y、W同主族,且Z处于偶数族,而Y的氧化物常用作耐高温材料,结合原子序数可知Y为Mg、W为Ca,Z原子最外层电子数为4,可推知Z为Si元素。SiO2是酸性氧化物,不是两性氧化物,A错误;元素的非金属性:O>S>Si,故简单氢化物的稳定性:H2O>H2S>SiH4,B错误;简单离子半径:S2->Ca2+>Mg2+,C错误;第一电离能:Ca12.B HF的热稳定性强于HCl是由于F的非金属性大于Cl,NH4F、NH4Cl受热分解属于铵盐的分解,与非金属性无关,A错误;SO2是“V形”分子,O3与SO2是等电子体,等电子体的空间结构相似,因此O3也是“V形”分子,B正确;SrCl2为强酸强碱形成的盐,Sr2+不水解,因此SrCl2溶液在空气中蒸干得到SrCl2固体,C错误;HgO在加热的条件下发生分解2HgO2Hg+O2↑,因此HgS与O2在高温下得不到HgO,D错误。
13.A 由装置可知a电极上CO和H2失电子生成CO2和H2O,a极为负极,b极为正极,b电极上O2得电子结合CO2生成C。由以上分析可知b极为正极,得电子发生还原反应,A正确;电子不经过电解质,B错误;由以上分析可知a极反应物不是甲烷,C错误;熔融碳酸盐为电解质,故隔膜允许碳酸根离子通过,为阴离子交换膜,D错误。
14.B 由图可知,该反应为放热反应,故1 mol C2H6(g)的能量小于1 mol C2H4(g)与1 mol H2(g)具有的能量之和,A错误;由图可知C2H4(g)+H2(g) ===C2H6(g) ΔH=生成物能量-反应物能量=-129.6 kJ·mol-1,B正确;由图可知,过渡态1的能量大于过渡态2的能量,能量越低越稳定,则稳定性:过渡态1<过渡态2,C错误;由图可知,催化剂AuF、催化剂AuP相应的活化能分别为109.34 kJ·mol-1、26.3 kJ·mol-1,D错误。
15.A 根据平衡常数的定义,结合开始时氮气和氧气的物质的量相等,可知该平衡常数为K=,A正确;由于该容器是一个恒容容器,反应前后气体的质量不发生改变,所以气体的密度一直不变,B错误;催化剂仅能改变达到平衡所用的时间,不能使平衡移动,即不能改变平衡浓度,C错误;若曲线b对应的条件改变是温度,根据先达到平衡可知为升高温度,平衡向吸热反应的方向移动,而氮气的浓度降低,说明平衡向正方向移动,正反应为吸热反应,ΔH>0,D错误。
16.D 溶解在水中的草酸钙电离出C2,C2能水解,但水解程度很小,故含碳微粒主要是C2,A正确;根据元素守恒,有c=c+c+c,B正确;草酸加入氯化钙中反应生成草酸钙,加入醋酸钠粉末,根据电离平衡常数分析,醋酸根离子水解程度大于草酸根离子,故醋酸钠的碱性抑制草酸根离子水解,有利于生成草酸钙,C正确;向上层清液中通入HCl至pH=1,则有电荷守恒:2c+c=2c+c+c+c,根据氢离子浓度为0.1 mol·L-1分析,2c-2c-c-c=c-c,不能确定氯离子浓度,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
选择题保分练(三)
1.(2023·浙江Z20名校联盟一联)化学是材料科学的基础。下列说法不正确的是( )
A.制造5G芯片的氮化铝晶圆属于无机非金属材料
B.La-Ni合金是一种新型储氢合金材料
C.高吸水性树脂聚丙烯酸钠是通过缩聚反应合成的
D.制造防弹装甲的芳纶纤维属于有机高分子材料
2.下列化学用语表示正确的是( )
A.中子数为10的氧原子O
B.1-丁醇的键线式:
C.C的空间结构为三角锥形
D.某激发态碳原子的轨道表示式:
3.(2023·浙江重点中学培优考试)硫酸钡(BaSO4)应用广泛。下列说法不正确的是( )
A.Ba元素位于周期表p区
B.硫酸钡常用于消化道造影
C.硫酸钡饱和溶液呈中性
D.与碳共热可生产硫化钡
4.(2023·浙江1月选考)物质的性质决定用途。下列二者对应关系不正确的是( )
A.SO2能使某些色素褪色,可用作漂白剂
B.金属钠导热性好,可用作传热介质
C.NaClO溶液呈碱性,可用作消毒剂
D.Fe2O3呈红色,可用作颜料
5.(2023·浙江乐清知临中学二次仿真) 已知反应:11P4+60CuSO4+96H2O===20Cu3P+60H2SO4+24H3PO4。下列说法正确的是( )
A.CuSO4是氧化剂,生成Cu3P过程中被氧化
B.Cu3P既是氧化产物又是还原产物
C.氧化剂与还原剂的物质的量之比为60∶11
D.反应中160 g CuSO4参加反应,共转移2 mol电子
6.(2023·浙江浙南名校二次联考)下列说法不正确的是( )
A.酰胺均能在碱性条件下水解得到氨气
B.聚乙炔可用于制备导电高分子材料
C.苯在一定条件可以与氯气发生加成反应和取代反应
D.二氧化碳和环氧丙烷()在一定条件下聚合生成一种可降解的塑料
7.(2023·浙江四校联盟高三模拟)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.60 g SiO2中的Si—O共价键的数目为NA
B.1 mol苯乙醛分子中含π键的数目为4NA
C.25 ℃时,1 L pH为12的氨水中含有OH-数目为0.01 NA
D.56 g铁发生吸氧腐蚀完全转化成铁锈,电极反应中转移电子数为3NA
8.下列反应的离子方程式不正确的是( )
A.将少量SO2通入NaClO溶液中:ClO-+SO2+H2O===S+Cl-+2H+
B.Cl2与冷的NaOH溶液反应:Cl2+2OH-===ClO-+Cl-+H2O
C.乙酰水杨酸()与过量NaOH溶液共热:+3OH-+CH3COO-+2H2O
D.向100 mL 0.1 mol·L-1 FeBr2溶液中通入0.012 mol Cl2:10Fe2++14Br-+12Cl2===10Fe3++7Br2+24Cl-
9.下列实验方案(图中部分夹持装置略),不能达到实验目的的是( )
选项 A B
目的 制取无水FeCl3固体 检验产生的SO2
实验 方案
选项 C D
目的 证明Ksp< Ksp 探究化学反应速 率的影响因素
实验 方案 (表面积大致相同)
10.(2023·浙江十校联考) 辅酶Q10具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶Q10的说法不正确的是( )
A.分子式为C59H90O4,存在3种官能团
B.分子中4个氧原子在同一平面
C.1 mol该物质与NaOH溶液反应,最多可消耗2 mol NaOH
D.1 mol该物质与足量H2反应,最多可消耗14 mol H2
11.中国地质科学院地质研究所对嫦娥五号月球玄武岩开展了分析,证明月球在19.6亿年前仍存在岩浆活动。X、Y、Z、V、W是月核中含有的五种原子序数依次增大的前20号元素,X原子的s能级电子数和p能级电子数相等,V的单质常在地球火山口附近沉积,Y的氧化物常用作耐高温材料。Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数。下列说法正确的是( )
A.Y的氧化物是两性氧化物
B.简单氢化物的稳定性:X>Z>V
C.简单离子半径:W>V>Y
D.第一电离能:W
A.HF的热稳定性强于HCl,则NH4F的热稳定性强于NH4Cl
B.SO2是“V形”分子,则O3是“V形”分子
C.MgCl2溶液在空气中蒸干得到MgO固体,则SrCl2溶液在空气中蒸干得到SrO固体
D.若发生2CuS+3O22CuO+2SO2,则发生2HgS+3O22HgO+2SO2
13.内部重整式高温燃料电池具有良好的商业化前景,其基本工作原理(以CH4为原料,熔融碳酸盐为电解质)如图所示。下列说法正确的是( )
A.b极为正极,发生还原反应
B.电子流向:a极→导线→b极→电解质→a极
C.a极电极反应为CH4-8e-+4C===5CO2+2H2O
D.该电池所用的隔膜一定属于阳离子交换膜
14.(2023·浙江高三百校联考)乙烯氢化的热化学方程式为C2H4(g) + H2(g) ===C2H6(g) ΔH=a kJ·mol-1,使用不同含Au催化剂的反应历程如图所示。下列说法正确的是( )
A.1 mol C2H6(g)的能量大于 1 mol C2H4(g)与1 mol H2(g)具有的能量之和
B.该反应的焓变:ΔH=-129.6 kJ·mol-1
C.过渡态物质的稳定性:过渡态1>过渡态2
D.相应的活化能:催化剂AuF<催化剂AuP
15.(2024·湖南师大附中摸底考)汽车尾气中NO产生的反应为N2(g)+O2(g)2NO(g)。一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A.温度T下,该反应的平衡常数K=
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH<0
16.(2023·浙江金丽衢十二校联考)草酸钙是常见的难溶物。将过量草酸钙粉末置于水中达到溶解平衡:CaC2O4Ca2++C2[已知Ksp=2.3×10-9,Ka=1.75×10-5,H2C2O4的电离常数=5.6×10-2,=1.5×10-4]。下列有关说法不正确的是( )
A.上层清液中含碳微粒主要以C2形式存在
B.上层清液中存在:c=c+c+c
C.H2C2O4加入CaCl2溶液时,加入适量醋酸钠粉末,有利于生成CaC2O4沉淀
D.向上层清液中通入HCl至pH=1,则:2c-2c-c-c=0.1 mol·L-1
选择题保分练(三)
1.C 高吸水性树脂聚丙烯酸钠是丙烯酸钠通过加聚反应合成的,C错误。
2.D 中子数为10的氧原子表示为O,A错误;是1-丙醇的键线式,1-丁醇的键线式为,B错误;C中心原子C原子的价层电子对数为3,其空间结构为平面三角形,C错误;基态碳原子电子排布式为1s22s22p2,故表示激发态碳原子,D正确。
3.A 钡元素位于元素周期表的s区,A错误。
4.C NaClO溶液用于杀菌消毒,不是由于其具有碱性,而是因为其具有强氧化性,C不正确。
5.D Cu元素的化合价降低,故CuSO4是氧化剂,生成Cu3P过程中被还原发生还原反应,A错误;Cu、P元素的化合价均降低,则生成的Cu3P是还原产物,B错误;11 mol P4参与反应时,则有5 mol P4、60 mol CuSO4是氧化剂,6 mol P4是还原剂,氧化剂与还原剂的物质的量之比为65∶6,C错误;消耗60 mol CuSO4,反应转移120 mol电子,消耗1 mol CuSO4,转移2 mol电子,D正确。
6.A 含有—CO—NH2的酰胺在碱性条件下水解才能得到氨气,A错误。
7.C 二氧化硅中每个硅原子与4个氧原子形成硅氧共价键,则60 g二氧化硅中含有硅氧键的数目为×4×NA mol-1=4NA,A错误;苯乙醛分子中苯环中含有1个大π键,醛基中含有1个π键,则1 mol苯乙醛分子中含π键的数目为1 mol×2×NA mol-1=2NA,B错误;25 ℃时,1 L pH为12的氨水中含有氢氧根离子的数目为0.01 mol·L-1×1 L×NA mol-1=0.01NA,C正确;铁发生吸氧腐蚀时,铁为负极,铁失去电子生成亚铁离子,则电极反应中转移电子数为 ×2×NA mol-1=2NA,D错误。
8.A SO2具有还原性,NaClO具有强氧化性,SO2与NaClO发生氧化还原反应,该反应的离子方程式为3ClO-+SO2+H2O===S+Cl-+2HClO,A错误;Cl2与冷的NaOH溶液反应生成氯化钠和次氯酸钠:Cl2+2OH-===ClO-+Cl-+H2O,B正确;乙酰水杨酸()与过量NaOH溶液共热:+3OH-+CH3COO-+2H2O,C正确;Fe2+的还原性强于Br-,因此Cl2先将Fe2+氧化,根据电子守恒,完全氧化0.01 mol Fe2+应消耗0.005 mol Cl2,剩余0.007 mol Cl2氧化0.014 mol Br-,因此参与反应的Fe2+和Br-的物质的量之比为0.01 mol∶0.014 mol=10∶14,离子方程式为12Cl2+10Fe2++14Br-===7Br2+10Fe3++24Cl-,D正确。
9.A 氯化铁固体加热过程中发生水解,应该在氯化氢的气流中进行,故该实验不能达到实验目的,A符合题意;铜和浓硫酸在加热的条件下反应生成SO2,SO2能使品红褪色,多余的SO2用氢氧化钠溶液吸收,防止污染,该实验能达到实验目的,B不符合题意;硫酸锌和硫化钠反应生成硫化锌沉淀,再加入硫酸铜溶液,硫化锌转化为黑色的硫化铜沉淀,说明硫化铜的溶度积小于硫化锌,该实验能达到实验目的,C不符合题意;该实验中只有盐酸的浓度不同,可以根据产生气泡的快慢分析浓度对反应速率的影响,能达到实验目的,D不符合题意。
10.C 该物质分子式为C59H90O4,含醚键、羰基和碳碳双键三种官能团,A正确;双键碳以及与其相连的4个原子共平面,羰基碳原子和与其相连的氧原子及另外2个原子共平面,所以4个氧原子在同一平面上,B正确;该物质不与氢氧化钠溶液反应,C错误;该物质的1个分子有12个碳碳双键和2个碳氧双键,则1 mol该物质可与14 mol氢气发生加成反应,D正确。
11.D X、Y、Z、V、W是原子序数依次增大的前20号元素,X原子的s能级电子数和p能级电子数相等,则X的电子排布式为1s22s22p4,X为O元素;V的单质常在地球火山口附近沉积,则V为S元素;Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数,Y、W同主族,且Z处于偶数族,而Y的氧化物常用作耐高温材料,结合原子序数可知Y为Mg、W为Ca,Z原子最外层电子数为4,可推知Z为Si元素。SiO2是酸性氧化物,不是两性氧化物,A错误;元素的非金属性:O>S>Si,故简单氢化物的稳定性:H2O>H2S>SiH4,B错误;简单离子半径:S2->Ca2+>Mg2+,C错误;第一电离能:Ca
13.A 由装置可知a电极上CO和H2失电子生成CO2和H2O,a极为负极,b极为正极,b电极上O2得电子结合CO2生成C。由以上分析可知b极为正极,得电子发生还原反应,A正确;电子不经过电解质,B错误;由以上分析可知a极反应物不是甲烷,C错误;熔融碳酸盐为电解质,故隔膜允许碳酸根离子通过,为阴离子交换膜,D错误。
14.B 由图可知,该反应为放热反应,故1 mol C2H6(g)的能量小于1 mol C2H4(g)与1 mol H2(g)具有的能量之和,A错误;由图可知C2H4(g)+H2(g) ===C2H6(g) ΔH=生成物能量-反应物能量=-129.6 kJ·mol-1,B正确;由图可知,过渡态1的能量大于过渡态2的能量,能量越低越稳定,则稳定性:过渡态1<过渡态2,C错误;由图可知,催化剂AuF、催化剂AuP相应的活化能分别为109.34 kJ·mol-1、26.3 kJ·mol-1,D错误。
15.A 根据平衡常数的定义,结合开始时氮气和氧气的物质的量相等,可知该平衡常数为K=,A正确;由于该容器是一个恒容容器,反应前后气体的质量不发生改变,所以气体的密度一直不变,B错误;催化剂仅能改变达到平衡所用的时间,不能使平衡移动,即不能改变平衡浓度,C错误;若曲线b对应的条件改变是温度,根据先达到平衡可知为升高温度,平衡向吸热反应的方向移动,而氮气的浓度降低,说明平衡向正方向移动,正反应为吸热反应,ΔH>0,D错误。
16.D 溶解在水中的草酸钙电离出C2,C2能水解,但水解程度很小,故含碳微粒主要是C2,A正确;根据元素守恒,有c=c+c+c,B正确;草酸加入氯化钙中反应生成草酸钙,加入醋酸钠粉末,根据电离平衡常数分析,醋酸根离子水解程度大于草酸根离子,故醋酸钠的碱性抑制草酸根离子水解,有利于生成草酸钙,C正确;向上层清液中通入HCl至pH=1,则有电荷守恒:2c+c=2c+c+c+c,根据氢离子浓度为0.1 mol·L-1分析,2c-2c-c-c=c-c,不能确定氯离子浓度,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
