2025浙江专版新教材化学高考第一轮基础练--选择题保分练(一)(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--选择题保分练(一)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 504.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:18:37 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
选择题保分练(一)
1.(2023·浙江杭州地区重点中学联考)熔融状态下能导电且含有极性共价键的化合物是( )
A.AlCl3 B.Na2O2 C.NaOH D.H2SO4
2.(2023·浙江杭州地区重点中学5月联考)下列化学用语表示正确的是( )
A.异丁烯的键线式:
B.BF3的电子式:
C.淀粉的分子式:(C6H12O6)n
D.H3O+的中心原子的杂化轨道类型:sp3
3.(2023·浙江金丽衢十二校联考)Na2SiO3应用广泛。下列说法不正确的是( )
A.Si元素位于周期表p区
B. Na2SiO3属于强电解质
C. Na2SiO3的水溶液俗称水玻璃
D.存放 Na2SiO3溶液的试剂瓶可以用玻璃塞
4.(2023·浙江宁波镇海中学模考)下列有关化工生产的说法不正确的是( )
A.工业上用Na2O和H2O反应制备NaOH
B.工业上用氯化氢在一定条件下将粗硅转化为SiHCl3
C.工业上常用“吹出法”提取溴,其过程主要包括氧化、吹出、吸收、蒸馏等环节
D.工业上所用的碳素电极可以用石油焦和沥青焦原料制取
5.(2023·浙江绍兴高三月考)关于反应3Cu2S+16HNO3===6Cu(NO3)2+3S+4NO↑+8H2O,下列说法正确的是( )
A.HNO3在反应中仅体现氧化性
B.Cu2S既是氧化剂又是还原剂
C.氧化产物与还原产物的物质的量之比为3∶4
D.4 mol HNO3发生反应,转移3 mol电子
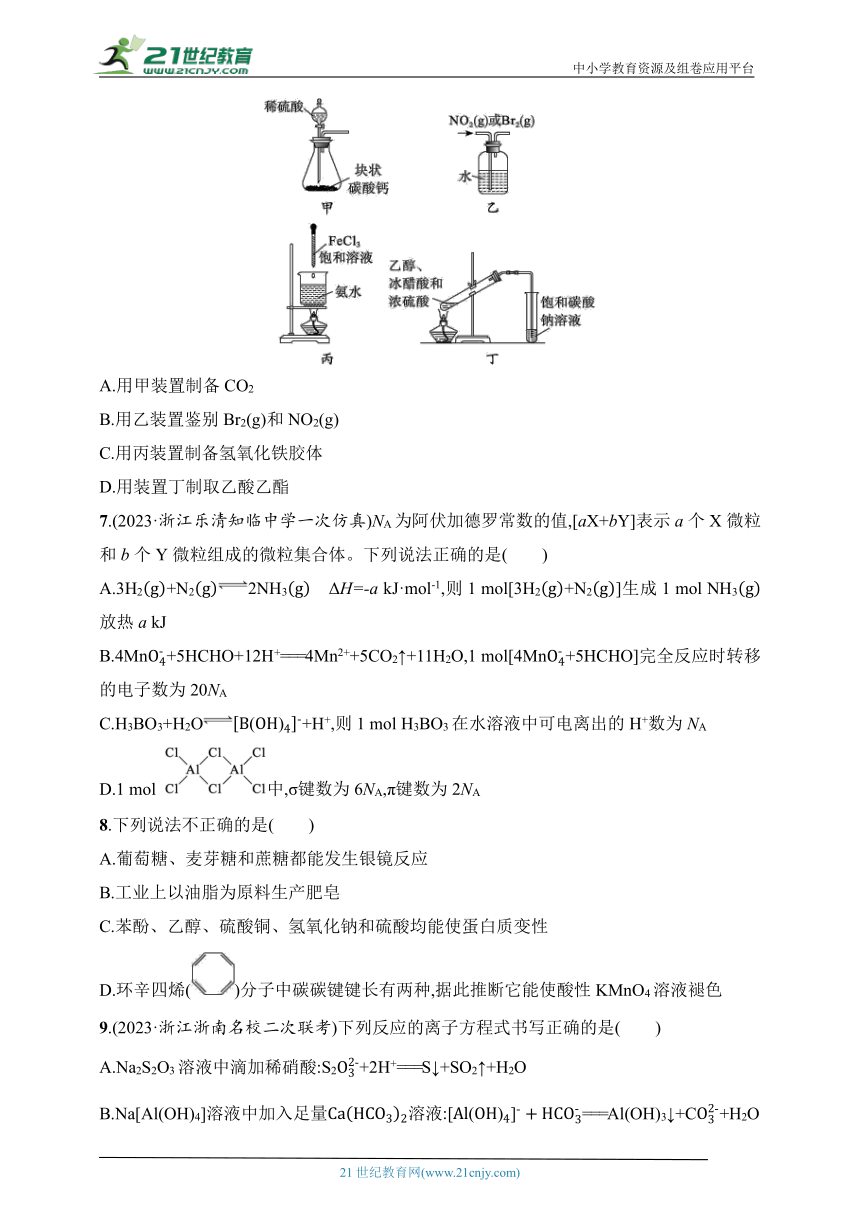
6.(2023·浙江金华十校联考)下列实验装置合理且能达到实验目的的是( )
A.用甲装置制备CO2
B.用乙装置鉴别Br2(g)和NO2(g)
C.用丙装置制备氢氧化铁胶体
D.用装置丁制取乙酸乙酯
7.(2023·浙江乐清知临中学一次仿真)NA为阿伏加德罗常数的值,[aX+bY]表示a个X微粒和b个Y微粒组成的微粒集合体。下列说法正确的是( )
A.3H2+N22NH3 ΔH=-a kJ·mol-1,则1 mol[3H2+N2]生成1 mol NH3放热a kJ
B.4Mn+5HCHO+12H+===4Mn2++5CO2↑+11H2O,1 mol[4Mn+5HCHO]完全反应时转移的电子数为20NA
C.H3BO3+H2O+H+,则1 mol H3BO3在水溶液中可电离出的H+数为NA
D.1 mol 中,σ键数为6NA,π键数为2NA
8.下列说法不正确的是( )
A.葡萄糖、麦芽糖和蔗糖都能发生银镜反应
B.工业上以油脂为原料生产肥皂
C.苯酚、乙醇、硫酸铜、氢氧化钠和硫酸均能使蛋白质变性
D.环辛四烯()分子中碳碳键键长有两种,据此推断它能使酸性KMnO4溶液褪色
9.(2023·浙江浙南名校二次联考)下列反应的离子方程式书写正确的是( )
A.Na2S2O3溶液中滴加稀硝酸:S2+2H+===S↓+SO2↑+H2O
B.Na[Al(OH)4]溶液中加入足量===Al(OH)3↓+C+H2O
C.向溶液中通入少量CO2:
+CO2+H2O+C
D.向明矾溶液中滴加氢氧化钡至沉淀质量最大:Al3++2S+2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-
10.(2023·浙江四校联盟高三模拟)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2p轨道上有两个未成对电子,Z最高能级电子数是总电子数的一半,M是同周期主族元素中原子半径最大的,Q与Z的某种化合物可作为新型自来水消毒剂。下列说法不正确的是( )
A.第一电离能:Y>X>Z>M
B.X的氢化物沸点可能高于Z的氢化物
C.X、Z与M三种元素形成的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:Q>Y
11. ADP的结构简式如图所示。下列说法不正确的是( )
A.1 mol ADP与足量NaOH溶液反应时消耗6 mol NaOH
B.核磁共振氢谱共有13个吸收峰
C.虚框内所有原子共面
D.ADP一定条件下可发生氧化、消去、取代、加成反应
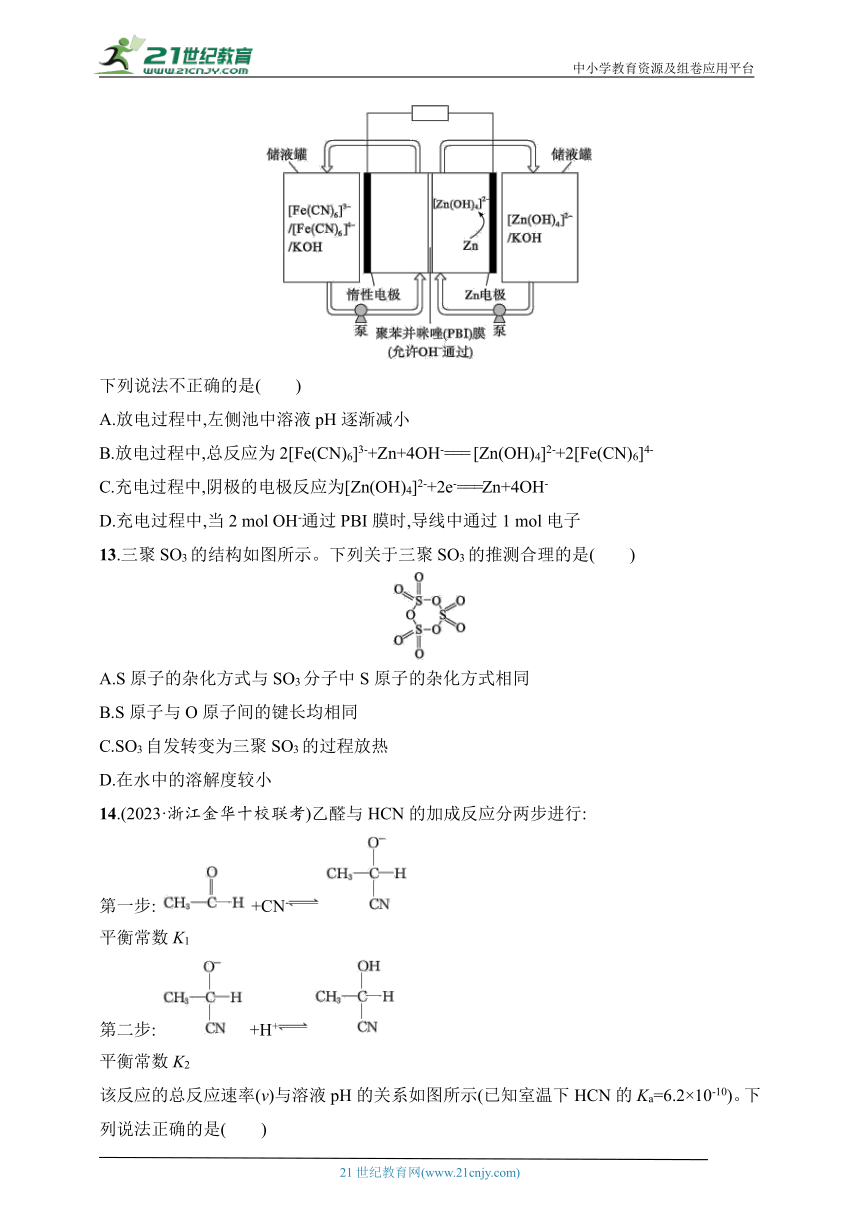
12.锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以[Zn(OH)4]2-/Zn和/[Fe(CN)6]4-作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
下列说法不正确的是( )
A.放电过程中,左侧池中溶液pH逐渐减小
B.放电过程中,总反应为2[Fe(CN)6]3-+Zn+4OH-=== [Zn(OH)4]2-+2[Fe(CN)6]4-
C.充电过程中,阴极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-
D.充电过程中,当2 mol OH-通过PBI膜时,导线中通过1 mol电子
13.三聚SO3的结构如图所示。下列关于三聚SO3的推测合理的是( )
A.S原子的杂化方式与SO3分子中S原子的杂化方式相同
B.S原子与O原子间的键长均相同
C.SO3自发转变为三聚SO3的过程放热
D.在水中的溶解度较小
14.(2023·浙江金华十校联考)乙醛与HCN的加成反应分两步进行:
第一步:+CN-
平衡常数K1
第二步:+H+
平衡常数K2
该反应的总反应速率(v)与溶液pH的关系如图所示(已知室温下HCN的Ka=6.2×10-10)。下列说法正确的是( )
A.1分子加成反应的最终产物中,sp3杂化的原子有2个
B.加少量NaOH,因c(CN-)增大,总反应速率增大
C.加NaOH过多,因第二步平衡逆向移动,总反应速率减小
D.将HCN溶液的pH调至9,则溶液中c(CN-)>c(HCN)
15.(2023·浙江杭州高三期中)常温下,向20 mL 0.1 mol·L-1 H2S溶液中缓慢加入少量溶于水的MSO4粉末(已知MS难溶,忽略溶液体积变化),溶液中c与c变化如图所示[横纵坐标未按比例画,已知:=1.0×10-9,=1.0×10-13]。下列有关说法不正确的是( )
A.a点溶液中c约为10-5 mol·L-1
B.a、b、c三点中由水电离产生的c最小的是c点
C.Ksp约为1.0×10-24
D.c点溶液可能存在关系:c+c+c=0.1 mol·L-1
16.(2023·浙江十校联考)下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究乙醇消去反应的产物 取4 mL乙醇,加入12 mL浓硫酸、少量沸石,迅速升温,将产生的气体通入2 mL酸性KMnO4溶液中 若KMnO4溶液褪色,则乙醇消去反应的产物为乙烯
B 比较 CH3COO- 和HC的水解常数 分别测浓度均为0.1 mol·L-1的CH3COONH4和NaHCO3溶液的pH 若后者大于前者,则 Kb< Kb
C 检验乙醇中是否含有水 向乙醇中加入一小粒金属钠 若产生无色气体,乙醇中含有水
D 探究Na2SO3固体样品是否变质 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 若有白色沉淀产生,则样品已经变质
选择题保分练(一)
1.C NaOH熔融状态下能导电,且OH-中含极性共价键,C正确。
2.D 异丁烯的主链上是3个碳原子,中间碳原子有1个支链,A错误;B最外层有3个电子,与F形成共用电子对后,无孤电子对存在,B错误;淀粉的分子式为(C6H10O5)n,C错误;H3O+的中心原子的价层电子对数=3+(6-1-3×1)=4,所以杂化轨道类型为sp3杂化,D正确。
3.D Si元素位于周期表p区,A正确;Na2SiO3为可溶性盐,在水溶液中完全电离,属于强电解质,B正确;Na2SiO3又称泡花碱,俗称水玻璃,C正确;Na2SiO3溶液能将玻璃瓶塞与瓶口粘在一起,难以打开,所以存放Na2SiO3溶液的试剂瓶不能用玻璃塞,D不正确。
4.A Na2O和H2O反应制取NaOH反应剧烈,原料来源少且不符合经济效益,工业上电解饱和食盐水制备NaOH,A错误。
5.D 反应中N元素化合价从+5价降低到+2价,被还原,HNO3作氧化剂,体现了氧化性,生成物有Cu(NO3)2,还体现了HNO3的酸性,A错误;反应中Cu元素化合价由+1价升高到+2价,S元素化合价从-2价升高到0价,均被氧化,Cu2S只作还原剂,B错误;Cu2S作还原剂,氧化产物为Cu(NO3)2和S,HNO3作氧化剂,还原产物为NO,故氧化产物与还原产物物质的量之比为9∶4,C错误;根据方程式,每4 mol HNO3反应时,只有1 mol作氧化剂被还原,转移的电子为1 mol×3=3 mol,D正确。
6.B 因为硫酸钙为微溶物,在实验室制备CO2时,若用稀硫酸和碳酸钙反应,生成的硫酸钙会覆盖在碳酸钙表面,阻止反应的进一步进行,A错误;Br2(g)和NO2(g)都为红棕色气体,NO2(g)和水完全反应,生成硝酸和无色NO,气体褪色,得到无色溶液,而Br2(g)和水反应程度很小,气体颜色不会完全褪色,溶液变成橙色,可以用与水反应来区分Br2(g)和NO2(g),B正确;实验室用饱和氯化铁溶液滴入沸水中制备氢氧化铁胶体,若向氨水中滴加饱和的氯化铁溶液,只能得到氢氧化铁沉淀,C错误;制备乙酸乙酯时,长导管口不能伸入饱和碳酸钠溶液液面以下,以防止倒吸,D错误。
7.B 3H2(g)+N2(g)2NH3(g) ΔH=-a kJ·mol-1意味着1 mol[3H2(g)+N2(g)]完全反应生成2 mol NH3(g)时放热a kJ,当生成1 mol NH3(g)放热 kJ,A错误;反应4Mn+5HCHO+12H+===4Mn2++5CO2↑+11H2O中,消耗4 mol Mn和5 mol HCHO,即1 mol[4Mn+5HCHO]完全反应时转移的电子数为20NA,B正确;H3BO3是一元弱酸,则1 mol H3BO3在水溶液中可电离出H+数小于NA,C错误;1 mol中,σ键数为8NA,不含π键,D错误。
8.A 蔗糖是非还原性糖,不能发生银镜反应,故A错误。
9.D 硝酸有强氧化性,和Na2S2O3发生氧化还原反应,A错误;Na[Al(OH)4]溶液中滴入足量Ca溶液生成碳酸钙沉淀和氢氧化铝沉淀,离子方程式为Ca2++[Al(OH)4]-+HC===Al(OH)3↓+CaCO3↓+H2O,B错误;向溶液中通入少量CO2生成邻羟基苯甲酸钠和碳酸氢钠,离子方程式为+CO2+H2O→+HC,C错误;使沉淀质量最大,则生成硫酸钡和K[Al(OH)4],离子方程式为Al3++2S+2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-,D正确。
10.A X、Y、Z、M、Q五种短周期元素,原子序数依次增大。M是同周期主族元素中原子半径最大的,则M为Na;Z最高能级电子数是总电子数的一半,则Z为O;X的2p轨道上有两个未成对电子,则X为C,Y为N;Q与Z的某种化合物可作为新型自来水消毒剂,则Q为Cl。第一电离能:Y>Z>X>M,A错误;X的氢化物可能是固体,其沸点可能高于Z的氢化物,B正确;X、Z与M三种元素形成的化合物中可能含有非极性共价键,如草酸钠,C正确;最高价氧化物对应水化物的酸性:Q>Y,D正确。
11.B 根据ADP的结构简式,1 mol ADP完全水解后,生成2 mol H3PO4,与NaOH溶液反应,消耗6 mol NaOH,故A正确;根据ADP的结构简式,最左侧P上的两个羟基成键情况相同,有12个不同化学环境的氢原子,核磁共振氢谱共有12个吸收峰,故B错误;虚框中C、N的杂化类型均为sp2杂化,因此虚框中所有原子共面,故C正确;五元环上含有羟基,羟基能被氧化,五元环上所含羟基邻位碳原子上有H,能发生消去反应,羟基、氨基能与羧基发生取代反应,虚框中双键能与氢气发生加成反应,故D正确。
12.D Zn极为负极,电极反应:Zn+4OH--2e-=== [Zn(OH)4]2-,则左侧池中OH-通过PBI膜进入右侧池,左侧池中OH-浓度降低,pH逐渐减小,A正确;负极电极反应:Zn+4OH--2e-=== [Zn(OH)4]2-,正极电极反应:[Fe(CN)6]3-+e-=== [Fe(CN)6]4-,则总反应为2[Fe(CN)6]3-+Zn+4OH-=== [Zn(OH)4]2-+2[Fe(CN)6]4-,B正确;充电过程中,阴极[Zn(OH)4]2-转化为Zn,电极反应:[Zn(OH)4]2-+2e-===Zn+4OH-,C正确;充电过程中,当2 mol OH-通过PBI膜时,导线中通过2 mol电子,D错误。
13.C SO3分子中S原子的杂化方式为sp2,三聚三氧化硫中S原子杂化方式为sp3,A错误;S原子与O原子间存在双键和单键,单键和双键键长不相同,B错误;SO3自发转变为三聚SO3的过程是成键的过程,放热,C正确;由三聚SO3的结构可知,其为极性分子,根据相似相溶原理,在水中的溶解度较大,D错误。
14.B 1分子加成反应的最终产物为,其中饱和碳为sp3杂化,另外氧原子也是sp3杂化,则一共有3个,A错误;加入少量氢氧化钠可以和HCN反应生成CN-,则CN-浓度增大,反应速率增大,B正确;加NaOH过多,则溶液中氢离子浓度比较小,导致第二步反应较慢,成为影响总反应速率的主要因素,故总反应速率减小,C错误;将HCN溶液的pH调至9,则c(H+)=1.0×10-9 mol·L-1,Ka==6.2×10-10,所以=6.2×10-1<1,故c(CN-)15.D 设0.1 mol·L-1H2S溶液中c(H+)为x,则c(HS-)近似也为x,由(H2S)==1.0×10-9,解得x=10-5 mol·L-1,故A正确;根据化学反应H2S+MSO4===MS↓+H2SO4可知,随着反应进行H2SO4浓度逐渐增大,对水的电离的抑制作用逐渐增强,所以a、b、c三点中由水电离产生的c最小的是c点,故B正确;(H2S)==1.0×10-9,=1.0×10-13,(H2S)×=1.0×10-22,结合b点数据,c(H+)=0.1 mol·L-1,c(M2+)=0.002 mol·L-1,此时溶液中c(H2S)=0.05 mol·L-1,解得c(S2-)=5×10-22 mol·L-1,MS为难溶物,上述反应的Ksp=c(M2+)×c(S2-)=0.002×5×10-22=1.0×10-24,故C正确;根据元素守恒规律可知,c点除了溶液中含有S元素之外,MS沉淀中也有S元素,故D错误。
16.D 乙醇易挥发,也能使酸性高锰酸钾溶液褪色,该实验中酸性高锰酸钾溶液褪色并不能说明有乙烯生成,A错误;CH3COONH4为弱酸弱碱盐,NaHCO3为强碱弱酸盐,不能通过比较等浓度两种溶液的pH判断水解常数大小,B错误;乙醇和水均能与金属钠反应生成气体,不能用金属钠检验乙醇中是否含有水,C错误;向Na2SO3固体样品溶液中加入足量稀盐酸除去干扰离子S、C,再加入氯化钡溶液,若有沉淀生成,则Na2SO3固体样品已变质,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
选择题保分练(一)
1.(2023·浙江杭州地区重点中学联考)熔融状态下能导电且含有极性共价键的化合物是( )
A.AlCl3 B.Na2O2 C.NaOH D.H2SO4
2.(2023·浙江杭州地区重点中学5月联考)下列化学用语表示正确的是( )
A.异丁烯的键线式:
B.BF3的电子式:
C.淀粉的分子式:(C6H12O6)n
D.H3O+的中心原子的杂化轨道类型:sp3
3.(2023·浙江金丽衢十二校联考)Na2SiO3应用广泛。下列说法不正确的是( )
A.Si元素位于周期表p区
B. Na2SiO3属于强电解质
C. Na2SiO3的水溶液俗称水玻璃
D.存放 Na2SiO3溶液的试剂瓶可以用玻璃塞
4.(2023·浙江宁波镇海中学模考)下列有关化工生产的说法不正确的是( )
A.工业上用Na2O和H2O反应制备NaOH
B.工业上用氯化氢在一定条件下将粗硅转化为SiHCl3
C.工业上常用“吹出法”提取溴,其过程主要包括氧化、吹出、吸收、蒸馏等环节
D.工业上所用的碳素电极可以用石油焦和沥青焦原料制取
5.(2023·浙江绍兴高三月考)关于反应3Cu2S+16HNO3===6Cu(NO3)2+3S+4NO↑+8H2O,下列说法正确的是( )
A.HNO3在反应中仅体现氧化性
B.Cu2S既是氧化剂又是还原剂
C.氧化产物与还原产物的物质的量之比为3∶4
D.4 mol HNO3发生反应,转移3 mol电子
6.(2023·浙江金华十校联考)下列实验装置合理且能达到实验目的的是( )
A.用甲装置制备CO2
B.用乙装置鉴别Br2(g)和NO2(g)
C.用丙装置制备氢氧化铁胶体
D.用装置丁制取乙酸乙酯
7.(2023·浙江乐清知临中学一次仿真)NA为阿伏加德罗常数的值,[aX+bY]表示a个X微粒和b个Y微粒组成的微粒集合体。下列说法正确的是( )
A.3H2+N22NH3 ΔH=-a kJ·mol-1,则1 mol[3H2+N2]生成1 mol NH3放热a kJ
B.4Mn+5HCHO+12H+===4Mn2++5CO2↑+11H2O,1 mol[4Mn+5HCHO]完全反应时转移的电子数为20NA
C.H3BO3+H2O+H+,则1 mol H3BO3在水溶液中可电离出的H+数为NA
D.1 mol 中,σ键数为6NA,π键数为2NA
8.下列说法不正确的是( )
A.葡萄糖、麦芽糖和蔗糖都能发生银镜反应
B.工业上以油脂为原料生产肥皂
C.苯酚、乙醇、硫酸铜、氢氧化钠和硫酸均能使蛋白质变性
D.环辛四烯()分子中碳碳键键长有两种,据此推断它能使酸性KMnO4溶液褪色
9.(2023·浙江浙南名校二次联考)下列反应的离子方程式书写正确的是( )
A.Na2S2O3溶液中滴加稀硝酸:S2+2H+===S↓+SO2↑+H2O
B.Na[Al(OH)4]溶液中加入足量===Al(OH)3↓+C+H2O
C.向溶液中通入少量CO2:
+CO2+H2O+C
D.向明矾溶液中滴加氢氧化钡至沉淀质量最大:Al3++2S+2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-
10.(2023·浙江四校联盟高三模拟)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2p轨道上有两个未成对电子,Z最高能级电子数是总电子数的一半,M是同周期主族元素中原子半径最大的,Q与Z的某种化合物可作为新型自来水消毒剂。下列说法不正确的是( )
A.第一电离能:Y>X>Z>M
B.X的氢化物沸点可能高于Z的氢化物
C.X、Z与M三种元素形成的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:Q>Y
11. ADP的结构简式如图所示。下列说法不正确的是( )
A.1 mol ADP与足量NaOH溶液反应时消耗6 mol NaOH
B.核磁共振氢谱共有13个吸收峰
C.虚框内所有原子共面
D.ADP一定条件下可发生氧化、消去、取代、加成反应
12.锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以[Zn(OH)4]2-/Zn和/[Fe(CN)6]4-作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
下列说法不正确的是( )
A.放电过程中,左侧池中溶液pH逐渐减小
B.放电过程中,总反应为2[Fe(CN)6]3-+Zn+4OH-=== [Zn(OH)4]2-+2[Fe(CN)6]4-
C.充电过程中,阴极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-
D.充电过程中,当2 mol OH-通过PBI膜时,导线中通过1 mol电子
13.三聚SO3的结构如图所示。下列关于三聚SO3的推测合理的是( )
A.S原子的杂化方式与SO3分子中S原子的杂化方式相同
B.S原子与O原子间的键长均相同
C.SO3自发转变为三聚SO3的过程放热
D.在水中的溶解度较小
14.(2023·浙江金华十校联考)乙醛与HCN的加成反应分两步进行:
第一步:+CN-
平衡常数K1
第二步:+H+
平衡常数K2
该反应的总反应速率(v)与溶液pH的关系如图所示(已知室温下HCN的Ka=6.2×10-10)。下列说法正确的是( )
A.1分子加成反应的最终产物中,sp3杂化的原子有2个
B.加少量NaOH,因c(CN-)增大,总反应速率增大
C.加NaOH过多,因第二步平衡逆向移动,总反应速率减小
D.将HCN溶液的pH调至9,则溶液中c(CN-)>c(HCN)
15.(2023·浙江杭州高三期中)常温下,向20 mL 0.1 mol·L-1 H2S溶液中缓慢加入少量溶于水的MSO4粉末(已知MS难溶,忽略溶液体积变化),溶液中c与c变化如图所示[横纵坐标未按比例画,已知:=1.0×10-9,=1.0×10-13]。下列有关说法不正确的是( )
A.a点溶液中c约为10-5 mol·L-1
B.a、b、c三点中由水电离产生的c最小的是c点
C.Ksp约为1.0×10-24
D.c点溶液可能存在关系:c+c+c=0.1 mol·L-1
16.(2023·浙江十校联考)下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究乙醇消去反应的产物 取4 mL乙醇,加入12 mL浓硫酸、少量沸石,迅速升温,将产生的气体通入2 mL酸性KMnO4溶液中 若KMnO4溶液褪色,则乙醇消去反应的产物为乙烯
B 比较 CH3COO- 和HC的水解常数 分别测浓度均为0.1 mol·L-1的CH3COONH4和NaHCO3溶液的pH 若后者大于前者,则 Kb< Kb
C 检验乙醇中是否含有水 向乙醇中加入一小粒金属钠 若产生无色气体,乙醇中含有水
D 探究Na2SO3固体样品是否变质 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 若有白色沉淀产生,则样品已经变质
选择题保分练(一)
1.C NaOH熔融状态下能导电,且OH-中含极性共价键,C正确。
2.D 异丁烯的主链上是3个碳原子,中间碳原子有1个支链,A错误;B最外层有3个电子,与F形成共用电子对后,无孤电子对存在,B错误;淀粉的分子式为(C6H10O5)n,C错误;H3O+的中心原子的价层电子对数=3+(6-1-3×1)=4,所以杂化轨道类型为sp3杂化,D正确。
3.D Si元素位于周期表p区,A正确;Na2SiO3为可溶性盐,在水溶液中完全电离,属于强电解质,B正确;Na2SiO3又称泡花碱,俗称水玻璃,C正确;Na2SiO3溶液能将玻璃瓶塞与瓶口粘在一起,难以打开,所以存放Na2SiO3溶液的试剂瓶不能用玻璃塞,D不正确。
4.A Na2O和H2O反应制取NaOH反应剧烈,原料来源少且不符合经济效益,工业上电解饱和食盐水制备NaOH,A错误。
5.D 反应中N元素化合价从+5价降低到+2价,被还原,HNO3作氧化剂,体现了氧化性,生成物有Cu(NO3)2,还体现了HNO3的酸性,A错误;反应中Cu元素化合价由+1价升高到+2价,S元素化合价从-2价升高到0价,均被氧化,Cu2S只作还原剂,B错误;Cu2S作还原剂,氧化产物为Cu(NO3)2和S,HNO3作氧化剂,还原产物为NO,故氧化产物与还原产物物质的量之比为9∶4,C错误;根据方程式,每4 mol HNO3反应时,只有1 mol作氧化剂被还原,转移的电子为1 mol×3=3 mol,D正确。
6.B 因为硫酸钙为微溶物,在实验室制备CO2时,若用稀硫酸和碳酸钙反应,生成的硫酸钙会覆盖在碳酸钙表面,阻止反应的进一步进行,A错误;Br2(g)和NO2(g)都为红棕色气体,NO2(g)和水完全反应,生成硝酸和无色NO,气体褪色,得到无色溶液,而Br2(g)和水反应程度很小,气体颜色不会完全褪色,溶液变成橙色,可以用与水反应来区分Br2(g)和NO2(g),B正确;实验室用饱和氯化铁溶液滴入沸水中制备氢氧化铁胶体,若向氨水中滴加饱和的氯化铁溶液,只能得到氢氧化铁沉淀,C错误;制备乙酸乙酯时,长导管口不能伸入饱和碳酸钠溶液液面以下,以防止倒吸,D错误。
7.B 3H2(g)+N2(g)2NH3(g) ΔH=-a kJ·mol-1意味着1 mol[3H2(g)+N2(g)]完全反应生成2 mol NH3(g)时放热a kJ,当生成1 mol NH3(g)放热 kJ,A错误;反应4Mn+5HCHO+12H+===4Mn2++5CO2↑+11H2O中,消耗4 mol Mn和5 mol HCHO,即1 mol[4Mn+5HCHO]完全反应时转移的电子数为20NA,B正确;H3BO3是一元弱酸,则1 mol H3BO3在水溶液中可电离出H+数小于NA,C错误;1 mol中,σ键数为8NA,不含π键,D错误。
8.A 蔗糖是非还原性糖,不能发生银镜反应,故A错误。
9.D 硝酸有强氧化性,和Na2S2O3发生氧化还原反应,A错误;Na[Al(OH)4]溶液中滴入足量Ca溶液生成碳酸钙沉淀和氢氧化铝沉淀,离子方程式为Ca2++[Al(OH)4]-+HC===Al(OH)3↓+CaCO3↓+H2O,B错误;向溶液中通入少量CO2生成邻羟基苯甲酸钠和碳酸氢钠,离子方程式为+CO2+H2O→+HC,C错误;使沉淀质量最大,则生成硫酸钡和K[Al(OH)4],离子方程式为Al3++2S+2Ba2++4OH-===2BaSO4↓+[Al(OH)4]-,D正确。
10.A X、Y、Z、M、Q五种短周期元素,原子序数依次增大。M是同周期主族元素中原子半径最大的,则M为Na;Z最高能级电子数是总电子数的一半,则Z为O;X的2p轨道上有两个未成对电子,则X为C,Y为N;Q与Z的某种化合物可作为新型自来水消毒剂,则Q为Cl。第一电离能:Y>Z>X>M,A错误;X的氢化物可能是固体,其沸点可能高于Z的氢化物,B正确;X、Z与M三种元素形成的化合物中可能含有非极性共价键,如草酸钠,C正确;最高价氧化物对应水化物的酸性:Q>Y,D正确。
11.B 根据ADP的结构简式,1 mol ADP完全水解后,生成2 mol H3PO4,与NaOH溶液反应,消耗6 mol NaOH,故A正确;根据ADP的结构简式,最左侧P上的两个羟基成键情况相同,有12个不同化学环境的氢原子,核磁共振氢谱共有12个吸收峰,故B错误;虚框中C、N的杂化类型均为sp2杂化,因此虚框中所有原子共面,故C正确;五元环上含有羟基,羟基能被氧化,五元环上所含羟基邻位碳原子上有H,能发生消去反应,羟基、氨基能与羧基发生取代反应,虚框中双键能与氢气发生加成反应,故D正确。
12.D Zn极为负极,电极反应:Zn+4OH--2e-=== [Zn(OH)4]2-,则左侧池中OH-通过PBI膜进入右侧池,左侧池中OH-浓度降低,pH逐渐减小,A正确;负极电极反应:Zn+4OH--2e-=== [Zn(OH)4]2-,正极电极反应:[Fe(CN)6]3-+e-=== [Fe(CN)6]4-,则总反应为2[Fe(CN)6]3-+Zn+4OH-=== [Zn(OH)4]2-+2[Fe(CN)6]4-,B正确;充电过程中,阴极[Zn(OH)4]2-转化为Zn,电极反应:[Zn(OH)4]2-+2e-===Zn+4OH-,C正确;充电过程中,当2 mol OH-通过PBI膜时,导线中通过2 mol电子,D错误。
13.C SO3分子中S原子的杂化方式为sp2,三聚三氧化硫中S原子杂化方式为sp3,A错误;S原子与O原子间存在双键和单键,单键和双键键长不相同,B错误;SO3自发转变为三聚SO3的过程是成键的过程,放热,C正确;由三聚SO3的结构可知,其为极性分子,根据相似相溶原理,在水中的溶解度较大,D错误。
14.B 1分子加成反应的最终产物为,其中饱和碳为sp3杂化,另外氧原子也是sp3杂化,则一共有3个,A错误;加入少量氢氧化钠可以和HCN反应生成CN-,则CN-浓度增大,反应速率增大,B正确;加NaOH过多,则溶液中氢离子浓度比较小,导致第二步反应较慢,成为影响总反应速率的主要因素,故总反应速率减小,C错误;将HCN溶液的pH调至9,则c(H+)=1.0×10-9 mol·L-1,Ka==6.2×10-10,所以=6.2×10-1<1,故c(CN-)
16.D 乙醇易挥发,也能使酸性高锰酸钾溶液褪色,该实验中酸性高锰酸钾溶液褪色并不能说明有乙烯生成,A错误;CH3COONH4为弱酸弱碱盐,NaHCO3为强碱弱酸盐,不能通过比较等浓度两种溶液的pH判断水解常数大小,B错误;乙醇和水均能与金属钠反应生成气体,不能用金属钠检验乙醇中是否含有水,C错误;向Na2SO3固体样品溶液中加入足量稀盐酸除去干扰离子S、C,再加入氯化钡溶液,若有沉淀生成,则Na2SO3固体样品已变质,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
