2025浙江专版新教材化学高考第一轮基础练--作业4物质的量 气体摩尔体积(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业4物质的量 气体摩尔体积(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 368.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:20:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业4物质的量 气体摩尔体积
A组 基础达标
1.(2023·浙江台州书生中学段考)碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均能溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜,溶解28.4 g上述混合物恰好消耗1 mol·L-1盐酸500 mL,灼烧等量的上述混合物,得到的氧化铜质量是( )
A.35 g
B.30 g
C.20 g
D.15 g
2.(2023·浙江杭州四中检测)磷在氯气中燃烧可以生成PCl3和PCl5,若用去的氯气的物质的量是磷的2倍,则产物中PCl3和PCl5的物质的量之比为( )
A.1∶1
B.1∶2
C.2∶1
D.3∶5
3.(2023·浙江杭州学军中学段考)标准状况下,CH4和CO的混合气体8.96 L,总质量为7.60 g。下列说法不正确的是( )
A.CO和CH4物质的量之比为1∶3
B.CO的质量分数约为36.8%
C.H和C原子个数之比为3∶1
D.混合气体的密度约为8.48 g·L-1
4.(2023·浙江宁波李惠利中学段考)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中的NA为阿伏加德罗常数的值)( )
A. L
B. L
C. L
D. L
5.(2023·浙江鄞州姜山中学月考)NH4N3(叠氮化铵)易发生分解反应生成N2和H2,且两种气体的物质的量相等。若得到NH4N3的分解产物(简称a)28 g,则下列说法错误的是( )
A.叠氮化铵中N元素不止一种价态
B.a中两种气体的质量比为14∶1
C.a的平均摩尔质量为14.5 g·mol-1
D.同温同压下,a中两种气体的体积比为1∶1
6.(2023·浙江苍南一中段考)25 ℃、101 kPa条件下,相同体积的两个密闭容器甲和乙,甲中充满O2,乙中充满O2和O3的混合气体。下列说法错误的是( )
A.两容器中气体的质量不相同
B.两容器中气体的分子数目相同
C.两容器中气体的氧原子数目不相同
D.两容器中气体的密度相同
7.(2023·浙江温州高三一模)将40.8 g Fe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4 g Fe3O4,则Fe、FeO的物质的量之比为( )
A.1∶3
B.1∶2
C.1∶1
D.2∶1
8.(2023·浙江镇海龙赛中学检测)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M甲>M乙,则气体体积:甲<乙
B.若M甲乙
C.若M甲>M乙,则气体的摩尔体积:甲<乙
D.若M甲9.(2023·浙江嘉兴一中月考)在2.8 g Fe中加入100 mL 3 mol·L-1盐酸,Fe完全溶解。NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.反应转移电子为0.1 mol
B.盐酸中Cl-数为3NA
C.2.8 g 56Fe含有的中子数为1.3NA
D.反应生成标准状况下气体3.36 L
10.(2023·浙江舟山定海一中月考)将3.84 g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成NO2和NO的混合气体,当铜完全溶解时,共产生气体1.12 L(已折合为标准状况),则产生的NO2和NO的物质的量之比为( )
A.3∶7
B.9∶1
C.4∶1
D.2∶3
B组 综合提升
11.(2024·浙江温州高三一模)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18 g O中含有的中子数为10NA
B.42 g环己烷()中含有σ键的数目为9NA
C.标准状况下,22.4 L CHCl3中含有的分子数为NA
D.6.0 g SiO2与足量NaOH溶液反应,所得溶液中Si的个数为0.1NA
12.(2023·浙江海盐元济高级中学段考)把5.1 g镁铝合金的粉末放入500 mL盐酸中,金属和酸均恰好反应,得到标准状况下H2 5.6 L。下列说法错误的是( )
A.该合金中铝的质量分数约为52.94%
B.该盐酸的物质的量浓度为2 mol·L-1
C.该合金镁和铝的物质的量之比为1∶1
D.该反应中一共转移的电子的物质的量为0.5 mol
13.(2023·浙江富阳新登中学月考)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g,下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.4 mol·L-1
C.产生的NO在标准状况下的体积为6.72 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
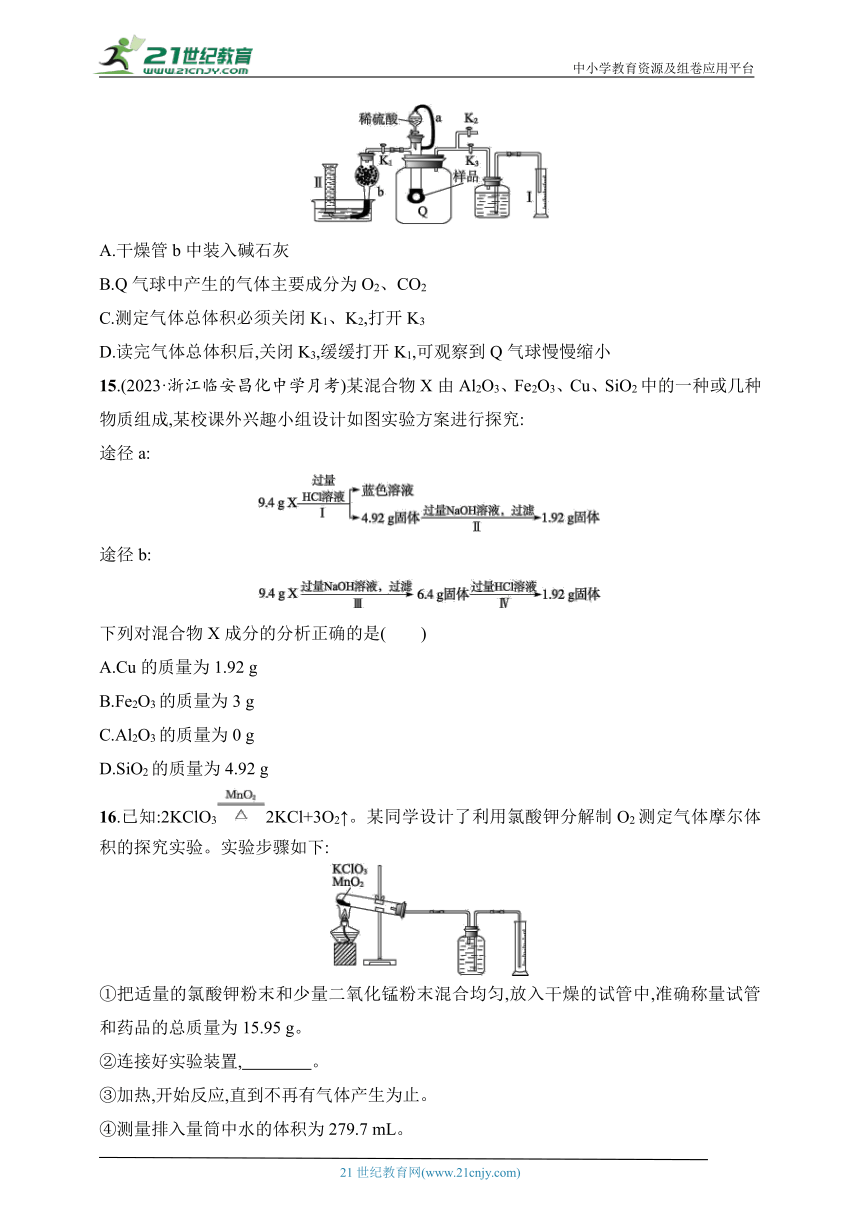
14.(2023·浙江萧山第三高级中学段考)通过测定混合气中O2含量可计算已变质的Na2O2(含Na2CO3)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成分为O2、CO2
C.测定气体总体积必须关闭K1、K2,打开K3
D.读完气体总体积后,关闭K3,缓缓打开K1,可观察到Q气球慢慢缩小
15.(2023·浙江临安昌化中学月考)某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成,某校课外兴趣小组设计如图实验方案进行探究:
途径a:
途径b:
下列对混合物X成分的分析正确的是( )
A.Cu的质量为1.92 g
B.Fe2O3的质量为3 g
C.Al2O3的质量为0 g
D.SiO2的质量为4.92 g
16.已知:2KClO32KCl+3O2↑。某同学设计了利用氯酸钾分解制O2测定气体摩尔体积的探究实验。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置, 。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为279.7 mL。
⑤准确称量试管和残留物的质量为15.55 g。根据上述实验过程,回答下列问题:
(1)请补充②中的实验步骤 。
(2)以下是测量收集到气体体积必须包括的几个步骤:a.调整量筒的高度使广口瓶和量筒内的液面高度相同;b.使试管和广口瓶内气体都冷却至室温;c.读取量筒内液体的体积。这三步操作的正确顺序是 (请填写步骤序号)。进行实验操作c时,若仰视读数,则读取液体的体积 (填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是 mol;实验测得该条件下的气体摩尔体积是 (保留小数点后两位)。
(4)若欲检验试管中产物所含的阴离子,方案为:将固体冷却后溶于水,过滤,
(填写具体实验方案)。检验产物中所含的阳离子方法为 。
作业4 物质的量 气体摩尔体积
1.C 混合物溶于盐酸后溶质成分是CuCl2,根据铜元素和氯元素守恒可得:CuO~CuCl2~2HCl,n(CuO)=n(HCl)=0.25 mol,m(CuO)=0.25 mol×80 g·mol-1=20 g。
2.A 设磷的物质的量为1 mol,则氯气的物质的量为2 mol,生成PCl3和PCl5的物质的量分别为x、y,由P、Cl守恒可知解得x=0.5 mol,y=0.5 mol,x∶y=0.5 mol∶0.5 mol=1∶1。
3.D 标准状况下,CH4和CO的混合气体8.96 L,总物质的量为0.4 mol,总质量为7.60 g,则平均摩尔质量为=19 g·mol-1,则有=
=19 g·mol-1,解得n(CO)∶n(CH4)=1∶3,A正确;混合气体的总物质的量为0.4 mol,n(CO)∶n(CH4)=1∶3,则有n(CO)=0.1 mol,m(CO)=2.8 g,故CO的质量分数为×100%≈36.8%,B正确;0.1 mol CO和0.3 mol CH4共含有1.2 mol H原子和0.4 mol C原子,故H和C原子个数比为3∶1,C正确;CH4和CO的混合气体8.96 L,总质量为7.60 g,则混合气体的密度为≈0.848 g·L-1,D错误。
4.B 由=n=,所以有,M=。根据=n=,所以有=n=,解得V= L。
5.C N中的N元素的化合价为-3价,中的N元素的平均化合价为-价,A正确;两种气体的物质的量相等,则其质量比等于二者摩尔质量之比,即为28 g·mol-1∶2 g·mol-1=14∶1,B正确;分解产物中两种气体的物质的量相等,则=28 g·mol-1×+2 g·mol-1×=15 g·mol-1,C错误;同温同压下,气体体积与其物质的量成正比,则两种气体的体积比为1∶1,D正确。
6.D 同温、同压、同体积的两个密闭容器中,气体的分子数相同(即气体的物质的量相同)。由于两个容器中气体的摩尔质量不相同,故两容器中气体的质量也不相同,A、B均正确;容器甲中,1 mol 气体含有2 mol氧原子,容器乙中,1 mol气体含有氧原子的物质的量为2~3 mol之间,所以两容器中气体的氧原子数目不相同,C正确;同温、同压条件下,气体的密度与气体的摩尔质量成正比,由于两个容器中气体的摩尔质量不相同,所以两容器中气体的密度也不相同,D错误。
7.A 46.4 g Fe3O4中,n(Fe3O4)==0.2 mol,则n(Fe)=0.6 mol;40.8 g Fe、FeO混合物中,m(Fe)=0.6 mol×56 g·mol-1=33.6 g,m(O)=40.8 g-33.6 g=7.2 g,n(FeO)=n(O)==0.45 mol,则n(Fe)=0.6 mol-0.45 mol=0.15 mol,Fe、FeO的物质的量之比为0.15 mol∶0.45 mol=1∶3,故选A。
8.B 两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ=可知气体的体积相等,故A错误;若M甲乙,因为气体体积相等,所以气体的压强:甲>乙,故B正确;根据n=,若M甲>M乙,则气体的物质的量:甲<乙,根据Vm=,则气体的摩尔体积:甲>乙,故C错误;根据n=,若M甲n乙,则气体的分子数:甲>乙,故D错误。
9.A 2.8 g Fe的物质的量为0.05 mol;100 mL 3 mol·L-1盐酸中H+和Cl-的物质的量均为0.3 mol,两者发生反应后,Fe完全溶解,而盐酸过量。Fe完全溶解生成Fe2+,该反应转移电子0.1 mol,A正确;盐酸中Cl-的物质的量为0.3 mol,因此,Cl-数为0.3NA,B不正确;56Fe的质子数为26、中子数为30,2.8 g 56Fe的物质的量为0.05 mol,因此,2.8 g 56Fe含有的中子数为1.5NA,C不正确;反应生成H2的物质的量为0.05 mol,在标准状况下的体积为1.12 L,D不正确。
10.A 将3.84 g铜(物质的量为0.06 mol)和一定量的浓硝酸反应,当铜完全溶解时,产生NO2和NO的混合气体,混合气体体积为1.12 L(已折合为标准状况)即物质的量为0.05 mol,根据得失电子守恒建立方程式n(NO2)+n(NO)=0.05 mol,n(NO2)+3n(NO)=0.06 mol×2,解得n(NO)=0.035 mol,n(NO2)=0.015 mol,则产生的NO2和NO的物质的量之比为3∶7,故A符合题意。
11.B n(O)==0.9 mol,则中子数为9NA,A错误;n(环己烷)==0.5 mol,1个环己烷中含有18个σ键,则42 g环己烷中含有σ键的数目为9NA,B正确;标准状况下,CHCl3为液体,无法根据体积计算物质的量,C错误;二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,硅酸钠在溶液中发生水解反应,根据原子守恒,n(Si)==0.1 mol,则Si个数小于0.1NA,故D错误。
12.B n(H2)==0.25 mol,设Mg的物质的量为x mol,则Al的物质的量为(0.25-x) mol,从而得出24x+27×(0.25-x)=5.1,x=0.1,(0.25-x)=0.1。由计算可知,Al为0.1 mol,质量为2.7 g,则该合金中铝的质量分数约为×100%≈52.94%,A正确;Mg、Al都为0.1 mol,共消耗HCl的物质的量为0.5 mol,该盐酸的物质的量浓度为=1 mol·L-1,B错误;该合金镁和铝的物质的量之比为0.1 mol∶0.1 mol=1∶1,C正确;该反应中一共转移的电子的物质的量为0.1 mol×2+0.1 mol×3=0.5 mol,D正确。
13.C n[Cu(OH)2]==0.4 mol,m(Cu元素)=0.4 mol×64 g·mol-1=25.6 g,n(O)=n(Cu2O)==0.1 mol,n(Cu单质)=0.4 mol-0.1 mol×2=0.2 mol,依据得失电子守恒,可求出n(NO)==0.2 mol。由分析可知,n(Cu单质)=0.2 mol,n(Cu2O)=0.1 mol,则Cu与Cu2O的物质的量之比为0.2 mol∶0.1 mol=2∶1,A正确;n(HNO3)=n(NaNO3)+n(NO)=1.0 mol·L-1×1.0 L+0.2 mol=1.2 mol,硝酸的物质的量浓度为=2.4 mol·L-1,B正确;产生的NO在标准状况下的体积为0.2 mol×22.4 L·mol-1=4.48 L,C不正确;加入NaOH,与Cu(NO3)2和过量HNO3反应,则Cu、Cu2O与硝酸反应后剩余HNO3为1.0 mol·L-1×1.0 L-0.4 mol×2=0.2 mol,D正确。
14.D 加入硫酸与样品反应在Q气囊中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水测氧气的量,进而计算过氧化钠的量,选项A、B都正确。测定气体的总体积是利用Q的膨胀将瓶中的空气挤入右边进行排水量气,所以必须关闭K1、K2,打开K3,选项C正确。读完气体总体积后,关闭K3,缓缓打开K1,还要再打开K2,才可观察到Q气球慢慢缩小,原因是不打开K2体系是密闭的,气球体积无法减小,选项D错误。
15.C 途径Ⅰ得到的4.92 g固体部分溶于NaOH溶液,说明X中含有二氧化硅,且m(SiO2)=4.92 g-1.92 g=3 g,剩余的1.92 g固体为单质铜;又途径a的Ⅰ中加入过量盐酸时得到蓝色溶液,则发生反应Fe2O3+6H+===2Fe3++3H2O、Cu十2Fe3+===2Fe2++Cu2+,铜有剩余,说明Fe3+全部转化为Fe2+,则加入过量盐酸时发生的反应可写成Fe2O3+6H++Cu===2Fe2++Cu2++3H2O。途径b的Ⅲ中溶于NaOH溶液的固体质量为9.4 g-6.4 g=3 g,说明X中不含Al2O3;6.4 g固体为Fe2O3、Cu的混合物,加入过量盐酸发生反应Fe2O3+6H++Cu===2Fe2++Cu2++3H2O,剩余1.92 g Cu,故Fe2O3的质量为(6.4 g-1.92 g)×=3.2 g,Cu的质量为6.4 g-3.2 g=3.2 g。
16.答案 (1)检查装置的气密性 (2)bac 偏小
(3)0.012 5 22.38 L·mol-1
(4)滤液加入硝酸酸化的AgNO3溶液,若产生白色沉淀,则含Cl- 焰色试验
解析 (2)在测量收集到O2的体积时,先将装置中的气体冷却至室温,然后调整量筒高度,使量筒内液面和广口瓶中液面相平,最后再读取量筒内水的体积。读数时若仰视量筒内的液面,会使读取液体的体积偏小。(3)根据质量守恒定律,产生O2的质量为15.95 g-15.55 g=0.4 g,n(O2)==0.012 5 mol,则Vm==22.38 L·mol-1。(4)氯酸钾分解制O2的产物还有Cl-,检验Cl-的方法是:滤液加入硝酸酸化的AgNO3溶液,若产生白色沉淀,则含Cl-。滤液中的阳离子是K+,要用焰色试验来检验。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业4物质的量 气体摩尔体积
A组 基础达标
1.(2023·浙江台州书生中学段考)碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均能溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜,溶解28.4 g上述混合物恰好消耗1 mol·L-1盐酸500 mL,灼烧等量的上述混合物,得到的氧化铜质量是( )
A.35 g
B.30 g
C.20 g
D.15 g
2.(2023·浙江杭州四中检测)磷在氯气中燃烧可以生成PCl3和PCl5,若用去的氯气的物质的量是磷的2倍,则产物中PCl3和PCl5的物质的量之比为( )
A.1∶1
B.1∶2
C.2∶1
D.3∶5
3.(2023·浙江杭州学军中学段考)标准状况下,CH4和CO的混合气体8.96 L,总质量为7.60 g。下列说法不正确的是( )
A.CO和CH4物质的量之比为1∶3
B.CO的质量分数约为36.8%
C.H和C原子个数之比为3∶1
D.混合气体的密度约为8.48 g·L-1
4.(2023·浙江宁波李惠利中学段考)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中的NA为阿伏加德罗常数的值)( )
A. L
B. L
C. L
D. L
5.(2023·浙江鄞州姜山中学月考)NH4N3(叠氮化铵)易发生分解反应生成N2和H2,且两种气体的物质的量相等。若得到NH4N3的分解产物(简称a)28 g,则下列说法错误的是( )
A.叠氮化铵中N元素不止一种价态
B.a中两种气体的质量比为14∶1
C.a的平均摩尔质量为14.5 g·mol-1
D.同温同压下,a中两种气体的体积比为1∶1
6.(2023·浙江苍南一中段考)25 ℃、101 kPa条件下,相同体积的两个密闭容器甲和乙,甲中充满O2,乙中充满O2和O3的混合气体。下列说法错误的是( )
A.两容器中气体的质量不相同
B.两容器中气体的分子数目相同
C.两容器中气体的氧原子数目不相同
D.两容器中气体的密度相同
7.(2023·浙江温州高三一模)将40.8 g Fe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4 g Fe3O4,则Fe、FeO的物质的量之比为( )
A.1∶3
B.1∶2
C.1∶1
D.2∶1
8.(2023·浙江镇海龙赛中学检测)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M甲>M乙,则气体体积:甲<乙
B.若M甲
C.若M甲>M乙,则气体的摩尔体积:甲<乙
D.若M甲
A.反应转移电子为0.1 mol
B.盐酸中Cl-数为3NA
C.2.8 g 56Fe含有的中子数为1.3NA
D.反应生成标准状况下气体3.36 L
10.(2023·浙江舟山定海一中月考)将3.84 g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成NO2和NO的混合气体,当铜完全溶解时,共产生气体1.12 L(已折合为标准状况),则产生的NO2和NO的物质的量之比为( )
A.3∶7
B.9∶1
C.4∶1
D.2∶3
B组 综合提升
11.(2024·浙江温州高三一模)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18 g O中含有的中子数为10NA
B.42 g环己烷()中含有σ键的数目为9NA
C.标准状况下,22.4 L CHCl3中含有的分子数为NA
D.6.0 g SiO2与足量NaOH溶液反应,所得溶液中Si的个数为0.1NA
12.(2023·浙江海盐元济高级中学段考)把5.1 g镁铝合金的粉末放入500 mL盐酸中,金属和酸均恰好反应,得到标准状况下H2 5.6 L。下列说法错误的是( )
A.该合金中铝的质量分数约为52.94%
B.该盐酸的物质的量浓度为2 mol·L-1
C.该合金镁和铝的物质的量之比为1∶1
D.该反应中一共转移的电子的物质的量为0.5 mol
13.(2023·浙江富阳新登中学月考)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g,下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.4 mol·L-1
C.产生的NO在标准状况下的体积为6.72 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
14.(2023·浙江萧山第三高级中学段考)通过测定混合气中O2含量可计算已变质的Na2O2(含Na2CO3)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成分为O2、CO2
C.测定气体总体积必须关闭K1、K2,打开K3
D.读完气体总体积后,关闭K3,缓缓打开K1,可观察到Q气球慢慢缩小
15.(2023·浙江临安昌化中学月考)某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成,某校课外兴趣小组设计如图实验方案进行探究:
途径a:
途径b:
下列对混合物X成分的分析正确的是( )
A.Cu的质量为1.92 g
B.Fe2O3的质量为3 g
C.Al2O3的质量为0 g
D.SiO2的质量为4.92 g
16.已知:2KClO32KCl+3O2↑。某同学设计了利用氯酸钾分解制O2测定气体摩尔体积的探究实验。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置, 。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为279.7 mL。
⑤准确称量试管和残留物的质量为15.55 g。根据上述实验过程,回答下列问题:
(1)请补充②中的实验步骤 。
(2)以下是测量收集到气体体积必须包括的几个步骤:a.调整量筒的高度使广口瓶和量筒内的液面高度相同;b.使试管和广口瓶内气体都冷却至室温;c.读取量筒内液体的体积。这三步操作的正确顺序是 (请填写步骤序号)。进行实验操作c时,若仰视读数,则读取液体的体积 (填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是 mol;实验测得该条件下的气体摩尔体积是 (保留小数点后两位)。
(4)若欲检验试管中产物所含的阴离子,方案为:将固体冷却后溶于水,过滤,
(填写具体实验方案)。检验产物中所含的阳离子方法为 。
作业4 物质的量 气体摩尔体积
1.C 混合物溶于盐酸后溶质成分是CuCl2,根据铜元素和氯元素守恒可得:CuO~CuCl2~2HCl,n(CuO)=n(HCl)=0.25 mol,m(CuO)=0.25 mol×80 g·mol-1=20 g。
2.A 设磷的物质的量为1 mol,则氯气的物质的量为2 mol,生成PCl3和PCl5的物质的量分别为x、y,由P、Cl守恒可知解得x=0.5 mol,y=0.5 mol,x∶y=0.5 mol∶0.5 mol=1∶1。
3.D 标准状况下,CH4和CO的混合气体8.96 L,总物质的量为0.4 mol,总质量为7.60 g,则平均摩尔质量为=19 g·mol-1,则有=
=19 g·mol-1,解得n(CO)∶n(CH4)=1∶3,A正确;混合气体的总物质的量为0.4 mol,n(CO)∶n(CH4)=1∶3,则有n(CO)=0.1 mol,m(CO)=2.8 g,故CO的质量分数为×100%≈36.8%,B正确;0.1 mol CO和0.3 mol CH4共含有1.2 mol H原子和0.4 mol C原子,故H和C原子个数比为3∶1,C正确;CH4和CO的混合气体8.96 L,总质量为7.60 g,则混合气体的密度为≈0.848 g·L-1,D错误。
4.B 由=n=,所以有,M=。根据=n=,所以有=n=,解得V= L。
5.C N中的N元素的化合价为-3价,中的N元素的平均化合价为-价,A正确;两种气体的物质的量相等,则其质量比等于二者摩尔质量之比,即为28 g·mol-1∶2 g·mol-1=14∶1,B正确;分解产物中两种气体的物质的量相等,则=28 g·mol-1×+2 g·mol-1×=15 g·mol-1,C错误;同温同压下,气体体积与其物质的量成正比,则两种气体的体积比为1∶1,D正确。
6.D 同温、同压、同体积的两个密闭容器中,气体的分子数相同(即气体的物质的量相同)。由于两个容器中气体的摩尔质量不相同,故两容器中气体的质量也不相同,A、B均正确;容器甲中,1 mol 气体含有2 mol氧原子,容器乙中,1 mol气体含有氧原子的物质的量为2~3 mol之间,所以两容器中气体的氧原子数目不相同,C正确;同温、同压条件下,气体的密度与气体的摩尔质量成正比,由于两个容器中气体的摩尔质量不相同,所以两容器中气体的密度也不相同,D错误。
7.A 46.4 g Fe3O4中,n(Fe3O4)==0.2 mol,则n(Fe)=0.6 mol;40.8 g Fe、FeO混合物中,m(Fe)=0.6 mol×56 g·mol-1=33.6 g,m(O)=40.8 g-33.6 g=7.2 g,n(FeO)=n(O)==0.45 mol,则n(Fe)=0.6 mol-0.45 mol=0.15 mol,Fe、FeO的物质的量之比为0.15 mol∶0.45 mol=1∶3,故选A。
8.B 两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ=可知气体的体积相等,故A错误;若M甲
9.A 2.8 g Fe的物质的量为0.05 mol;100 mL 3 mol·L-1盐酸中H+和Cl-的物质的量均为0.3 mol,两者发生反应后,Fe完全溶解,而盐酸过量。Fe完全溶解生成Fe2+,该反应转移电子0.1 mol,A正确;盐酸中Cl-的物质的量为0.3 mol,因此,Cl-数为0.3NA,B不正确;56Fe的质子数为26、中子数为30,2.8 g 56Fe的物质的量为0.05 mol,因此,2.8 g 56Fe含有的中子数为1.5NA,C不正确;反应生成H2的物质的量为0.05 mol,在标准状况下的体积为1.12 L,D不正确。
10.A 将3.84 g铜(物质的量为0.06 mol)和一定量的浓硝酸反应,当铜完全溶解时,产生NO2和NO的混合气体,混合气体体积为1.12 L(已折合为标准状况)即物质的量为0.05 mol,根据得失电子守恒建立方程式n(NO2)+n(NO)=0.05 mol,n(NO2)+3n(NO)=0.06 mol×2,解得n(NO)=0.035 mol,n(NO2)=0.015 mol,则产生的NO2和NO的物质的量之比为3∶7,故A符合题意。
11.B n(O)==0.9 mol,则中子数为9NA,A错误;n(环己烷)==0.5 mol,1个环己烷中含有18个σ键,则42 g环己烷中含有σ键的数目为9NA,B正确;标准状况下,CHCl3为液体,无法根据体积计算物质的量,C错误;二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,硅酸钠在溶液中发生水解反应,根据原子守恒,n(Si)==0.1 mol,则Si个数小于0.1NA,故D错误。
12.B n(H2)==0.25 mol,设Mg的物质的量为x mol,则Al的物质的量为(0.25-x) mol,从而得出24x+27×(0.25-x)=5.1,x=0.1,(0.25-x)=0.1。由计算可知,Al为0.1 mol,质量为2.7 g,则该合金中铝的质量分数约为×100%≈52.94%,A正确;Mg、Al都为0.1 mol,共消耗HCl的物质的量为0.5 mol,该盐酸的物质的量浓度为=1 mol·L-1,B错误;该合金镁和铝的物质的量之比为0.1 mol∶0.1 mol=1∶1,C正确;该反应中一共转移的电子的物质的量为0.1 mol×2+0.1 mol×3=0.5 mol,D正确。
13.C n[Cu(OH)2]==0.4 mol,m(Cu元素)=0.4 mol×64 g·mol-1=25.6 g,n(O)=n(Cu2O)==0.1 mol,n(Cu单质)=0.4 mol-0.1 mol×2=0.2 mol,依据得失电子守恒,可求出n(NO)==0.2 mol。由分析可知,n(Cu单质)=0.2 mol,n(Cu2O)=0.1 mol,则Cu与Cu2O的物质的量之比为0.2 mol∶0.1 mol=2∶1,A正确;n(HNO3)=n(NaNO3)+n(NO)=1.0 mol·L-1×1.0 L+0.2 mol=1.2 mol,硝酸的物质的量浓度为=2.4 mol·L-1,B正确;产生的NO在标准状况下的体积为0.2 mol×22.4 L·mol-1=4.48 L,C不正确;加入NaOH,与Cu(NO3)2和过量HNO3反应,则Cu、Cu2O与硝酸反应后剩余HNO3为1.0 mol·L-1×1.0 L-0.4 mol×2=0.2 mol,D正确。
14.D 加入硫酸与样品反应在Q气囊中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水测氧气的量,进而计算过氧化钠的量,选项A、B都正确。测定气体的总体积是利用Q的膨胀将瓶中的空气挤入右边进行排水量气,所以必须关闭K1、K2,打开K3,选项C正确。读完气体总体积后,关闭K3,缓缓打开K1,还要再打开K2,才可观察到Q气球慢慢缩小,原因是不打开K2体系是密闭的,气球体积无法减小,选项D错误。
15.C 途径Ⅰ得到的4.92 g固体部分溶于NaOH溶液,说明X中含有二氧化硅,且m(SiO2)=4.92 g-1.92 g=3 g,剩余的1.92 g固体为单质铜;又途径a的Ⅰ中加入过量盐酸时得到蓝色溶液,则发生反应Fe2O3+6H+===2Fe3++3H2O、Cu十2Fe3+===2Fe2++Cu2+,铜有剩余,说明Fe3+全部转化为Fe2+,则加入过量盐酸时发生的反应可写成Fe2O3+6H++Cu===2Fe2++Cu2++3H2O。途径b的Ⅲ中溶于NaOH溶液的固体质量为9.4 g-6.4 g=3 g,说明X中不含Al2O3;6.4 g固体为Fe2O3、Cu的混合物,加入过量盐酸发生反应Fe2O3+6H++Cu===2Fe2++Cu2++3H2O,剩余1.92 g Cu,故Fe2O3的质量为(6.4 g-1.92 g)×=3.2 g,Cu的质量为6.4 g-3.2 g=3.2 g。
16.答案 (1)检查装置的气密性 (2)bac 偏小
(3)0.012 5 22.38 L·mol-1
(4)滤液加入硝酸酸化的AgNO3溶液,若产生白色沉淀,则含Cl- 焰色试验
解析 (2)在测量收集到O2的体积时,先将装置中的气体冷却至室温,然后调整量筒高度,使量筒内液面和广口瓶中液面相平,最后再读取量筒内水的体积。读数时若仰视量筒内的液面,会使读取液体的体积偏小。(3)根据质量守恒定律,产生O2的质量为15.95 g-15.55 g=0.4 g,n(O2)==0.012 5 mol,则Vm==22.38 L·mol-1。(4)氯酸钾分解制O2的产物还有Cl-,检验Cl-的方法是:滤液加入硝酸酸化的AgNO3溶液,若产生白色沉淀,则含Cl-。滤液中的阳离子是K+,要用焰色试验来检验。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
