2025浙江专版新教材化学高考第一轮基础练--作业6钠及其化合物(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业6钠及其化合物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 461.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:21:40 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业6钠及其化合物
A组 基础达标
1.(2023·浙江温州高三二模)碳酸钠应用广泛,下列说法不正确的是( )
A.碳酸钠受热易分解
B.碳酸钠属于强电解质
C.碳酸钠溶液呈碱性
D.Na元素位于元素周期表s区
2.(2023·浙江上虞中学月考)下列关于Na的化合物之间转化反应的离子方程式书写正确的是( )
A.碱转化为两种盐:OH-+Cl2===ClO-+Cl-
B.碱转化为酸式盐:OH-+CO2===HC
C.过氧化物转化为碱:2+2H2O===4OH-+O2↑
D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
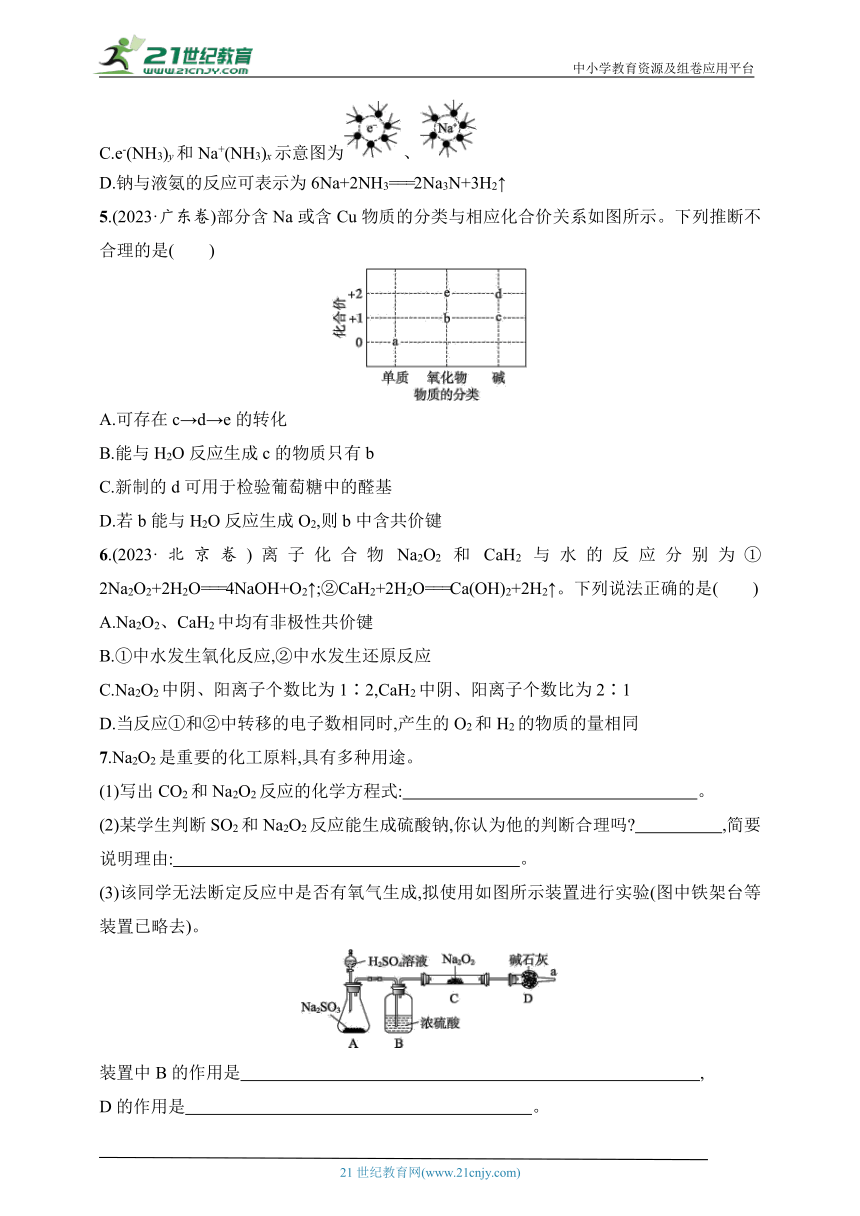
3.(2023·浙江萧山中学段考)某学习小组设计实验制备供氢剂氢化钠(NaH),实验装置如下图所示。
下列说法错误的是( )
A.相同条件下,粗锌比纯锌反应速率快
B.装置a还能用来制备CO2和H2S气体
C.实验时先打开活塞K,再点燃c处酒精灯
D.判断钠是否剩余,可取c中固体加水检验
4.(2023·浙江宁波十校联考)在液氨中投入金属钠,迅速溶剂化得到蓝色溶液[含有Na+(NH3)x和e-(NH3)y],且过程中有少量H2产生。下列说法正确的是( )
A.0.1 mol钠投入液氨中生成0.01 mol H2时,Na共失去0.1 mol电子
B.电子通过配位键和NH3结合
C.e-(NH3)y和Na+(NH3)x示意图为、
D.钠与液氨的反应可表示为6Na+2NH3===2Na3N+3H2↑
5.(2023·广东卷)部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.可存在c→d→e的转化
B.能与H2O反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与H2O反应生成O2,则b中含共价键
6.(2023·北京卷)离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O===4NaOH+O2↑;②CaH2+2H2O===Ca(OH)2+2H2↑。下列说法正确的是( )
A.Na2O2、CaH2中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.Na2O2中阴、阳离子个数比为1∶2,CaH2中阴、阳离子个数比为2∶1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
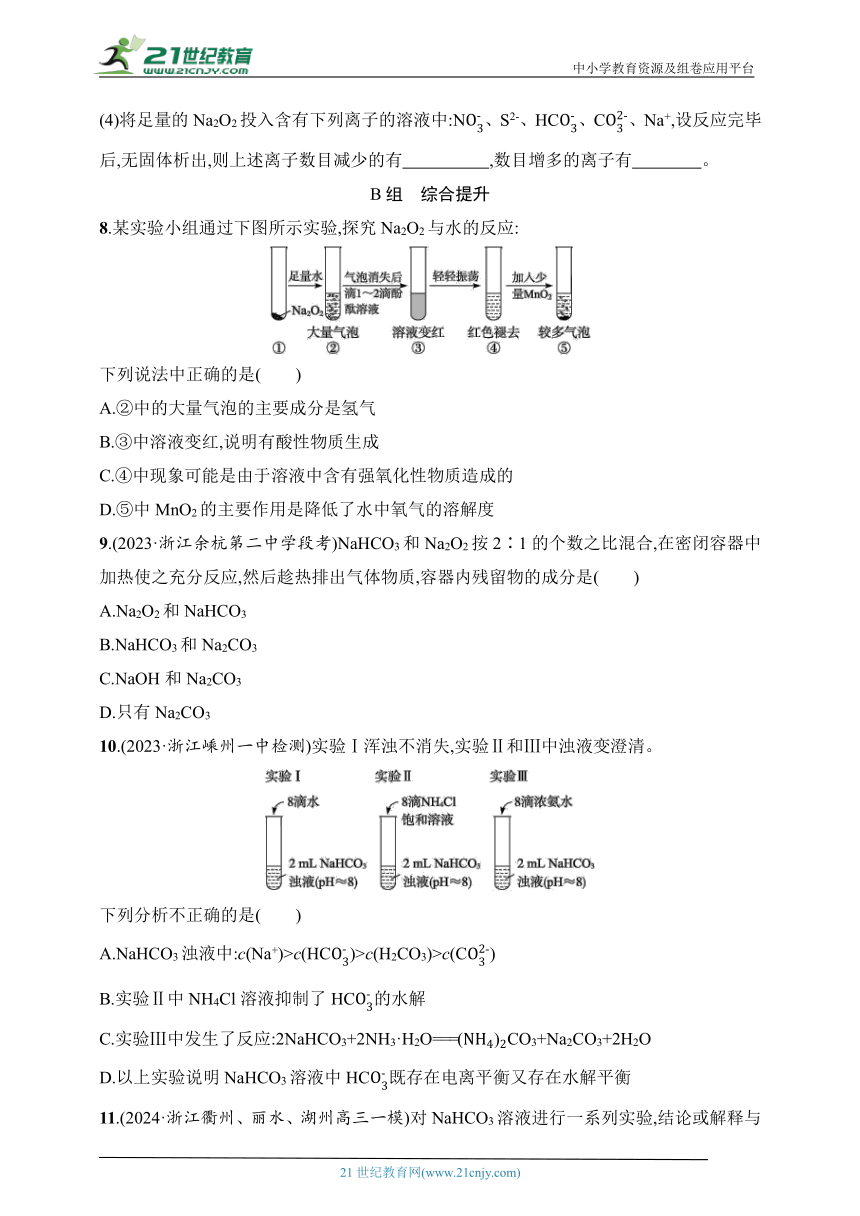
7.Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式: 。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗 ,简要说明理由: 。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
装置中B的作用是 ,
D的作用是 。
(4)将足量的Na2O2投入含有下列离子的溶液中:N、S2-、HC、C、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有 ,数目增多的离子有 。
B组 综合提升
8.某实验小组通过下图所示实验,探究Na2O2与水的反应:
下列说法中正确的是( )
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
9.(2023·浙江余杭第二中学段考)NaHCO3和Na2O2按2∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是( )
A.Na2O2和NaHCO3
B.NaHCO3和Na2CO3
C.NaOH和Na2CO3
D.只有Na2CO3
10.(2023·浙江嵊州一中检测)实验Ⅰ浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。
下列分析不正确的是( )
A.NaHCO3浊液中:c(Na+)>c(HC)>c(H2CO3)>c(C)
B.实验Ⅱ中NH4Cl溶液抑制了HC的水解
C.实验Ⅲ中发生了反应:2NaHCO3+2NH3·H2O===CO3+Na2CO3+2H2O
D.以上实验说明NaHCO3溶液中HC既存在电离平衡又存在水解平衡
11.(2024·浙江衢州、丽水、湖州高三一模)对NaHCO3溶液进行一系列实验,结论或解释与实验方案、现象不相符的是( )
选项 实验方案 现象 结论或解释
A 往0.5 mol·L-1 NaHCO3溶液中加入盐酸,将产生的气体通入Na2SiO3水溶液中 Na2SiO3溶液中有沉淀 非金属性强弱顺序为氯>碳>硅
B 0.5 mol·L-1 NaHCO3溶液与0.5 mol·L-1 FeSO4溶液混合 产生沉淀并有 气泡冒出 HC电离产生的C与Fe2+结合促进HCH++C平衡正移,使c(H+)增大,产生CO2气体
C 将0.5 mol·L-1 NaHCO3溶液加少量水稀释 溶液的 碱性增强 稀释可以破坏HC之间的氢键,使得c(HC) 增大,碱性增强
D 将0.5 mol·L-1 NaHCO3溶液加热 溶液pH先减小后增大 加热促进HC 和H2O的电离,使c(H+)增大,pH减小,后由于分解生成C,溶液pH增大
12.(2023·浙江宁海知恩中学段考)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色试验火焰均为黄色。
请填写下列空白:
(1)写出B和C的电子式:B ,C 。
(2)以上反应中,属于非氧化还原反应的有 (填序号)。
(3)写出反应④的化学方程式 ,该反应中B (填字母)。
a.是氧化剂
b.是还原剂
c.既是氧化剂又是还原剂
d.既非氧化剂又非还原剂
(4)写出下列反应的离子方程式:
C+ED: ;
E与足量Ba(OH)2溶液: ;
B与FeSO4溶液: 。
作业6 钠及其化合物
1.A 碳酸钠受热不易分解,故A错误;碳酸钠在溶液中能完全电离出自由移动的离子,属于强电解质,故B正确;碳酸钠是强碱弱酸盐,在溶液中水解使溶液呈碱性,故C正确;钠元素的原子序数为11,价层电子排布式为3s1,位于元素周期表s区,故D正确。
2.B 碱转化为两种盐:氯气通入NaOH溶液中,其离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,故A错误;碱转化为酸式盐:二氧化碳和氢氧化钠反应生成碳酸氢钠OH-+CO2===HC,故B正确;过氧化物即过氧化钠和水反应生成碱:2Na2O2+2H2O===4OH-+4Na++O2↑,故C错误;盐转化为另一种盐:硅酸钠和稀盐酸等强酸反应生成硅酸沉淀和氯化钠等钠盐Si+2H+===H2SiO3↓,故D错误。
3.D 粗锌与稀硫酸形成原电池,会加快化学反应速率,A正确;启普发生器使用条件:块状固体与液体反应制取气体,气体难溶于水(或溶解度不大),反应不需要加热,氢气、二氧化碳(用大理石和盐酸制取)、硫化氢(用FeS和稀硫酸制取)等气体制取符合启普发生器使用条件,因此可以制取H2S、CO2气体,B正确;实验时先打开K,利用氢气排尽装置内的空气,然后加热,防止氢气与空气的混合气体点燃发生爆炸,C正确;产物氢化钠也会与水反应产生氢气,因此不能使用该方法进行检验,D错误。
4.A 0.1 mol钠投入液氨中生成0.01 mol H2,0.1 mol Na转化为0.1 mol Na+,共失去0.1 mol电子,A正确。含有孤电子对和含有空轨道的原子之间容易形成配位键,NH3无空轨道、氮原子含有孤电子对,故电子不是通过配位键和NH3结合,B错误。e-(NH3)y中NH3的氮原子含有孤电子对,带负电,中心的e-也带负电,相互排斥,故NH3中的N原子应该朝外,对应的示意图错误;Na+(NH3)x中Na+含有空轨道,NH3含有孤电子对,故形成配位键,对应的示意图正确,C错误。钠与液氨发生氧化还原反应生成氢气,反应可表示为2Na+2NH3===2NaNH2+H2↑,D错误。
5.B 由图可知a、b、c对应物质分别为钠、氧化钠(过氧化钠)、氢氧化钠或a、b、e、d对应物质分别为铜、氧化亚铜、氧化铜、氢氧化铜。由分析可知氢氧化钠和硫酸铜反应生成氢氧化铜,氢氧化铜受热分解生成氧化铜,所以存在c→d→e的转化,A合理;钠和氧化钠(过氧化钠)都能与H2O反应生成氢氧化钠,B不合理;新制氢氧化铜可用于检验葡萄糖中的醛基,C合理;若b能与H2O反应生成O2,则b为过氧化钠,结构中含共价键和离子键,D合理。
6.C Na2O2中有离子键和非极性键,CaH2中只有离子键而不含非极性键,A错误;①中Na2O2发生自身的氧化还原反应,②中水发生还原反应,B错误;Na2O2由Na+和构成,阴、阳离子个数之比为1∶2,CaH2由Ca2+和H-构成,阴、阳离子个数之比为2∶1,C正确;①中每生成1个氧气分子转移2个电子,②中每生成1个氢气分子转移1个电子,转移电子数相同时,生成氧气和氢气的物质的量之比为1∶2,D错误。
7.答案 (1)2CO2+2Na2O2===2Na2CO3+O2
(2)合理 由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠
(3)干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 防止空气中的水蒸气进入C装置与Na2O2反应,同时吸收过量SO2气体,便于氧气的检验和防止污染空气
(4)S2-、HC Na+、C
解析 (3)浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰实验;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰;碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气。(4)Na2O2具有强氧化性,可与S2-发生氧化还原反应,则S2-数目减小,Na2O2与水反应生成NaOH可与HC反应,则溶液中HC数目减少,C数目增多,Na+的数目增多。
8.C 过氧化钠与水反应生成NaOH和氧气,则②中大量气泡的主要成分是氧气,A错误;酚酞在碱性溶液中显红色,③中溶液变红,说明有碱性物质生成,B错误;④中红色褪去,是由溶液中的H2O2氧化酚酞致酚酞变质导致,C正确;⑤中加入MnO2产生较多气泡,说明溶液中存在H2O2,MnO2的主要作用是催化剂,D错误。
9.D NaHCO3和Na2O2按2∶1的个数之比混合,在密闭容器中加热使之充分反应,发生的反应方程式为①2NaHCO3Na2CO3+CO2↑+H2O,②2Na2O2+2CO2===2Na2CO3+O2,③2Na2O2+2H2O===4NaOH+O2↑,CO2和H2O同时存在时,遇Na2O2,CO2先反应、H2O后反应,设NaHCO3和Na2O2的物质的量分别是2 mol、1 mol,2 mol NaHCO3完全分解生成1 mol Na2CO3、1 mol CO2、1 mol H2O,根据方程式②知,1 mol Na2O2完全反应需要1 mol CO2,所以二氧化碳和过氧化钠恰好完全反应,水蒸气不反应,则最终容器内残留物的成分是Na2CO3,故选D。
10.B 实验Ⅰ浑浊不消失,NaHCO3浊液为饱和溶液,pH=8显碱性,说明溶液中HC水解程度大于其电离程度,溶液中离子浓度关系:c(Na+)>c(HC)>c(H2CO3)>c(C),选项A正确;氯化铵溶液中N水解显酸性,促进HC的水解,碳酸氢钠溶解,溶液变澄清,选项B错误;实验Ⅲ中浊液变澄清,说明加入氨水和HC电离出的氢离子反应,促进HC电离平衡正向进行,反应的化学方程式为2NaHCO3+2NH3·H2O=== (NH4)2CO3+Na2CO3+2H2O,选项C正确;实验Ⅱ说明HC存在水解平衡,实验Ⅲ中说明HC存在电离平衡,以上实验说明NaHCO3溶液中HC既存在电离平衡又存在水解平衡,选项D正确。
11.A 不能通过盐酸酸性的强弱,来证明氯的非金属性的强弱,且盐酸是挥发性酸,A错误;二价铁结合碳酸根离子的能力较大,从而促进碳酸氢根离子的电离,导致溶液显酸性,则氢离子和碳酸氢根离子反应生成水和二氧化碳,B正确;HC水解使溶液显碱性,少量水稀释后溶液的碱性增强,说明少量的水破坏了HC之间的氢键,使得c(HC)增大,C正确;NaHCO3溶液中共存在三个平衡过程:HC的电离平衡、水的电离平衡和HC的水解平衡,加热后三个平衡均正向移动,溶液pH先减小,说明加热促进了HC和H2O的电离,使c(H+)增大;后pH增大则是NaHCO3分解生成C,C水解能力较HC强,故溶液pH增大,D正确。
12.答案 (1)Na+]2-Na+ Na+H]-
(2)⑤⑥
(3)2Na2O2+2CO2===2Na2CO3+O2 c
(4)OH-+HC===C+H2O
Ba2++OH-+HC===BaCO3↓+H2O
3Na2O2+6Fe2++6H2O===4Fe(OH)3+2Fe3++6Na+
解析 A是一种常见单质,其焰色试验火焰为黄色,则A是Na;B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2;Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH;NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3;Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3。(1)B和C分别为Na2O2、NaOH,故B和C的电子式分别为Na+]2-Na+、Na+H]-。(2)题中反应分别为①2Na+O2Na2O2,②2Na+2H2O===2NaOH+H2↑,③2Na2O2+2H2O===4NaOH+O2↑,④2Na2O2+2CO2===2Na2CO3+O2,⑤NaOH+CO2===NaHCO3,⑥2NaHCO3Na2CO3+H2O+CO2↑,故属于非氧化还原反应的有⑤⑥。(3)由(2)分析可知,反应④的化学方程式为2Na2O2+2CO2===2Na2CO3+O2,该反应中Na2O2既是氧化剂又是还原剂。(4)由分析可知:C+E→D的反应方程式为NaOH+NaHCO3===Na2CO3+H2O,离子方程式为OH-+HC===C+H2O。E为NaHCO3,其与足量Ba(OH)2溶液反应生成BaCO3、Na2CO3和H2O,离子方程式为Ba2++OH-+HC===BaCO3↓+H2O。B即Na2O2,由于Na2O2具有强氧化性,故与FeSO4溶液反应生成Fe(OH)3和Fe2(SO4)3,该反应的离子方程式为3Na2O2+6Fe2++6H2O===4Fe(OH)3+2Fe3++6Na+。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业6钠及其化合物
A组 基础达标
1.(2023·浙江温州高三二模)碳酸钠应用广泛,下列说法不正确的是( )
A.碳酸钠受热易分解
B.碳酸钠属于强电解质
C.碳酸钠溶液呈碱性
D.Na元素位于元素周期表s区
2.(2023·浙江上虞中学月考)下列关于Na的化合物之间转化反应的离子方程式书写正确的是( )
A.碱转化为两种盐:OH-+Cl2===ClO-+Cl-
B.碱转化为酸式盐:OH-+CO2===HC
C.过氧化物转化为碱:2+2H2O===4OH-+O2↑
D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
3.(2023·浙江萧山中学段考)某学习小组设计实验制备供氢剂氢化钠(NaH),实验装置如下图所示。
下列说法错误的是( )
A.相同条件下,粗锌比纯锌反应速率快
B.装置a还能用来制备CO2和H2S气体
C.实验时先打开活塞K,再点燃c处酒精灯
D.判断钠是否剩余,可取c中固体加水检验
4.(2023·浙江宁波十校联考)在液氨中投入金属钠,迅速溶剂化得到蓝色溶液[含有Na+(NH3)x和e-(NH3)y],且过程中有少量H2产生。下列说法正确的是( )
A.0.1 mol钠投入液氨中生成0.01 mol H2时,Na共失去0.1 mol电子
B.电子通过配位键和NH3结合
C.e-(NH3)y和Na+(NH3)x示意图为、
D.钠与液氨的反应可表示为6Na+2NH3===2Na3N+3H2↑
5.(2023·广东卷)部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.可存在c→d→e的转化
B.能与H2O反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与H2O反应生成O2,则b中含共价键
6.(2023·北京卷)离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O===4NaOH+O2↑;②CaH2+2H2O===Ca(OH)2+2H2↑。下列说法正确的是( )
A.Na2O2、CaH2中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.Na2O2中阴、阳离子个数比为1∶2,CaH2中阴、阳离子个数比为2∶1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
7.Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式: 。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗 ,简要说明理由: 。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
装置中B的作用是 ,
D的作用是 。
(4)将足量的Na2O2投入含有下列离子的溶液中:N、S2-、HC、C、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有 ,数目增多的离子有 。
B组 综合提升
8.某实验小组通过下图所示实验,探究Na2O2与水的反应:
下列说法中正确的是( )
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
9.(2023·浙江余杭第二中学段考)NaHCO3和Na2O2按2∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是( )
A.Na2O2和NaHCO3
B.NaHCO3和Na2CO3
C.NaOH和Na2CO3
D.只有Na2CO3
10.(2023·浙江嵊州一中检测)实验Ⅰ浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。
下列分析不正确的是( )
A.NaHCO3浊液中:c(Na+)>c(HC)>c(H2CO3)>c(C)
B.实验Ⅱ中NH4Cl溶液抑制了HC的水解
C.实验Ⅲ中发生了反应:2NaHCO3+2NH3·H2O===CO3+Na2CO3+2H2O
D.以上实验说明NaHCO3溶液中HC既存在电离平衡又存在水解平衡
11.(2024·浙江衢州、丽水、湖州高三一模)对NaHCO3溶液进行一系列实验,结论或解释与实验方案、现象不相符的是( )
选项 实验方案 现象 结论或解释
A 往0.5 mol·L-1 NaHCO3溶液中加入盐酸,将产生的气体通入Na2SiO3水溶液中 Na2SiO3溶液中有沉淀 非金属性强弱顺序为氯>碳>硅
B 0.5 mol·L-1 NaHCO3溶液与0.5 mol·L-1 FeSO4溶液混合 产生沉淀并有 气泡冒出 HC电离产生的C与Fe2+结合促进HCH++C平衡正移,使c(H+)增大,产生CO2气体
C 将0.5 mol·L-1 NaHCO3溶液加少量水稀释 溶液的 碱性增强 稀释可以破坏HC之间的氢键,使得c(HC) 增大,碱性增强
D 将0.5 mol·L-1 NaHCO3溶液加热 溶液pH先减小后增大 加热促进HC 和H2O的电离,使c(H+)增大,pH减小,后由于分解生成C,溶液pH增大
12.(2023·浙江宁海知恩中学段考)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色试验火焰均为黄色。
请填写下列空白:
(1)写出B和C的电子式:B ,C 。
(2)以上反应中,属于非氧化还原反应的有 (填序号)。
(3)写出反应④的化学方程式 ,该反应中B (填字母)。
a.是氧化剂
b.是还原剂
c.既是氧化剂又是还原剂
d.既非氧化剂又非还原剂
(4)写出下列反应的离子方程式:
C+ED: ;
E与足量Ba(OH)2溶液: ;
B与FeSO4溶液: 。
作业6 钠及其化合物
1.A 碳酸钠受热不易分解,故A错误;碳酸钠在溶液中能完全电离出自由移动的离子,属于强电解质,故B正确;碳酸钠是强碱弱酸盐,在溶液中水解使溶液呈碱性,故C正确;钠元素的原子序数为11,价层电子排布式为3s1,位于元素周期表s区,故D正确。
2.B 碱转化为两种盐:氯气通入NaOH溶液中,其离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,故A错误;碱转化为酸式盐:二氧化碳和氢氧化钠反应生成碳酸氢钠OH-+CO2===HC,故B正确;过氧化物即过氧化钠和水反应生成碱:2Na2O2+2H2O===4OH-+4Na++O2↑,故C错误;盐转化为另一种盐:硅酸钠和稀盐酸等强酸反应生成硅酸沉淀和氯化钠等钠盐Si+2H+===H2SiO3↓,故D错误。
3.D 粗锌与稀硫酸形成原电池,会加快化学反应速率,A正确;启普发生器使用条件:块状固体与液体反应制取气体,气体难溶于水(或溶解度不大),反应不需要加热,氢气、二氧化碳(用大理石和盐酸制取)、硫化氢(用FeS和稀硫酸制取)等气体制取符合启普发生器使用条件,因此可以制取H2S、CO2气体,B正确;实验时先打开K,利用氢气排尽装置内的空气,然后加热,防止氢气与空气的混合气体点燃发生爆炸,C正确;产物氢化钠也会与水反应产生氢气,因此不能使用该方法进行检验,D错误。
4.A 0.1 mol钠投入液氨中生成0.01 mol H2,0.1 mol Na转化为0.1 mol Na+,共失去0.1 mol电子,A正确。含有孤电子对和含有空轨道的原子之间容易形成配位键,NH3无空轨道、氮原子含有孤电子对,故电子不是通过配位键和NH3结合,B错误。e-(NH3)y中NH3的氮原子含有孤电子对,带负电,中心的e-也带负电,相互排斥,故NH3中的N原子应该朝外,对应的示意图错误;Na+(NH3)x中Na+含有空轨道,NH3含有孤电子对,故形成配位键,对应的示意图正确,C错误。钠与液氨发生氧化还原反应生成氢气,反应可表示为2Na+2NH3===2NaNH2+H2↑,D错误。
5.B 由图可知a、b、c对应物质分别为钠、氧化钠(过氧化钠)、氢氧化钠或a、b、e、d对应物质分别为铜、氧化亚铜、氧化铜、氢氧化铜。由分析可知氢氧化钠和硫酸铜反应生成氢氧化铜,氢氧化铜受热分解生成氧化铜,所以存在c→d→e的转化,A合理;钠和氧化钠(过氧化钠)都能与H2O反应生成氢氧化钠,B不合理;新制氢氧化铜可用于检验葡萄糖中的醛基,C合理;若b能与H2O反应生成O2,则b为过氧化钠,结构中含共价键和离子键,D合理。
6.C Na2O2中有离子键和非极性键,CaH2中只有离子键而不含非极性键,A错误;①中Na2O2发生自身的氧化还原反应,②中水发生还原反应,B错误;Na2O2由Na+和构成,阴、阳离子个数之比为1∶2,CaH2由Ca2+和H-构成,阴、阳离子个数之比为2∶1,C正确;①中每生成1个氧气分子转移2个电子,②中每生成1个氢气分子转移1个电子,转移电子数相同时,生成氧气和氢气的物质的量之比为1∶2,D错误。
7.答案 (1)2CO2+2Na2O2===2Na2CO3+O2
(2)合理 由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠
(3)干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 防止空气中的水蒸气进入C装置与Na2O2反应,同时吸收过量SO2气体,便于氧气的检验和防止污染空气
(4)S2-、HC Na+、C
解析 (3)浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰实验;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰;碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气。(4)Na2O2具有强氧化性,可与S2-发生氧化还原反应,则S2-数目减小,Na2O2与水反应生成NaOH可与HC反应,则溶液中HC数目减少,C数目增多,Na+的数目增多。
8.C 过氧化钠与水反应生成NaOH和氧气,则②中大量气泡的主要成分是氧气,A错误;酚酞在碱性溶液中显红色,③中溶液变红,说明有碱性物质生成,B错误;④中红色褪去,是由溶液中的H2O2氧化酚酞致酚酞变质导致,C正确;⑤中加入MnO2产生较多气泡,说明溶液中存在H2O2,MnO2的主要作用是催化剂,D错误。
9.D NaHCO3和Na2O2按2∶1的个数之比混合,在密闭容器中加热使之充分反应,发生的反应方程式为①2NaHCO3Na2CO3+CO2↑+H2O,②2Na2O2+2CO2===2Na2CO3+O2,③2Na2O2+2H2O===4NaOH+O2↑,CO2和H2O同时存在时,遇Na2O2,CO2先反应、H2O后反应,设NaHCO3和Na2O2的物质的量分别是2 mol、1 mol,2 mol NaHCO3完全分解生成1 mol Na2CO3、1 mol CO2、1 mol H2O,根据方程式②知,1 mol Na2O2完全反应需要1 mol CO2,所以二氧化碳和过氧化钠恰好完全反应,水蒸气不反应,则最终容器内残留物的成分是Na2CO3,故选D。
10.B 实验Ⅰ浑浊不消失,NaHCO3浊液为饱和溶液,pH=8显碱性,说明溶液中HC水解程度大于其电离程度,溶液中离子浓度关系:c(Na+)>c(HC)>c(H2CO3)>c(C),选项A正确;氯化铵溶液中N水解显酸性,促进HC的水解,碳酸氢钠溶解,溶液变澄清,选项B错误;实验Ⅲ中浊液变澄清,说明加入氨水和HC电离出的氢离子反应,促进HC电离平衡正向进行,反应的化学方程式为2NaHCO3+2NH3·H2O=== (NH4)2CO3+Na2CO3+2H2O,选项C正确;实验Ⅱ说明HC存在水解平衡,实验Ⅲ中说明HC存在电离平衡,以上实验说明NaHCO3溶液中HC既存在电离平衡又存在水解平衡,选项D正确。
11.A 不能通过盐酸酸性的强弱,来证明氯的非金属性的强弱,且盐酸是挥发性酸,A错误;二价铁结合碳酸根离子的能力较大,从而促进碳酸氢根离子的电离,导致溶液显酸性,则氢离子和碳酸氢根离子反应生成水和二氧化碳,B正确;HC水解使溶液显碱性,少量水稀释后溶液的碱性增强,说明少量的水破坏了HC之间的氢键,使得c(HC)增大,C正确;NaHCO3溶液中共存在三个平衡过程:HC的电离平衡、水的电离平衡和HC的水解平衡,加热后三个平衡均正向移动,溶液pH先减小,说明加热促进了HC和H2O的电离,使c(H+)增大;后pH增大则是NaHCO3分解生成C,C水解能力较HC强,故溶液pH增大,D正确。
12.答案 (1)Na+]2-Na+ Na+H]-
(2)⑤⑥
(3)2Na2O2+2CO2===2Na2CO3+O2 c
(4)OH-+HC===C+H2O
Ba2++OH-+HC===BaCO3↓+H2O
3Na2O2+6Fe2++6H2O===4Fe(OH)3+2Fe3++6Na+
解析 A是一种常见单质,其焰色试验火焰为黄色,则A是Na;B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2;Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH;NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3;Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3。(1)B和C分别为Na2O2、NaOH,故B和C的电子式分别为Na+]2-Na+、Na+H]-。(2)题中反应分别为①2Na+O2Na2O2,②2Na+2H2O===2NaOH+H2↑,③2Na2O2+2H2O===4NaOH+O2↑,④2Na2O2+2CO2===2Na2CO3+O2,⑤NaOH+CO2===NaHCO3,⑥2NaHCO3Na2CO3+H2O+CO2↑,故属于非氧化还原反应的有⑤⑥。(3)由(2)分析可知,反应④的化学方程式为2Na2O2+2CO2===2Na2CO3+O2,该反应中Na2O2既是氧化剂又是还原剂。(4)由分析可知:C+E→D的反应方程式为NaOH+NaHCO3===Na2CO3+H2O,离子方程式为OH-+HC===C+H2O。E为NaHCO3,其与足量Ba(OH)2溶液反应生成BaCO3、Na2CO3和H2O,离子方程式为Ba2++OH-+HC===BaCO3↓+H2O。B即Na2O2,由于Na2O2具有强氧化性,故与FeSO4溶液反应生成Fe(OH)3和Fe2(SO4)3,该反应的离子方程式为3Na2O2+6Fe2++6H2O===4Fe(OH)3+2Fe3++6Na+。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
