2025浙江专版新教材化学高考第一轮基础练--作业9氯及其化合物(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业9氯及其化合物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 444.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:22:22 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业9氯及其化合物
A组 基础达标
1.(2023·浙江稽阳联谊学校月考)ClO2是一种新型的自来水消毒剂,下列说法不正确的是( )
A.ClO2属于非电解质
B.ClO2具有强氧化性
C.ClO2为直线形分子
D.电负性:O>Cl
2.化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述正确的是( )
A.氯气和活性炭均可作漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH,对测定结果无影响
D.厕宝除垢,利用了盐酸的氧化性
3.氯气是一种很活泼的非金属单质,它具有较强的氧化性,下列叙述不正确的是( )
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
B.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状
D.通常状况下氯气能和Fe反应,氯气的储存不能用铁制容器
4.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
5.制取高效消毒剂ClO2的反应为2KClO3+H2C2O4===CO2↑+2ClO2↑+K2CO3+H2O。下列说法正确的是( )
A.H2C2O4中的C被还原
B.H2C2O4是氧化剂
C.氧化产物与还原产物的物质的量之比为1∶1
D.每消耗1 mol KClO3转移2 mol电子
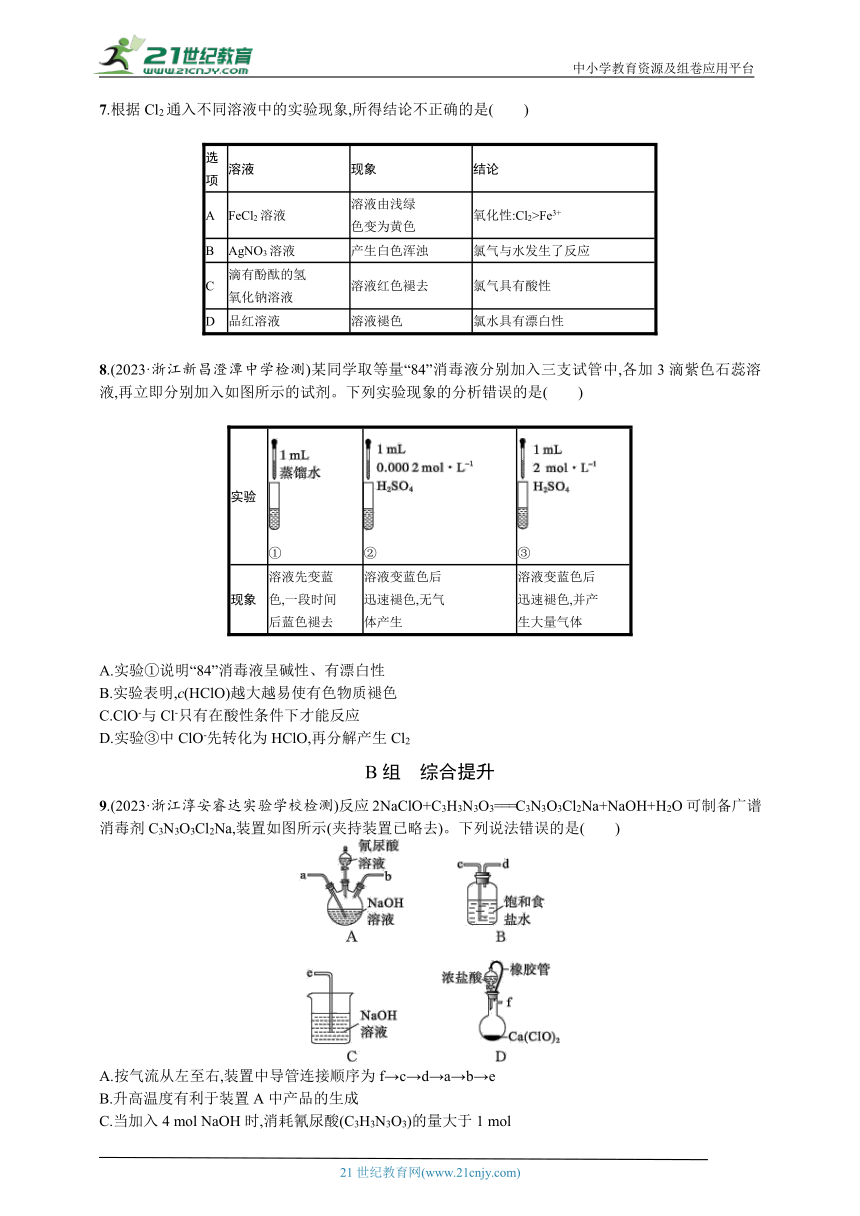
6.(2023·浙江浙鳌高中段考)如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法不正确的是( )
A.若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠
B.检验氯气是否有漂白性,则Ⅰ、Ⅱ、Ⅲ分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸
C.装置b既可以洗气又可以作安全瓶监测装置c是否堵塞
D.含有4 mol HCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4 L
7.根据Cl2通入不同溶液中的实验现象,所得结论不正确的是( )
选 项 溶液 现象 结论
A FeCl2溶液 溶液由浅绿 色变为黄色 氧化性:Cl2>Fe3+
B AgNO3溶液 产生白色浑浊 氯气与水发生了反应
C 滴有酚酞的氢 氧化钠溶液 溶液红色褪去 氯气具有酸性
D 品红溶液 溶液褪色 氯水具有漂白性
8.(2023·浙江新昌澄潭中学检测)某同学取等量“84”消毒液分别加入三支试管中,各加3滴紫色石蕊溶液,再立即分别加入如图所示的试剂。下列实验现象的分析错误的是( )
实验 ① ② ③
现象 溶液先变蓝 色,一段时间 后蓝色褪去 溶液变蓝色后 迅速褪色,无气 体产生 溶液变蓝色后 迅速褪色,并产 生大量气体
A.实验①说明“84”消毒液呈碱性、有漂白性
B.实验表明,c(HClO)越大越易使有色物质褪色
C.ClO-与Cl-只有在酸性条件下才能反应
D.实验③中ClO-先转化为HClO,再分解产生Cl2
B组 综合提升
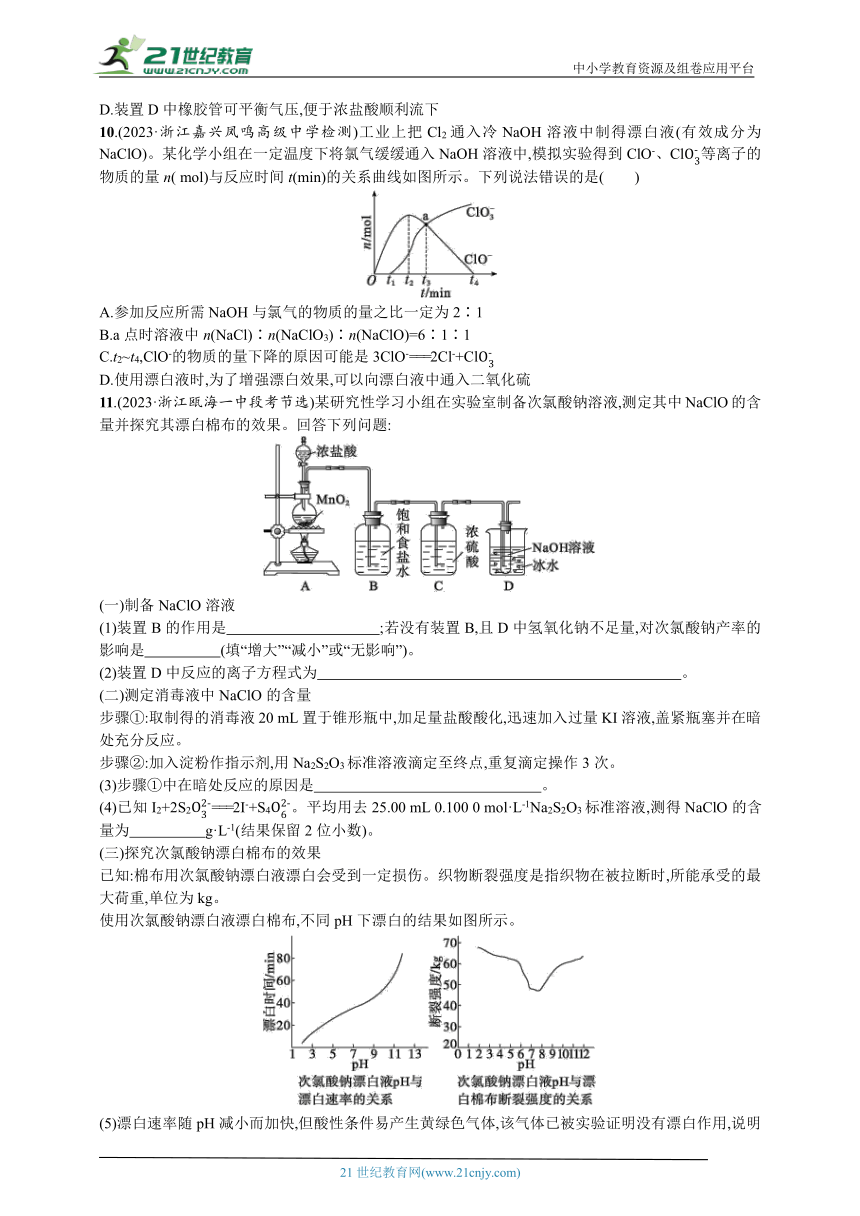
9.(2023·浙江淳安睿达实验学校检测)反应2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O可制备广谱消毒剂C3N3O3Cl2Na,装置如图所示(夹持装置已略去)。下列说法错误的是( )
A.按气流从左至右,装置中导管连接顺序为f→c→d→a→b→e
B.升高温度有利于装置A中产品的生成
C.当加入4 mol NaOH时,消耗氰尿酸(C3H3N3O3)的量大于1 mol
D.装置D中橡胶管可平衡气压,便于浓盐酸顺利流下
10.(2023·浙江嘉兴凤鸣高级中学检测)工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、Cl等离子的物质的量n( mol)与反应时间t(min)的关系曲线如图所示。下列说法错误的是( )
A.参加反应所需NaOH与氯气的物质的量之比一定为2∶1
B.a点时溶液中n(NaCl)∶n(NaClO3)∶n(NaClO)=6∶1∶1
C.t2~t4,ClO-的物质的量下降的原因可能是3ClO-===2Cl-+Cl
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
11.(2023·浙江瓯海一中段考节选)某研究性学习小组在实验室制备次氯酸钠溶液,测定其中NaClO的含量并探究其漂白棉布的效果。回答下列问题:
(一)制备NaClO溶液
(1)装置B的作用是 ;若没有装置B,且D中氢氧化钠不足量,对次氯酸钠产率的影响是 (填“增大”“减小”或“无影响”)。
(2)装置D中反应的离子方程式为 。
(二)测定消毒液中NaClO的含量
步骤①:取制得的消毒液20 mL置于锥形瓶中,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
步骤②:加入淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,重复滴定操作3次。
(3)步骤①中在暗处反应的原因是 。
(4)已知I2+2S2===2I-+S4。平均用去25.00 mL 0.100 0 mol·L-1Na2S2O3标准溶液,测得NaClO的含量为 g·L-1(结果保留2位小数)。
(三)探究次氯酸钠漂白棉布的效果
已知:棉布用次氯酸钠漂白液漂白会受到一定损伤。织物断裂强度是指织物在被拉断时,所能承受的最大荷重,单位为kg。
使用次氯酸钠漂白液漂白棉布,不同pH下漂白的结果如图所示。
(5)漂白速率随pH减小而加快,但酸性条件易产生黄绿色气体,该气体已被实验证明没有漂白作用,说明起漂白作用的主要是 (填粒子符号);pH最好选择9~11,虽然漂白速率较慢,但可延长漂白时间达到效果。不宜选择酸性或中性的原因分别是 。
作业9 氯及其化合物
1.C ClO2是非金属氧化物,属于非电解质,故A正确;ClO2中氯元素为+4价,易得电子,具有强氧化性,故B正确;ClO2为V形分子,故C错误;氧的电负性大于氯,故D正确。
2.B A项,活性炭具有吸附性,可以吸附氯气,若同时使用,漂白效果会减弱,错误;B项,氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,次氯酸盐为含氯消毒剂,正确;C项,氯水中的次氯酸具有漂白性,不能用pH试纸测定新制氯水的pH,错误;D项,厕宝除垢,利用了盐酸的还原性和酸性,错误。
3.D 红热的铜丝在氯气里剧烈燃烧生成氯化铜,生成棕黄色的烟,故A正确。氯气与水反应生成HCl和HClO,次氯酸不稳定,在光照下分解生成氧气和氯化氢,所以久置氯水最终变为稀盐酸,故B正确。纯净的H2在Cl2中安静地燃烧生成氯化氢,发出苍白色火焰,氯化氢结合水蒸气产生盐酸小液滴,所以集气瓶口呈现雾状,故C正确。通常状况下氯气和Fe不反应,氯气的储存能用铁制容器,故D错误。
4.B A项,氯水能使有色布条褪色是因为氯水中含有的HClO具有强氧化性,错误;C项,由于加入盐酸酸化的过程中引入了Cl-,所以根据生成白色沉淀无法说明氯水中存在Cl-,错误;D项,Cl2有颜色,HClO无色,错误。
5.C 反应后草酸中的碳元素化合价升高,作还原剂,碳元素被氧化,A、B错误;二氧化碳和碳酸钾为氧化产物,二氧化氯为还原产物,氧化产物与还原产物的物质的量之比为1∶1,C正确;氯元素化合价由+5价变为+4价,所以每消耗1 mol KClO3转移1 mol电子,D错误。
6.B 高锰酸钾、次氯酸钠具有强氧化性,在不加热条件下,能与浓盐酸反应产生氯气,故A正确;氯气能与碱石灰发生反应,因此干燥氯气时不能用碱石灰,应用无水氯化钙,故B错误;饱和食盐水能吸收氯气中的HCl,b装置有长颈漏斗,还起到安全瓶的作用,可以监测后续装置是否发生堵塞,平衡气压,故C正确;含4 mol HCl的浓盐酸与足量二氧化锰发生反应,随着反应的进行,浓盐酸逐渐变稀,变成稀盐酸后反应停止,因此产生标准状况下氯气的体积小于22.4 L,故D正确。
7.C FeCl2溶液中通入氯气,溶液由浅绿色变为黄色,说明氯气氧化Fe2+变为Fe3+,氧化性:Cl2>Fe3+,故A正确;AgNO3溶液中通入氯气,生成白色沉淀,说明氯气与水发生了反应生成盐酸和次氯酸,盐酸和硝酸银反应生成氯化银沉淀,故B正确;滴有酚酞的氢氧化钠溶液中通入氯气,溶液褪色,说明氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,不是氯气有酸性,故C错误;品红溶液中通入氯气,溶液褪色,说明氯水具有漂白性,故D正确。
8.D 实验①中加入石蕊溶液的“84”消毒液变为蓝色,说明溶液呈碱性,一段时间后蓝色褪去说明具有漂白性,A正确;实验①中,ClO-水解产生HClO,浓度较小,实验③中加入稀硫酸产生HClO,浓度较大,分析实验现象发现c(HClO)越大蓝色褪去得越快,说明c(HClO)越大越易使有色物质褪色,B正确;实验③加入硫酸后产生大量气体,而实验①中不产生气体,说明ClO-与Cl-只有在酸性条件下才能反应,C正确;实验③产生气体是因为ClO-与Cl-在酸性条件下能反应产生氯气,D错误。
9.B A为制取C3N3O3Cl2Na的装置,B为除去氯气中的HCl的装置,C为尾气处理装置,D为制取氯气装置,所以为完成实验,按气流从左至右,导管连接顺序为f→c→d→a→b→e,A正确;升高温度,氯气和NaOH溶液反应生成NaClO3,生成NaClO的浓度减小,不利于装置A中产品的生成,B错误;由反应方程式:Cl2+2NaOH===NaCl+NaClO+H2O、2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O,可得关系式:4NaOH~2NaClO~C3H3N3O3,加入4 mol NaOH时,可消耗1 mol C3H3N3O3,由于也生成NaOH,则消耗氰尿酸的量大于1 mol,C正确;装置D中浓盐酸和Ca(ClO)2反应生成Cl2,由于产生气体,装置D内压强较大,使用橡胶管可平衡气压,便于浓盐酸顺利流下,D正确。
10.D 溶液中溶质为NaCl、NaClO、NaClO3,n(Na)=n(Cl),则参加反应所需要的NaOH与氯气的物质的量之比一定为2∶1,故A正确;a点时,Cl2通入NaOH溶液中,反应所得ClO-与Cl的物质的量之比为1∶1,根据得失电子守恒配平方程式为4Cl2+8NaOH===6NaCl+NaClO3+NaClO+4H2O,溶液中n(NaCl)∶n(NaClO3)∶n(NaClO)=6∶1∶1,故B正确;由图可知,t2~t4,n(Cl)增大,n(ClO-)减小,结合转移电子守恒,可能是ClO-发生歧化反应:3ClO-===2Cl-+Cl,故C正确;二氧化硫具有强还原性,能与漂白液发生氧化还原反应,则向漂白液中通入二氧化硫,会减弱漂白能力,故D错误。
11.答案 (1)除去HCl气体 减小
(2)Cl2+2OH-===Cl-+ClO-+H2O
(3)防止HClO分解
(4)4.66
(5)HClO 酸性条件易产生氯气导致环境污染;中性条件下对棉布损伤较大
解析 (1)氯气难溶于饱和食盐水,装置B中饱和食盐水的作用是除去HCl气体,降低Cl2在水中的溶解度;若没有装置B除去Cl2中混有的HCl,D中氢氧化钠不足量,HCl会消耗一定量的氢氧化钠,次氯酸钠的产率减小。(3)步骤①中NaClO在酸性条件下与KI反应生成碘单质和氯化钠,离子方程式为ClO-+2H++2I-===Cl-+I2+H2O,ClO-与H+结合形成HClO,HClO见光易分解,所以要在暗处进行。(4)滴定消耗Na2S2O3的物质的量为0.025 L×0.100 0 mol·L-1=0.002 5 mol,根据关系式ClO-~I2~2S2,得n(NaClO)=n(I2)=×0.002 5 mol,NaClO的含量为≈4.66 g·L-1。(5)黄绿色气体为Cl2,无漂白性,NaClO与盐酸反应的离子方程式为ClO-+H+HClO,pH越小,氢离子浓度越大,平衡向正反应方向移动,HClO浓度越大,漂白性越强,所以具有漂白性的是HClO。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业9氯及其化合物
A组 基础达标
1.(2023·浙江稽阳联谊学校月考)ClO2是一种新型的自来水消毒剂,下列说法不正确的是( )
A.ClO2属于非电解质
B.ClO2具有强氧化性
C.ClO2为直线形分子
D.电负性:O>Cl
2.化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述正确的是( )
A.氯气和活性炭均可作漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH,对测定结果无影响
D.厕宝除垢,利用了盐酸的氧化性
3.氯气是一种很活泼的非金属单质,它具有较强的氧化性,下列叙述不正确的是( )
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
B.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状
D.通常状况下氯气能和Fe反应,氯气的储存不能用铁制容器
4.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
5.制取高效消毒剂ClO2的反应为2KClO3+H2C2O4===CO2↑+2ClO2↑+K2CO3+H2O。下列说法正确的是( )
A.H2C2O4中的C被还原
B.H2C2O4是氧化剂
C.氧化产物与还原产物的物质的量之比为1∶1
D.每消耗1 mol KClO3转移2 mol电子
6.(2023·浙江浙鳌高中段考)如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法不正确的是( )
A.若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠
B.检验氯气是否有漂白性,则Ⅰ、Ⅱ、Ⅲ分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸
C.装置b既可以洗气又可以作安全瓶监测装置c是否堵塞
D.含有4 mol HCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4 L
7.根据Cl2通入不同溶液中的实验现象,所得结论不正确的是( )
选 项 溶液 现象 结论
A FeCl2溶液 溶液由浅绿 色变为黄色 氧化性:Cl2>Fe3+
B AgNO3溶液 产生白色浑浊 氯气与水发生了反应
C 滴有酚酞的氢 氧化钠溶液 溶液红色褪去 氯气具有酸性
D 品红溶液 溶液褪色 氯水具有漂白性
8.(2023·浙江新昌澄潭中学检测)某同学取等量“84”消毒液分别加入三支试管中,各加3滴紫色石蕊溶液,再立即分别加入如图所示的试剂。下列实验现象的分析错误的是( )
实验 ① ② ③
现象 溶液先变蓝 色,一段时间 后蓝色褪去 溶液变蓝色后 迅速褪色,无气 体产生 溶液变蓝色后 迅速褪色,并产 生大量气体
A.实验①说明“84”消毒液呈碱性、有漂白性
B.实验表明,c(HClO)越大越易使有色物质褪色
C.ClO-与Cl-只有在酸性条件下才能反应
D.实验③中ClO-先转化为HClO,再分解产生Cl2
B组 综合提升
9.(2023·浙江淳安睿达实验学校检测)反应2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O可制备广谱消毒剂C3N3O3Cl2Na,装置如图所示(夹持装置已略去)。下列说法错误的是( )
A.按气流从左至右,装置中导管连接顺序为f→c→d→a→b→e
B.升高温度有利于装置A中产品的生成
C.当加入4 mol NaOH时,消耗氰尿酸(C3H3N3O3)的量大于1 mol
D.装置D中橡胶管可平衡气压,便于浓盐酸顺利流下
10.(2023·浙江嘉兴凤鸣高级中学检测)工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、Cl等离子的物质的量n( mol)与反应时间t(min)的关系曲线如图所示。下列说法错误的是( )
A.参加反应所需NaOH与氯气的物质的量之比一定为2∶1
B.a点时溶液中n(NaCl)∶n(NaClO3)∶n(NaClO)=6∶1∶1
C.t2~t4,ClO-的物质的量下降的原因可能是3ClO-===2Cl-+Cl
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
11.(2023·浙江瓯海一中段考节选)某研究性学习小组在实验室制备次氯酸钠溶液,测定其中NaClO的含量并探究其漂白棉布的效果。回答下列问题:
(一)制备NaClO溶液
(1)装置B的作用是 ;若没有装置B,且D中氢氧化钠不足量,对次氯酸钠产率的影响是 (填“增大”“减小”或“无影响”)。
(2)装置D中反应的离子方程式为 。
(二)测定消毒液中NaClO的含量
步骤①:取制得的消毒液20 mL置于锥形瓶中,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
步骤②:加入淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,重复滴定操作3次。
(3)步骤①中在暗处反应的原因是 。
(4)已知I2+2S2===2I-+S4。平均用去25.00 mL 0.100 0 mol·L-1Na2S2O3标准溶液,测得NaClO的含量为 g·L-1(结果保留2位小数)。
(三)探究次氯酸钠漂白棉布的效果
已知:棉布用次氯酸钠漂白液漂白会受到一定损伤。织物断裂强度是指织物在被拉断时,所能承受的最大荷重,单位为kg。
使用次氯酸钠漂白液漂白棉布,不同pH下漂白的结果如图所示。
(5)漂白速率随pH减小而加快,但酸性条件易产生黄绿色气体,该气体已被实验证明没有漂白作用,说明起漂白作用的主要是 (填粒子符号);pH最好选择9~11,虽然漂白速率较慢,但可延长漂白时间达到效果。不宜选择酸性或中性的原因分别是 。
作业9 氯及其化合物
1.C ClO2是非金属氧化物,属于非电解质,故A正确;ClO2中氯元素为+4价,易得电子,具有强氧化性,故B正确;ClO2为V形分子,故C错误;氧的电负性大于氯,故D正确。
2.B A项,活性炭具有吸附性,可以吸附氯气,若同时使用,漂白效果会减弱,错误;B项,氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,次氯酸盐为含氯消毒剂,正确;C项,氯水中的次氯酸具有漂白性,不能用pH试纸测定新制氯水的pH,错误;D项,厕宝除垢,利用了盐酸的还原性和酸性,错误。
3.D 红热的铜丝在氯气里剧烈燃烧生成氯化铜,生成棕黄色的烟,故A正确。氯气与水反应生成HCl和HClO,次氯酸不稳定,在光照下分解生成氧气和氯化氢,所以久置氯水最终变为稀盐酸,故B正确。纯净的H2在Cl2中安静地燃烧生成氯化氢,发出苍白色火焰,氯化氢结合水蒸气产生盐酸小液滴,所以集气瓶口呈现雾状,故C正确。通常状况下氯气和Fe不反应,氯气的储存能用铁制容器,故D错误。
4.B A项,氯水能使有色布条褪色是因为氯水中含有的HClO具有强氧化性,错误;C项,由于加入盐酸酸化的过程中引入了Cl-,所以根据生成白色沉淀无法说明氯水中存在Cl-,错误;D项,Cl2有颜色,HClO无色,错误。
5.C 反应后草酸中的碳元素化合价升高,作还原剂,碳元素被氧化,A、B错误;二氧化碳和碳酸钾为氧化产物,二氧化氯为还原产物,氧化产物与还原产物的物质的量之比为1∶1,C正确;氯元素化合价由+5价变为+4价,所以每消耗1 mol KClO3转移1 mol电子,D错误。
6.B 高锰酸钾、次氯酸钠具有强氧化性,在不加热条件下,能与浓盐酸反应产生氯气,故A正确;氯气能与碱石灰发生反应,因此干燥氯气时不能用碱石灰,应用无水氯化钙,故B错误;饱和食盐水能吸收氯气中的HCl,b装置有长颈漏斗,还起到安全瓶的作用,可以监测后续装置是否发生堵塞,平衡气压,故C正确;含4 mol HCl的浓盐酸与足量二氧化锰发生反应,随着反应的进行,浓盐酸逐渐变稀,变成稀盐酸后反应停止,因此产生标准状况下氯气的体积小于22.4 L,故D正确。
7.C FeCl2溶液中通入氯气,溶液由浅绿色变为黄色,说明氯气氧化Fe2+变为Fe3+,氧化性:Cl2>Fe3+,故A正确;AgNO3溶液中通入氯气,生成白色沉淀,说明氯气与水发生了反应生成盐酸和次氯酸,盐酸和硝酸银反应生成氯化银沉淀,故B正确;滴有酚酞的氢氧化钠溶液中通入氯气,溶液褪色,说明氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,不是氯气有酸性,故C错误;品红溶液中通入氯气,溶液褪色,说明氯水具有漂白性,故D正确。
8.D 实验①中加入石蕊溶液的“84”消毒液变为蓝色,说明溶液呈碱性,一段时间后蓝色褪去说明具有漂白性,A正确;实验①中,ClO-水解产生HClO,浓度较小,实验③中加入稀硫酸产生HClO,浓度较大,分析实验现象发现c(HClO)越大蓝色褪去得越快,说明c(HClO)越大越易使有色物质褪色,B正确;实验③加入硫酸后产生大量气体,而实验①中不产生气体,说明ClO-与Cl-只有在酸性条件下才能反应,C正确;实验③产生气体是因为ClO-与Cl-在酸性条件下能反应产生氯气,D错误。
9.B A为制取C3N3O3Cl2Na的装置,B为除去氯气中的HCl的装置,C为尾气处理装置,D为制取氯气装置,所以为完成实验,按气流从左至右,导管连接顺序为f→c→d→a→b→e,A正确;升高温度,氯气和NaOH溶液反应生成NaClO3,生成NaClO的浓度减小,不利于装置A中产品的生成,B错误;由反应方程式:Cl2+2NaOH===NaCl+NaClO+H2O、2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O,可得关系式:4NaOH~2NaClO~C3H3N3O3,加入4 mol NaOH时,可消耗1 mol C3H3N3O3,由于也生成NaOH,则消耗氰尿酸的量大于1 mol,C正确;装置D中浓盐酸和Ca(ClO)2反应生成Cl2,由于产生气体,装置D内压强较大,使用橡胶管可平衡气压,便于浓盐酸顺利流下,D正确。
10.D 溶液中溶质为NaCl、NaClO、NaClO3,n(Na)=n(Cl),则参加反应所需要的NaOH与氯气的物质的量之比一定为2∶1,故A正确;a点时,Cl2通入NaOH溶液中,反应所得ClO-与Cl的物质的量之比为1∶1,根据得失电子守恒配平方程式为4Cl2+8NaOH===6NaCl+NaClO3+NaClO+4H2O,溶液中n(NaCl)∶n(NaClO3)∶n(NaClO)=6∶1∶1,故B正确;由图可知,t2~t4,n(Cl)增大,n(ClO-)减小,结合转移电子守恒,可能是ClO-发生歧化反应:3ClO-===2Cl-+Cl,故C正确;二氧化硫具有强还原性,能与漂白液发生氧化还原反应,则向漂白液中通入二氧化硫,会减弱漂白能力,故D错误。
11.答案 (1)除去HCl气体 减小
(2)Cl2+2OH-===Cl-+ClO-+H2O
(3)防止HClO分解
(4)4.66
(5)HClO 酸性条件易产生氯气导致环境污染;中性条件下对棉布损伤较大
解析 (1)氯气难溶于饱和食盐水,装置B中饱和食盐水的作用是除去HCl气体,降低Cl2在水中的溶解度;若没有装置B除去Cl2中混有的HCl,D中氢氧化钠不足量,HCl会消耗一定量的氢氧化钠,次氯酸钠的产率减小。(3)步骤①中NaClO在酸性条件下与KI反应生成碘单质和氯化钠,离子方程式为ClO-+2H++2I-===Cl-+I2+H2O,ClO-与H+结合形成HClO,HClO见光易分解,所以要在暗处进行。(4)滴定消耗Na2S2O3的物质的量为0.025 L×0.100 0 mol·L-1=0.002 5 mol,根据关系式ClO-~I2~2S2,得n(NaClO)=n(I2)=×0.002 5 mol,NaClO的含量为≈4.66 g·L-1。(5)黄绿色气体为Cl2,无漂白性,NaClO与盐酸反应的离子方程式为ClO-+H+HClO,pH越小,氢离子浓度越大,平衡向正反应方向移动,HClO浓度越大,漂白性越强,所以具有漂白性的是HClO。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
