2025浙江专版新教材化学高考第一轮基础练--作业10卤族元素 海水资源的开发和利用(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业10卤族元素 海水资源的开发和利用(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 507.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:23:11 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业10卤族元素 海水资源的开发和利用
A组 基础达标
1.(2023·浙江长兴虹溪中学月考)下列关于卤素的叙述正确的是( )
①卤素的钾盐中,最易被氧化的是氟化钾 ②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯 ③溴化银具有感光性,碘化银不具有感光性 ④某溶液与淀粉-KI溶液反应出现蓝色,则证明该溶液是氯水或溴水 ⑤氟气与氯化钠水溶液反应,一定有氟化氢和氧气生成 ⑥氯气与水反应时,水既不是氧化剂也不是还原剂
A.①③⑤ B.②③⑥ C.②⑤⑥ D.①③④
2.下列说法不正确的是( )
A.海水提溴过程中鼓入热空气的目的是除去多余的氯气
B.H2O2可用于海带提碘
C.将Cl2通入冷的石灰乳中,可制得有效成分为Ca(ClO)2的漂白粉
D.合成氨反应的原料气必须经过净化,目的是防止混有的杂质使催化剂“中毒”
3.(2023·浙江四校高三月考)下列关于工业生产的说法不正确的是( )
A.铝制品可用化学氧化法增加膜的厚度及对氧化膜进行着色
B.工业上用电解熔融氧化物的方法制备金属镁和铝
C.氯碱工业中使用阳离子交换膜防止副反应的发生
D.工业制备硫酸时在吸收塔中使用浓硫酸吸收三氧化硫
4.如图是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.单质④能使淀粉溶液变蓝
D.单质的氧化性:④>③>②>①
5.(教材必修第二册第八章第一节练习与应用改编)从海带中提取碘单质,成熟的工艺流程如下,下列关于海带提碘的说法不正确的是( )
干海带海带灰悬浊液滤液碘水I2的CCl4溶液I2
A.在蒸发皿中灼烧干海带,并用玻璃棒搅拌
B.往含I-的滤液中加入稀硫酸和双氧水后,I-发生氧化反应
C.往碘水中加入几滴淀粉溶液,溶液变蓝色
D.将碘水加入CCl4中,通过萃取、分液得到I2的CCl4溶液
6.工业上用活性炭吸附海带提碘后废水中的碘制取I2,其流程如图:
下列说法错误的是( )
A.NaNO2氧化I-时使溶液pH变大
B.活性炭吸附是为了净化水溶液
C.I2与NaOH(浓、热)反应的化学方程式:3I2+6NaOH(浓、热) ===5NaI+NaIO3+3H2O
D.热空气能吹出I2,是因为I2在水中溶解度小、易升华
7.(2023·浙江湖州菱湖中学月考)从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,理论上需要消耗Cl2 44.8 L
D.步骤Ⅳ为蒸馏
B组 综合提升
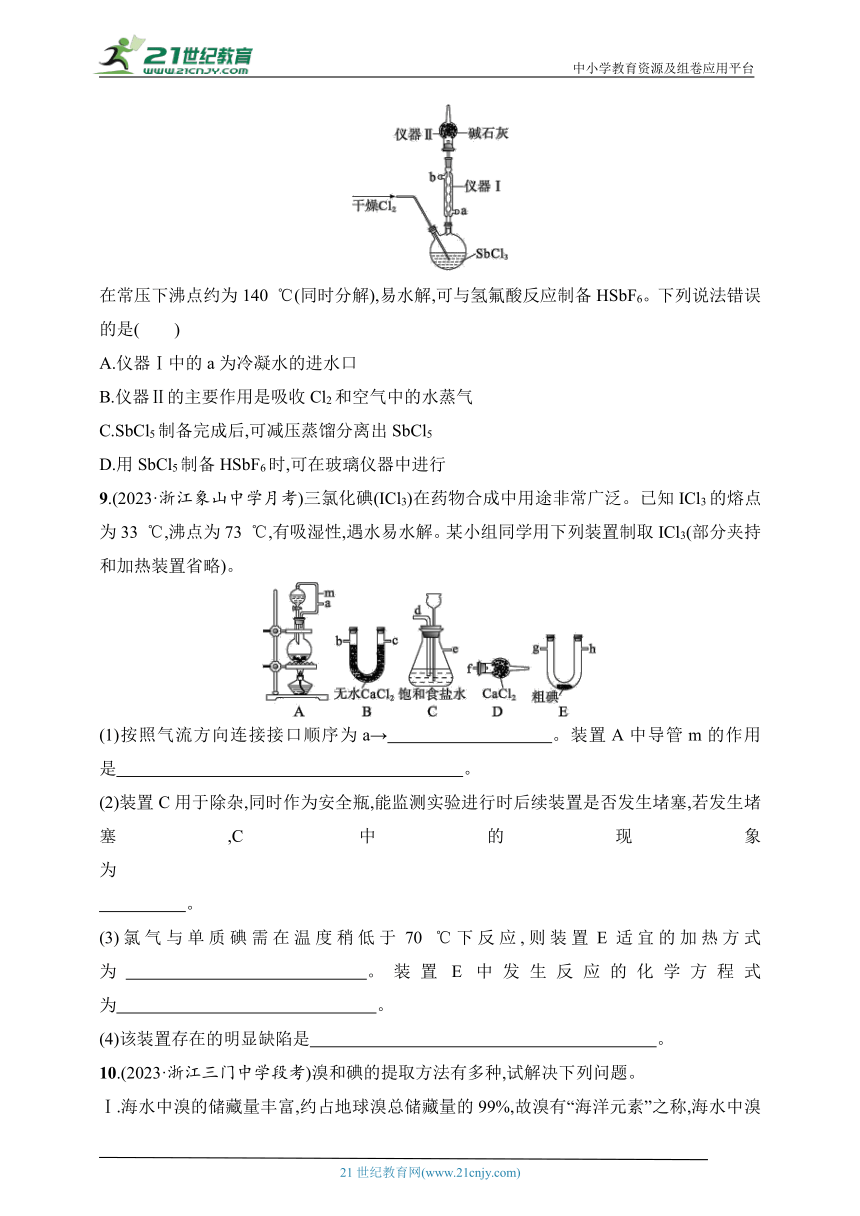
8.(2023·浙江桐乡茅盾中学月考)实验室利用如图所示装置制备SbCl5。已知:SbCl3的沸点为220.6 ℃,易水解;SbCl5
在常压下沸点约为140 ℃(同时分解),易水解,可与氢氟酸反应制备HSbF6。下列说法错误的是( )
A.仪器Ⅰ中的a为冷凝水的进水口
B.仪器Ⅱ的主要作用是吸收Cl2和空气中的水蒸气
C.SbCl5制备完成后,可减压蒸馏分离出SbCl5
D.用SbCl5制备HSbF6时,可在玻璃仪器中进行
9.(2023·浙江象山中学月考)三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3的熔点为33 ℃,沸点为73 ℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
(1)按照气流方向连接接口顺序为a→ 。装置A中导管m的作用是 。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞,C中的现象为 。
(3)氯气与单质碘需在温度稍低于70 ℃下反应,则装置E适宜的加热方式为 。装置E中发生反应的化学方程式为 。
(4)该装置存在的明显缺陷是 。
10.(2023·浙江三门中学段考)溴和碘的提取方法有多种,试解决下列问题。
Ⅰ.海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴的含量为65 mg·L-1。空气吹出法是目前海水提溴的最主要方法之一。其工艺流程如下:
(1)写出步骤③的离子方程式: 。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃,温度过高或过低都不利于生产。实验室里蒸馏所用的盛装混合物的仪器名称为 ,为控制温度,最好采用的加热方式为 ;溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离仪器的名称是 。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过 (填试剂名称)溶液,以除去氯气。
(4)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 。
(5)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因: 。
Ⅱ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;
该操作将I2还原为I-的目的是 。操作X的名称为 。
11.(教材必修第二册第八章第一节练习与应用改编)海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、S等离子,为除去杂质离子,所加试剂及其先后顺序为(填化学式): 。
(2)①电解饱和食盐水的化学方程式为 。
②制取MgCl2的过程中涉及反应:MgCl2·6H2OMgCl2+6H2O,该反应要在HCl气氛中进行,原因是 。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式: ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为 。
(4)海水提溴,也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是 。
作业10 卤族元素 海水资源的开发和利用
1.C 易被氧化的物质应具有较强的还原性,卤素离子中,I-的还原性最强,故卤素的钾盐中,最易被氧化的是KI,①错误;卤化银中除AgF外均有感光性,③错误;能与淀粉-KI溶液反应出现蓝色现象的,除氯水或溴水外,还可以是双氧水等,④错误。
2.A 海水提溴过程中鼓入热空气的目的是使溴从溶液中挥发出来,A错误;海带提碘中可用H2O2作氧化剂将I-氧化为I2,B正确;将Cl2通入冷的石灰乳中,氯气与石灰乳反应生成氯化钙、次氯酸钙和水,可制得有效成分为Ca(ClO)2的漂白粉,C正确;若合成氨反应的原料气不纯,催化剂易“中毒”,因此原料气必须经过净化,防止催化剂“中毒”,D正确。
3.B 铝能与O2反应在表面形成一层氧化膜,可用化学氧化法增加膜的厚度及对氧化膜进行着色,A正确;工业上用电解熔融MgCl2的方法制备金属镁,B错误;氯碱工业中阳极生成氯气,阴极生成氢气和氢氧根离子,为防止副反应发生,使用阳离子交换膜,C正确;工业上制备硫酸时,用浓硫酸吸收三氧化硫,如用水吸收三氧化硫,可能因反应放热形成酸雾,阻碍水对三氧化硫的吸收,而浓硫酸沸点高,难以汽化且三氧化硫易溶于浓硫酸,D正确。
4.D 从F2→I2,相对分子质量逐渐增大,沸点也逐渐升高,故①为F2,②为Cl2,③为Br2,④为I2。F2是最活泼的非金属单质;单质的氧化性:①>②>③>④,D项错误。
5.A 灼烧固体应使用坩埚,A错误;酸性条件下H2O2能将I-氧化为I2,B正确;淀粉遇碘变蓝,C正确;将碘水加入CCl4中,通过萃取、分液可得到I2的CCl4溶液,D正确。
6.B NaNO2氧化I-的离子方程式是2N+2I-+4H+===2NO↑+2H2O+I2,反应使溶液pH变大,A正确;活性炭吸附是为了富集单质碘,B不正确;I2与热的浓NaOH溶液反应生成NaI、NaIO3和H2O,化学方程式正确,C正确;利用I2在水中溶解度小、易升华的特点,可用热空气吹出I2,D正确。
7.C Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,通过置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用了Cl2,故制取1 mol Br2理论上需要消耗2 mol氯气,但未标明氯气所处的温度和压强,无法确定其体积,C错误;溴易挥发,从浓溴水中提取溴,可利用蒸馏的方法,D正确。
8.D 冷凝管中冷凝水应该“低进高出”,仪器Ⅰ中的a为冷凝水的进水口,故A正确;氯气有毒,污染空气,SbCl3、SbCl5易水解,仪器Ⅱ中碱石灰的主要作用是吸收Cl2和空气中的水蒸气,故B正确;SbCl5在常压下沸点约为140 ℃(同时分解),比SbCl3的低,为防止SbCl5分解,制备完成后应减压蒸馏分离出SbCl5,故C正确;SbCl5可与氢氟酸反应制备HSbF6,玻璃中的二氧化硅和氢氟酸反应,所以不能在玻璃仪器中进行,故D错误。
9.答案 (1)d→e→b→c→g→h→f(接口b与c、g与h可互换) 使浓盐酸顺利滴下
(2)锥形瓶中液面下降,长颈漏斗中液面上升
(3)水浴加热 3Cl2+I22ICl3
(4)缺少尾气处理装置
解析 (1)装置A中用浓盐酸与MnO2混合加热制取Cl2,浓盐酸易挥发,制取的氯气中含有氯化氢、水蒸气等杂质,通过装置C除去HCl,再通过装置B干燥,然后在装置E中氯气与碘单质反应制得ICl3;为防止ICl3水解,在E后面连接盛有干燥剂的装置D,防止空气中的水蒸气进入E装置。故按照气流方向连接装置接口顺序为a→d→e→b→c→g→h→f(接口b与c、g与h可互换);在装置A中导管m使分液漏斗中的液体上下压强一致,分液漏斗中的浓盐酸可以顺利滴下。(2)装置C可监测装置E中是否发生堵塞,若装置E发生堵塞,则C中气体压强增大,液体会进入长颈漏斗中,使锥形瓶中液面下降,长颈漏斗中液面上升。(3)水浴加热便于控制加热的温度,且能使反应装置受热均匀,又因为氯气与单质碘需在温度稍低于70 ℃下反应,故应采取水浴加热的方式;在装置E中Cl2与I2在低于70 ℃下发生反应:3Cl2+I22ICl3。(4)Cl2是有毒气体,通过盛有无水氯化钙的干燥管只能吸收水分,不能吸收氯气,这样就会造成大气污染,故该装置的缺陷是缺少尾气处理装置。
10.答案 Ⅰ.(1)Br2+SO2+2H2O===4H++2Br-+S
(2)蒸馏烧瓶 水浴加热 分液漏斗
(3)溴化铁(或其他含Br-的盐类物质)
(4)酸化可抑制Cl2与水反应
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,可提高效率,减少能耗,降低成本
Ⅱ.S+I2+H2O===2I-+S+2H+ 使溶于CCl4中的碘进入水层 分液
解析 Ⅰ.从海水中提取溴,一般要经过浓缩、氧化、提取三个步骤。步骤①发生的反应是Cl2+2Br-===2Cl-+Br2,根据溴易挥发的性质,可以鼓入热空气(步骤②),使它随热空气一起挥发出来,再用SO2吸收(步骤③):Br2+SO2+2H2O===4H++2Br-+S,这样可以得到较高浓度的含Br-的溶液,进一步用氯气氧化(步骤④),然后蒸馏便得到液溴。Ⅱ.S将I2还原为I-,自身被氧化为S,离子方程式为S+I2+H2O===2I-+S+2H+,该操作可使溶于CCl4中的碘进入水层。
11.答案 (1)BaCl2、NaOH、Na2CO3、HCl(只要Na2CO3在BaCl2之后加,HCl最后加皆可)
(2)①2NaCl+2H2OCl2↑+H2↑+2NaOH ②防止MgCl2水解
(3)Br2+SO2+2H2O===2Br-+4H++S Cl2>Br2>SO2
(4)3Br2+3C===5Br-+Br+3CO2↑
解析 (1)S、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,Na2CO3溶液能除去Ca2+和过量的Ba2+,盐酸能除去过量的C和OH-,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确的顺序为BaCl2、NaOH、Na2CO3、HCl(只要Na2CO3在BaCl2之后加,HCl最后加皆可)。(2)①电解饱和食盐水的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH。②氯化镁在水中易发生水解,为抑制其水解,氯化镁晶体应在氯化氢气流中脱水。(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收Br2,Br2转化为Br-,再用Cl2置换,第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集溴的作用;在自发进行的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,在反应Cl2+2Br-===Br2+2Cl-中,氧化性:Cl2>Br2,在反应SO2+2H2O+Br2===H2SO4+2HBr中,氧化性:Br2>SO2,故氧化性强弱顺序为Cl2>Br2>SO2。(4)吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为3Br2+3C===5Br-+Br+3CO2↑。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业10卤族元素 海水资源的开发和利用
A组 基础达标
1.(2023·浙江长兴虹溪中学月考)下列关于卤素的叙述正确的是( )
①卤素的钾盐中,最易被氧化的是氟化钾 ②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯 ③溴化银具有感光性,碘化银不具有感光性 ④某溶液与淀粉-KI溶液反应出现蓝色,则证明该溶液是氯水或溴水 ⑤氟气与氯化钠水溶液反应,一定有氟化氢和氧气生成 ⑥氯气与水反应时,水既不是氧化剂也不是还原剂
A.①③⑤ B.②③⑥ C.②⑤⑥ D.①③④
2.下列说法不正确的是( )
A.海水提溴过程中鼓入热空气的目的是除去多余的氯气
B.H2O2可用于海带提碘
C.将Cl2通入冷的石灰乳中,可制得有效成分为Ca(ClO)2的漂白粉
D.合成氨反应的原料气必须经过净化,目的是防止混有的杂质使催化剂“中毒”
3.(2023·浙江四校高三月考)下列关于工业生产的说法不正确的是( )
A.铝制品可用化学氧化法增加膜的厚度及对氧化膜进行着色
B.工业上用电解熔融氧化物的方法制备金属镁和铝
C.氯碱工业中使用阳离子交换膜防止副反应的发生
D.工业制备硫酸时在吸收塔中使用浓硫酸吸收三氧化硫
4.如图是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.单质④能使淀粉溶液变蓝
D.单质的氧化性:④>③>②>①
5.(教材必修第二册第八章第一节练习与应用改编)从海带中提取碘单质,成熟的工艺流程如下,下列关于海带提碘的说法不正确的是( )
干海带海带灰悬浊液滤液碘水I2的CCl4溶液I2
A.在蒸发皿中灼烧干海带,并用玻璃棒搅拌
B.往含I-的滤液中加入稀硫酸和双氧水后,I-发生氧化反应
C.往碘水中加入几滴淀粉溶液,溶液变蓝色
D.将碘水加入CCl4中,通过萃取、分液得到I2的CCl4溶液
6.工业上用活性炭吸附海带提碘后废水中的碘制取I2,其流程如图:
下列说法错误的是( )
A.NaNO2氧化I-时使溶液pH变大
B.活性炭吸附是为了净化水溶液
C.I2与NaOH(浓、热)反应的化学方程式:3I2+6NaOH(浓、热) ===5NaI+NaIO3+3H2O
D.热空气能吹出I2,是因为I2在水中溶解度小、易升华
7.(2023·浙江湖州菱湖中学月考)从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,理论上需要消耗Cl2 44.8 L
D.步骤Ⅳ为蒸馏
B组 综合提升
8.(2023·浙江桐乡茅盾中学月考)实验室利用如图所示装置制备SbCl5。已知:SbCl3的沸点为220.6 ℃,易水解;SbCl5
在常压下沸点约为140 ℃(同时分解),易水解,可与氢氟酸反应制备HSbF6。下列说法错误的是( )
A.仪器Ⅰ中的a为冷凝水的进水口
B.仪器Ⅱ的主要作用是吸收Cl2和空气中的水蒸气
C.SbCl5制备完成后,可减压蒸馏分离出SbCl5
D.用SbCl5制备HSbF6时,可在玻璃仪器中进行
9.(2023·浙江象山中学月考)三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3的熔点为33 ℃,沸点为73 ℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
(1)按照气流方向连接接口顺序为a→ 。装置A中导管m的作用是 。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞,C中的现象为 。
(3)氯气与单质碘需在温度稍低于70 ℃下反应,则装置E适宜的加热方式为 。装置E中发生反应的化学方程式为 。
(4)该装置存在的明显缺陷是 。
10.(2023·浙江三门中学段考)溴和碘的提取方法有多种,试解决下列问题。
Ⅰ.海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴的含量为65 mg·L-1。空气吹出法是目前海水提溴的最主要方法之一。其工艺流程如下:
(1)写出步骤③的离子方程式: 。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃,温度过高或过低都不利于生产。实验室里蒸馏所用的盛装混合物的仪器名称为 ,为控制温度,最好采用的加热方式为 ;溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离仪器的名称是 。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过 (填试剂名称)溶液,以除去氯气。
(4)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 。
(5)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因: 。
Ⅱ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;
该操作将I2还原为I-的目的是 。操作X的名称为 。
11.(教材必修第二册第八章第一节练习与应用改编)海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、S等离子,为除去杂质离子,所加试剂及其先后顺序为(填化学式): 。
(2)①电解饱和食盐水的化学方程式为 。
②制取MgCl2的过程中涉及反应:MgCl2·6H2OMgCl2+6H2O,该反应要在HCl气氛中进行,原因是 。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式: ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为 。
(4)海水提溴,也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是 。
作业10 卤族元素 海水资源的开发和利用
1.C 易被氧化的物质应具有较强的还原性,卤素离子中,I-的还原性最强,故卤素的钾盐中,最易被氧化的是KI,①错误;卤化银中除AgF外均有感光性,③错误;能与淀粉-KI溶液反应出现蓝色现象的,除氯水或溴水外,还可以是双氧水等,④错误。
2.A 海水提溴过程中鼓入热空气的目的是使溴从溶液中挥发出来,A错误;海带提碘中可用H2O2作氧化剂将I-氧化为I2,B正确;将Cl2通入冷的石灰乳中,氯气与石灰乳反应生成氯化钙、次氯酸钙和水,可制得有效成分为Ca(ClO)2的漂白粉,C正确;若合成氨反应的原料气不纯,催化剂易“中毒”,因此原料气必须经过净化,防止催化剂“中毒”,D正确。
3.B 铝能与O2反应在表面形成一层氧化膜,可用化学氧化法增加膜的厚度及对氧化膜进行着色,A正确;工业上用电解熔融MgCl2的方法制备金属镁,B错误;氯碱工业中阳极生成氯气,阴极生成氢气和氢氧根离子,为防止副反应发生,使用阳离子交换膜,C正确;工业上制备硫酸时,用浓硫酸吸收三氧化硫,如用水吸收三氧化硫,可能因反应放热形成酸雾,阻碍水对三氧化硫的吸收,而浓硫酸沸点高,难以汽化且三氧化硫易溶于浓硫酸,D正确。
4.D 从F2→I2,相对分子质量逐渐增大,沸点也逐渐升高,故①为F2,②为Cl2,③为Br2,④为I2。F2是最活泼的非金属单质;单质的氧化性:①>②>③>④,D项错误。
5.A 灼烧固体应使用坩埚,A错误;酸性条件下H2O2能将I-氧化为I2,B正确;淀粉遇碘变蓝,C正确;将碘水加入CCl4中,通过萃取、分液可得到I2的CCl4溶液,D正确。
6.B NaNO2氧化I-的离子方程式是2N+2I-+4H+===2NO↑+2H2O+I2,反应使溶液pH变大,A正确;活性炭吸附是为了富集单质碘,B不正确;I2与热的浓NaOH溶液反应生成NaI、NaIO3和H2O,化学方程式正确,C正确;利用I2在水中溶解度小、易升华的特点,可用热空气吹出I2,D正确。
7.C Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,通过置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用了Cl2,故制取1 mol Br2理论上需要消耗2 mol氯气,但未标明氯气所处的温度和压强,无法确定其体积,C错误;溴易挥发,从浓溴水中提取溴,可利用蒸馏的方法,D正确。
8.D 冷凝管中冷凝水应该“低进高出”,仪器Ⅰ中的a为冷凝水的进水口,故A正确;氯气有毒,污染空气,SbCl3、SbCl5易水解,仪器Ⅱ中碱石灰的主要作用是吸收Cl2和空气中的水蒸气,故B正确;SbCl5在常压下沸点约为140 ℃(同时分解),比SbCl3的低,为防止SbCl5分解,制备完成后应减压蒸馏分离出SbCl5,故C正确;SbCl5可与氢氟酸反应制备HSbF6,玻璃中的二氧化硅和氢氟酸反应,所以不能在玻璃仪器中进行,故D错误。
9.答案 (1)d→e→b→c→g→h→f(接口b与c、g与h可互换) 使浓盐酸顺利滴下
(2)锥形瓶中液面下降,长颈漏斗中液面上升
(3)水浴加热 3Cl2+I22ICl3
(4)缺少尾气处理装置
解析 (1)装置A中用浓盐酸与MnO2混合加热制取Cl2,浓盐酸易挥发,制取的氯气中含有氯化氢、水蒸气等杂质,通过装置C除去HCl,再通过装置B干燥,然后在装置E中氯气与碘单质反应制得ICl3;为防止ICl3水解,在E后面连接盛有干燥剂的装置D,防止空气中的水蒸气进入E装置。故按照气流方向连接装置接口顺序为a→d→e→b→c→g→h→f(接口b与c、g与h可互换);在装置A中导管m使分液漏斗中的液体上下压强一致,分液漏斗中的浓盐酸可以顺利滴下。(2)装置C可监测装置E中是否发生堵塞,若装置E发生堵塞,则C中气体压强增大,液体会进入长颈漏斗中,使锥形瓶中液面下降,长颈漏斗中液面上升。(3)水浴加热便于控制加热的温度,且能使反应装置受热均匀,又因为氯气与单质碘需在温度稍低于70 ℃下反应,故应采取水浴加热的方式;在装置E中Cl2与I2在低于70 ℃下发生反应:3Cl2+I22ICl3。(4)Cl2是有毒气体,通过盛有无水氯化钙的干燥管只能吸收水分,不能吸收氯气,这样就会造成大气污染,故该装置的缺陷是缺少尾气处理装置。
10.答案 Ⅰ.(1)Br2+SO2+2H2O===4H++2Br-+S
(2)蒸馏烧瓶 水浴加热 分液漏斗
(3)溴化铁(或其他含Br-的盐类物质)
(4)酸化可抑制Cl2与水反应
(5)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,可提高效率,减少能耗,降低成本
Ⅱ.S+I2+H2O===2I-+S+2H+ 使溶于CCl4中的碘进入水层 分液
解析 Ⅰ.从海水中提取溴,一般要经过浓缩、氧化、提取三个步骤。步骤①发生的反应是Cl2+2Br-===2Cl-+Br2,根据溴易挥发的性质,可以鼓入热空气(步骤②),使它随热空气一起挥发出来,再用SO2吸收(步骤③):Br2+SO2+2H2O===4H++2Br-+S,这样可以得到较高浓度的含Br-的溶液,进一步用氯气氧化(步骤④),然后蒸馏便得到液溴。Ⅱ.S将I2还原为I-,自身被氧化为S,离子方程式为S+I2+H2O===2I-+S+2H+,该操作可使溶于CCl4中的碘进入水层。
11.答案 (1)BaCl2、NaOH、Na2CO3、HCl(只要Na2CO3在BaCl2之后加,HCl最后加皆可)
(2)①2NaCl+2H2OCl2↑+H2↑+2NaOH ②防止MgCl2水解
(3)Br2+SO2+2H2O===2Br-+4H++S Cl2>Br2>SO2
(4)3Br2+3C===5Br-+Br+3CO2↑
解析 (1)S、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,Na2CO3溶液能除去Ca2+和过量的Ba2+,盐酸能除去过量的C和OH-,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确的顺序为BaCl2、NaOH、Na2CO3、HCl(只要Na2CO3在BaCl2之后加,HCl最后加皆可)。(2)①电解饱和食盐水的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH。②氯化镁在水中易发生水解,为抑制其水解,氯化镁晶体应在氯化氢气流中脱水。(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收Br2,Br2转化为Br-,再用Cl2置换,第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集溴的作用;在自发进行的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,在反应Cl2+2Br-===Br2+2Cl-中,氧化性:Cl2>Br2,在反应SO2+2H2O+Br2===H2SO4+2HBr中,氧化性:Br2>SO2,故氧化性强弱顺序为Cl2>Br2>SO2。(4)吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为3Br2+3C===5Br-+Br+3CO2↑。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
