2025浙江专版新教材化学高考第一轮基础练--作业11硫及其化合物(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业11硫及其化合物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 499.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 21:23:28 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业11硫及其化合物
A组 基础达标
1.(2022·浙江浙南名校第二次联考)关于反应H2SO4(浓)+H2S===SO2↑+S↓+2H2O,下列说法不正确的是( )
A.H2SO4是氧化剂
B.SO2是还原产物
C.H2S中的S元素被还原
D.消耗1 mol H2SO4,转移2 mol电子
2.(2023·浙江高三百校联考)硫酸钡在医疗上常用作消化系统X射线检查的内服药剂,下列说法不正确的是( )
A.Ba元素位于周期表s区
B.所有钡盐都能使蛋白质变性
C.硫酸钡属于强电解质
D.硫酸根离子的空间结构是四面体形
3.(2023·湖北六校高三月考)我国晋代《抱朴子》中描述了“丹砂(HgS)烧之成水银,积变又还成丹砂”。下列有关叙述正确的是( )
A.“丹砂”和“水银”都是化合物
B.该描述中的反应是可逆反应
C.水银有恒定的体积膨胀系数,被用于制作温度计
D.“积变又还成丹砂”中的“还”可理解为“被还原”
4.(教材必修第二册第五章第一节实验5-3改编)下图虚线框中的装置(试剂均足量)可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,其中供选择的试剂有无水硫酸铜、品红溶液、酸性高锰酸钾溶液、澄清石灰水四种试剂,下列说法正确的是( )
A.物质甲可以是无水硫酸铜,也可以是变色硅胶、无水氯化钙等物质
B.丙中发生反应的离子方程式可能是SO2+2OH-===S+H2O
C.乙和戊两种溶液都不宜用作尾气吸收装置中的试剂
D.如果将装置的连接顺序变为①③②,不影响检验
5.对于Na2S2O5、Na2S2O7、Na2S2O8三种物质,下列说法不正确的是( )
A.Na2S2O5在空气中易被氧化
B.Na2S2O5可通过NaHSO3过饱和溶液结晶脱水制得
C.Na2S2O7与水反应可得到硫酸氢钠
D.Na2S2O8中+7价的硫元素体现强氧化性
6.(2023·河南十校尖子班二考)下列各物质在给定条件下通过一步反应就能实现所示转化的是( )
A.CuSO4(aq)Cu(OH)2(s)Cu2O(s)
B.H2S(g)SO2(g)H2SO3(aq)
C.Fe(s)FeCl2(s)Fe(OH)2(s)
D.SO2(g)Na2SO3(aq)Na2SO3(s)
7.(2023·浙江大学附属中学月考)工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
A.吸收过程中有气体生成
B.结晶后母液中含有NaHCO3
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含Na2SO3和NaHCO3
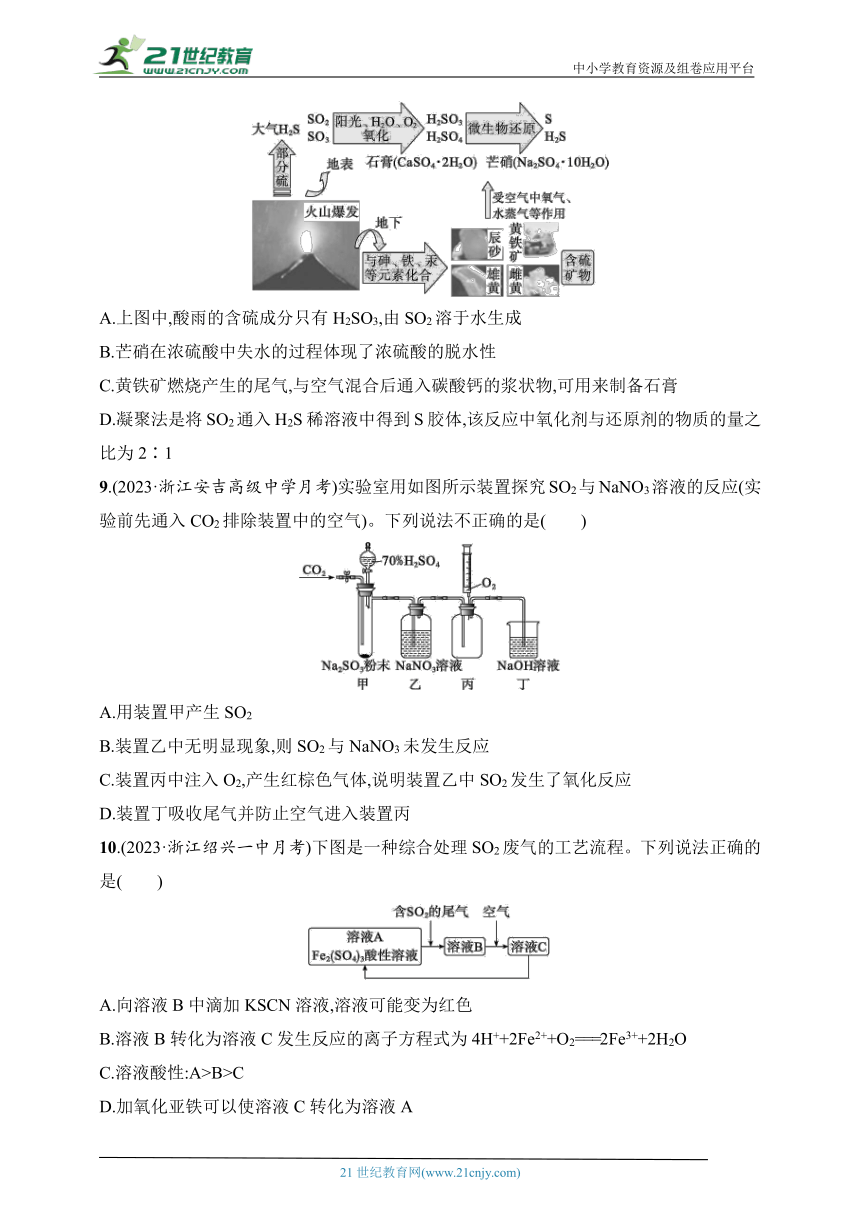
8.(教材必修第二册第五章第一节练习与应用改编)自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是( )
自然界中不同价态硫元素间的转化
A.上图中,酸雨的含硫成分只有H2SO3,由SO2溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将SO2通入H2S稀溶液中得到S胶体,该反应中氧化剂与还原剂的物质的量之比为2∶1
9.(2023·浙江安吉高级中学月考)实验室用如图所示装置探究SO2与NaNO3溶液的反应(实验前先通入CO2排除装置中的空气)。下列说法不正确的是( )
A.用装置甲产生SO2
B.装置乙中无明显现象,则SO2与NaNO3未发生反应
C.装置丙中注入O2,产生红棕色气体,说明装置乙中SO2发生了氧化反应
D.装置丁吸收尾气并防止空气进入装置丙
10.(2023·浙江绍兴一中月考)下图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
A.向溶液B中滴加KSCN溶液,溶液可能变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
B组 综合提升
11.(2023·江苏淮安高中协作体期中)硫代硫酸钠(Na2S2O3)的制备和应用相关流程如图所示。
已知:(H2SO3)>(H2CO3)>(H2SO3)>(H2CO3)。
下列离子方程式书写正确的是( )
A.反应①:C+2HS===2S+CO2↑+H2O
B.向Na2S2O3溶液中加入稀硫酸:3S2+2H+===4S↓+2S+H2O
C.反应③:Ag++2S2=== [Ag(S2O3)2]3-
D.利用Na2S2O3滴定碘单质生成Na2S4O6:I2+2S2===2I-+S4
12.(2023·华南师大附中综合测试)含硫化合物的反应具有多样性。下列有关反应的离子方程式书写不正确的是( )
A.用Na2SO3溶液吸收SO2废气:S+SO2+H2O===2HS
B.海水提溴工艺中用SO2还原Br2:Br2+SO2+2H2O===2H++S+2HBr
C.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+C(aq)CaCO3(s)+S(aq)
D.将S与Na2SO3溶液混合加热制备Na2S2O3:S+SS2
13.(2024·浙江绍兴高三上一模)探究硫及其化合物的性质,下列实验方案、现象和结论都正确的是( )
选 项 实验方案 现象 结论
A 往Cu2O固体中加入稀硫酸 产生蓝色溶液 不能说明稀硫酸具有强氧化性
B 往Fe2(SO4)3溶液中通入SO2,再加入BaCl2溶液 产生白色沉淀 SO2具有还原性
C 往CuSO4溶液中通入H2S 产生黑色沉淀 H2S酸性强于H2SO4
D 往紫色石蕊溶液中通入SO2 石蕊溶液先变红后褪色 SO2具有漂白性
14.(2024·浙江温州高三上一模)烟道气中含有SO2,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
(1)写出NH3的电子式: 。
(2)下列叙述正确的是 。
A.烟道气中的SO2含量可用一定体积、浓度的酸性高锰酸钾溶液测定
B.S2Cl2是橡胶硫化剂,橡胶硫化程度越高,弹性越好
C.SOCl2可与H2O发生反应,能作为AlCl3·6H2O的脱水剂
D.PCl5固体中含阳离子和阴离子空间结构为正四面体形
E.S2Cl2易溶于CCl4,则S2Cl2为非极性分子
(3)SOCl2与过量NH3反应的化学方程式: 。
(4)S2Cl2与NH3反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为 。
(5)设计实验检验SOCl2与足量NaOH溶液反应生成的阴离子: 。
作业11 硫及其化合物
1.C H2SO4中S元素的化合价降低,H2SO4是氧化剂,A正确;氧化剂H2SO4对应的还原产物为SO2,B正确;还原剂H2S对应的氧化产物为S,H2S中的S元素被氧化,C错误;H2SO4中S元素由+6价降低为+4价,消耗1 mol H2SO4转移2 mol电子,D正确。
2.B Ba元素位于第ⅡA族,周期表s区,A正确;可溶性钡盐都能使蛋白质变性,硫酸钡不溶于水,不能使蛋白质变性,B错误;硫酸钡在熔融状态下能完全电离,属于强电解质,C正确;硫酸根离子的中心原子σ键电子对数为4,孤电子对数为×(6+2-4×2)=0,空间结构是四面体形,D正确。
3.C 水银(Hg)是单质,A错误;“丹砂(HgS)烧之成水银,积变又还成丹砂”,前者需要加热,后者常温下反应,不是同一条件,故不是可逆反应,B错误;体积膨胀系数是表征物体热膨胀性质的物理量,水银有恒定的体积膨胀系数,受热时体积变化均匀,可用于制作温度计,C正确;“积变又还成丹砂”发生的反应是Hg+S===HgS,Hg发生了氧化反应,D错误。
4.C 装置①检验混合气体中是否含有水蒸气,应该用无水硫酸铜或变色硅胶,无水氯化钙吸水后无明显现象,不能用无水氯化钙,A错误;装置②检验并除去混合气体中的SO2,由于CO2也能被强碱溶液吸收,故丙中试剂应该是酸性高锰酸钾溶液,B错误;品红溶液可以检验SO2,但一般不能用来除去SO2,澄清石灰水浓度太小,不能用来吸收尾气,C正确;如果将装置的连接顺序变为①③②,SO2、CO2都能使澄清石灰水变浑浊,无法检验CO2的存在,D错误。
5.D Na2S2O5中S显+4价,处于中间价态,以还原性为主,容易被空气中氧气氧化,故A说法正确;Na2S2O5、NaHSO3中S均显+4价,Na2S2O5可通过NaHSO3过饱和溶液结晶脱水制得,故B说法正确;Na2S2O7中S显+6价,硫酸氢钠中S显+6价,Na2S2O7与水反应可得到硫酸氢钠,故C说法正确;S的最高价为+6价,Na2S2O8中含有1个“—O—O—”,“—O—O—”体现强氧化性,故D说法错误。
6.A 向CuSO4溶液中加入足量NaOH溶液得到Cu(OH)2悬浊液,向其中加入葡萄糖溶液,加热得到红色Cu2O沉淀,A正确;H2S气体具有可燃性,在少量氧气中燃烧得到H2O和S单质,B错误;铁在氯气中燃烧,产物只有FeCl3,C错误;Na2SO3具有还原性,在空气中加热蒸发Na2SO3溶液,Na2SO3易被O2氧化为Na2SO4,而无法获得Na2SO3固体,D错误。
7.B 根据工艺流程逆向分析可知,以二氧化硫和纯碱为原料,得到的结晶成分为NaHSO3,则母液为饱和NaHSO3和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,涉及反应:H2SO3+2Na2CO3===Na2SO3+2NaHCO3,NaHSO3+Na2CO3===Na2SO3+NaHCO3,所以调节pH为8进行中和后得到Na2SO3和NaHCO3,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应:Na2SO3+SO2+H2O===2NaHSO3↓,SO2+NaHCO3===CO2+NaHSO3↓,此时会析出大量NaHSO3晶体,经过离心分离,将得到的湿料再进行气流干燥,最终得到NaHSO3产品,据此分析解答。根据上述分析可知,吸收过程中有二氧化碳生成,A正确;结晶后母液中含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,没有NaHCO3,B错误;NaHSO3高温时易分解变质,所以气流干燥过程中温度不宜过高,C正确;结合上述分析可知,中和后溶液中含Na2SO3和NaHCO3,D正确。
8.C 酸雨的含硫成分有硫酸和亚硫酸,故A错误;芒硝是Na2SO4·10H2O,失水后生成Na2SO4,体现了浓硫酸的吸水性,故B错误;黄铁矿燃烧产生的尾气是SO2,SO2与空气混合后与碳酸钙反应生成硫酸钙,可用来制备石膏,故C正确;SO2与H2S的反应为2H2S+SO2===3S↓+2H2O,氧化剂是SO2,还原剂是H2S,氧化剂与还原剂的物质的量之比为1∶2,故D错误。
9.B 甲为二氧化硫产生装置,乙为二氧化硫与硝酸钠的反应装置,反应生成的NO进入丙,但是整个过程没有明显现象,因此可通过向丙中注入氧气,看是否有红棕色气体生成,来确定乙中是否发生反应。甲为二氧化硫的产生装置,方程式为H2SO4+Na2SO3===Na2SO4+SO2↑+H2O,A正确;由于生成的NO为无色气体,故该反应没有明显现象,B错误;注入氧气,产生红棕色气体,说明装置丙中有NO,进一步证明乙中发生了反应,C正确;丁为尾气处理装置,并且防止空气进入装置丙,D正确。
10.A SO2与Fe3+发生氧化还原反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不变红色;若二氧化硫不足,则溶液中有Fe3+,加入KSCN溶液,溶液变红色,A正确;离子方程式中电荷不守恒,B错误;溶液A转化为溶液B后溶液酸性增强,C错误;FeO与H+反应生成Fe2+,故溶液C不能转化为溶液A,D错误。
11.D NaHSO3和碳酸钠反应生成亚硫酸钠,亚硫酸钠和硫反应生成硫代硫酸钠,硫代硫酸钠和溴化银反应生成Na3[Ag(S2O3)2]。根据给出的电离平衡常数大小关系可知,HS的酸性弱于碳酸,所以选项中的反应不能发生,正确的离子方程式为C+HS===S+HC,故A错误;向Na2S2O3溶液中加入稀硫酸,生成硫、二氧化硫和水:S2+2H+===S↓+SO2↑+H2O,故B错误;反应③是硫代硫酸钠和溴化银反应生成Na3[Ag(S2O3)2],AgBr不溶于水,不能写成离子形式,故C错误;利用Na2S2O3滴定碘单质生成Na2S4O6,碘单质被还原为I-,故D正确。
12.B 用Na2SO3溶液吸收SO2废气过程中,SO2和Na2SO3溶液反应生成NaHSO3,离子方程式为S+SO2+H2O===2HS,故A正确;HBr是强酸,在离子方程式中要拆分,故B错误;CaCO3的溶解度小于CaSO4,用Na2CO3溶液处理锅炉水垢中的CaSO4,CaSO4可以转化为CaCO3,离子方程式为CaSO4(s)+C(aq)CaCO3(s)+S(aq),故C正确;S与Na2SO3溶液反应生成Na2S2O3,离子方程式为S+SS2,故D正确。
13.A 在该反应过程中,+1价铜发生歧化反应生成+2价铜离子和单质铜,硫酸中元素化合价未发生变化,不能表现稀硫酸的氧化性,A正确;硫酸铁中含有S,S和Ba2+反应生成BaSO4白色沉淀,不能体现二氧化硫的还原性,B错误;硫化铜难溶于水和稀硫酸,故CuSO4和硫化氢反应可以生成硫化铜和硫酸,不能证明酸性的强弱,C错误;二氧化硫不能漂白指示剂,D错误。
14.答案 (1)H (2)ACD (3)SOCl2+4NH3===SO(NH2)2+2NH4Cl (4)S4N4或N4S4 (5)取少量反应液滴加稀盐酸并加热,若产生的气体使品红溶液褪色,则有S;另取少量反应液先滴加稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则有Cl-
解析 (2)烟道气中的SO2具有还原性,其含量可用一定体积、浓度的酸性高锰酸钾溶液测定,A正确;S2Cl2是橡胶硫化剂,橡胶硫化程度越高,弹性越差,B错误;SOCl2可与H2O发生反应,能作为AlCl3·6H2O的脱水剂,C正确;中心原子P价层电子对数:4+×(4-4×1)=4,无孤电子对,空间结构为正四面体形,D正确;S2Cl2正负电荷中心不重合,为极性分子,E错误。(4)S2Cl2与NH3反应除生成M外,同时有淡黄色固体S生成,则M为S4N4或N4S4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业11硫及其化合物
A组 基础达标
1.(2022·浙江浙南名校第二次联考)关于反应H2SO4(浓)+H2S===SO2↑+S↓+2H2O,下列说法不正确的是( )
A.H2SO4是氧化剂
B.SO2是还原产物
C.H2S中的S元素被还原
D.消耗1 mol H2SO4,转移2 mol电子
2.(2023·浙江高三百校联考)硫酸钡在医疗上常用作消化系统X射线检查的内服药剂,下列说法不正确的是( )
A.Ba元素位于周期表s区
B.所有钡盐都能使蛋白质变性
C.硫酸钡属于强电解质
D.硫酸根离子的空间结构是四面体形
3.(2023·湖北六校高三月考)我国晋代《抱朴子》中描述了“丹砂(HgS)烧之成水银,积变又还成丹砂”。下列有关叙述正确的是( )
A.“丹砂”和“水银”都是化合物
B.该描述中的反应是可逆反应
C.水银有恒定的体积膨胀系数,被用于制作温度计
D.“积变又还成丹砂”中的“还”可理解为“被还原”
4.(教材必修第二册第五章第一节实验5-3改编)下图虚线框中的装置(试剂均足量)可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,其中供选择的试剂有无水硫酸铜、品红溶液、酸性高锰酸钾溶液、澄清石灰水四种试剂,下列说法正确的是( )
A.物质甲可以是无水硫酸铜,也可以是变色硅胶、无水氯化钙等物质
B.丙中发生反应的离子方程式可能是SO2+2OH-===S+H2O
C.乙和戊两种溶液都不宜用作尾气吸收装置中的试剂
D.如果将装置的连接顺序变为①③②,不影响检验
5.对于Na2S2O5、Na2S2O7、Na2S2O8三种物质,下列说法不正确的是( )
A.Na2S2O5在空气中易被氧化
B.Na2S2O5可通过NaHSO3过饱和溶液结晶脱水制得
C.Na2S2O7与水反应可得到硫酸氢钠
D.Na2S2O8中+7价的硫元素体现强氧化性
6.(2023·河南十校尖子班二考)下列各物质在给定条件下通过一步反应就能实现所示转化的是( )
A.CuSO4(aq)Cu(OH)2(s)Cu2O(s)
B.H2S(g)SO2(g)H2SO3(aq)
C.Fe(s)FeCl2(s)Fe(OH)2(s)
D.SO2(g)Na2SO3(aq)Na2SO3(s)
7.(2023·浙江大学附属中学月考)工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
A.吸收过程中有气体生成
B.结晶后母液中含有NaHCO3
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含Na2SO3和NaHCO3
8.(教材必修第二册第五章第一节练习与应用改编)自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是( )
自然界中不同价态硫元素间的转化
A.上图中,酸雨的含硫成分只有H2SO3,由SO2溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将SO2通入H2S稀溶液中得到S胶体,该反应中氧化剂与还原剂的物质的量之比为2∶1
9.(2023·浙江安吉高级中学月考)实验室用如图所示装置探究SO2与NaNO3溶液的反应(实验前先通入CO2排除装置中的空气)。下列说法不正确的是( )
A.用装置甲产生SO2
B.装置乙中无明显现象,则SO2与NaNO3未发生反应
C.装置丙中注入O2,产生红棕色气体,说明装置乙中SO2发生了氧化反应
D.装置丁吸收尾气并防止空气进入装置丙
10.(2023·浙江绍兴一中月考)下图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
A.向溶液B中滴加KSCN溶液,溶液可能变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
B组 综合提升
11.(2023·江苏淮安高中协作体期中)硫代硫酸钠(Na2S2O3)的制备和应用相关流程如图所示。
已知:(H2SO3)>(H2CO3)>(H2SO3)>(H2CO3)。
下列离子方程式书写正确的是( )
A.反应①:C+2HS===2S+CO2↑+H2O
B.向Na2S2O3溶液中加入稀硫酸:3S2+2H+===4S↓+2S+H2O
C.反应③:Ag++2S2=== [Ag(S2O3)2]3-
D.利用Na2S2O3滴定碘单质生成Na2S4O6:I2+2S2===2I-+S4
12.(2023·华南师大附中综合测试)含硫化合物的反应具有多样性。下列有关反应的离子方程式书写不正确的是( )
A.用Na2SO3溶液吸收SO2废气:S+SO2+H2O===2HS
B.海水提溴工艺中用SO2还原Br2:Br2+SO2+2H2O===2H++S+2HBr
C.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+C(aq)CaCO3(s)+S(aq)
D.将S与Na2SO3溶液混合加热制备Na2S2O3:S+SS2
13.(2024·浙江绍兴高三上一模)探究硫及其化合物的性质,下列实验方案、现象和结论都正确的是( )
选 项 实验方案 现象 结论
A 往Cu2O固体中加入稀硫酸 产生蓝色溶液 不能说明稀硫酸具有强氧化性
B 往Fe2(SO4)3溶液中通入SO2,再加入BaCl2溶液 产生白色沉淀 SO2具有还原性
C 往CuSO4溶液中通入H2S 产生黑色沉淀 H2S酸性强于H2SO4
D 往紫色石蕊溶液中通入SO2 石蕊溶液先变红后褪色 SO2具有漂白性
14.(2024·浙江温州高三上一模)烟道气中含有SO2,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
(1)写出NH3的电子式: 。
(2)下列叙述正确的是 。
A.烟道气中的SO2含量可用一定体积、浓度的酸性高锰酸钾溶液测定
B.S2Cl2是橡胶硫化剂,橡胶硫化程度越高,弹性越好
C.SOCl2可与H2O发生反应,能作为AlCl3·6H2O的脱水剂
D.PCl5固体中含阳离子和阴离子空间结构为正四面体形
E.S2Cl2易溶于CCl4,则S2Cl2为非极性分子
(3)SOCl2与过量NH3反应的化学方程式: 。
(4)S2Cl2与NH3反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为 。
(5)设计实验检验SOCl2与足量NaOH溶液反应生成的阴离子: 。
作业11 硫及其化合物
1.C H2SO4中S元素的化合价降低,H2SO4是氧化剂,A正确;氧化剂H2SO4对应的还原产物为SO2,B正确;还原剂H2S对应的氧化产物为S,H2S中的S元素被氧化,C错误;H2SO4中S元素由+6价降低为+4价,消耗1 mol H2SO4转移2 mol电子,D正确。
2.B Ba元素位于第ⅡA族,周期表s区,A正确;可溶性钡盐都能使蛋白质变性,硫酸钡不溶于水,不能使蛋白质变性,B错误;硫酸钡在熔融状态下能完全电离,属于强电解质,C正确;硫酸根离子的中心原子σ键电子对数为4,孤电子对数为×(6+2-4×2)=0,空间结构是四面体形,D正确。
3.C 水银(Hg)是单质,A错误;“丹砂(HgS)烧之成水银,积变又还成丹砂”,前者需要加热,后者常温下反应,不是同一条件,故不是可逆反应,B错误;体积膨胀系数是表征物体热膨胀性质的物理量,水银有恒定的体积膨胀系数,受热时体积变化均匀,可用于制作温度计,C正确;“积变又还成丹砂”发生的反应是Hg+S===HgS,Hg发生了氧化反应,D错误。
4.C 装置①检验混合气体中是否含有水蒸气,应该用无水硫酸铜或变色硅胶,无水氯化钙吸水后无明显现象,不能用无水氯化钙,A错误;装置②检验并除去混合气体中的SO2,由于CO2也能被强碱溶液吸收,故丙中试剂应该是酸性高锰酸钾溶液,B错误;品红溶液可以检验SO2,但一般不能用来除去SO2,澄清石灰水浓度太小,不能用来吸收尾气,C正确;如果将装置的连接顺序变为①③②,SO2、CO2都能使澄清石灰水变浑浊,无法检验CO2的存在,D错误。
5.D Na2S2O5中S显+4价,处于中间价态,以还原性为主,容易被空气中氧气氧化,故A说法正确;Na2S2O5、NaHSO3中S均显+4价,Na2S2O5可通过NaHSO3过饱和溶液结晶脱水制得,故B说法正确;Na2S2O7中S显+6价,硫酸氢钠中S显+6价,Na2S2O7与水反应可得到硫酸氢钠,故C说法正确;S的最高价为+6价,Na2S2O8中含有1个“—O—O—”,“—O—O—”体现强氧化性,故D说法错误。
6.A 向CuSO4溶液中加入足量NaOH溶液得到Cu(OH)2悬浊液,向其中加入葡萄糖溶液,加热得到红色Cu2O沉淀,A正确;H2S气体具有可燃性,在少量氧气中燃烧得到H2O和S单质,B错误;铁在氯气中燃烧,产物只有FeCl3,C错误;Na2SO3具有还原性,在空气中加热蒸发Na2SO3溶液,Na2SO3易被O2氧化为Na2SO4,而无法获得Na2SO3固体,D错误。
7.B 根据工艺流程逆向分析可知,以二氧化硫和纯碱为原料,得到的结晶成分为NaHSO3,则母液为饱和NaHSO3和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,涉及反应:H2SO3+2Na2CO3===Na2SO3+2NaHCO3,NaHSO3+Na2CO3===Na2SO3+NaHCO3,所以调节pH为8进行中和后得到Na2SO3和NaHCO3,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应:Na2SO3+SO2+H2O===2NaHSO3↓,SO2+NaHCO3===CO2+NaHSO3↓,此时会析出大量NaHSO3晶体,经过离心分离,将得到的湿料再进行气流干燥,最终得到NaHSO3产品,据此分析解答。根据上述分析可知,吸收过程中有二氧化碳生成,A正确;结晶后母液中含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,没有NaHCO3,B错误;NaHSO3高温时易分解变质,所以气流干燥过程中温度不宜过高,C正确;结合上述分析可知,中和后溶液中含Na2SO3和NaHCO3,D正确。
8.C 酸雨的含硫成分有硫酸和亚硫酸,故A错误;芒硝是Na2SO4·10H2O,失水后生成Na2SO4,体现了浓硫酸的吸水性,故B错误;黄铁矿燃烧产生的尾气是SO2,SO2与空气混合后与碳酸钙反应生成硫酸钙,可用来制备石膏,故C正确;SO2与H2S的反应为2H2S+SO2===3S↓+2H2O,氧化剂是SO2,还原剂是H2S,氧化剂与还原剂的物质的量之比为1∶2,故D错误。
9.B 甲为二氧化硫产生装置,乙为二氧化硫与硝酸钠的反应装置,反应生成的NO进入丙,但是整个过程没有明显现象,因此可通过向丙中注入氧气,看是否有红棕色气体生成,来确定乙中是否发生反应。甲为二氧化硫的产生装置,方程式为H2SO4+Na2SO3===Na2SO4+SO2↑+H2O,A正确;由于生成的NO为无色气体,故该反应没有明显现象,B错误;注入氧气,产生红棕色气体,说明装置丙中有NO,进一步证明乙中发生了反应,C正确;丁为尾气处理装置,并且防止空气进入装置丙,D正确。
10.A SO2与Fe3+发生氧化还原反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不变红色;若二氧化硫不足,则溶液中有Fe3+,加入KSCN溶液,溶液变红色,A正确;离子方程式中电荷不守恒,B错误;溶液A转化为溶液B后溶液酸性增强,C错误;FeO与H+反应生成Fe2+,故溶液C不能转化为溶液A,D错误。
11.D NaHSO3和碳酸钠反应生成亚硫酸钠,亚硫酸钠和硫反应生成硫代硫酸钠,硫代硫酸钠和溴化银反应生成Na3[Ag(S2O3)2]。根据给出的电离平衡常数大小关系可知,HS的酸性弱于碳酸,所以选项中的反应不能发生,正确的离子方程式为C+HS===S+HC,故A错误;向Na2S2O3溶液中加入稀硫酸,生成硫、二氧化硫和水:S2+2H+===S↓+SO2↑+H2O,故B错误;反应③是硫代硫酸钠和溴化银反应生成Na3[Ag(S2O3)2],AgBr不溶于水,不能写成离子形式,故C错误;利用Na2S2O3滴定碘单质生成Na2S4O6,碘单质被还原为I-,故D正确。
12.B 用Na2SO3溶液吸收SO2废气过程中,SO2和Na2SO3溶液反应生成NaHSO3,离子方程式为S+SO2+H2O===2HS,故A正确;HBr是强酸,在离子方程式中要拆分,故B错误;CaCO3的溶解度小于CaSO4,用Na2CO3溶液处理锅炉水垢中的CaSO4,CaSO4可以转化为CaCO3,离子方程式为CaSO4(s)+C(aq)CaCO3(s)+S(aq),故C正确;S与Na2SO3溶液反应生成Na2S2O3,离子方程式为S+SS2,故D正确。
13.A 在该反应过程中,+1价铜发生歧化反应生成+2价铜离子和单质铜,硫酸中元素化合价未发生变化,不能表现稀硫酸的氧化性,A正确;硫酸铁中含有S,S和Ba2+反应生成BaSO4白色沉淀,不能体现二氧化硫的还原性,B错误;硫化铜难溶于水和稀硫酸,故CuSO4和硫化氢反应可以生成硫化铜和硫酸,不能证明酸性的强弱,C错误;二氧化硫不能漂白指示剂,D错误。
14.答案 (1)H (2)ACD (3)SOCl2+4NH3===SO(NH2)2+2NH4Cl (4)S4N4或N4S4 (5)取少量反应液滴加稀盐酸并加热,若产生的气体使品红溶液褪色,则有S;另取少量反应液先滴加稀硝酸酸化,再滴加硝酸银溶液,若产生白色沉淀,则有Cl-
解析 (2)烟道气中的SO2具有还原性,其含量可用一定体积、浓度的酸性高锰酸钾溶液测定,A正确;S2Cl2是橡胶硫化剂,橡胶硫化程度越高,弹性越差,B错误;SOCl2可与H2O发生反应,能作为AlCl3·6H2O的脱水剂,C正确;中心原子P价层电子对数:4+×(4-4×1)=4,无孤电子对,空间结构为正四面体形,D正确;S2Cl2正负电荷中心不重合,为极性分子,E错误。(4)S2Cl2与NH3反应除生成M外,同时有淡黄色固体S生成,则M为S4N4或N4S4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
