2025浙江专版新教材化学高考第一轮基础练--作业25化学反应速率(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业25化学反应速率(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 485.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业25化学反应速率
A组 基础达标
1.(2023·浙江北仑中学段考)NH3是具有刺激性气味的气体,密度比空气小,易液化成液氨,且它极易溶于水形成氨水,工业上常用氨气制备硝酸。在2.0 L恒温恒容密闭容器中充入2.0 mol N2和6.0 mol H2,加入催化剂发生反应:N2(g)+3H2(g)2NH3(g),N2、H2的物质的量随时间的变化如图所示。下列有关说法正确的是( )
A.t1 min时,N2的生成速率等于N2的消耗速率
B.反应达到平衡时N2的转化率为40%
C.0~t2 min内,v(NH3)= mol·L-1·min-1
D.反应中通入足量的N2,可使H2完全转化为NH3
2.反应A(g)4B(g)+C(g)在100 ℃和T ℃时,A的物质的量浓度[单位:(mol·L-1)]随时间变化的有关实验数据见下表:
时间/min 0 1 2 3 4 5
100 ℃ 0.80 0.55 0.35 0.20 0.15 0.15
T ℃ 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述正确的是( )
A.在100 ℃时,2 min内用B表示的化学反应速率为0.112 5 mol·L-1·min-1
B.T ℃下,3 min时反应刚好达到平衡状态
C.根据上表内A浓度变化,可知浓度越大,反应速率越大
D.从表中可以看出T<100
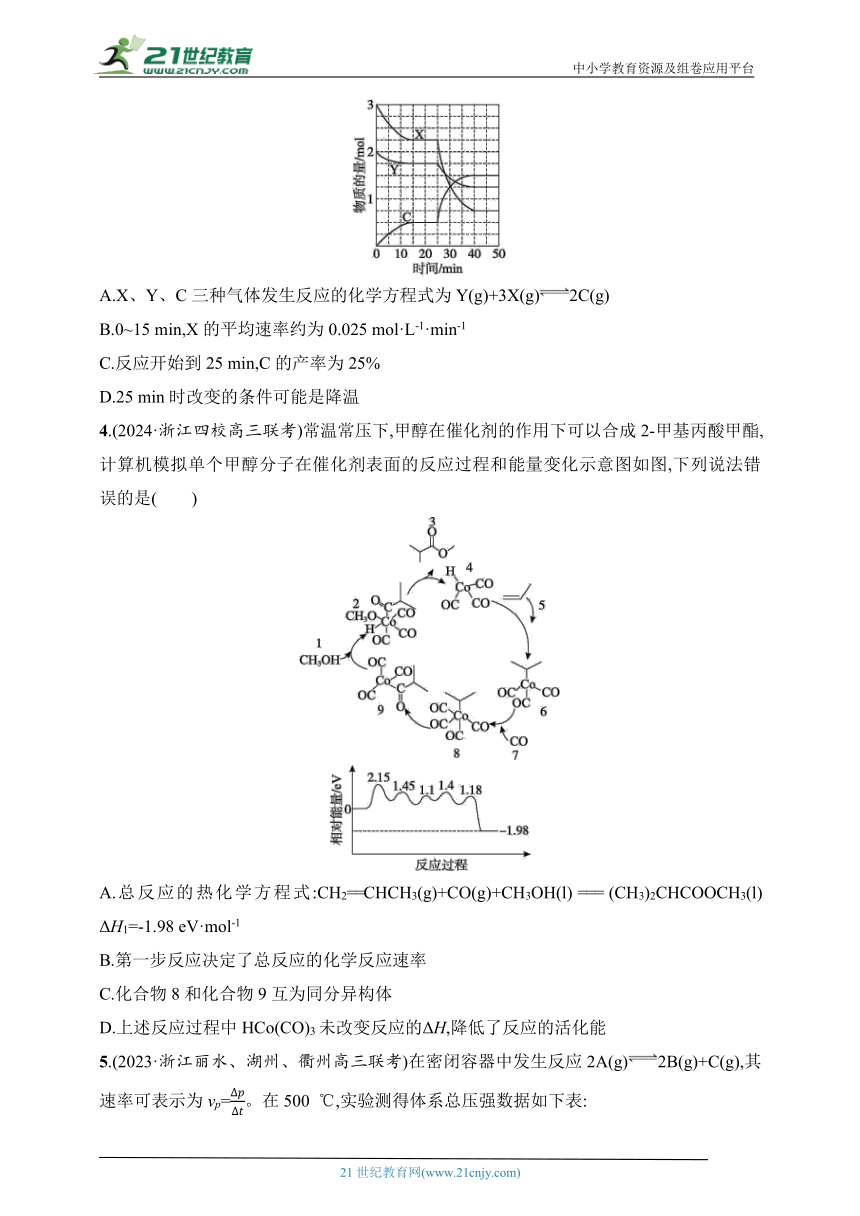
3.在一定条件下的2 L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法一定不正确的是( )
A.X、Y、C三种气体发生反应的化学方程式为Y(g)+3X(g)2C(g)
B.0~15 min,X的平均速率约为0.025 mol·L-1·min-1
C.反应开始到25 min,C的产率为25%
D.25 min时改变的条件可能是降温
4.(2024·浙江四校高三联考)常温常压下,甲醇在催化剂的作用下可以合成2-甲基丙酸甲酯,计算机模拟单个甲醇分子在催化剂表面的反应过程和能量变化示意图如图,下列说法错误的是( )
A.总反应的热化学方程式:CH2==CHCH3(g)+CO(g)+CH3OH(l) === (CH3)2CHCOOCH3(l) ΔH1=-1.98 eV·mol-1
B.第一步反应决定了总反应的化学反应速率
C.化合物8和化合物9互为同分异构体
D.上述反应过程中HCo(CO)3未改变反应的ΔH,降低了反应的活化能
5.(2023·浙江丽水、湖州、衢州高三联考)在密闭容器中发生反应2A(g)2B(g)+C(g),其速率可表示为vp=。在500 ℃,实验测得体系总压强数据如下表:
t/min 0 50 100 150 200
p总/kPa 200 250 275 x 293.75
下列说法正确的是( )
A.0~50 min,生成B的平均速率为1 kPa·min-1
B.第80 min的瞬时速率小于第120 min的瞬时速率
C.推测上表中的x为287.5
D.反应到达平衡时2v正(A)=v逆(C)
B组 综合提升
6.(2024·浙江绍兴高三一模)已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )
A.该反应的ΔH=(E2-E1) kJ·mol-1
B.正反应活化能E1等于反应物的键能之和
C.由图可知升温对NO2(g)+CO(g)NO(g)+CO2(g)的逆反应速率影响更大
D.恒温条件下,缩小容器容积,平衡不移动,所以正、逆反应速率均不变
7.(2023·浙江温州高三二模)工业上利用CO2和H2制备HCOOH,相关化学键的键能如下表所示:
键 C==O H—H O—H C—H C—O
键能/(kJ·mol-1) 745 436 462.8 413.4 351
已知:①温度为T1 ℃时,CO2(g)+H2(g)HCOOH(g) K=2;
②实验测得v(正)=k正c(CO2)·c(H2),v(逆)=k逆c(HCOOH),k正、k逆为速率常数。
下列说法不正确的是( )
A.反应CO2(g)+H2(g)HCOOH(g)的ΔH<0
B.T1 ℃时,密闭容器充入浓度均为1 mol·L-1的CO2(g)、H2(g),反应至平衡,则HCOOH(g)体积分数为
C.T1 ℃时,k逆=0.5k正
D.若温度为T2 ℃时,k正=2.1k逆,则T2 ℃>T1 ℃
8.某温度下,将A和B各0.15 mol充入10 L恒容密闭容器中,发生反应2A(g)+B(g)2X(g) ΔH<0,反应过程中,B的物质的量n(B)随时间t的变化如图所示。下列说法正确的是( )
A.当v(A)=v(X)时,反应达到平衡
B.前2 min的平均速率v(X)=1.5×10-3 mol·L-1·min-1
C.9 min时,改变的反应条件为降温或加催化剂
D.若起始充入A和B各0.30 mol,平衡时c(B)<0.02 mol·L-1
9.某反应分两步进行,其能量变化如图所示。下列说法正确的是( )
A.反应①的活化能E1=-177 kJ·mol-1
B.该反应过程中,反应速率由反应②决定
C.总反应的热化学方程式为C2H6(g)+CO2(g)C2H4(g)+CO(g)+H2O(g) ΔH=+346 kJ·mol-1
D.增大C2H6(g)的浓度,可以增大活化分子百分数,提高化学反应速率
10.(2023·浙江6月选考)一定条件下,1-苯基丙炔(Ph—C≡C—CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
作业25 化学反应速率
1.B t1 min时,反应未达到平衡,N2的生成速率不等于N2的消耗速率,A错误;当氮气和氢气以化学计量数比进行投料时,相同时间时两者的转化率相同,由图可知,反应达到平衡时H2的转化率为×100%=40%,故N2的转化率也为40%,B正确;0~t2 min内,H2物质的量的变化量为2.4 mol,则NH3物质的量的变化量为1.6 mol,故v(NH3)= mol·L-1·min-1,C错误;该反应为可逆反应,反应中通入足量的N2,H2也不可能完全转化为NH3,D错误。
2.C 在100 ℃时,2 min内A的物质的量浓度的变化量为0.80 mol·L-1-0.35 mol·L-1=0.45 mol·L-1,根据方程式可知B的物质的量浓度的变化量为0.45 mol·L-1×4=1.8 mol·L-1,则用B表示的化学反应速率为=0.9 mol·L-1·min-1,A错误;T ℃下,3 min及以后A的物质的量浓度均不发生改变,说明反应达到平衡,但不能说明3 min时反应刚好达到平衡,可能在2~3 min之间反应就已经达到平衡,B错误;根据表格数据分析,单位时间内A的浓度减少量越来越小,说明浓度越大,反应速率越大,C正确;由表格数据可知,T ℃下,反应先达到平衡,说明T ℃下反应速率更快,则T>100,D错误。
3.D 由图可知X、Y物质的量减少,X、Y是反应物,C物质的量增加,C是生成物,X、Y、C在相同时间物质的量的变化量之比为3∶1∶2,所以反应方程式是Y(g)+3X(g)2C(g),故A正确;0~15 min,X消耗的物质的量为0.75 mol,体积为2 L,平均速率约为=0.025 mol·L-1·min-1,故B正确;0~25 min生成C的物质的量为0.5 mol,C的理论产量为2 mol,则C的产率为25%,故C正确;25 min时,改变条件后三种气体反应速率都加快,不可能是降温,故D错误。
4.A 图像给出的是单个分子参与反应时的能量变化,总反应的热化学方程式为CH2==CHCH3(g)+CO(g)+CH3OH(l) === (CH3)2CHCOOCH3(l) ΔH1=-1.98NA eV·mol-1,故A错误;第一步反应的能垒最高,所以第一步反应的化学反应速率最慢,是决速步,故B正确;化合物8和化合物9的分子式相同而结构不同,故C正确;HCo(CO)3为反应的催化剂,故HCo(CO)3未改变反应的ΔH,降低了反应的活化能,故D正确。
5.C 等温等容条件下,气体的压强之比等于物质的量之比,由表格数据可知,0~50 min,Δp=50 kPa,结合反应2A(g)2B(g)+C(g),ΔpB=2Δp=100 kPa,则生成B的平均速率为=2 kPa·min-1,故A错误;由数据可知,0~50 min,Δp=50 kPa,50~100 min,Δp=25 kPa,而100~200 min,Δp=18.75 kPa,速率越来越慢,第80 min的瞬时速率大于第120 min的瞬时速率,故B错误;第一个50 min,Δp=50 kPa,第二个50 min,Δp=25 kPa,如果第三个50 min,Δp=12.5 kPa,此时x为275+12.5=287.5,第四个50 min,Δp=6.25 kPa,200 min时287.5+6.25=293.75,假设合理,则推测出x为287.5,故C正确;达到平衡时v正=v逆,用不同物质表示同一反应的反应速率时,速率之比等于化学计量数之比,则反应到达平衡时v正(A)=2v逆(C),故D错误。
6.C 焓变ΔH=正反应的活化能-逆反应的活化能,则题中反应的ΔH=-(E2-E1) kJ·mol-1,A错误;使普通分子变成活化分子所需提供的最低限度的能量叫活化能,由图知正反应活化能E1为过渡态与分子平均能量之差,而反应物的键能之和是气体反应物分子的化学键断裂形成气态原子时所吸收的总能量,由图知,过渡态并不是原子状态,则二者不相等,B错误;升温对吸热方向的速率影响更大,由图可知NO2(g)+CO(g)NO(g)+CO2(g)的正反应方向放热,则升温对其逆反应速率影响更大,C正确;该反应气体分子总数不变,则恒温条件下,缩小容器容积,平衡不移动,但所有气体浓度增大,所以正、逆反应速率均增大,D错误。
7.D 由反应热=反应物的键能之和-生成物的键能之和可知,ΔH=(745 kJ·mol-1×2+436 kJ·mol-1)-(745 kJ·mol-1+462.8 kJ·mol-1+413.4 kJ·mol-1+351 kJ·mol-1)<0,故A正确;设平衡时生成甲酸的浓度为a mol·L-1,由题意可建立如下三段式:
CO2(g)+H2(g)HCOOH(g)
起始/(mol·L-1) 1 1 0
变化/(mol·L-1) a a a
平衡/(mol·L-1) 1-a 1-a a
由平衡常数可得:=2,解得a=0.5,甲酸的体积分数等于物质的量分数,为,故B正确;T1 ℃反应达到平衡时,正、逆反应速率相等,则k正c(CO2)·c(H2)=k逆c(HCOOH),=K,T1 ℃时,反应的平衡常数K==2,则k逆=0.5k正,故C正确;该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,由温度为T2 ℃时,k正=2.1k逆可知,反应的平衡常数K'==2.1>K,则反应温度T2 ℃8.D 同一化学反应用不同物质表示速率,速率之比等于方程式中各物质的化学计量数之比,反应过程中一定有v(A)=v(X),不能由此判断反应是否达到平衡,A错误;前2 min的平均速率v(B)==1.5×10-3 mol·L-1·min-1,v(X)=2v(B)=2×1.5×10-3 mol·L-1·min-1=3×10-3 mol·L-1·min-1,B错误;由图像可知7~9 min反应达平衡状态,加催化剂平衡不移动,B的物质的量不会改变,C错误;由图像可知,某温度下,将A和B各0.15 mol充入10 L恒容密闭容器中,达平衡,B的浓度c(B)==0.01 mol·L-1,在恒温恒容时,投料变为原来2倍,若平衡转化率相同,达平衡时c(B)=0.02 mol·L-1,但是恒温恒容条件下,相同比例相同倍数地增加反应物浓度,其平衡移动结果相当于加压,B的转化率增大,所以c(B)<0.02 mol·L-1,D正确。
9.B 由图可知,活化能E1=-300 kJ·mol-1-(-477 kJ·mol-1)=+177 kJ·mol-1,A错误;慢反应控制总反应速率,反应②的活化能E2=+210 kJ·mol-1>E1,故反应速率由反应②决定,B正确;总反应的ΔH=-300 kJ·mol-1-(-477 kJ·mol-1)=+177 kJ·mol-1,热化学方程式为C2H6(g)+CO2(g)C2H4(g)+CO(g)+H2O(g) ΔH=+177 kJ·mol-1,C错误;增大反应物浓度,可增大活化分子的数目,但活化能不变,活化分子百分数不变,D错误。
10.C 根据盖斯定律,反应Ⅰ和反应Ⅲ的焓变总和等于反应Ⅱ的焓变,即ΔH2=ΔH1+ΔH3,由已知条件可知,反应Ⅰ和反应Ⅲ为放热反应,选项A正确。由题图可知,开始反应时,几乎只生成产物Ⅰ,即反应Ⅰ速率大于反应Ⅱ,故反应Ⅰ的活化能小于反应Ⅱ,选项B正确。反应温度不变,反应的平衡常数不变,产物Ⅱ和产物Ⅰ的比例就不变,增加HCl浓度不能增加两者比值,选项C错误。由图可知,反应Ⅰ速率较快,20 min时占比几乎达到100%,及时分离产物Ⅰ,可以防止其转化为产物Ⅱ,选项D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业25化学反应速率
A组 基础达标
1.(2023·浙江北仑中学段考)NH3是具有刺激性气味的气体,密度比空气小,易液化成液氨,且它极易溶于水形成氨水,工业上常用氨气制备硝酸。在2.0 L恒温恒容密闭容器中充入2.0 mol N2和6.0 mol H2,加入催化剂发生反应:N2(g)+3H2(g)2NH3(g),N2、H2的物质的量随时间的变化如图所示。下列有关说法正确的是( )
A.t1 min时,N2的生成速率等于N2的消耗速率
B.反应达到平衡时N2的转化率为40%
C.0~t2 min内,v(NH3)= mol·L-1·min-1
D.反应中通入足量的N2,可使H2完全转化为NH3
2.反应A(g)4B(g)+C(g)在100 ℃和T ℃时,A的物质的量浓度[单位:(mol·L-1)]随时间变化的有关实验数据见下表:
时间/min 0 1 2 3 4 5
100 ℃ 0.80 0.55 0.35 0.20 0.15 0.15
T ℃ 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述正确的是( )
A.在100 ℃时,2 min内用B表示的化学反应速率为0.112 5 mol·L-1·min-1
B.T ℃下,3 min时反应刚好达到平衡状态
C.根据上表内A浓度变化,可知浓度越大,反应速率越大
D.从表中可以看出T<100
3.在一定条件下的2 L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法一定不正确的是( )
A.X、Y、C三种气体发生反应的化学方程式为Y(g)+3X(g)2C(g)
B.0~15 min,X的平均速率约为0.025 mol·L-1·min-1
C.反应开始到25 min,C的产率为25%
D.25 min时改变的条件可能是降温
4.(2024·浙江四校高三联考)常温常压下,甲醇在催化剂的作用下可以合成2-甲基丙酸甲酯,计算机模拟单个甲醇分子在催化剂表面的反应过程和能量变化示意图如图,下列说法错误的是( )
A.总反应的热化学方程式:CH2==CHCH3(g)+CO(g)+CH3OH(l) === (CH3)2CHCOOCH3(l) ΔH1=-1.98 eV·mol-1
B.第一步反应决定了总反应的化学反应速率
C.化合物8和化合物9互为同分异构体
D.上述反应过程中HCo(CO)3未改变反应的ΔH,降低了反应的活化能
5.(2023·浙江丽水、湖州、衢州高三联考)在密闭容器中发生反应2A(g)2B(g)+C(g),其速率可表示为vp=。在500 ℃,实验测得体系总压强数据如下表:
t/min 0 50 100 150 200
p总/kPa 200 250 275 x 293.75
下列说法正确的是( )
A.0~50 min,生成B的平均速率为1 kPa·min-1
B.第80 min的瞬时速率小于第120 min的瞬时速率
C.推测上表中的x为287.5
D.反应到达平衡时2v正(A)=v逆(C)
B组 综合提升
6.(2024·浙江绍兴高三一模)已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )
A.该反应的ΔH=(E2-E1) kJ·mol-1
B.正反应活化能E1等于反应物的键能之和
C.由图可知升温对NO2(g)+CO(g)NO(g)+CO2(g)的逆反应速率影响更大
D.恒温条件下,缩小容器容积,平衡不移动,所以正、逆反应速率均不变
7.(2023·浙江温州高三二模)工业上利用CO2和H2制备HCOOH,相关化学键的键能如下表所示:
键 C==O H—H O—H C—H C—O
键能/(kJ·mol-1) 745 436 462.8 413.4 351
已知:①温度为T1 ℃时,CO2(g)+H2(g)HCOOH(g) K=2;
②实验测得v(正)=k正c(CO2)·c(H2),v(逆)=k逆c(HCOOH),k正、k逆为速率常数。
下列说法不正确的是( )
A.反应CO2(g)+H2(g)HCOOH(g)的ΔH<0
B.T1 ℃时,密闭容器充入浓度均为1 mol·L-1的CO2(g)、H2(g),反应至平衡,则HCOOH(g)体积分数为
C.T1 ℃时,k逆=0.5k正
D.若温度为T2 ℃时,k正=2.1k逆,则T2 ℃>T1 ℃
8.某温度下,将A和B各0.15 mol充入10 L恒容密闭容器中,发生反应2A(g)+B(g)2X(g) ΔH<0,反应过程中,B的物质的量n(B)随时间t的变化如图所示。下列说法正确的是( )
A.当v(A)=v(X)时,反应达到平衡
B.前2 min的平均速率v(X)=1.5×10-3 mol·L-1·min-1
C.9 min时,改变的反应条件为降温或加催化剂
D.若起始充入A和B各0.30 mol,平衡时c(B)<0.02 mol·L-1
9.某反应分两步进行,其能量变化如图所示。下列说法正确的是( )
A.反应①的活化能E1=-177 kJ·mol-1
B.该反应过程中,反应速率由反应②决定
C.总反应的热化学方程式为C2H6(g)+CO2(g)C2H4(g)+CO(g)+H2O(g) ΔH=+346 kJ·mol-1
D.增大C2H6(g)的浓度,可以增大活化分子百分数,提高化学反应速率
10.(2023·浙江6月选考)一定条件下,1-苯基丙炔(Ph—C≡C—CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
作业25 化学反应速率
1.B t1 min时,反应未达到平衡,N2的生成速率不等于N2的消耗速率,A错误;当氮气和氢气以化学计量数比进行投料时,相同时间时两者的转化率相同,由图可知,反应达到平衡时H2的转化率为×100%=40%,故N2的转化率也为40%,B正确;0~t2 min内,H2物质的量的变化量为2.4 mol,则NH3物质的量的变化量为1.6 mol,故v(NH3)= mol·L-1·min-1,C错误;该反应为可逆反应,反应中通入足量的N2,H2也不可能完全转化为NH3,D错误。
2.C 在100 ℃时,2 min内A的物质的量浓度的变化量为0.80 mol·L-1-0.35 mol·L-1=0.45 mol·L-1,根据方程式可知B的物质的量浓度的变化量为0.45 mol·L-1×4=1.8 mol·L-1,则用B表示的化学反应速率为=0.9 mol·L-1·min-1,A错误;T ℃下,3 min及以后A的物质的量浓度均不发生改变,说明反应达到平衡,但不能说明3 min时反应刚好达到平衡,可能在2~3 min之间反应就已经达到平衡,B错误;根据表格数据分析,单位时间内A的浓度减少量越来越小,说明浓度越大,反应速率越大,C正确;由表格数据可知,T ℃下,反应先达到平衡,说明T ℃下反应速率更快,则T>100,D错误。
3.D 由图可知X、Y物质的量减少,X、Y是反应物,C物质的量增加,C是生成物,X、Y、C在相同时间物质的量的变化量之比为3∶1∶2,所以反应方程式是Y(g)+3X(g)2C(g),故A正确;0~15 min,X消耗的物质的量为0.75 mol,体积为2 L,平均速率约为=0.025 mol·L-1·min-1,故B正确;0~25 min生成C的物质的量为0.5 mol,C的理论产量为2 mol,则C的产率为25%,故C正确;25 min时,改变条件后三种气体反应速率都加快,不可能是降温,故D错误。
4.A 图像给出的是单个分子参与反应时的能量变化,总反应的热化学方程式为CH2==CHCH3(g)+CO(g)+CH3OH(l) === (CH3)2CHCOOCH3(l) ΔH1=-1.98NA eV·mol-1,故A错误;第一步反应的能垒最高,所以第一步反应的化学反应速率最慢,是决速步,故B正确;化合物8和化合物9的分子式相同而结构不同,故C正确;HCo(CO)3为反应的催化剂,故HCo(CO)3未改变反应的ΔH,降低了反应的活化能,故D正确。
5.C 等温等容条件下,气体的压强之比等于物质的量之比,由表格数据可知,0~50 min,Δp=50 kPa,结合反应2A(g)2B(g)+C(g),ΔpB=2Δp=100 kPa,则生成B的平均速率为=2 kPa·min-1,故A错误;由数据可知,0~50 min,Δp=50 kPa,50~100 min,Δp=25 kPa,而100~200 min,Δp=18.75 kPa,速率越来越慢,第80 min的瞬时速率大于第120 min的瞬时速率,故B错误;第一个50 min,Δp=50 kPa,第二个50 min,Δp=25 kPa,如果第三个50 min,Δp=12.5 kPa,此时x为275+12.5=287.5,第四个50 min,Δp=6.25 kPa,200 min时287.5+6.25=293.75,假设合理,则推测出x为287.5,故C正确;达到平衡时v正=v逆,用不同物质表示同一反应的反应速率时,速率之比等于化学计量数之比,则反应到达平衡时v正(A)=2v逆(C),故D错误。
6.C 焓变ΔH=正反应的活化能-逆反应的活化能,则题中反应的ΔH=-(E2-E1) kJ·mol-1,A错误;使普通分子变成活化分子所需提供的最低限度的能量叫活化能,由图知正反应活化能E1为过渡态与分子平均能量之差,而反应物的键能之和是气体反应物分子的化学键断裂形成气态原子时所吸收的总能量,由图知,过渡态并不是原子状态,则二者不相等,B错误;升温对吸热方向的速率影响更大,由图可知NO2(g)+CO(g)NO(g)+CO2(g)的正反应方向放热,则升温对其逆反应速率影响更大,C正确;该反应气体分子总数不变,则恒温条件下,缩小容器容积,平衡不移动,但所有气体浓度增大,所以正、逆反应速率均增大,D错误。
7.D 由反应热=反应物的键能之和-生成物的键能之和可知,ΔH=(745 kJ·mol-1×2+436 kJ·mol-1)-(745 kJ·mol-1+462.8 kJ·mol-1+413.4 kJ·mol-1+351 kJ·mol-1)<0,故A正确;设平衡时生成甲酸的浓度为a mol·L-1,由题意可建立如下三段式:
CO2(g)+H2(g)HCOOH(g)
起始/(mol·L-1) 1 1 0
变化/(mol·L-1) a a a
平衡/(mol·L-1) 1-a 1-a a
由平衡常数可得:=2,解得a=0.5,甲酸的体积分数等于物质的量分数,为,故B正确;T1 ℃反应达到平衡时,正、逆反应速率相等,则k正c(CO2)·c(H2)=k逆c(HCOOH),=K,T1 ℃时,反应的平衡常数K==2,则k逆=0.5k正,故C正确;该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,由温度为T2 ℃时,k正=2.1k逆可知,反应的平衡常数K'==2.1>K,则反应温度T2 ℃
9.B 由图可知,活化能E1=-300 kJ·mol-1-(-477 kJ·mol-1)=+177 kJ·mol-1,A错误;慢反应控制总反应速率,反应②的活化能E2=+210 kJ·mol-1>E1,故反应速率由反应②决定,B正确;总反应的ΔH=-300 kJ·mol-1-(-477 kJ·mol-1)=+177 kJ·mol-1,热化学方程式为C2H6(g)+CO2(g)C2H4(g)+CO(g)+H2O(g) ΔH=+177 kJ·mol-1,C错误;增大反应物浓度,可增大活化分子的数目,但活化能不变,活化分子百分数不变,D错误。
10.C 根据盖斯定律,反应Ⅰ和反应Ⅲ的焓变总和等于反应Ⅱ的焓变,即ΔH2=ΔH1+ΔH3,由已知条件可知,反应Ⅰ和反应Ⅲ为放热反应,选项A正确。由题图可知,开始反应时,几乎只生成产物Ⅰ,即反应Ⅰ速率大于反应Ⅱ,故反应Ⅰ的活化能小于反应Ⅱ,选项B正确。反应温度不变,反应的平衡常数不变,产物Ⅱ和产物Ⅰ的比例就不变,增加HCl浓度不能增加两者比值,选项C错误。由图可知,反应Ⅰ速率较快,20 min时占比几乎达到100%,及时分离产物Ⅰ,可以防止其转化为产物Ⅱ,选项D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
