2025浙江专版新教材化学高考第一轮基础练--作业28影响化学平衡的因素(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业28影响化学平衡的因素(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 427.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 08:28:58 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业28影响化学平衡的因素
A组 基础达标
1.(教材选择性必修1第二章复习与提高改编)一定条件下,将三组CO(g)和H2O(g)分别通入容积均为2 L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
实验 组 起始时/mol 平衡时/mol 达到平衡 所需时间/min
CO H2O CO2
1 650 4 2 1.6 5
2 900 2 1 0.4 3
3 2 1 0.4 0.1
下列说法错误的是( )
A.实验1中,前5 min CO的平均速率为0.16 mol·L-1·min-1
B.与实验2相比,实验3改变的条件可能是温度
C.平衡常数:实验1>实验2
D.CO平衡转化率:实验1>实验2
2.(2023·浙江萧山中学段考)工业上制备Ti,采用碳氯化法将TiO2转化成TiCl4。在1 000 ℃时发生如下反应:
①TiO2(s)+2Cl2(g)+2C(s) ===TiCl4(g)+2CO(g)
ΔH1=-51.0 kJ·mol-1 K1=1.6×1014
②2CO(g) ===CO2(g)+C(s) ΔH2=-172.5 kJ·mol-1 K2=1.0×10-4
③2C(s)+O2(g) ===2CO(g) ΔH3=-223.0 kJ·mol-1 K3=2.5×1018。
在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行碳氯化,平衡时体系中CO2、CO、TiCl4和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是( )
A.1 000 ℃时,反应TiO2(s)+2Cl2(g) ===TiCl4(g)+O2(g)的平衡常数K=6.4×10-5
B.曲线Ⅲ表示平衡时CO2的物质的量分数随温度的变化
C.高于600 ℃,升高温度,主要对反应②的平衡产生影响
D.为保证TiCl4的平衡产率,选择反应温度应高于1 000 ℃
3.(2024·浙江杭州四中检测)工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=a kJ·mol-1。在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入容积为1 L的密闭容器中,测得n(CH4)(单位:mol)随时间变化数据如下表:
温度 0 min 10 min 20 min 40 min 50 min
T1 0.50 0.35 0.25 0.10 0.10
T2 0.50 0.30 0.18 … 0.15
下列说法错误的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1C.平衡常数:K(T1)D.a<0
4.(2023·北京卷)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
5.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
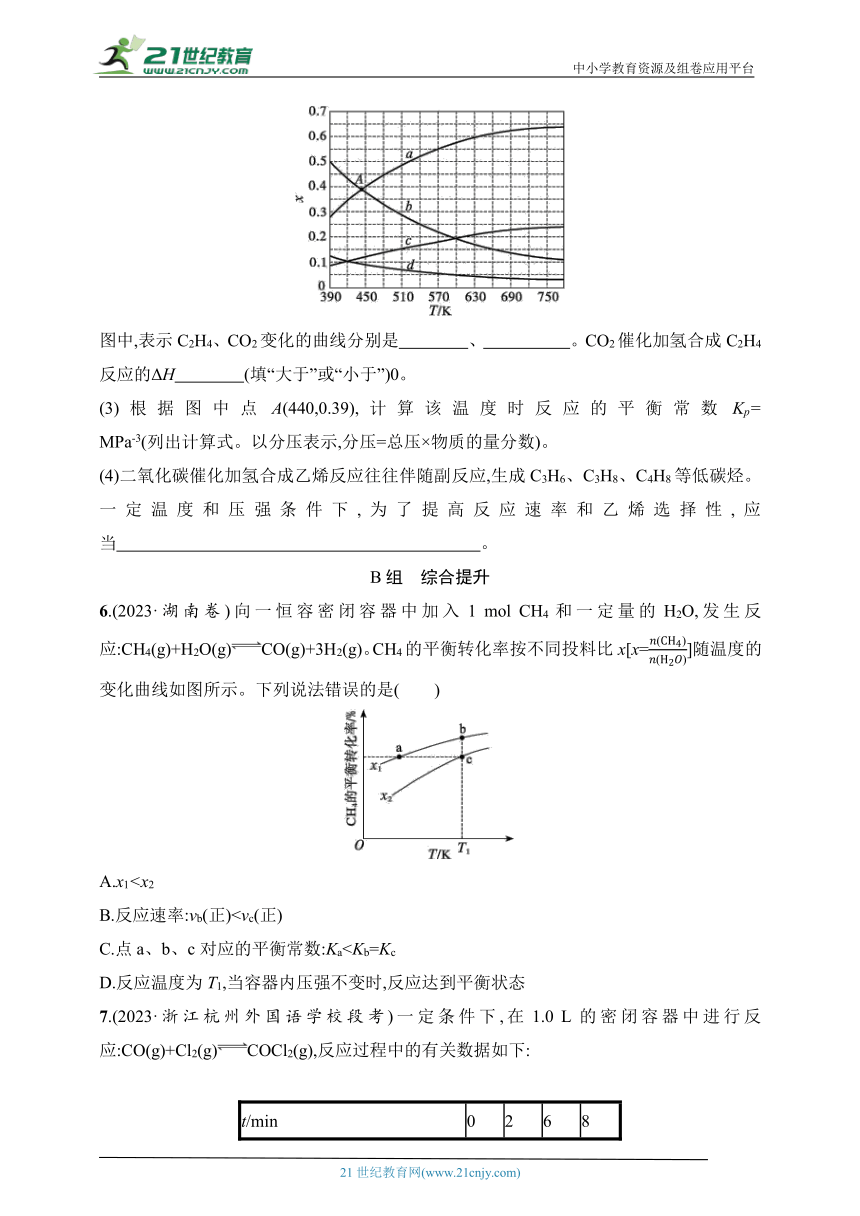
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH (填“大于”或“小于”)0。
(3)根据图中点A(440,0.39),计算该温度时反应的平衡常数Kp= MPa-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
B组 综合提升
6.(2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x[x=]随温度的变化曲线如图所示。下列说法错误的是( )
A.x1B.反应速率:vb(正)C.点a、b、c对应的平衡常数:KaD.反应温度为T1,当容器内压强不变时,反应达到平衡状态
7.(2023·浙江杭州外国语学校段考)一定条件下,在1.0 L的密闭容器中进行反应:CO(g)+Cl2(g)COCl2(g),反应过程中的有关数据如下:
t/min 0 2 6 8
c(Cl2)/(mol·L-1) 2.4 1.6 0.6
c(CO)/(mol·L-1) 2 0.2
c(COCl2)/(mol·L-1) 0
下列说法正确的是( )
A.0~2 min内,用CO表示的化学反应速率为0.3 mol·L-1·min-1
B.其他条件不变,升高温度,平衡时c(COCl2)=1.5 mol·L-1,则该反应低温时能自发进行
C.若保持温度不变,第8 min向体系中加入三种物质各1 mol,则平衡向逆反应方向移动
D.若保持温度不变,在第8 min再充入1.0 mol COCl2(g),达到新平衡时COCl2的体积分数小于原平衡COCl2的体积分数
8.(2023·浙江湖州菱湖中学月考)恒容密闭容器中,n mol CO2与3n mol H2在不同温度下发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,达到平衡时c(H2)9.(2024·浙江金华十校高三一模)科学家开发新型催化剂实现了N2O对CH3CH==CHCH3(2-丁烯)的气相选择性氧化,其反应为:
反应Ⅰ:CH3CH==CHCH3(g)+N2O(g)CH3CH2COCH3(g)+N2(g) ΔH1=-398 kJ·mol-1
反应Ⅱ:CH3CH==CHCH3(g)+2N2O(g)2CH3CHO(g)+2N2(g) ΔH2
请回答:
一定温度下,向恒压密闭容器中充入
CH3CH==CHCH3(g)和N2O(g),发生反应Ⅰ和反应Ⅱ,测得平衡体系中N2的体积分数与起始投料比[]的关系如图所示。下列有关说法正确的是 (填字母)。
A.混合气体中N2的体积分数不再变化说明反应已达到平衡状态
B.达到平衡时,体系中N2的体积分数总是小于50%
C.M、N、Q三点,N2O(g)的转化率大小:N>M>Q
D.从N到Q,N2百分含量下降,是因为反应Ⅰ逆向移动
作业28 影响化学平衡的因素
1.B 实验1中,参加反应的一氧化碳的物质的量为1.6 mol,前5 min用一氧化碳表示的平均速率为1.6 mol÷2 L÷5 min=0.16 mol·L-1·min-1,A正确;实验3与实验2相比,起始量、平衡量均相等,但达到平衡所用的时间实验3短,说明实验3的反应速率快,因此改变的条件为使用了催化剂,B错误;实验1列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始量/(mol·L-1) 2 1 0 0
转化量/(mol·L-1) 0.8 0.8 0.8 0.8
平衡量/(mol·L-1) 1.2 0.2 0.8 0.8
平衡常数K=≈2.67,CO转化率:×100%=40%;
实验2列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始量/(mol·L-1) 1 0.5 0 0
转化量/(mol·L-1) 0.2 0.2 0.2 0.2
平衡量/(mol·L-1) 0.8 0.3 0.2 0.2
平衡常数K=≈0.17,CO转化率:×100%=20%;平衡常数:实验1>实验2,C正确;CO平衡转化率:实验1>实验2,D正确。
2.D 由题图可知,TiCl4的物质的量分数几乎不变,则反应①生成CO的物质的量分数几乎不变,1 000 ℃时①③的平衡常数远大于②,则此时CO的组成比远大于CO2,故曲线Ⅰ代表CO;反应②生成等量的CO2、C,由于投料中含有C,则C的组成比大于CO2,故曲线Ⅱ、Ⅲ分别代表C、CO2。由盖斯定律可知,①-③得反应TiO2(s)+2Cl2(g) ===TiCl4(g)+O2(g),则1 000 ℃时,其平衡常数K==6.4×10-5,A正确;由分析可知B正确;高于600 ℃,升高温度,TiCl4的物质的量分数几乎不变,而CO含量显著增大,反应均放热,升温反应逆向进行,则说明此时升高温度主要对反应②的平衡产生影响,导致CO含量显著增大,C正确;温度在200~1 200 ℃之间TiCl4的平衡转化率几乎不变,故升高温度对其平衡产率增加作用不大,D错误。
3.C 10 min内,T1时CH4的化学反应速率为=0.015 mol·L-1·min-1,T2时CH4的化学反应速率为=0.02 mol·L-1·min-1,故A正确;温度越高反应速率越快,T1时CH4的化学反应速率小于T2,所以温度:T1K(T2),故C错误;升高温度化学平衡常数减小,可知升高温度,平衡逆向移动,正反应放热,a<0,故D正确。
4.B MnO2会催化H2O2分解,与平衡移动无关,A项错误;NO2转化为N2O4的反应是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B项正确;铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误。
5.答案 (1)1∶4 变大 (2)d c 小于
(3)等
(4)选择合适催化剂等
解析 (1)由题意知二氧化碳与氢气反应生成乙烯和水,反应的化学方程式为2CO2+6H2CH2==CH2+4H2O,n(C2H4)∶n(H2O)=1∶4;此反应为气体体积减小的反应,增大压强,平衡向气体体积减小的方向(正反应方向)移动,n(C2H4)变大。(2)反应方程式中CO2和H2的系数之比为1∶3,开始时加入的n(CO2)∶n(H2)=1∶3,则平衡时n(CO2)∶n(H2)也应为1∶3,n(C2H4)∶n(H2O)应为1∶4,由题图可知曲线a为H2,b为H2O,c为CO2,d为C2H4,随温度升高,平衡时C2H4和H2O的物质的量分数逐渐减小,H2和CO2的物质的量分数逐渐增加,说明升高温度平衡逆向移动,根据升高温度平衡向吸热的方向移动,知正反应为放热反应,ΔH小于0。(3)在440 K时,氢气的物质的量分数为0.39,H2O的物质的量分数也为0.39,根据平衡时n(CO2)∶n(H2)=1∶3,知CO2的物质的量分数为,根据平衡时n(C2H4)∶n(H2O)=1∶4,知C2H4的物质的量分数为,则p(H2)=0.39×0.1 MPa,p(H2O)=0.39×0.1 MPa,p(C2H4)=0.39×,p(CO2)=0.39×,Kp= MPa-3= MPa-3。(4)压强和温度一定,若要提高反应速率和乙烯的选择性,可采用选择合适催化剂等方法。
6.B 一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则x1vc(正),故B错误;由图像可知,x一定时,温度升高CH4的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向移动,K增大;温度相同,K不变,则点a、b、c对应的平衡常数:Ka7.B 根据表格数据可知:在0~2 min内,Cl2的浓度由2.4 mol·L-1变为1.6 mol·L-1,减小了0.8 mol·L-1,则根据物质反应转化关系可知v(CO)=v(Cl2)==0.4 mol·L-1·min-1,A错误;从反应开始至6 min时CO的浓度减小了1.8 mol·L-1,则相同时间内Cl2的浓度也会减小1.8 mol·L-1,此时Cl2的浓度c(Cl2)=2.4 mol·L-1-1.8 mol·L-1=0.6 mol·L-1与第8 min时Cl2的浓度相同,说明6 min时反应已经达到平衡状态,根据物质反应转化关系可知平衡时c(COCl2)=1.8 mol·L-1。当反应温度升高并达到平衡时c(COCl2)=1.5 mol·L-1,物质浓度降低,说明升高温度,化学平衡向逆反应方向移动,则该反应的正反应是放热反应,ΔH<0,该反应正反应是气体体积减小的反应,ΔS<0,反应若要自发进行,则ΔG=ΔH-TΔS<0,低温下ΔG<0,反应可自发进行,B正确;若保持温度不变,第8 min向体系中加入三种物质各1 mol,则相对来说反应物浓度增大得多,化学平衡向正反应方向移动,C错误;若保持温度不变,在第8 min再充入1.0 mol COCl2(g),COCl2(g)浓度增大,同时必然会导致体系的压强增大,增大压强,化学平衡向气体体积减小的正反应方向移动,达到新平衡时COCl2的体积分数大于原平衡COCl2的体积分数,D错误。
8.C 由图可知,温度升高,H2的平衡浓度增大,说明平衡逆向移动,该反应为放热反应,该反应的平衡常数随温度升高而减小,故A错误;结合方程式2CO2(g)+6H2(g)C2H4(g)+4H2O(g)可知,c(C2H4)的变化量为c(H2O)变化量的,则曲线Y表示c(H2O)随温度的变化关系,故B错误;提高投料比[n(CO2)∶n(H2)]即增大CO2的浓度,平衡正向移动,H2的平衡转化率增大,故C正确;其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,等效于增大压强,平衡时H2的浓度小于2c1,大于n mol CO2与3n mol H2在T1 ℃下发生反应时H2的平衡浓度c1,故D错误。
9.答案 AB
解析 混合气体中N2的体积分数不再变化,则其浓度不再变化,说明反应已达到平衡状态,A正确;反应Ⅰ和反应Ⅱ的产物中N2的体积分数均为50%,可逆反应中必存在反应物,则N2体积分数一定小于50%,B正确;保持CH3CH==CHCH3(g)的物质的量不变,增大N2O(g)的物质的量,起始投料比增大,反应Ⅰ和反应Ⅱ平衡均正向移动,但N2O(g)的转化率减小,则在M、N、Q三点中,N2O(g)的转化率大小排序为M>N>Q,C错误;从N到Q,继续增大起始投料比,平衡时气体总体积增加的幅度大于N2增加的幅度,使得N2百分含量下降,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业28影响化学平衡的因素
A组 基础达标
1.(教材选择性必修1第二章复习与提高改编)一定条件下,将三组CO(g)和H2O(g)分别通入容积均为2 L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
实验 组 起始时/mol 平衡时/mol 达到平衡 所需时间/min
CO H2O CO2
1 650 4 2 1.6 5
2 900 2 1 0.4 3
3 2 1 0.4 0.1
下列说法错误的是( )
A.实验1中,前5 min CO的平均速率为0.16 mol·L-1·min-1
B.与实验2相比,实验3改变的条件可能是温度
C.平衡常数:实验1>实验2
D.CO平衡转化率:实验1>实验2
2.(2023·浙江萧山中学段考)工业上制备Ti,采用碳氯化法将TiO2转化成TiCl4。在1 000 ℃时发生如下反应:
①TiO2(s)+2Cl2(g)+2C(s) ===TiCl4(g)+2CO(g)
ΔH1=-51.0 kJ·mol-1 K1=1.6×1014
②2CO(g) ===CO2(g)+C(s) ΔH2=-172.5 kJ·mol-1 K2=1.0×10-4
③2C(s)+O2(g) ===2CO(g) ΔH3=-223.0 kJ·mol-1 K3=2.5×1018。
在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行碳氯化,平衡时体系中CO2、CO、TiCl4和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是( )
A.1 000 ℃时,反应TiO2(s)+2Cl2(g) ===TiCl4(g)+O2(g)的平衡常数K=6.4×10-5
B.曲线Ⅲ表示平衡时CO2的物质的量分数随温度的变化
C.高于600 ℃,升高温度,主要对反应②的平衡产生影响
D.为保证TiCl4的平衡产率,选择反应温度应高于1 000 ℃
3.(2024·浙江杭州四中检测)工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=a kJ·mol-1。在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入容积为1 L的密闭容器中,测得n(CH4)(单位:mol)随时间变化数据如下表:
温度 0 min 10 min 20 min 40 min 50 min
T1 0.50 0.35 0.25 0.10 0.10
T2 0.50 0.30 0.18 … 0.15
下列说法错误的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1
4.(2023·北京卷)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
5.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH (填“大于”或“小于”)0。
(3)根据图中点A(440,0.39),计算该温度时反应的平衡常数Kp= MPa-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
B组 综合提升
6.(2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x[x=]随温度的变化曲线如图所示。下列说法错误的是( )
A.x1
7.(2023·浙江杭州外国语学校段考)一定条件下,在1.0 L的密闭容器中进行反应:CO(g)+Cl2(g)COCl2(g),反应过程中的有关数据如下:
t/min 0 2 6 8
c(Cl2)/(mol·L-1) 2.4 1.6 0.6
c(CO)/(mol·L-1) 2 0.2
c(COCl2)/(mol·L-1) 0
下列说法正确的是( )
A.0~2 min内,用CO表示的化学反应速率为0.3 mol·L-1·min-1
B.其他条件不变,升高温度,平衡时c(COCl2)=1.5 mol·L-1,则该反应低温时能自发进行
C.若保持温度不变,第8 min向体系中加入三种物质各1 mol,则平衡向逆反应方向移动
D.若保持温度不变,在第8 min再充入1.0 mol COCl2(g),达到新平衡时COCl2的体积分数小于原平衡COCl2的体积分数
8.(2023·浙江湖州菱湖中学月考)恒容密闭容器中,n mol CO2与3n mol H2在不同温度下发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,达到平衡时c(H2)
反应Ⅰ:CH3CH==CHCH3(g)+N2O(g)CH3CH2COCH3(g)+N2(g) ΔH1=-398 kJ·mol-1
反应Ⅱ:CH3CH==CHCH3(g)+2N2O(g)2CH3CHO(g)+2N2(g) ΔH2
请回答:
一定温度下,向恒压密闭容器中充入
CH3CH==CHCH3(g)和N2O(g),发生反应Ⅰ和反应Ⅱ,测得平衡体系中N2的体积分数与起始投料比[]的关系如图所示。下列有关说法正确的是 (填字母)。
A.混合气体中N2的体积分数不再变化说明反应已达到平衡状态
B.达到平衡时,体系中N2的体积分数总是小于50%
C.M、N、Q三点,N2O(g)的转化率大小:N>M>Q
D.从N到Q,N2百分含量下降,是因为反应Ⅰ逆向移动
作业28 影响化学平衡的因素
1.B 实验1中,参加反应的一氧化碳的物质的量为1.6 mol,前5 min用一氧化碳表示的平均速率为1.6 mol÷2 L÷5 min=0.16 mol·L-1·min-1,A正确;实验3与实验2相比,起始量、平衡量均相等,但达到平衡所用的时间实验3短,说明实验3的反应速率快,因此改变的条件为使用了催化剂,B错误;实验1列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始量/(mol·L-1) 2 1 0 0
转化量/(mol·L-1) 0.8 0.8 0.8 0.8
平衡量/(mol·L-1) 1.2 0.2 0.8 0.8
平衡常数K=≈2.67,CO转化率:×100%=40%;
实验2列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始量/(mol·L-1) 1 0.5 0 0
转化量/(mol·L-1) 0.2 0.2 0.2 0.2
平衡量/(mol·L-1) 0.8 0.3 0.2 0.2
平衡常数K=≈0.17,CO转化率:×100%=20%;平衡常数:实验1>实验2,C正确;CO平衡转化率:实验1>实验2,D正确。
2.D 由题图可知,TiCl4的物质的量分数几乎不变,则反应①生成CO的物质的量分数几乎不变,1 000 ℃时①③的平衡常数远大于②,则此时CO的组成比远大于CO2,故曲线Ⅰ代表CO;反应②生成等量的CO2、C,由于投料中含有C,则C的组成比大于CO2,故曲线Ⅱ、Ⅲ分别代表C、CO2。由盖斯定律可知,①-③得反应TiO2(s)+2Cl2(g) ===TiCl4(g)+O2(g),则1 000 ℃时,其平衡常数K==6.4×10-5,A正确;由分析可知B正确;高于600 ℃,升高温度,TiCl4的物质的量分数几乎不变,而CO含量显著增大,反应均放热,升温反应逆向进行,则说明此时升高温度主要对反应②的平衡产生影响,导致CO含量显著增大,C正确;温度在200~1 200 ℃之间TiCl4的平衡转化率几乎不变,故升高温度对其平衡产率增加作用不大,D错误。
3.C 10 min内,T1时CH4的化学反应速率为=0.015 mol·L-1·min-1,T2时CH4的化学反应速率为=0.02 mol·L-1·min-1,故A正确;温度越高反应速率越快,T1时CH4的化学反应速率小于T2,所以温度:T1
4.B MnO2会催化H2O2分解,与平衡移动无关,A项错误;NO2转化为N2O4的反应是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B项正确;铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误。
5.答案 (1)1∶4 变大 (2)d c 小于
(3)等
(4)选择合适催化剂等
解析 (1)由题意知二氧化碳与氢气反应生成乙烯和水,反应的化学方程式为2CO2+6H2CH2==CH2+4H2O,n(C2H4)∶n(H2O)=1∶4;此反应为气体体积减小的反应,增大压强,平衡向气体体积减小的方向(正反应方向)移动,n(C2H4)变大。(2)反应方程式中CO2和H2的系数之比为1∶3,开始时加入的n(CO2)∶n(H2)=1∶3,则平衡时n(CO2)∶n(H2)也应为1∶3,n(C2H4)∶n(H2O)应为1∶4,由题图可知曲线a为H2,b为H2O,c为CO2,d为C2H4,随温度升高,平衡时C2H4和H2O的物质的量分数逐渐减小,H2和CO2的物质的量分数逐渐增加,说明升高温度平衡逆向移动,根据升高温度平衡向吸热的方向移动,知正反应为放热反应,ΔH小于0。(3)在440 K时,氢气的物质的量分数为0.39,H2O的物质的量分数也为0.39,根据平衡时n(CO2)∶n(H2)=1∶3,知CO2的物质的量分数为,根据平衡时n(C2H4)∶n(H2O)=1∶4,知C2H4的物质的量分数为,则p(H2)=0.39×0.1 MPa,p(H2O)=0.39×0.1 MPa,p(C2H4)=0.39×,p(CO2)=0.39×,Kp= MPa-3= MPa-3。(4)压强和温度一定,若要提高反应速率和乙烯的选择性,可采用选择合适催化剂等方法。
6.B 一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则x1
8.C 由图可知,温度升高,H2的平衡浓度增大,说明平衡逆向移动,该反应为放热反应,该反应的平衡常数随温度升高而减小,故A错误;结合方程式2CO2(g)+6H2(g)C2H4(g)+4H2O(g)可知,c(C2H4)的变化量为c(H2O)变化量的,则曲线Y表示c(H2O)随温度的变化关系,故B错误;提高投料比[n(CO2)∶n(H2)]即增大CO2的浓度,平衡正向移动,H2的平衡转化率增大,故C正确;其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,等效于增大压强,平衡时H2的浓度小于2c1,大于n mol CO2与3n mol H2在T1 ℃下发生反应时H2的平衡浓度c1,故D错误。
9.答案 AB
解析 混合气体中N2的体积分数不再变化,则其浓度不再变化,说明反应已达到平衡状态,A正确;反应Ⅰ和反应Ⅱ的产物中N2的体积分数均为50%,可逆反应中必存在反应物,则N2体积分数一定小于50%,B正确;保持CH3CH==CHCH3(g)的物质的量不变,增大N2O(g)的物质的量,起始投料比增大,反应Ⅰ和反应Ⅱ平衡均正向移动,但N2O(g)的转化率减小,则在M、N、Q三点中,N2O(g)的转化率大小排序为M>N>Q,C错误;从N到Q,继续增大起始投料比,平衡时气体总体积增加的幅度大于N2增加的幅度,使得N2百分含量下降,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
