2025浙江专版新教材化学高考第一轮基础练--作业37 反应过程中溶液中粒子浓度变化的图像分析(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业37 反应过程中溶液中粒子浓度变化的图像分析(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 575.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 00:00:00 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业37反应过程中溶液中粒子浓度变化的图像分析
A组 基础达标
1.(2023·浙江义乌五校高三上联考)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2O(l)HClO(aq)+H+(aq)+Cl-(aq) K2=10-3.4
HClO(aq)H+(aq)+ClO-(aq) K3
其中Cl2(aq)、HClO(aq)和ClO-(aq)分别在三者中所占分数(α)随pH变化的关系如图所示。
下列表述不正确的是( )
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.在氯处理水体系中,存在c(HClO)+2c(ClO-)+c(OH-)=c(H+)
C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时更好
D.经计算,Cl2(g)+H2O(l)2H+(aq)+ClO-(aq)+Cl-(aq)的平衡常数K=10-12.1
2.常温下,已知H3PO3溶液中含磷微粒的浓度之和为0.1 mol·L-1,溶液中各含磷微粒的pc-pOH关系如图所示,图中pc表示各含磷微粒的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法不正确的是( )
A.由图可得H3PO3为二元弱酸
B.曲线③表示pc(H3PO3)随pOH的变化
C.pH=6.7的溶液中:c(H3PO3)=0.1 mol·L-1-2c(HP)
D.H3PO3+HP2H2P的平衡常数K<1.0×105
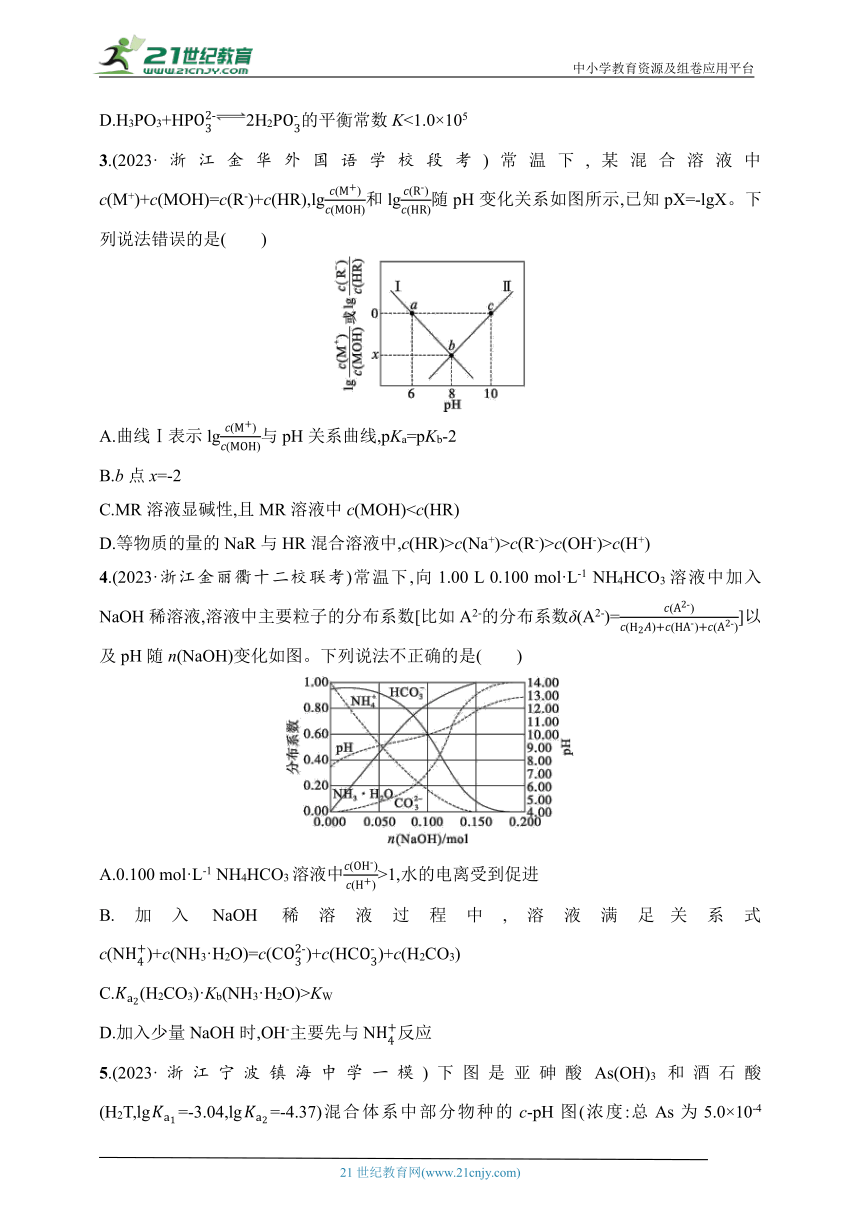
3.(2023·浙江金华外国语学校段考)常温下,某混合溶液中c(M+)+c(MOH)=c(R-)+c(HR),lg和lg随pH变化关系如图所示,已知pX=-lgX。下列说法错误的是( )
A.曲线Ⅰ表示lg与pH关系曲线,pKa=pKb-2
B.b点x=-2
C.MR溶液显碱性,且MR溶液中c(MOH)D.等物质的量的NaR与HR混合溶液中,c(HR)>c(Na+)>c(R-)>c(OH-)>c(H+)
4.(2023·浙江金丽衢十二校联考)常温下,向1.00 L 0.100 mol·L-1 NH4HCO3溶液中加入NaOH稀溶液,溶液中主要粒子的分布系数[比如A2-的分布系数δ(A2-)=]以及pH随n(NaOH)变化如图。下列说法不正确的是( )
A.0.100 mol·L-1 NH4HCO3溶液中>1,水的电离受到促进
B.加入NaOH稀溶液过程中,溶液满足关系式c(N)+c(NH3·H2O)=c(C)+c(HC)+c(H2CO3)
C.(H2CO3)·Kb(NH3·H2O)>KW
D.加入少量NaOH时,OH-主要先与N反应
5.(2023·浙江宁波镇海中学一模)下图是亚砷酸As(OH)3和酒石酸(H2T,lg=-3.04,lg=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是( )
A.As(OH)3的lg为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
B组 综合提升
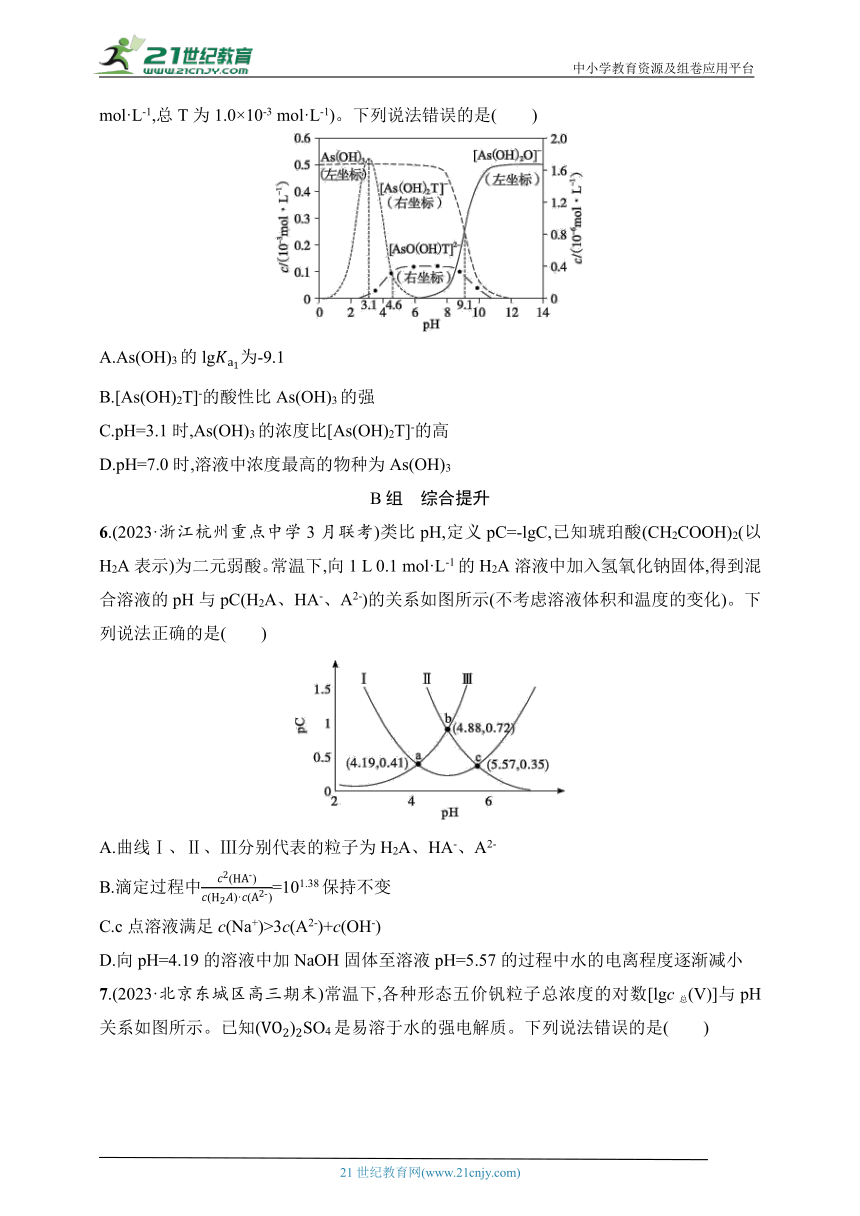
6.(2023·浙江杭州重点中学3月联考)类比pH,定义pC=-lgC,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸。常温下,向1 L 0.1 mol·L-1的H2A溶液中加入氢氧化钠固体,得到混合溶液的pH与pC(H2A、HA-、A2-)的关系如图所示(不考虑溶液体积和温度的变化)。下列说法正确的是( )
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的粒子为H2A、HA-、A2-
B.滴定过程中=101.38保持不变
C.c点溶液满足c(Na+)>3c(A2-)+c(OH-)
D.向pH=4.19的溶液中加NaOH固体至溶液pH=5.57的过程中水的电离程度逐渐减小
7.(2023·北京东城区高三期末)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图所示。已知SO4是易溶于水的强电解质。下列说法错误的是( )
A.用稀硫酸溶解V2O5可得到(VO2)2SO4溶液
B.存在V+2H2OH2V+2H+,若加入(VO2)2SO4固体,c(H2V)一定增大
C.若lgc总(V)=-2、pH=4,五价钒粒子的存在形式主要为HV10
D.若lgc总(V)=-3、pH=1,加入适量NaOH,可使V转化为H3V2
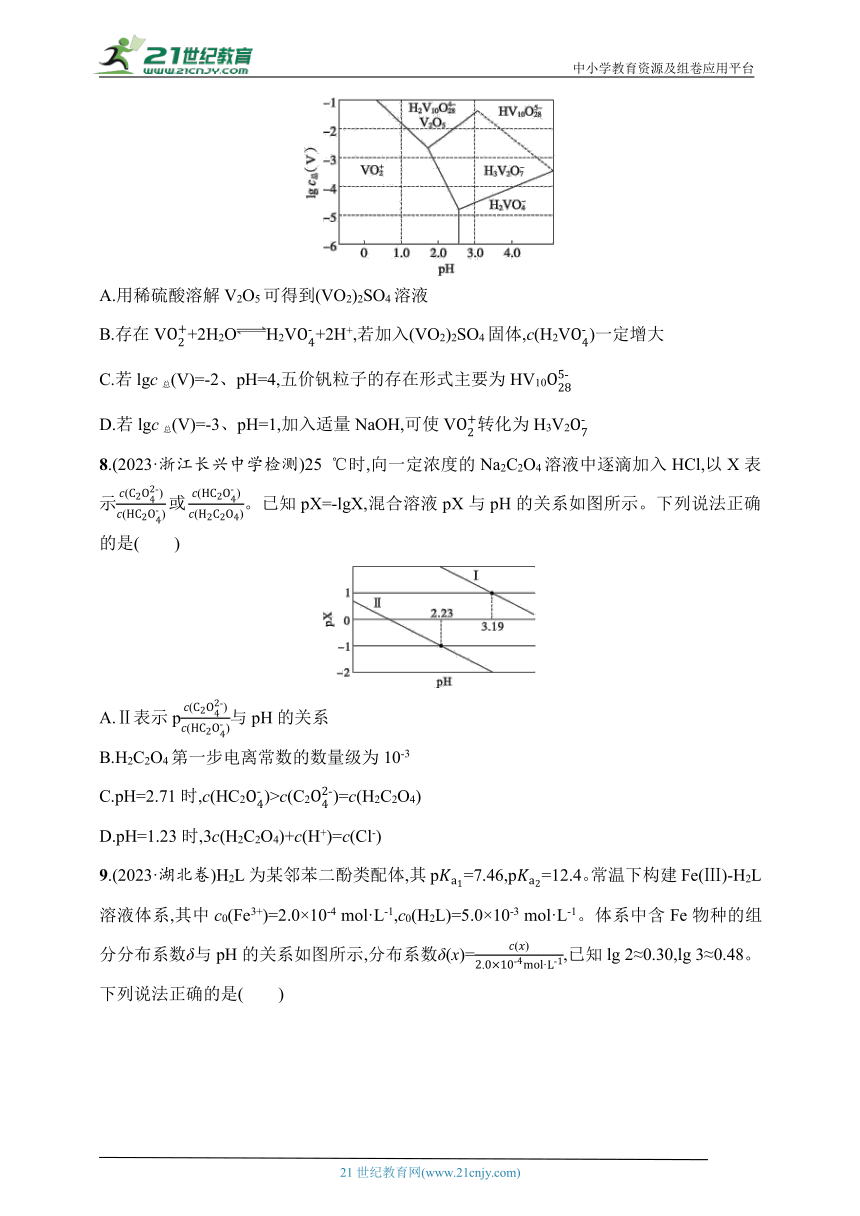
8.(2023·浙江长兴中学检测)25 ℃时,向一定浓度的Na2C2O4溶液中逐滴加入HCl,以X表示。已知pX=-lgX,混合溶液pX与pH的关系如图所示。下列说法正确的是( )
A.Ⅱ表示p与pH的关系
B.H2C2O4第一步电离常数的数量级为10-3
C.pH=2.71时,c(HC2)>c(C2)=c(H2C2O4)
D.pH=1.23时,3c(H2C2O4)+c(H+)=c(Cl-)
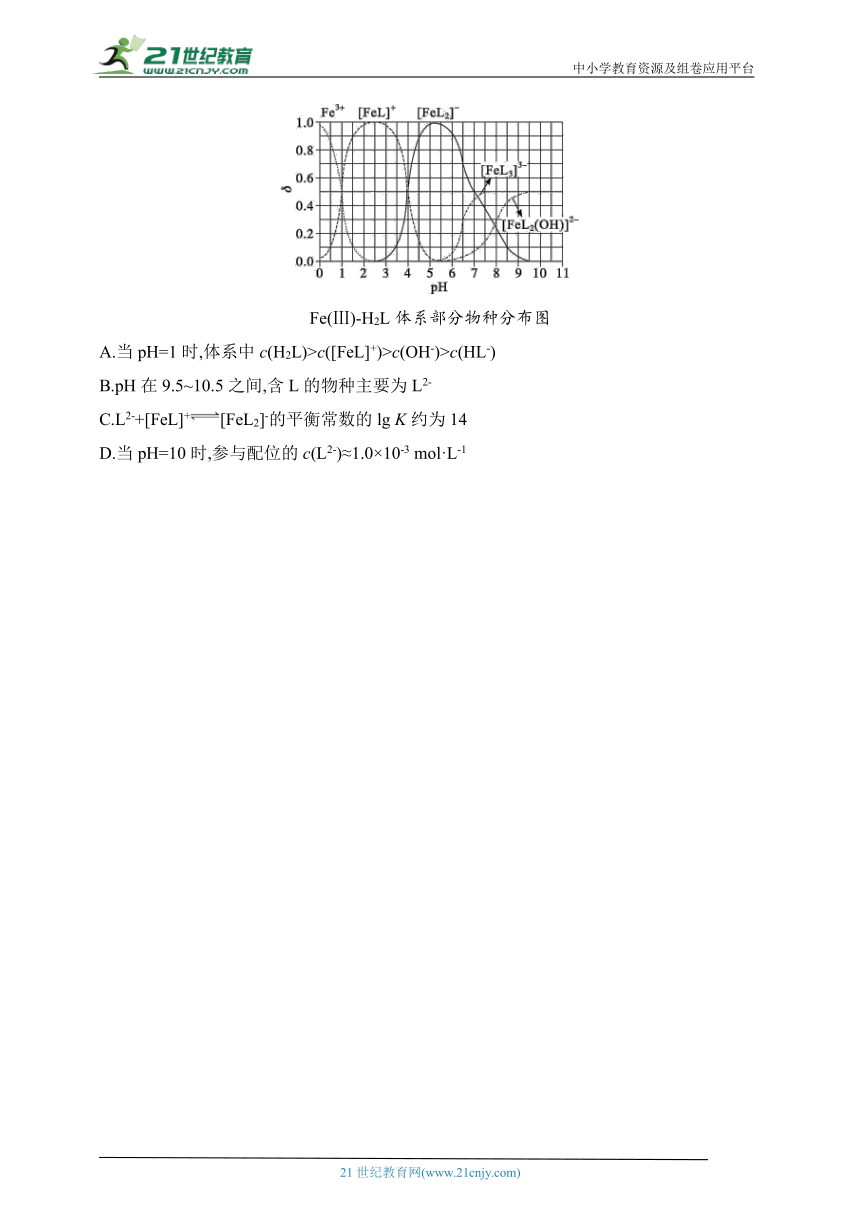
9.(2023·湖北卷)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+[FeL2]-的平衡常数的lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
作业37 反应过程中溶液中粒子浓度变化的图像分析
1.A 夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,A错误;根据体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),氯气与水反应产生等量的HCl和HClO,在氯水中HCl完全电离、而HClO部分电离,所以c(HClO)+c(ClO-)=c(Cl-),所以c(HClO)+2c(ClO-)+c(OH-)=c(H+),B正确;起杀菌作用的是HClO,由图像可知,pH=6.5时c(HClO)比pH=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=7.5时杀菌效果比pH=6.5时差,C正确;根据图像知,HClOH++ClO-中pH=7.5,Ka==c(H+)=10-7.5,将已知的三个式子相加可得Cl2(g)+H2O2H++ClO-+Cl-,所以K=K1·K2·Ka=10-1.2×10-3.4×10-7.5=10-12.1,D正确。
2.D 由图可知,H3PO3溶液中含磷微粒只有3种,说明H3PO3在溶液中能分步电离出H2P和HP,则H3PO3为二元弱酸;溶液的碱性越强,POH越小,溶液中H3PO3的浓度越小、HP的浓度越大,则曲线①表示pc(HP)随pOH的变化、曲线②表示pc(H2P)随pOH的变化、曲线③表示pc(H3PO3)随pOH的变化;由z点坐标可知,溶液中H3PO3与H2P的浓度相等,溶液中氢离子浓度为10-14+12.6 mol·L-1=10-1.4 mol·L-1,则H3PO3的=1,同理由x点坐标可知,H3PO3的=10-6.7。H3PO3为二元弱酸,在溶液中能分步电离出H2P和HP,故A正确;曲线①表示pc(HP)随pOH的变化、曲线②表示pc(H2P)随pOH的变化、曲线③表示pc(H3PO3)随pOH的变化,故B正确;pH为6.7的溶液中pOH为7.3,由图可知,溶液中H2P与HP的浓度相等,由元素守恒可知,溶液中c(H3PO3)+c(H2P)+c(HP)=0.1 mol·L-1,则溶液中c(H3PO3)=0.1 mol·L-1-2c(HP),故C正确;由方程式可知,反应的平衡常数K==1.0×105.3>1.0×105,故D错误。
3.A 由Kb=,当lg=0即c(M+)=c(MOH)时,Kb=c(OH-),同理,Ka=c(H+);随pH的增大,c(H+)减小,c(OH-)增大,温度不变 ,Ka、Kb不变,则随pH的增大,增大、减小,由此推断曲线Ⅰ表示lg与pH的关系,曲线Ⅱ表示lg与pH的关系。A项,由上述分析可知,曲线Ⅰ表示lg与pH关系,Kb=c(OH-)==10-8,常温下c点c(H+)=10-10 mol·L-1,Ka=c(H+)=10-10,则pKa=pKb+2,A错误;b点溶液pH=8,溶液呈碱性,c(OH-)= mol·L-1=10-6 mol·L-1,由Kb==10-8,则=10-2,则x=lg=-2,B正确;由Ka=10-10,Kb=10-8,相对而言MOH碱性较强、HR酸性较弱,则MR溶液显碱性,由越弱越水解规律可知,R-水解程度大于M+,则MR溶液中c(MOH)Ka,则等物质的量的NaR与HR混合溶液中,HR电离程度小于R-水解程度,c(HR)>c(Na+)>c(R-)>c(OH-)>c(H+),D正确。
4.C NH4HCO3===N+HC,N和HC分别发生水解,HC+H2OH2CO3+OH-,N+H2ONH3·H2O+H+,因为>1,所以c(OH-)>c(H+),则说明HC水解程度大,使水电离受到促进,故A正确;加入NaOH稀溶液过程中,由元素守恒得c(N)+c(NH3·H2O)=c(C)+c(HC)+c(H2CO3),故B正确;(H2CO3)·Kb(NH3·H2O)=,图中c(HC)=c(C)时,c(N)5.D As(OH)3[As(OH)2O]-+H+,,当pH=9.1时,c{[As(OH)2O]-}=c[As(OH)3],)=10-9.1,lg=-9.1,A正确;[As(OH)2T]-[AsO(OH)T]2-+H+,Ka=,当pH=4.6时,c{[AsO(OH)T]2-}=c{[As(OH)2T]-},Ka=10-4.6,而由A选项计算得As(OH)3的=10-9.1,即Ka>,所以[As(OH)2T]-的酸性比As(OH)3的强,B正确;由图可知As(OH)3的浓度为左坐标,浓度的数量级为10-3 mol·L-1,[As(OH)2T]-的浓度为右坐标,浓度的数量级为10-6 mol·L-1,所以pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高,C正确;由已知条件,酒石酸(H2T),lg=-3.04,lg=-4.37,As(OH)3的lg=-9.1,即酒石酸的第一步电离常数远大于As(OH)3的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
6.B 加入氢氧化钠固体后,随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,由pC=-lgC可知,pC(H2A)逐渐增大,pC(HA-)先减小后增大,pC(A2-)逐渐减小,即曲线Ⅰ、Ⅱ、Ⅲ分别代表的粒子为HA-、A2-、H2A。由分析可知,A选项错误;a点时,有c(HA-)=c(H2A),则=c(H+)=10-4.19,c点时,有c(HA-)=c(A2-),则=c(H+)=10-5.57,可得=101.38,温度不变,不变,则=101.38保持不变,B选项正确;根据电荷守恒得c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),c点时,有c(HA-)=c(A2-),则c(Na+)+c(H+)=3c(A2-)+c(OH-),可得c点溶液满足c(Na+)<3c(A2-)+c(OH-),C选项错误;向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中,溶液酸性逐渐减弱,对水的电离抑制作用逐渐减弱,则水的电离程度逐渐增大,D选项错误。
7.B 由图可知,用稀硫酸溶解V2O5调节pH为0~1之间可以得到(VO2)2SO4溶液,故A正确;存在V+2H2OH2V+2H+,若是(VO2)2SO4饱和溶液,再加该固体,V浓度不变,平衡不移动,c(H2V)不变,故B错误;若lgc总(V)=-2、pH=4,由图可知,五价钒粒子的存在形式主要为HV10,故C正确;若lgc总(V)=-3、pH=1,加入适量NaOH,调节pH为3~4之间,V浓度减小,H3V2增大,可使V转化为H3V2,故D正确。
8.C A项,当pX=0,c(HC2)=c(C2),=c(H+);当pX=0,c(HC2)=c(H2C2O4),=c(H+);由于,结合图像可知,Ⅱ表示p与pH的关系、Ⅰ表示p与pH的关系,A错误。B项,由点(2.23,-1)可知,H2C2O4第一步电离常数=101×10-2.23=10-1.23,B错误。C项,由图可知,pH=2.71时,p>1,则c(HC2)>c(C2),由点(3.19,1)可知,=10-1×10-3.19=10-4.19,=10-5.42,此时pH=2.71,则=10-5.42,得c(C2)=c(H2C2O4),C正确。D项,由电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HC2)+2c(C2);由元素守恒可知,c(Na+)=2c(HC2)+2c(H2C2O4)+2c(C2),两式联立可得:c(HC2)+2c(H2C2O4)+c(H+)=c(Cl-)+c(OH-);=10-1.23,pH=1.23时,c(HC2)=c(H2C2O4),则有3c(H2C2O4)+c(H+)=c(Cl-)+c(OH-),D错误。
9.C 已知H2L的=10-7.46,=10-12.4,Fe(Ⅲ)-H2L溶液体系中进行的反应:Fe3++H2L[FeL]++2H+,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。
当pH=1时,δ(Fe3+)=δ([FeL]+)=0.5,c(Fe3+)=c([FeL]+)=1.0×10-4 mol·L-1,c(H2L)≈5.0×10-3 mol·L-1,c(HL-)= mol·L-1=5.0×10-9.46 mol·L-1>c(OH-)=1.0×10-13 mol·L-1,所以A错误;根据可知,当pH=7.46时,c(H2L)=c(HL-),pH=12.4时,c(HL-)=c(L2-),则当pH在9.5~10.5之间,c(HL-)>c(L2-),c(HL-)>c(H2L),含L的物种主要为HL-,所以B错误;L2-+[FeL]+[FeL2]-,K=,由图像知,pH=4时,c([FeL2]-)=c([FeL]+),K=,对于H2L,=10-7.46×10-12.4=10-19.86,pH=4时,c(H+)=10-4 mol·L-1,c(L2-)= mol·L-1=5.0×10-14.86 mol·L-1,此时K==2×1013.86,lg K≈14.16,C正确;由图像知,当pH=10时,δ([FeL3]3-)=δ([FeL2(OH)]2-)≈0.5,参与配位的c(L2-)≈1.0×10-4 mol·L-1×3+1.0×10-4 mol·L-1×2=5.0×10-4 mol·L-1,所以D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业37反应过程中溶液中粒子浓度变化的图像分析
A组 基础达标
1.(2023·浙江义乌五校高三上联考)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2O(l)HClO(aq)+H+(aq)+Cl-(aq) K2=10-3.4
HClO(aq)H+(aq)+ClO-(aq) K3
其中Cl2(aq)、HClO(aq)和ClO-(aq)分别在三者中所占分数(α)随pH变化的关系如图所示。
下列表述不正确的是( )
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.在氯处理水体系中,存在c(HClO)+2c(ClO-)+c(OH-)=c(H+)
C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时更好
D.经计算,Cl2(g)+H2O(l)2H+(aq)+ClO-(aq)+Cl-(aq)的平衡常数K=10-12.1
2.常温下,已知H3PO3溶液中含磷微粒的浓度之和为0.1 mol·L-1,溶液中各含磷微粒的pc-pOH关系如图所示,图中pc表示各含磷微粒的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法不正确的是( )
A.由图可得H3PO3为二元弱酸
B.曲线③表示pc(H3PO3)随pOH的变化
C.pH=6.7的溶液中:c(H3PO3)=0.1 mol·L-1-2c(HP)
D.H3PO3+HP2H2P的平衡常数K<1.0×105
3.(2023·浙江金华外国语学校段考)常温下,某混合溶液中c(M+)+c(MOH)=c(R-)+c(HR),lg和lg随pH变化关系如图所示,已知pX=-lgX。下列说法错误的是( )
A.曲线Ⅰ表示lg与pH关系曲线,pKa=pKb-2
B.b点x=-2
C.MR溶液显碱性,且MR溶液中c(MOH)
4.(2023·浙江金丽衢十二校联考)常温下,向1.00 L 0.100 mol·L-1 NH4HCO3溶液中加入NaOH稀溶液,溶液中主要粒子的分布系数[比如A2-的分布系数δ(A2-)=]以及pH随n(NaOH)变化如图。下列说法不正确的是( )
A.0.100 mol·L-1 NH4HCO3溶液中>1,水的电离受到促进
B.加入NaOH稀溶液过程中,溶液满足关系式c(N)+c(NH3·H2O)=c(C)+c(HC)+c(H2CO3)
C.(H2CO3)·Kb(NH3·H2O)>KW
D.加入少量NaOH时,OH-主要先与N反应
5.(2023·浙江宁波镇海中学一模)下图是亚砷酸As(OH)3和酒石酸(H2T,lg=-3.04,lg=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是( )
A.As(OH)3的lg为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
B组 综合提升
6.(2023·浙江杭州重点中学3月联考)类比pH,定义pC=-lgC,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸。常温下,向1 L 0.1 mol·L-1的H2A溶液中加入氢氧化钠固体,得到混合溶液的pH与pC(H2A、HA-、A2-)的关系如图所示(不考虑溶液体积和温度的变化)。下列说法正确的是( )
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的粒子为H2A、HA-、A2-
B.滴定过程中=101.38保持不变
C.c点溶液满足c(Na+)>3c(A2-)+c(OH-)
D.向pH=4.19的溶液中加NaOH固体至溶液pH=5.57的过程中水的电离程度逐渐减小
7.(2023·北京东城区高三期末)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图所示。已知SO4是易溶于水的强电解质。下列说法错误的是( )
A.用稀硫酸溶解V2O5可得到(VO2)2SO4溶液
B.存在V+2H2OH2V+2H+,若加入(VO2)2SO4固体,c(H2V)一定增大
C.若lgc总(V)=-2、pH=4,五价钒粒子的存在形式主要为HV10
D.若lgc总(V)=-3、pH=1,加入适量NaOH,可使V转化为H3V2
8.(2023·浙江长兴中学检测)25 ℃时,向一定浓度的Na2C2O4溶液中逐滴加入HCl,以X表示。已知pX=-lgX,混合溶液pX与pH的关系如图所示。下列说法正确的是( )
A.Ⅱ表示p与pH的关系
B.H2C2O4第一步电离常数的数量级为10-3
C.pH=2.71时,c(HC2)>c(C2)=c(H2C2O4)
D.pH=1.23时,3c(H2C2O4)+c(H+)=c(Cl-)
9.(2023·湖北卷)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+[FeL2]-的平衡常数的lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
作业37 反应过程中溶液中粒子浓度变化的图像分析
1.A 夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,A错误;根据体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),氯气与水反应产生等量的HCl和HClO,在氯水中HCl完全电离、而HClO部分电离,所以c(HClO)+c(ClO-)=c(Cl-),所以c(HClO)+2c(ClO-)+c(OH-)=c(H+),B正确;起杀菌作用的是HClO,由图像可知,pH=6.5时c(HClO)比pH=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=7.5时杀菌效果比pH=6.5时差,C正确;根据图像知,HClOH++ClO-中pH=7.5,Ka==c(H+)=10-7.5,将已知的三个式子相加可得Cl2(g)+H2O2H++ClO-+Cl-,所以K=K1·K2·Ka=10-1.2×10-3.4×10-7.5=10-12.1,D正确。
2.D 由图可知,H3PO3溶液中含磷微粒只有3种,说明H3PO3在溶液中能分步电离出H2P和HP,则H3PO3为二元弱酸;溶液的碱性越强,POH越小,溶液中H3PO3的浓度越小、HP的浓度越大,则曲线①表示pc(HP)随pOH的变化、曲线②表示pc(H2P)随pOH的变化、曲线③表示pc(H3PO3)随pOH的变化;由z点坐标可知,溶液中H3PO3与H2P的浓度相等,溶液中氢离子浓度为10-14+12.6 mol·L-1=10-1.4 mol·L-1,则H3PO3的=1,同理由x点坐标可知,H3PO3的=10-6.7。H3PO3为二元弱酸,在溶液中能分步电离出H2P和HP,故A正确;曲线①表示pc(HP)随pOH的变化、曲线②表示pc(H2P)随pOH的变化、曲线③表示pc(H3PO3)随pOH的变化,故B正确;pH为6.7的溶液中pOH为7.3,由图可知,溶液中H2P与HP的浓度相等,由元素守恒可知,溶液中c(H3PO3)+c(H2P)+c(HP)=0.1 mol·L-1,则溶液中c(H3PO3)=0.1 mol·L-1-2c(HP),故C正确;由方程式可知,反应的平衡常数K==1.0×105.3>1.0×105,故D错误。
3.A 由Kb=,当lg=0即c(M+)=c(MOH)时,Kb=c(OH-),同理,Ka=c(H+);随pH的增大,c(H+)减小,c(OH-)增大,温度不变 ,Ka、Kb不变,则随pH的增大,增大、减小,由此推断曲线Ⅰ表示lg与pH的关系,曲线Ⅱ表示lg与pH的关系。A项,由上述分析可知,曲线Ⅰ表示lg与pH关系,Kb=c(OH-)==10-8,常温下c点c(H+)=10-10 mol·L-1,Ka=c(H+)=10-10,则pKa=pKb+2,A错误;b点溶液pH=8,溶液呈碱性,c(OH-)= mol·L-1=10-6 mol·L-1,由Kb==10-8,则=10-2,则x=lg=-2,B正确;由Ka=10-10,Kb=10-8,相对而言MOH碱性较强、HR酸性较弱,则MR溶液显碱性,由越弱越水解规律可知,R-水解程度大于M+,则MR溶液中c(MOH)
4.C NH4HCO3===N+HC,N和HC分别发生水解,HC+H2OH2CO3+OH-,N+H2ONH3·H2O+H+,因为>1,所以c(OH-)>c(H+),则说明HC水解程度大,使水电离受到促进,故A正确;加入NaOH稀溶液过程中,由元素守恒得c(N)+c(NH3·H2O)=c(C)+c(HC)+c(H2CO3),故B正确;(H2CO3)·Kb(NH3·H2O)=,图中c(HC)=c(C)时,c(N)
6.B 加入氢氧化钠固体后,随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,由pC=-lgC可知,pC(H2A)逐渐增大,pC(HA-)先减小后增大,pC(A2-)逐渐减小,即曲线Ⅰ、Ⅱ、Ⅲ分别代表的粒子为HA-、A2-、H2A。由分析可知,A选项错误;a点时,有c(HA-)=c(H2A),则=c(H+)=10-4.19,c点时,有c(HA-)=c(A2-),则=c(H+)=10-5.57,可得=101.38,温度不变,不变,则=101.38保持不变,B选项正确;根据电荷守恒得c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),c点时,有c(HA-)=c(A2-),则c(Na+)+c(H+)=3c(A2-)+c(OH-),可得c点溶液满足c(Na+)<3c(A2-)+c(OH-),C选项错误;向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中,溶液酸性逐渐减弱,对水的电离抑制作用逐渐减弱,则水的电离程度逐渐增大,D选项错误。
7.B 由图可知,用稀硫酸溶解V2O5调节pH为0~1之间可以得到(VO2)2SO4溶液,故A正确;存在V+2H2OH2V+2H+,若是(VO2)2SO4饱和溶液,再加该固体,V浓度不变,平衡不移动,c(H2V)不变,故B错误;若lgc总(V)=-2、pH=4,由图可知,五价钒粒子的存在形式主要为HV10,故C正确;若lgc总(V)=-3、pH=1,加入适量NaOH,调节pH为3~4之间,V浓度减小,H3V2增大,可使V转化为H3V2,故D正确。
8.C A项,当pX=0,c(HC2)=c(C2),=c(H+);当pX=0,c(HC2)=c(H2C2O4),=c(H+);由于,结合图像可知,Ⅱ表示p与pH的关系、Ⅰ表示p与pH的关系,A错误。B项,由点(2.23,-1)可知,H2C2O4第一步电离常数=101×10-2.23=10-1.23,B错误。C项,由图可知,pH=2.71时,p>1,则c(HC2)>c(C2),由点(3.19,1)可知,=10-1×10-3.19=10-4.19,=10-5.42,此时pH=2.71,则=10-5.42,得c(C2)=c(H2C2O4),C正确。D项,由电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HC2)+2c(C2);由元素守恒可知,c(Na+)=2c(HC2)+2c(H2C2O4)+2c(C2),两式联立可得:c(HC2)+2c(H2C2O4)+c(H+)=c(Cl-)+c(OH-);=10-1.23,pH=1.23时,c(HC2)=c(H2C2O4),则有3c(H2C2O4)+c(H+)=c(Cl-)+c(OH-),D错误。
9.C 已知H2L的=10-7.46,=10-12.4,Fe(Ⅲ)-H2L溶液体系中进行的反应:Fe3++H2L[FeL]++2H+,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。
当pH=1时,δ(Fe3+)=δ([FeL]+)=0.5,c(Fe3+)=c([FeL]+)=1.0×10-4 mol·L-1,c(H2L)≈5.0×10-3 mol·L-1,c(HL-)= mol·L-1=5.0×10-9.46 mol·L-1>c(OH-)=1.0×10-13 mol·L-1,所以A错误;根据可知,当pH=7.46时,c(H2L)=c(HL-),pH=12.4时,c(HL-)=c(L2-),则当pH在9.5~10.5之间,c(HL-)>c(L2-),c(HL-)>c(H2L),含L的物种主要为HL-,所以B错误;L2-+[FeL]+[FeL2]-,K=,由图像知,pH=4时,c([FeL2]-)=c([FeL]+),K=,对于H2L,=10-7.46×10-12.4=10-19.86,pH=4时,c(H+)=10-4 mol·L-1,c(L2-)= mol·L-1=5.0×10-14.86 mol·L-1,此时K==2×1013.86,lg K≈14.16,C正确;由图像知,当pH=10时,δ([FeL3]3-)=δ([FeL2(OH)]2-)≈0.5,参与配位的c(L2-)≈1.0×10-4 mol·L-1×3+1.0×10-4 mol·L-1×2=5.0×10-4 mol·L-1,所以D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
