2025浙江专版新教材化学高考第一轮基础练--作业46简单实验方案的设计与评价(含答案)
文档属性
| 名称 | 2025浙江专版新教材化学高考第一轮基础练--作业46简单实验方案的设计与评价(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 417.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025浙江专版新教材化学高考第一轮
作业46简单实验方案的设计与评价
A组 基础达标
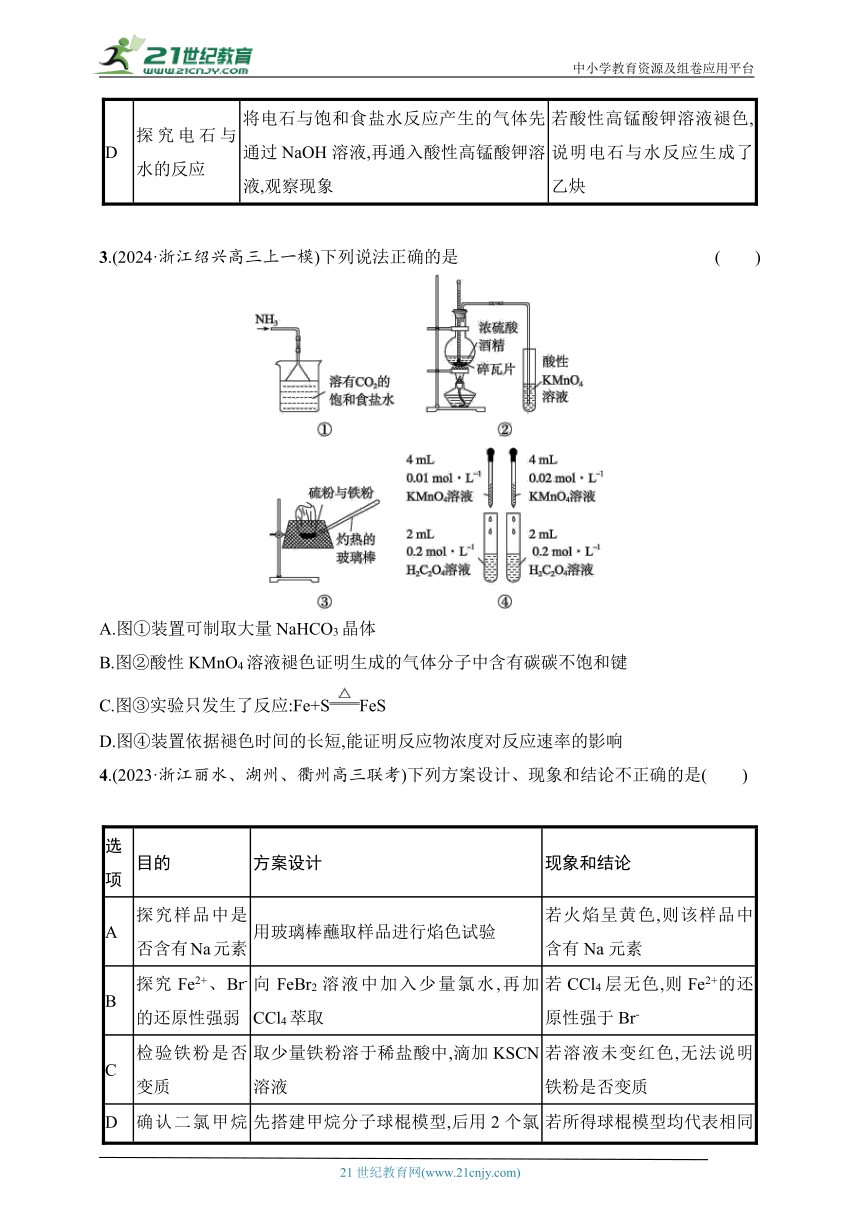
1.利用如图装置和试剂,能达到实验目的的是( )
A.电解饱和食盐水并收集某种产物 B.探究蔗糖在酸性条件下的水解反应
C.证明醋酸是一种弱电解质 D.探究温度对化学反应速率的影响
2.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 比较H2O2和Fe3+的氧化性 取适量H2O2溶液于试管中,滴入Fe2(SO4)3溶液,振荡,观察现象 若产生气体使带火星木条复燃,说明Fe3+的氧化性强于H2O2
B 证明 Na2CO3溶液中存在水解平衡 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 若溶液红色变浅,证明Na2CO3溶液中存在水解平衡
C 检验某有机物是否含有酯基 将适量有机物放入试管,加入足量NaOH溶液,加热 若分层现象消失,说明该有机物含有酯基
D 探究电石与水的反应 将电石与饱和食盐水反应产生的气体先通过NaOH溶液,再通入酸性高锰酸钾溶液,观察现象 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔
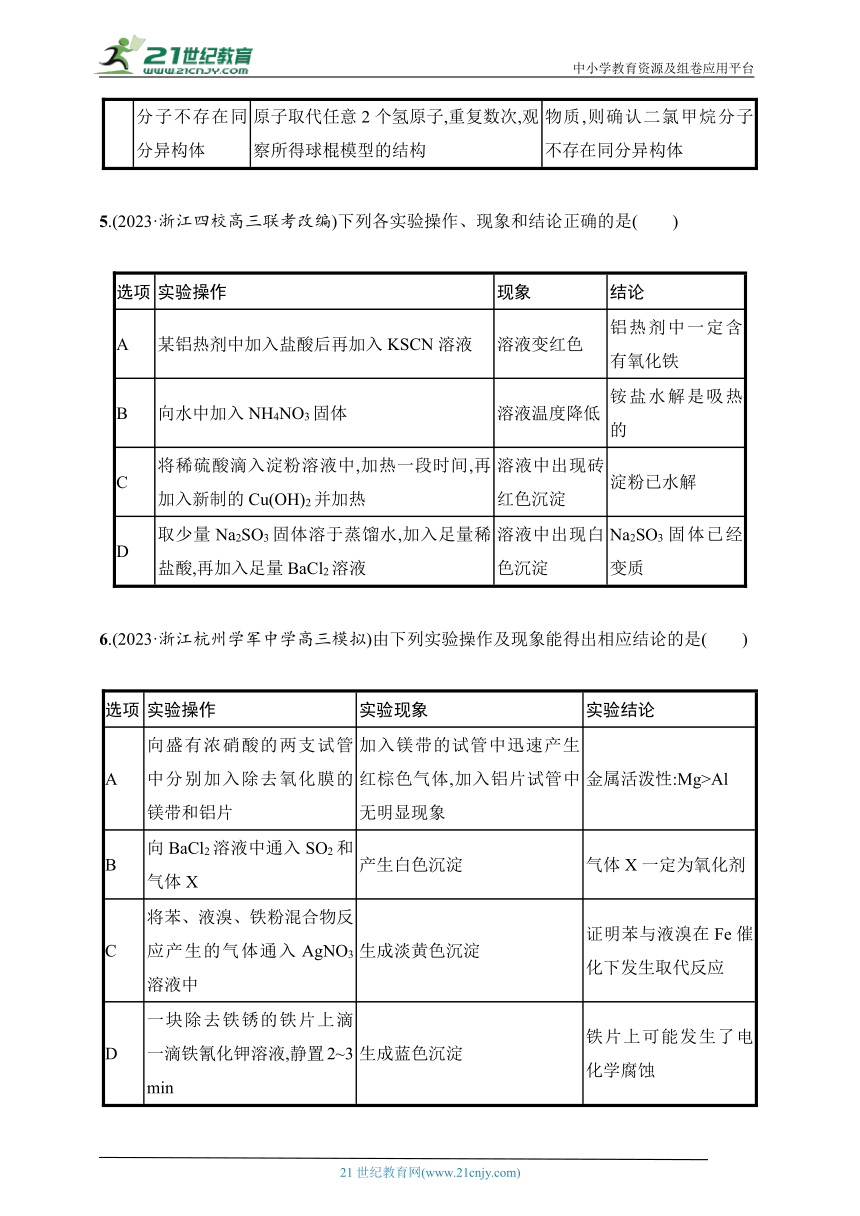
3.(2024·浙江绍兴高三上一模)下列说法正确的是 ( )
A.图①装置可制取大量NaHCO3晶体
B.图②酸性KMnO4溶液褪色证明生成的气体分子中含有碳碳不饱和键
C.图③实验只发生了反应:Fe+SFeS
D.图④装置依据褪色时间的长短,能证明反应物浓度对反应速率的影响
4.(2023·浙江丽水、湖州、衢州高三联考)下列方案设计、现象和结论不正确的是( )
选项 目的 方案设计 现象和结论
A 探究样品中是否含有Na元素 用玻璃棒蘸取样品进行焰色试验 若火焰呈黄色,则该样品中含有Na元素
B 探究Fe2+、Br-的还原性强弱 向FeBr2溶液中加入少量氯水,再加CCl4萃取 若CCl4层无色,则Fe2+的还原性强于Br-
C 检验铁粉是否变质 取少量铁粉溶于稀盐酸中,滴加KSCN溶液 若溶液未变红色,无法说明铁粉是否变质
D 确认二氯甲烷分子不存在同分异构体 先搭建甲烷分子球棍模型,后用2个氯原子取代任意2个氢原子,重复数次,观察所得球棍模型的结构 若所得球棍模型均代表相同物质,则确认二氯甲烷分子不存在同分异构体
5.(2023·浙江四校高三联考改编)下列各实验操作、现象和结论正确的是( )
选项 实验操作 现象 结论
A 某铝热剂中加入盐酸后再加入KSCN溶液 溶液变红色 铝热剂中一定含有氧化铁
B 向水中加入NH4NO3固体 溶液温度降低 铵盐水解是吸热的
C 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2并加热 溶液中出现砖红色沉淀 淀粉已水解
D 取少量Na2SO3固体溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 溶液中出现白色沉淀 Na2SO3固体已经变质
6.(2023·浙江杭州学军中学高三模拟)由下列实验操作及现象能得出相应结论的是( )
选项 实验操作 实验现象 实验结论
A 向盛有浓硝酸的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
B组 综合提升
7.探究硫及其化合物的性质,下列方案设计、现象和结论中不正确的是( )
选项 实验方案 现象 结论
A 在过硫化钠(Na2S2)中加入稀盐酸 产生淡黄色沉淀和臭鸡蛋气味的气体 发生歧化反应: Na2S2+2HCl===2NaCl+H2S↑+S↓
B 已知[Fe(SO2)6]3+呈红棕色,将SO2气体通入FeCl3溶液中 溶液先变为红棕色,过一段时间又变成浅绿色 Fe3+与SO2络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大
C 燃着的镁条插入盛有SO2的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量CuSO4溶液 剧烈燃烧,集气瓶口有淡黄色固体附着,集气瓶底有白色固体生成。试管中没有产生黑色沉淀 镁能在SO2中燃烧: 2Mg+SO22MgO+S
D 探究电石与水的反应 将电石与饱和食盐水反应产生的气体通入溴水中 若溴水褪色,说明电石与水反应生成了乙炔
8.(2023·浙江绍兴高三月考改编)下列方案设计、现象和结论不正确的是( )
选项 目的 方案设计 现象和结论
A 比较镁与铝元素的金属性强弱 取MgCl2与AlCl3溶液于试管,分别加入足量NaOH溶液,观察现象 观察到氯化镁溶液出现白色沉淀,氯化铝溶液先出现白色沉淀后溶解,证明镁的金属性更强
B 证明甲烷与氯气光照条件下发生反应 取试管收集半试管甲烷和半试管氯气,试管夹固定倒扣于水中,放在光亮处,静置,观察现象 观察到试管中的液面上升,则证明甲烷与氯气发生了反应
C 探究OH-浓度对Cr、Cr2相互转化的影响 向K2Cr2O7溶液中加入少量NaOH溶液,观察实验现象 溶液由橙红色变为黄色,则说明增大OH-浓度,平衡向生成Cr的方向移动
D 简单离子与配离子的区别 分别向两支盛有少量蒸馏水的试管里滴加2滴同浓度氯化铁和 K3[Fe(CN)6]溶液,再分别滴加2滴KSCN溶液,观察现象 盛有氯化铁的试管出现红色,另一支无明显现象,证明存在 [Fe(CN)6]3-
作业46 简单实验方案的设计与评价
1.A 电解饱和食盐水,铁棒是阴极,阴极生成氢气,用向下排空气法收集氢气,石墨棒是阳极,阳极生成氯气,用氢氧化钠吸收氯气,故选A;蔗糖在稀硫酸中发生水解反应生成葡萄糖和果糖,蔗糖和浓硫酸混合发生脱水反应,故不选B;用1 mol·L-1的盐酸和1 mol·L-1的醋酸溶液组成串联电路,串联电路中的电流一样大,灯泡亮度相同,不能证明醋酸是弱电解质,故不选C;图示装置可探究温度对化学平衡的影响,不能探究温度对反应速率的影响,故不选D。
2.B Fe3+是H2O2分解反应的催化剂,不能说明Fe3+的氧化性强于H2O2,A错误;向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,二者反应产生BaCO3沉淀,同时看到溶液红色变浅,说明反应后导致溶液中c(OH-)减小,证明Na2CO3溶液中存在水解平衡,降低C的浓度,水解平衡逆向移动,B正确;CH3CH2Br等卤代烃与NaOH溶液共热,分层现象也会消失,C错误;电石中含有杂质CaS、Ca3P2等,当电石与饱和食盐水反应时,杂质CaS与水反应产生的H2S会被NaOH溶液吸收,而Ca3P2与水反应产生的PH3不能被吸收,该气体具有还原性,PH3也能使溶液褪色,因此不能根据酸性KMnO4溶液褪色判断生成了乙炔气体,D错误。
3.D 饱和食盐水中应先通氨气再通二氧化碳制取NaHCO3晶体,A错误;酒精易挥发,同时也能使酸性高锰酸钾溶液褪色,另外浓硫酸能使酒精炭化,生成的碳单质与浓硫酸反应生成SO2,SO2也能使酸性高锰酸钾溶液褪色,因此不能根据高锰酸钾溶液褪色证明生成的气体分子中含有碳碳不饱和键,B错误;灼烧过程中还可能发生Fe与氧气、S与氧气的反应,C错误;所用高锰酸钾溶液的浓度不同,能通过褪色时间判断速率快慢,D正确。
4.A 玻璃中含有Na2SiO3,会对实验结果造成干扰,A错误;Br2的CCl4溶液显橙红色,CCl4层无色,说明没有Br2,则Fe2+优先被氧化,即Fe2+的还原性强于Br-,B正确;KSCN溶液与Fe3+反应会生成红色物质,溶液未变红色只能证明溶液中无Fe3+,但铁粉也可能变质生成亚铁离子,C正确;二氯甲烷分子的结构只有一种,二氯甲烷分子不存在同分异构体,用此方法可以验证,D正确。
5.D 某铝热剂中加入盐酸后再加入KSCN溶液,溶液变红色,铝热剂中还可能含有四氧化三铁,A错误;向水中加入NH4NO3固体,溶液温度降低,因为NH4NO3固体溶于水是吸热的,不能说明铵盐水解是吸热的,B错误;没有向水解液中加入NaOH溶液调至溶液呈碱性,再加入新制的Cu(OH)2与稀硫酸发生中和反应,故溶液中不会出现砖红色沉淀,C错误;因为Na2SO3与稀盐酸反应生成二氧化硫气体,再加入足量BaCl2溶液,溶液中出现白色沉淀,肯定是硫酸钡沉淀,则能说明Na2SO3固体已经变质,D正确。
6.D 常温下,浓硝酸和铝发生钝化,不能说明实验结论,A错误;向BaCl2溶液中通入SO2和气体X,气体X可以是氧化性气体Cl2、NO2等,此时白色沉淀是硫酸钡,气体X也可以是碱性气体氨气,此时白色沉淀是亚硫酸钡,B错误;溴单质易挥发,遇水反应生成溴化氢,溴离子可与硝酸银反应生成淡黄色沉淀,故不能证明取代反应的发生,C错误;滴加铁氰化钾溶液生成蓝色沉淀说明有Fe2+生成,铁片上可能发生了电化学腐蚀,D正确。
7.D Na2S2在酸性条件下发生自身氧化还原生成硫单质和硫化氢气体,会产生淡黄色沉淀和臭鸡蛋气味的气体,A正确;铁离子会和二氧化硫发生氧化还原反应生成Fe2+和S,溶液先变为红棕色,过一段时间又变成浅绿色说明Fe3+与SO2络合生成红棕色[Fe(SO2)6]3+的反应速率比氧化还原反应生成亚铁离子的速率快,最终显浅绿色说明氧化还原反应的平衡常数更大,B正确;剧烈燃烧,集气瓶口有淡黄色固体附着,说明生成硫单质;集气瓶底有白色固体生成,试管中没有产生黑色沉淀,说明没有生成硫化铜沉淀,而是生成白色氧化镁固体,C正确;电石与饱和食盐水反应生成的少量硫化氢气体也会使溴水褪色,不能说明生成了乙炔,D错误。
8.B 氯化镁与氯化铝溶液中分别加入足量氢氧化钠溶液,氯化镁溶液中出现白色沉淀,氯化铝溶液先出现白色沉淀后溶解说明氢氧化铝的碱性弱于氢氧化镁,则镁元素的金属性强于铝元素,A正确;试管中氯气能与水反应生成盐酸和次氯酸,次氯酸遇光分解生成盐酸和氧气会使气体体积减小,试管中的液面上升,观察到试管中的液面上升不能证明甲烷与氯气发生了反应,B错误;向K2Cr2O7溶液中加入NaOH溶液,溶液由橙红色变为黄色,说明增大OH-浓度,溶液中的平衡Cr2+H2O2Cr+2H+向生成Cr的方向移动,C正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025浙江专版新教材化学高考第一轮
作业46简单实验方案的设计与评价
A组 基础达标
1.利用如图装置和试剂,能达到实验目的的是( )
A.电解饱和食盐水并收集某种产物 B.探究蔗糖在酸性条件下的水解反应
C.证明醋酸是一种弱电解质 D.探究温度对化学反应速率的影响
2.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 比较H2O2和Fe3+的氧化性 取适量H2O2溶液于试管中,滴入Fe2(SO4)3溶液,振荡,观察现象 若产生气体使带火星木条复燃,说明Fe3+的氧化性强于H2O2
B 证明 Na2CO3溶液中存在水解平衡 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 若溶液红色变浅,证明Na2CO3溶液中存在水解平衡
C 检验某有机物是否含有酯基 将适量有机物放入试管,加入足量NaOH溶液,加热 若分层现象消失,说明该有机物含有酯基
D 探究电石与水的反应 将电石与饱和食盐水反应产生的气体先通过NaOH溶液,再通入酸性高锰酸钾溶液,观察现象 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔
3.(2024·浙江绍兴高三上一模)下列说法正确的是 ( )
A.图①装置可制取大量NaHCO3晶体
B.图②酸性KMnO4溶液褪色证明生成的气体分子中含有碳碳不饱和键
C.图③实验只发生了反应:Fe+SFeS
D.图④装置依据褪色时间的长短,能证明反应物浓度对反应速率的影响
4.(2023·浙江丽水、湖州、衢州高三联考)下列方案设计、现象和结论不正确的是( )
选项 目的 方案设计 现象和结论
A 探究样品中是否含有Na元素 用玻璃棒蘸取样品进行焰色试验 若火焰呈黄色,则该样品中含有Na元素
B 探究Fe2+、Br-的还原性强弱 向FeBr2溶液中加入少量氯水,再加CCl4萃取 若CCl4层无色,则Fe2+的还原性强于Br-
C 检验铁粉是否变质 取少量铁粉溶于稀盐酸中,滴加KSCN溶液 若溶液未变红色,无法说明铁粉是否变质
D 确认二氯甲烷分子不存在同分异构体 先搭建甲烷分子球棍模型,后用2个氯原子取代任意2个氢原子,重复数次,观察所得球棍模型的结构 若所得球棍模型均代表相同物质,则确认二氯甲烷分子不存在同分异构体
5.(2023·浙江四校高三联考改编)下列各实验操作、现象和结论正确的是( )
选项 实验操作 现象 结论
A 某铝热剂中加入盐酸后再加入KSCN溶液 溶液变红色 铝热剂中一定含有氧化铁
B 向水中加入NH4NO3固体 溶液温度降低 铵盐水解是吸热的
C 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2并加热 溶液中出现砖红色沉淀 淀粉已水解
D 取少量Na2SO3固体溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 溶液中出现白色沉淀 Na2SO3固体已经变质
6.(2023·浙江杭州学军中学高三模拟)由下列实验操作及现象能得出相应结论的是( )
选项 实验操作 实验现象 实验结论
A 向盛有浓硝酸的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
B组 综合提升
7.探究硫及其化合物的性质,下列方案设计、现象和结论中不正确的是( )
选项 实验方案 现象 结论
A 在过硫化钠(Na2S2)中加入稀盐酸 产生淡黄色沉淀和臭鸡蛋气味的气体 发生歧化反应: Na2S2+2HCl===2NaCl+H2S↑+S↓
B 已知[Fe(SO2)6]3+呈红棕色,将SO2气体通入FeCl3溶液中 溶液先变为红棕色,过一段时间又变成浅绿色 Fe3+与SO2络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大
C 燃着的镁条插入盛有SO2的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量CuSO4溶液 剧烈燃烧,集气瓶口有淡黄色固体附着,集气瓶底有白色固体生成。试管中没有产生黑色沉淀 镁能在SO2中燃烧: 2Mg+SO22MgO+S
D 探究电石与水的反应 将电石与饱和食盐水反应产生的气体通入溴水中 若溴水褪色,说明电石与水反应生成了乙炔
8.(2023·浙江绍兴高三月考改编)下列方案设计、现象和结论不正确的是( )
选项 目的 方案设计 现象和结论
A 比较镁与铝元素的金属性强弱 取MgCl2与AlCl3溶液于试管,分别加入足量NaOH溶液,观察现象 观察到氯化镁溶液出现白色沉淀,氯化铝溶液先出现白色沉淀后溶解,证明镁的金属性更强
B 证明甲烷与氯气光照条件下发生反应 取试管收集半试管甲烷和半试管氯气,试管夹固定倒扣于水中,放在光亮处,静置,观察现象 观察到试管中的液面上升,则证明甲烷与氯气发生了反应
C 探究OH-浓度对Cr、Cr2相互转化的影响 向K2Cr2O7溶液中加入少量NaOH溶液,观察实验现象 溶液由橙红色变为黄色,则说明增大OH-浓度,平衡向生成Cr的方向移动
D 简单离子与配离子的区别 分别向两支盛有少量蒸馏水的试管里滴加2滴同浓度氯化铁和 K3[Fe(CN)6]溶液,再分别滴加2滴KSCN溶液,观察现象 盛有氯化铁的试管出现红色,另一支无明显现象,证明存在 [Fe(CN)6]3-
作业46 简单实验方案的设计与评价
1.A 电解饱和食盐水,铁棒是阴极,阴极生成氢气,用向下排空气法收集氢气,石墨棒是阳极,阳极生成氯气,用氢氧化钠吸收氯气,故选A;蔗糖在稀硫酸中发生水解反应生成葡萄糖和果糖,蔗糖和浓硫酸混合发生脱水反应,故不选B;用1 mol·L-1的盐酸和1 mol·L-1的醋酸溶液组成串联电路,串联电路中的电流一样大,灯泡亮度相同,不能证明醋酸是弱电解质,故不选C;图示装置可探究温度对化学平衡的影响,不能探究温度对反应速率的影响,故不选D。
2.B Fe3+是H2O2分解反应的催化剂,不能说明Fe3+的氧化性强于H2O2,A错误;向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,二者反应产生BaCO3沉淀,同时看到溶液红色变浅,说明反应后导致溶液中c(OH-)减小,证明Na2CO3溶液中存在水解平衡,降低C的浓度,水解平衡逆向移动,B正确;CH3CH2Br等卤代烃与NaOH溶液共热,分层现象也会消失,C错误;电石中含有杂质CaS、Ca3P2等,当电石与饱和食盐水反应时,杂质CaS与水反应产生的H2S会被NaOH溶液吸收,而Ca3P2与水反应产生的PH3不能被吸收,该气体具有还原性,PH3也能使溶液褪色,因此不能根据酸性KMnO4溶液褪色判断生成了乙炔气体,D错误。
3.D 饱和食盐水中应先通氨气再通二氧化碳制取NaHCO3晶体,A错误;酒精易挥发,同时也能使酸性高锰酸钾溶液褪色,另外浓硫酸能使酒精炭化,生成的碳单质与浓硫酸反应生成SO2,SO2也能使酸性高锰酸钾溶液褪色,因此不能根据高锰酸钾溶液褪色证明生成的气体分子中含有碳碳不饱和键,B错误;灼烧过程中还可能发生Fe与氧气、S与氧气的反应,C错误;所用高锰酸钾溶液的浓度不同,能通过褪色时间判断速率快慢,D正确。
4.A 玻璃中含有Na2SiO3,会对实验结果造成干扰,A错误;Br2的CCl4溶液显橙红色,CCl4层无色,说明没有Br2,则Fe2+优先被氧化,即Fe2+的还原性强于Br-,B正确;KSCN溶液与Fe3+反应会生成红色物质,溶液未变红色只能证明溶液中无Fe3+,但铁粉也可能变质生成亚铁离子,C正确;二氯甲烷分子的结构只有一种,二氯甲烷分子不存在同分异构体,用此方法可以验证,D正确。
5.D 某铝热剂中加入盐酸后再加入KSCN溶液,溶液变红色,铝热剂中还可能含有四氧化三铁,A错误;向水中加入NH4NO3固体,溶液温度降低,因为NH4NO3固体溶于水是吸热的,不能说明铵盐水解是吸热的,B错误;没有向水解液中加入NaOH溶液调至溶液呈碱性,再加入新制的Cu(OH)2与稀硫酸发生中和反应,故溶液中不会出现砖红色沉淀,C错误;因为Na2SO3与稀盐酸反应生成二氧化硫气体,再加入足量BaCl2溶液,溶液中出现白色沉淀,肯定是硫酸钡沉淀,则能说明Na2SO3固体已经变质,D正确。
6.D 常温下,浓硝酸和铝发生钝化,不能说明实验结论,A错误;向BaCl2溶液中通入SO2和气体X,气体X可以是氧化性气体Cl2、NO2等,此时白色沉淀是硫酸钡,气体X也可以是碱性气体氨气,此时白色沉淀是亚硫酸钡,B错误;溴单质易挥发,遇水反应生成溴化氢,溴离子可与硝酸银反应生成淡黄色沉淀,故不能证明取代反应的发生,C错误;滴加铁氰化钾溶液生成蓝色沉淀说明有Fe2+生成,铁片上可能发生了电化学腐蚀,D正确。
7.D Na2S2在酸性条件下发生自身氧化还原生成硫单质和硫化氢气体,会产生淡黄色沉淀和臭鸡蛋气味的气体,A正确;铁离子会和二氧化硫发生氧化还原反应生成Fe2+和S,溶液先变为红棕色,过一段时间又变成浅绿色说明Fe3+与SO2络合生成红棕色[Fe(SO2)6]3+的反应速率比氧化还原反应生成亚铁离子的速率快,最终显浅绿色说明氧化还原反应的平衡常数更大,B正确;剧烈燃烧,集气瓶口有淡黄色固体附着,说明生成硫单质;集气瓶底有白色固体生成,试管中没有产生黑色沉淀,说明没有生成硫化铜沉淀,而是生成白色氧化镁固体,C正确;电石与饱和食盐水反应生成的少量硫化氢气体也会使溴水褪色,不能说明生成了乙炔,D错误。
8.B 氯化镁与氯化铝溶液中分别加入足量氢氧化钠溶液,氯化镁溶液中出现白色沉淀,氯化铝溶液先出现白色沉淀后溶解说明氢氧化铝的碱性弱于氢氧化镁,则镁元素的金属性强于铝元素,A正确;试管中氯气能与水反应生成盐酸和次氯酸,次氯酸遇光分解生成盐酸和氧气会使气体体积减小,试管中的液面上升,观察到试管中的液面上升不能证明甲烷与氯气发生了反应,B错误;向K2Cr2O7溶液中加入NaOH溶液,溶液由橙红色变为黄色,说明增大OH-浓度,溶液中的平衡Cr2+H2O2Cr+2H+向生成Cr的方向移动,C正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
