第六单元 常用的金属和盐基础练习(含解析) 2023----2024学年九年级化学沪教版(上海)第二学期
文档属性
| 名称 | 第六单元 常用的金属和盐基础练习(含解析) 2023----2024学年九年级化学沪教版(上海)第二学期 |  | |
| 格式 | docx | ||
| 文件大小 | 494.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-20 19:51:20 | ||
图片预览




文档简介
第6章常用的金属和盐基础练习
一、选择题
1.在下列各种情况下,埋在地下的输油铸铁管道被腐蚀速度最慢的是
A.在潮湿,疏松的土壤中
B.在含铁元素较多的酸性土壤中
C.在干燥、致密、不透气的土壤中
D.在含砂粒较多,潮湿透气的土壤中
2.用CO2和NH3反应合成尿素[CO(NH2)2]是固定和利用CO2的成功范例,化学反应方程式为: CO2+2NH3 CO(NH2)2+H2O,下列说法正确的是
A.上述反应共涉及到三种氧化物
B.C、H、O、N四种元素均位于周期表第二周期
C.尿素含氮高,是一种很好的氮肥
D.尿素种含有CO分子
3.某活动小组从工厂收集到了一些含有硝酸银的废液以及废铁屑、废锌屑的混合物。回收银时,他们将一定量的上述金属混合物加入到含硝酸银的废液中,充分反应后过滤,得到固体和浅绿色滤液,下列说法不正确的是
A.该固体中一定含有银,可能含有铁 B.上述过程中,先后发生了两个反应
C.该滤液中大量存在的离子有3种 D.该滤液中的溶质有2种或3种物质
4.下列根据某些性质区分一些常见物质的方法错误的是
A.羊毛和涤纶:灼烧闻气味 B.硫酸铵和氯化铵:加熟石灰研磨
C.铜片和黄铜片:相互刻画 D.氧气和二氧化碳:伸入燃着的木条
5.如图是某反应的微观示意图,下列有关该反应的说法不正确的是
A.属于氧化反应 B.相对分子质量最小的是NH3
C.生成丙和丁的质量比为1:3 D.氢元素的化合价在反应前后没有变化
6.做门窗的“铝合金”是一种比较理想的装潢材料,它属于
A.纯净物 B.化合物 C.单质 D.混合物
7.铝跟盐酸或氢氧化钠溶液都能反应且产生H2。反应的化学方程式如下:2Al + 6HCl = 2AlCl3 + 3H2↑;2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。甲、乙两烧杯中各盛有109.5g 10%的盐酸和120g 10%NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体质量比为甲∶乙=1∶2,则加入铝粉的质量为
A.1.8g B.2.7g C.3.6g D.5.4g
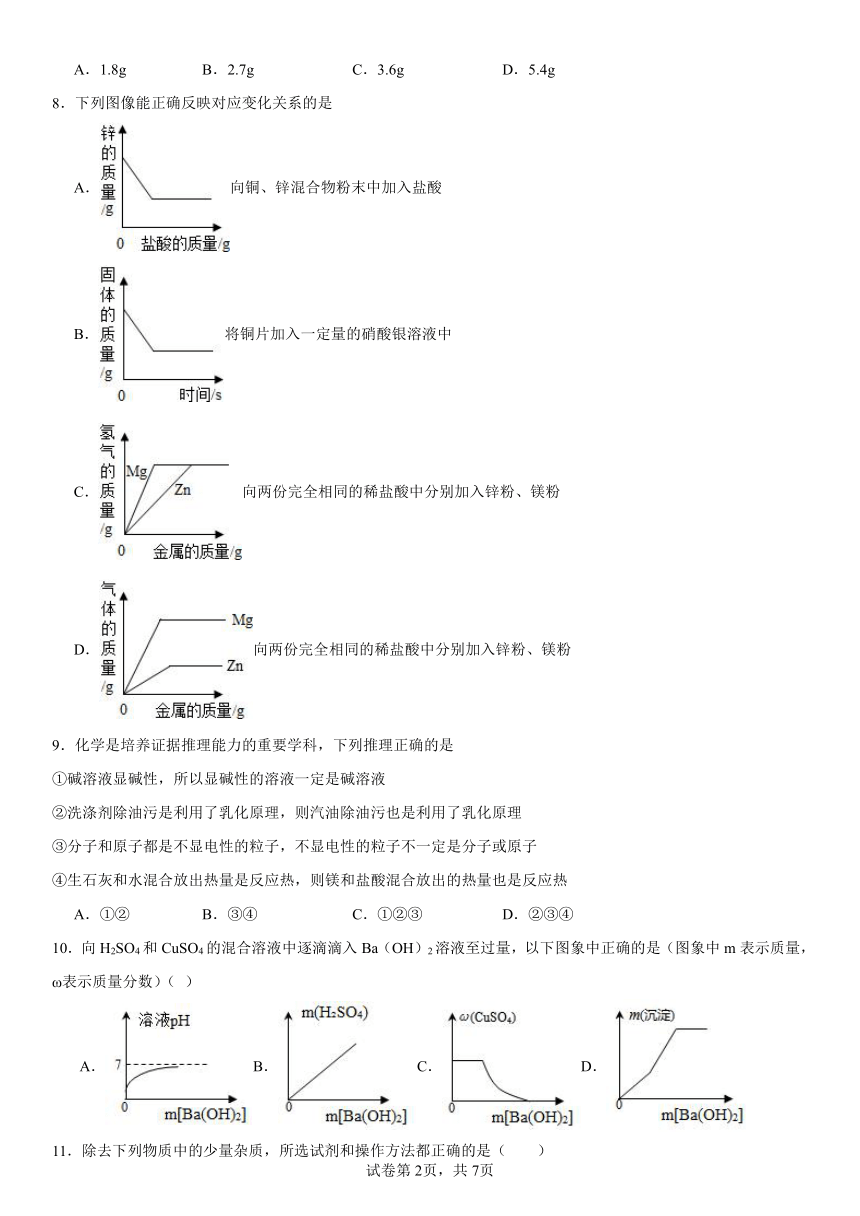
8.下列图像能正确反映对应变化关系的是
A.向铜、锌混合物粉末中加入盐酸
B.将铜片加入一定量的硝酸银溶液中
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
9.化学是培养证据推理能力的重要学科,下列推理正确的是
①碱溶液显碱性,所以显碱性的溶液一定是碱溶液
②洗涤剂除油污是利用了乳化原理,则汽油除油污也是利用了乳化原理
③分子和原子都是不显电性的粒子,不显电性的粒子不一定是分子或原子
④生石灰和水混合放出热量是反应热,则镁和盐酸混合放出的热量也是反应热
A.①② B.③④ C.①②③ D.②③④
10.向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液至过量,以下图象中正确的是(图象中m表示质量,ω表示质量分数)( )
A.B.C.D.
11.除去下列物质中的少量杂质,所选试剂和操作方法都正确的是( )
选项 物质 杂质 除杂试剂或操作方法
A Cu(NO3)2溶液 AgNO3 加过量铁粉,过滤
B 氨气 水蒸气 通过足量的氢氧化钠固体干燥
C KCl固体 KClO3 加少量二氧化锰,加热
D NH4HCO3固体 NaCl 加热
A.A B.B C.C D.D
12.A~E是初中化学常见物质。其中A、C、D均含碳元素,且C、D组成元素相同。E广泛用于玻璃、造纸的生产。“—”表示两种物质间会反应,“→”表示一种物质会一步转化成另一种物质,部分反应物、生成物和反应条件已略去。下列说法不正确的是
A.A可通过置换反应生成D B.B一定是氢氧化钙
C.C可用作燃料 D.A-E五种物质中一定没有酸
13.下列实验现象的描述不正确的是
A.一氧化碳通过灼热的氧化铁,固体由红色变为黑色
B.未打磨的铝丝伸入硝酸银溶液中,无明显现象
C.向氢氧化镁中加入硫酸铜产生蓝色沉淀
D.打开盛有浓盐酸的试剂瓶瓶盖,瓶口出现白雾
14.下列图像能正确反映其对应关系的是
A. 向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
B. 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸
C. 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
D. 向盛有稀硫酸的烧杯中不断加水稀释
二、填空与简答
15.用适当的化学语言表示下列物质。
①高锰酸钾中锰元素的化合价: ;
②烧碱: ;
③瓦斯: ;
④碱式碳酸铜: ;
⑤地壳中含量最高的金属元素与非金属组成的化合物: ;
16.世界是物质的,物质是由各种化学元素组成的,请你写出下列物质的化学式:
(1)“西气东输”工程中输送的气体是 ;
(2)水银不是银,是一种金属的俗称,这种金属是 ;
(3)氧元素的质量分数最多的氧化物是 。
17.化学就在我们身边。现有:①石墨;②氯化钠;③小苏打;④碳酸钙;⑤熟石灰;⑥二氧化碳。请选择适当的物质填空(填序号)。
(1)可用于焙制糕点的是 。
(2)常用作建筑装饰材料的是 。
(3)可用于腌制咸菜的是 。
(4)可作干电池电极的是 。
(5)可用于改良酸性土壤的是 。
18.正值初夏,家住寨阳的小李同学周末邀请同学去绿道野炊。
(1)早上:早上阳光明媚,但天气还是稍有凉意,小李同学穿了一件透气保暖的羊毛衫,因为它是由 材料制成的(填合成纤维或天然纤维)。
(2)上午:在绿道游玩的过程中,小李和同学们闻到了扑鼻的花香,这是因为 ;
(3)中午:生火时,小李选择用枯草引燃木炭,这样做的目的是 ;小李发现炒菜的锅有点生锈了,铁锅生锈的原因是 反应的结果;
(4)下午:回家的路上,同学们看到有一户人家准备刷墙,他们看到工人伯伯们将购买回来的一袋一袋的生石灰浸泡到了水里,小李立马想到了其中发生的化学反应的化学方程式是 。
19.化学与我们的生产、生活息息相关。
(1)生活:人们常用 的方法来降低水的硬度。
(2)健康:人体应适量摄入 元素,以防引起甲状腺肿大。
(3)学习:制作铅笔芯所用碳单质的名称是 。
(4)交通:自行车链条通常采取的防锈措施是 。
(5)衣服:纯棉、涤纶和蚕丝三种布料中, 的强度高、弹性好、耐磨和耐化学腐蚀。
20.已知固体混合物A是Na2CO3、KNO3和KC1三种物质中的两种,固体混合物B可能含有NH4Cl、CuO、Cu(NO3)2三种物质中的一种或多种。现欲探究这两种固体混合物的组成,按如图所示进行实验,出现的现象如图中所述。(假设过程中所有发生的反应都恰好完全反应)
试根据实验过程或发生的现象做出判断,填写以下空白:
(1)气体C是 (填化学式)。
(2)混合物B中一定存在的物质是 (填化学式)。
(3)滤液H中一定大量存在的阳离子有 (填离子符号)。
21.氯化亚铜(CuCl)常用作催化剂、杀菌剂、脱色剂等。工业上用印刷电路的蚀刻液的废液(含、、)生产CuCl并制得蚀刻液的流程如图所示。
【查阅资料】
①CuCl是一种白色晶体,不溶于乙醇而溶于氨水,在空气中迅速氧化,变成绿色,见光分解,变成褐色;
②
(1)写出向废液中加入过量铁粉后发生置换反应的化学方程式 。
(2)滤渣2的成分是 (写化学式)。
(3)滤液1、2合并后与溶液反应生成蚀刻液的化学方程式为,则X的化学式为 。
(4)在CuCl的生产过程中,除环境、安全问题外,你认为还应注意的关键问题是 。
三、科学探究题
22.有一瓶红色粉末,由铜和氧化铁中的一种或两种组成。某化学兴趣小组对该红色粉末的组成进行了探究。
【设计实验】实验装置如图,实验步骤如下:
(1)连接好装置并检查气密性。
(2)装入药品,通入一段时间一氧化碳。
(3)继续缓缓通入一氧化碳,点燃酒精喷灯,使反应充分进行。
(4)完全反应后熄灭酒精喷灯,继续通入一氧化碳至恢复到室温。
【讨论交流】
(1)反应前通入一段时间一氧化碳的目的是 。
(2)甲同学提出,为了防止溶液倒吸,熄灭酒精喷灯前应先断开装置A和B的连接,你认为是否需要并说明理由: 。
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,点燃前应对气体 。
【进行实验】该小组同学按上述步骤进行实验,观察到以下现象,确定该红色粉末由铜和氧化铁组成。
(1)硬质玻璃管中出现黑色物质,对应的化学方程式为 。
(2)澄清石灰水变浑浊,对应的化学方程式为 。
(3)完全反应后硬质玻璃管中仍有红色固体剩余。
【定量分析】上述实验中,测得某些实验数据如下表。请通过计算进一步确定该红色粉末中各成分的质量比: 。
反应前 红色粉末的质量 8.0g
硬质玻璃管的质量 64.6g
反应后 硬质玻璃管和其中固体的总质量 70.8g
【拓展探究】将上述实验反应后硬质玻璃管中的固体研磨成粉末。
(1)取少量粉末于小烧杯中,向其中加入足量稀盐酸,充分反应,你能观察到的现象有: 。
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,充分反应后过滤。向滤渣中滴加稀盐酸,有气泡产生,则滤渣为 (写化学式,下同),滤液中的溶质为 。
四、计算题
23.某兴趣小组为测定一包碳酸钠样品中碳酸钠的质量分数,进行实验.测得相关数据如图所示:
提示:①反应原理:
②样品中的杂质不参加反应
③计算结果保留一位小数
(1)根据质量守恒定律,反应生成二氧化碳的质量为 g.
(2)计算该样品中碳酸钠的质量分数.(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 潮湿,疏松的土壤中含有较多的空气和水分,满足铁生锈的条件,铁锈蚀较快,选项错误;
B.酸性环境能加快铁的锈蚀,选项错误;
C.干燥、致密、不透气的土壤中含有氧气和水分较少,铁锈蚀的速度较慢,选项正确
D. 含砂较多,潮湿透气的土壤中含有较多的空气和水分,满足铁生锈的条件,铁锈蚀较快,选项错误,故选C。
2.C
【详解】A、上述反应共涉及到二种氧化物,二氧化碳和水,不正确;
B、C、O、N四种元素均位于周期表第二周期 ,而H、元素位于第一周期,不正确;
C、尿素含氮高,是一种很好的氮肥是正确的叙述,正确;
D、尿素种含有C、O原子,不含有CO分子,不正确;
故选C。
3.C
【分析】将一定量的上述金属混合物加入到含硝酸银的废液中,锌先与硝酸银反应生成硝酸锌和银,待锌完全反应后,铁和硝酸银反应生成硝酸亚铁和银,充分反应后过滤,得到固体和浅绿色滤液,说明铁参与了反应,锌已经完全反应。
【详解】A、由分析可知,锌已经完全反应,锌和铁与硝酸银反应生成了银,故该固体中一定含银,可能含铁,选项正确;
B、上述过程中,先后发生了锌和硝酸银反应生成硝酸锌和银,铁和硝酸银反应生成硝酸亚铁和银两个反应,选项正确;
C、该滤液中含锌和硝酸银反应生成的硝酸锌,铁和硝酸银反应生成的硝酸亚铁,可能含硝酸银,故该滤液中一定大量存在的离子是锌离子和亚铁离子,选项错误,符合题意;
D、由C可知,该滤液中一定含硝酸锌和硝酸亚铁,可能含硝酸银,故该滤液中的溶质有2种或3种物质,选项正确。
故选C。
4.B
【详解】A、羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味,涤纶灼烧无此气味,现象不同,可以区分,不符合题意;
B、硫酸铵和氯化铵均属于铵态氮肥,均能与熟石灰反应生成氨气,均能产生刺激性气味,现象相同,无法区分,符合题意;
C、黄铜是铜的合金,合金比组成它的纯金属的硬度大,故铜片和黄铜片相互刻划,铜片上留下痕迹,不符合题意;
D、氧气具有助燃性,能使燃着的木条燃烧的更旺,二氧化碳不燃烧、不支持燃烧,能使燃着的木条熄灭,现象不同,可以区分,不符合题意。
故选B。
5.C
【详解】A、由图可知,甲为NH3、乙为O2、丙为N2、丁为H2O,则该反应为氨气和氧气的反应,则属于氧化反应,该选项说法正确;
B、NH3、O2、N2、H2O的相对分子质量分数为14+1×3=17、16×2=32、14×2=28、1×2+16=18,则相对分子质量最小的是NH3,该选项说法正确;
C、该反应的化学方程式为:,则生成丙和丁的质量比为(2×28):(6×18)=14:27,该选项说法不正确;
D、反应前后氢元素均在化合物中,化合价均为+1价,则反应前后氢元素化合价不变,该选项说法正确。
故选C。
6.D
【详解】“铝合金”是由铝与其它金属或非金属熔合而成的具有铝的性质的物质,所以“铝合金”属于混合物。
故选D。
7.D
【详解】根据2Al + 6HCl = 2AlCl3 + 3H2↑;2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑和加入等质量的铝粉,甲、乙两烧杯中各盛有109.5g 10%的盐酸和120g 10%NaOH溶液,反应结束后测得生成的气体质量比为甲∶乙=1∶2,分析知盐酸为不足量,与盐酸反应的铝粉有剩余。
解∶设铝粉的质量为m,盐酸产生的氢气质量为x,氢氧化钠溶液产生的氢气质量为y
2Al + 6HCl = 2AlCl3 + 3H2↑
36.5×6 6
109.5g ×10% x
= ,x=0.3g
y=0.3g×2=0.6g
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
54 6
m 0.6g
=,m=5.4g。故选D。
8.C
【详解】A、中加入盐酸后锌会反应直到反应完,锌的质量会变为零,不符合题意;
B、中加入铜片后会置换出溶液中的银,固体的质量会增加,不符合题意;
C、加入的酸的质量相等,所以里面含有的氢元素的质量也是相等的,而镁的金属活动性大于锌,故其反应更快,符合题意;
D、加入的金属质量持续增加,金属是过量的,最后得到的氢气的质量是相等的,不符合题意。
故选C。
9.B
【详解】①显碱性的溶液不一定是碱溶液,例如碳酸钠溶液显碱性,也能使酚酞试液变红色,该选项说法不正确;
②洗涤剂除油污是利用乳化原理,则汽油除油污是利用了溶解原理,该选项说法不正确。
③分子和原子都是不显电性的粒子,不显电性的粒子不一定是分子或原子,可能中子,说法正确;
④生石灰和水、镁和盐酸混合都发生了化学反应。生石灰和水混合放出热量是反应热,则镁和盐酸混合放出的热量也是反应热,说法正确
综上所述:推理正确的是③④。故选:B。
10.D
【分析】硫酸和氢氧化钡反应生成硫酸钡和水,硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀。
【详解】A、向和的混合溶液中逐滴滴入溶液至过量,因为溶液显碱性,最终pH>7,图象与事实不符,故A不正确;
B、向和的混合溶液中逐滴滴入溶液,随着溶液的不断加入,不断消耗,质量不断减小,图象与事实不符,故B不正确;
C、随着溶液的不断加入,溶液质量不断增加,的质量分数不断减小,图象与事实不符,故C不正确;
D、向和的混合溶液中逐滴滴入溶液,与会发生中和反应,生成水和BaSO4沉淀;当反应完,与反应生成
和 两种沉淀;当反应完毕,即使不断加入,也不会产生沉淀了,图象与事实相符,故D正确。故选D。
11.B
【详解】A、Cu(NO3)2溶液和AgNO3均能与过量铁粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;
B、氢氧化钠固体具有吸水性,且不与氨气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
C、KClO3在二氧化锰的催化作用下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,能除去杂质但引入了新的杂质二氧化锰,不符合除杂原则,故选项所采取的方法错误;
D、NH4HCO3固体在加热条件下生成氨气、水和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选B。
12.B
【分析】A、C、D均含碳元素,且C、D组成元素相同,所以C、D分别一氧化碳和二氧化碳中的一种;E广泛用于玻璃、造纸的生产,E是碳酸钠,D和E可以相互转化,所以D是二氧化碳,C是一氧化碳,A可以转化为C、D,且含有碳元素,所以A为碳单质;B既可以和D二氧化碳反应,也可以和E碳酸钠反应,所以B为氢氧化钙或氢氧化钡等,代入验证,符合题意。
【详解】A、由上述分析可知,碳单质可以通过还原金属氧化物转化为二氧化碳和金属单质,该反应属于置换反应,所以A可通过置换反应生成D,故A正确;
B、由上述分析可知,B是氢氧化钙或氢氧化钡,故B错误;
C、由上述分析可知,C是一氧化碳,具有可燃性,可以作燃料,故C正确;
D、由上述分析可知,A为碳单质、B为氢氧化钙或氢氧化钡、C是一氧化碳、D是二氧化碳、E是碳酸钠,A-E五种物质中一定没有酸,故D正确。
故选B。
13.C
【详解】A、一氧化碳通过灼热的氧化铁,反应生成铁和二氧化碳,可观察到固体由红色变为黑色,故A正确;
B、铝在常温下,与氧气反应生成氧化铝,覆盖在铝丝表面,氧化铝不能与硝酸银反应,所以未打磨的铝丝伸入硝酸银溶液中,无明显现象,故B正确;
C、氢氧化镁难溶于水,所以向氢氧化镁中加入硫酸铜,无明显现象,故C错误;
D、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶瓶盖,挥发出的氯化氢气体与空气中的水蒸气结合成盐酸小液滴,瓶口出现白雾,故D正确;
故选:C。
14.B
【详解】A、酸质量相等,金属过量,最终产生氢气质量相等,产生相同质量的氢气时,消耗的锌的质量应大于铁的质量,与图像不符;
B、向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸,稀盐酸会先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成二氧化碳氯化钠和水,与图像相符,故选B;
C、催化剂只能改变反应速率,不能改变生成物的多少,用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气,生成氧气质量应该相等,与图像不符;
D、加水稀释只会使稀硫酸酸性减弱,不可能pH大于7,变为碱性,与图像不符。
【点睛】该题是一道图像题,图像题的难点在于图像信息和文字信息的转化,然后和实际反应情况对应是否相符。
15. NaOH CH4 Cu2(OH)2CO3 Al2O3
【详解】①高锰酸钾的化学式为,钾元素为+1价,氧元素为-2价,设锰元素的化合价为x,根据化学式中元素化合价代数和为0有,解得x=+7,即高锰酸钾中锰元素为+7价,元素化合价要标在元素符号正上方,则高锰酸钾中锰元素的化合价表示为;
②氢氧化钠俗称火碱、烧碱、苛性钠,化学式为NaOH;
③甲烷广泛存在于天然气、可燃冰、坑道煤气、瓦斯等物质中,化学式为;
④碱式碳酸铜属于复盐,根据复盐读法和书写规则,碱式碳酸铜的化学式为;
⑤地壳中含量最高的金属元素为Al,含量最高的非金属为O,组成的化合物为三氧化二铝,化学式为。
16. CH4 Hg H2O2
【详解】(1)“西气东输”工程中输送的气体是天然气,其主要成分是甲烷,其化学式为:CH4.
(2)水银不是银,是一种金属的俗称,这种金属是汞,其化学式为:Hg.
(3)氧元素的质量分数最多的氧化物是过氧化氢,其化学式为:H2O2.
故答案为(1)CH4;(2)Hg;(3)H2O2.
17. ③ ④ ② ① ⑤
【详解】(1)小苏打受热会分解产生二氧化碳气体使糕点疏松多孔,因此可用于焙制糕点;故填:③。
(2)常用作建筑装饰材料的是碳酸钙;故填:④。
(3)氯化钠是生活中常用的调味品,因此可用于腌制咸菜的是氯化钠;故填:②。
(4)石墨具有优良的导电性,可作干电池电极;故填:①。
(5)熟石灰是一种碱,能与酸性物质反应,可用于改良酸性土壤;故填:⑤。
18. 天然纤维 分子在不断运动 使温度达到木炭的着火点 铁与空气中的氧气和水
【详解】(1)羊毛衫由羊毛制成,羊毛属于天然纤维;
(2)闻到了扑鼻的花香,是因为分子在不断运动,引起花香的分子四处扩散;
(3)选择用枯草引燃木炭,是因为枯草的着火点低,枯草燃烧放出热量,可使温度达到木炭的着火点;
铁锅生锈是因为铁与空气中的氧气和水发生了一系列的化学反应;
(4)生石灰是氧化钙的俗称,氧化钙和水反应生成氢氧化钙,该反应的化学方程式为:。
19.(1)煮沸
(2)碘/I
(3)石墨
(4)涂油
(5)涤纶
【详解】(1)生活中可以使用加热煮沸的方法降低水的硬度,煮沸时水中的可溶性的钙镁化合物转化为沉淀,水的硬度降低;
(2)碘是合成甲状腺激素的主要元素,人体应适量摄入碘元素,以预防甲状腺肿大;
(3)石墨质软,石墨是制作铅笔芯所用的碳单质;
(4)铁生锈需要和氧气、水接触,自行车链条通常采取的防锈措施是涂油,阻止铁和氧气、水接触,达到防锈的目的;
(5)合成纤维性质稳定,具有耐腐蚀的优点,且强度高、弹性好,涤纶是合成纤维,故填:涤纶。
20.(1)CO2
(2)NH4Cl、Cu(NO3)2
(3)Na+、H+
【分析】已知固体混合物A是Na2CO3、KNO3和KC1三种物质中的两种,加入稀硫酸有气体C生成,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,故固体混合物A中一定有碳酸钠,溶液D中一定的生成的硫酸钠,固体混合物B可能含有NH4Cl、CuO、Cu(NO3)2三种物质中的一种或多种,加入适量的氢氧化钡有蓝色沉淀生成和气体生成,硝酸铜与氢氧化钡反应生成的蓝色氢氧化铜沉淀,氢氧化钡与氯化铵反应生成氨气,说明固体混合物B中一定含有NH4Cl、Cu(NO3)2,滤液E中一定有硝酸铜与氢氧化钡反应生成的硝酸钡,氢氧化钡与氯化铵反应生成的氯化钡,则溶液D与滤液E混合,硫酸钠与硝酸钡和氯化钡反应生成硫酸钡沉淀和硝酸钠与氯化钠,加入硝酸,硫酸钡、硝酸钠和氯化钠都不与硝酸反应,则白色沉淀I是硫酸钡,滤液H中一定有硝酸钠与氯化钠和硝酸。
【详解】(1)由分析可知,气体C是二氧化碳,化学式为CO2。
(2)由分析可知,混合物B中一定存在的物质是NH4Cl、Cu(NO3)2。
(3)由分析可知,滤液H中一定大量存在酸钠与氯化钠和硝酸,故滤液H中一定大量存在的阳离子有Na+、H+。
【点睛】
21.(1)
(2)Cu
(3)
(4)防止氯化亚铜氧化和见光分解
【分析】向废液(含FeCl3、CuCl2、FeCl2)中加入过量铁粉时,铁和氯化铁反应生成氯化亚铁,铁和氯化铜反应生成氯化亚铁和铜,铁不能和氯化亚铁反应,则过滤后的滤液1中含有氯化亚铁,滤渣1中含有生成的铜和过量的铁粉;向滤渣1中加入过量的盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不能和盐酸反应,则滤液2中含有生成的氯化亚铁和过量的盐酸,滤渣2中含有铜;滤液1和滤液2中主要成分是氯化亚铁,氯化亚铁和过氧化氢溶液反应生成氯化铁;滤渣2中是铜,铜和浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水,硫酸铜、二氧化硫和氯化铜经过一系列操作可以得到CuCl晶体。
【详解】(1)加入过量铁粉,铁和氯化铜发生置换反应生成铜和氯化亚铁,化学方程式为:;
(2) 根据上述分析可知,滤液1中溶质为氯化亚铁,滤渣1为铜和铁,滤渣1加入过量稀盐酸,铁和稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,故滤渣2为铜,化学式为Cu;
(3)根据质量守恒定律,反应前后原子的种类、数目不变,反应前共有4个氢原子、2个氧原子、2个铁原子、6个氯原子,反应后共有2个铁原子、6个氯原子,故2X需提供4个氢原子、2个氧原子,故X的化学式为H2O;
(4)由查阅资料可知,氯化亚铜易氧化变质且见光分解,所以生产中应防止氯化亚铜氧化和见光分解,减少产品氯化亚铜的损失。
22. 排出装置中的空气,防止一氧化碳混有一定量的空气,高温时爆炸 不需要,因为熄灭酒精喷灯后还要继续通入一氧化碳至恢复到室温 验纯 铜和氧化铁的质量比为1∶3 产生无色气体,溶液变为浅绿色,有红色固体残留 Fe、Cu、Ag Fe(NO3)2
【详解】讨论交流:
(1)反应前通入一段时间一氧化碳的目的是:一氧化碳具有可燃性,可燃性气体混有一定量的空气,遇明火容易发生爆炸,故先通入一段时间一氧化碳,将装置内的空气排尽,防止发生爆炸;
(2)不需要,因为熄灭酒精喷灯后,还要继续通一段时间一氧化碳至恢复至室温;
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,一氧化碳具有可燃性,混有一定量的空气,遇明火容易发生爆炸,故点燃前应对气体验纯;
进行实验:
(1)硬质玻璃管中出现黑色物质,是因为氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为:;
(2)澄清石灰水变浑浊是因为氢氧化钙与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:;
定量分析:,反应后,装置内减少的质量为氧化铁中氧元素的质量,氧元素的质量为:64.6g+8.0g-70.8g=1.8g,红色粉末中氧化铁的质量为:,红色粉末中铜的质量为:8.0g-6g=2g,故红色粉末中铜和氧化铁的质量比为:2g:6g=1:3;
拓展研究:
(1)将上述实验反应后硬质玻璃管中的固体研磨成粉末,取少量粉末于烧杯中,加入足量稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,故实验现象为:有气泡生成,溶液变为浅绿色,有红色固体残留;
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,铁先与硝酸银反应生成硝酸亚铁和银,待铁完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,说明铁过量,硝酸银已经完全被置换,铜未参与反应,故滤渣为:Fe、Cu、Ag;
铁过量,说明只有铁和硝酸银发生了反应生成了硝酸亚铁和银,且硝酸银已经完全反应,故滤液中的溶质为:Fe(NO3)2。
23.(1)4.4
(2)解:设该样品中碳酸钠的质量分数为x
x≈88.3%
答:该样品中碳酸钠的质量分数为88.3%
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量不变,则生成二氧化碳的质量为:12.0g+100.0g-107.6g=4.4g;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.在下列各种情况下,埋在地下的输油铸铁管道被腐蚀速度最慢的是
A.在潮湿,疏松的土壤中
B.在含铁元素较多的酸性土壤中
C.在干燥、致密、不透气的土壤中
D.在含砂粒较多,潮湿透气的土壤中
2.用CO2和NH3反应合成尿素[CO(NH2)2]是固定和利用CO2的成功范例,化学反应方程式为: CO2+2NH3 CO(NH2)2+H2O,下列说法正确的是
A.上述反应共涉及到三种氧化物
B.C、H、O、N四种元素均位于周期表第二周期
C.尿素含氮高,是一种很好的氮肥
D.尿素种含有CO分子
3.某活动小组从工厂收集到了一些含有硝酸银的废液以及废铁屑、废锌屑的混合物。回收银时,他们将一定量的上述金属混合物加入到含硝酸银的废液中,充分反应后过滤,得到固体和浅绿色滤液,下列说法不正确的是
A.该固体中一定含有银,可能含有铁 B.上述过程中,先后发生了两个反应
C.该滤液中大量存在的离子有3种 D.该滤液中的溶质有2种或3种物质
4.下列根据某些性质区分一些常见物质的方法错误的是
A.羊毛和涤纶:灼烧闻气味 B.硫酸铵和氯化铵:加熟石灰研磨
C.铜片和黄铜片:相互刻画 D.氧气和二氧化碳:伸入燃着的木条
5.如图是某反应的微观示意图,下列有关该反应的说法不正确的是
A.属于氧化反应 B.相对分子质量最小的是NH3
C.生成丙和丁的质量比为1:3 D.氢元素的化合价在反应前后没有变化
6.做门窗的“铝合金”是一种比较理想的装潢材料,它属于
A.纯净物 B.化合物 C.单质 D.混合物
7.铝跟盐酸或氢氧化钠溶液都能反应且产生H2。反应的化学方程式如下:2Al + 6HCl = 2AlCl3 + 3H2↑;2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。甲、乙两烧杯中各盛有109.5g 10%的盐酸和120g 10%NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体质量比为甲∶乙=1∶2,则加入铝粉的质量为
A.1.8g B.2.7g C.3.6g D.5.4g
8.下列图像能正确反映对应变化关系的是
A.向铜、锌混合物粉末中加入盐酸
B.将铜片加入一定量的硝酸银溶液中
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
9.化学是培养证据推理能力的重要学科,下列推理正确的是
①碱溶液显碱性,所以显碱性的溶液一定是碱溶液
②洗涤剂除油污是利用了乳化原理,则汽油除油污也是利用了乳化原理
③分子和原子都是不显电性的粒子,不显电性的粒子不一定是分子或原子
④生石灰和水混合放出热量是反应热,则镁和盐酸混合放出的热量也是反应热
A.①② B.③④ C.①②③ D.②③④
10.向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液至过量,以下图象中正确的是(图象中m表示质量,ω表示质量分数)( )
A.B.C.D.
11.除去下列物质中的少量杂质,所选试剂和操作方法都正确的是( )
选项 物质 杂质 除杂试剂或操作方法
A Cu(NO3)2溶液 AgNO3 加过量铁粉,过滤
B 氨气 水蒸气 通过足量的氢氧化钠固体干燥
C KCl固体 KClO3 加少量二氧化锰,加热
D NH4HCO3固体 NaCl 加热
A.A B.B C.C D.D
12.A~E是初中化学常见物质。其中A、C、D均含碳元素,且C、D组成元素相同。E广泛用于玻璃、造纸的生产。“—”表示两种物质间会反应,“→”表示一种物质会一步转化成另一种物质,部分反应物、生成物和反应条件已略去。下列说法不正确的是
A.A可通过置换反应生成D B.B一定是氢氧化钙
C.C可用作燃料 D.A-E五种物质中一定没有酸
13.下列实验现象的描述不正确的是
A.一氧化碳通过灼热的氧化铁,固体由红色变为黑色
B.未打磨的铝丝伸入硝酸银溶液中,无明显现象
C.向氢氧化镁中加入硫酸铜产生蓝色沉淀
D.打开盛有浓盐酸的试剂瓶瓶盖,瓶口出现白雾
14.下列图像能正确反映其对应关系的是
A. 向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
B. 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸
C. 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
D. 向盛有稀硫酸的烧杯中不断加水稀释
二、填空与简答
15.用适当的化学语言表示下列物质。
①高锰酸钾中锰元素的化合价: ;
②烧碱: ;
③瓦斯: ;
④碱式碳酸铜: ;
⑤地壳中含量最高的金属元素与非金属组成的化合物: ;
16.世界是物质的,物质是由各种化学元素组成的,请你写出下列物质的化学式:
(1)“西气东输”工程中输送的气体是 ;
(2)水银不是银,是一种金属的俗称,这种金属是 ;
(3)氧元素的质量分数最多的氧化物是 。
17.化学就在我们身边。现有:①石墨;②氯化钠;③小苏打;④碳酸钙;⑤熟石灰;⑥二氧化碳。请选择适当的物质填空(填序号)。
(1)可用于焙制糕点的是 。
(2)常用作建筑装饰材料的是 。
(3)可用于腌制咸菜的是 。
(4)可作干电池电极的是 。
(5)可用于改良酸性土壤的是 。
18.正值初夏,家住寨阳的小李同学周末邀请同学去绿道野炊。
(1)早上:早上阳光明媚,但天气还是稍有凉意,小李同学穿了一件透气保暖的羊毛衫,因为它是由 材料制成的(填合成纤维或天然纤维)。
(2)上午:在绿道游玩的过程中,小李和同学们闻到了扑鼻的花香,这是因为 ;
(3)中午:生火时,小李选择用枯草引燃木炭,这样做的目的是 ;小李发现炒菜的锅有点生锈了,铁锅生锈的原因是 反应的结果;
(4)下午:回家的路上,同学们看到有一户人家准备刷墙,他们看到工人伯伯们将购买回来的一袋一袋的生石灰浸泡到了水里,小李立马想到了其中发生的化学反应的化学方程式是 。
19.化学与我们的生产、生活息息相关。
(1)生活:人们常用 的方法来降低水的硬度。
(2)健康:人体应适量摄入 元素,以防引起甲状腺肿大。
(3)学习:制作铅笔芯所用碳单质的名称是 。
(4)交通:自行车链条通常采取的防锈措施是 。
(5)衣服:纯棉、涤纶和蚕丝三种布料中, 的强度高、弹性好、耐磨和耐化学腐蚀。
20.已知固体混合物A是Na2CO3、KNO3和KC1三种物质中的两种,固体混合物B可能含有NH4Cl、CuO、Cu(NO3)2三种物质中的一种或多种。现欲探究这两种固体混合物的组成,按如图所示进行实验,出现的现象如图中所述。(假设过程中所有发生的反应都恰好完全反应)
试根据实验过程或发生的现象做出判断,填写以下空白:
(1)气体C是 (填化学式)。
(2)混合物B中一定存在的物质是 (填化学式)。
(3)滤液H中一定大量存在的阳离子有 (填离子符号)。
21.氯化亚铜(CuCl)常用作催化剂、杀菌剂、脱色剂等。工业上用印刷电路的蚀刻液的废液(含、、)生产CuCl并制得蚀刻液的流程如图所示。
【查阅资料】
①CuCl是一种白色晶体,不溶于乙醇而溶于氨水,在空气中迅速氧化,变成绿色,见光分解,变成褐色;
②
(1)写出向废液中加入过量铁粉后发生置换反应的化学方程式 。
(2)滤渣2的成分是 (写化学式)。
(3)滤液1、2合并后与溶液反应生成蚀刻液的化学方程式为,则X的化学式为 。
(4)在CuCl的生产过程中,除环境、安全问题外,你认为还应注意的关键问题是 。
三、科学探究题
22.有一瓶红色粉末,由铜和氧化铁中的一种或两种组成。某化学兴趣小组对该红色粉末的组成进行了探究。
【设计实验】实验装置如图,实验步骤如下:
(1)连接好装置并检查气密性。
(2)装入药品,通入一段时间一氧化碳。
(3)继续缓缓通入一氧化碳,点燃酒精喷灯,使反应充分进行。
(4)完全反应后熄灭酒精喷灯,继续通入一氧化碳至恢复到室温。
【讨论交流】
(1)反应前通入一段时间一氧化碳的目的是 。
(2)甲同学提出,为了防止溶液倒吸,熄灭酒精喷灯前应先断开装置A和B的连接,你认为是否需要并说明理由: 。
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,点燃前应对气体 。
【进行实验】该小组同学按上述步骤进行实验,观察到以下现象,确定该红色粉末由铜和氧化铁组成。
(1)硬质玻璃管中出现黑色物质,对应的化学方程式为 。
(2)澄清石灰水变浑浊,对应的化学方程式为 。
(3)完全反应后硬质玻璃管中仍有红色固体剩余。
【定量分析】上述实验中,测得某些实验数据如下表。请通过计算进一步确定该红色粉末中各成分的质量比: 。
反应前 红色粉末的质量 8.0g
硬质玻璃管的质量 64.6g
反应后 硬质玻璃管和其中固体的总质量 70.8g
【拓展探究】将上述实验反应后硬质玻璃管中的固体研磨成粉末。
(1)取少量粉末于小烧杯中,向其中加入足量稀盐酸,充分反应,你能观察到的现象有: 。
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,充分反应后过滤。向滤渣中滴加稀盐酸,有气泡产生,则滤渣为 (写化学式,下同),滤液中的溶质为 。
四、计算题
23.某兴趣小组为测定一包碳酸钠样品中碳酸钠的质量分数,进行实验.测得相关数据如图所示:
提示:①反应原理:
②样品中的杂质不参加反应
③计算结果保留一位小数
(1)根据质量守恒定律,反应生成二氧化碳的质量为 g.
(2)计算该样品中碳酸钠的质量分数.(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 潮湿,疏松的土壤中含有较多的空气和水分,满足铁生锈的条件,铁锈蚀较快,选项错误;
B.酸性环境能加快铁的锈蚀,选项错误;
C.干燥、致密、不透气的土壤中含有氧气和水分较少,铁锈蚀的速度较慢,选项正确
D. 含砂较多,潮湿透气的土壤中含有较多的空气和水分,满足铁生锈的条件,铁锈蚀较快,选项错误,故选C。
2.C
【详解】A、上述反应共涉及到二种氧化物,二氧化碳和水,不正确;
B、C、O、N四种元素均位于周期表第二周期 ,而H、元素位于第一周期,不正确;
C、尿素含氮高,是一种很好的氮肥是正确的叙述,正确;
D、尿素种含有C、O原子,不含有CO分子,不正确;
故选C。
3.C
【分析】将一定量的上述金属混合物加入到含硝酸银的废液中,锌先与硝酸银反应生成硝酸锌和银,待锌完全反应后,铁和硝酸银反应生成硝酸亚铁和银,充分反应后过滤,得到固体和浅绿色滤液,说明铁参与了反应,锌已经完全反应。
【详解】A、由分析可知,锌已经完全反应,锌和铁与硝酸银反应生成了银,故该固体中一定含银,可能含铁,选项正确;
B、上述过程中,先后发生了锌和硝酸银反应生成硝酸锌和银,铁和硝酸银反应生成硝酸亚铁和银两个反应,选项正确;
C、该滤液中含锌和硝酸银反应生成的硝酸锌,铁和硝酸银反应生成的硝酸亚铁,可能含硝酸银,故该滤液中一定大量存在的离子是锌离子和亚铁离子,选项错误,符合题意;
D、由C可知,该滤液中一定含硝酸锌和硝酸亚铁,可能含硝酸银,故该滤液中的溶质有2种或3种物质,选项正确。
故选C。
4.B
【详解】A、羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味,涤纶灼烧无此气味,现象不同,可以区分,不符合题意;
B、硫酸铵和氯化铵均属于铵态氮肥,均能与熟石灰反应生成氨气,均能产生刺激性气味,现象相同,无法区分,符合题意;
C、黄铜是铜的合金,合金比组成它的纯金属的硬度大,故铜片和黄铜片相互刻划,铜片上留下痕迹,不符合题意;
D、氧气具有助燃性,能使燃着的木条燃烧的更旺,二氧化碳不燃烧、不支持燃烧,能使燃着的木条熄灭,现象不同,可以区分,不符合题意。
故选B。
5.C
【详解】A、由图可知,甲为NH3、乙为O2、丙为N2、丁为H2O,则该反应为氨气和氧气的反应,则属于氧化反应,该选项说法正确;
B、NH3、O2、N2、H2O的相对分子质量分数为14+1×3=17、16×2=32、14×2=28、1×2+16=18,则相对分子质量最小的是NH3,该选项说法正确;
C、该反应的化学方程式为:,则生成丙和丁的质量比为(2×28):(6×18)=14:27,该选项说法不正确;
D、反应前后氢元素均在化合物中,化合价均为+1价,则反应前后氢元素化合价不变,该选项说法正确。
故选C。
6.D
【详解】“铝合金”是由铝与其它金属或非金属熔合而成的具有铝的性质的物质,所以“铝合金”属于混合物。
故选D。
7.D
【详解】根据2Al + 6HCl = 2AlCl3 + 3H2↑;2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑和加入等质量的铝粉,甲、乙两烧杯中各盛有109.5g 10%的盐酸和120g 10%NaOH溶液,反应结束后测得生成的气体质量比为甲∶乙=1∶2,分析知盐酸为不足量,与盐酸反应的铝粉有剩余。
解∶设铝粉的质量为m,盐酸产生的氢气质量为x,氢氧化钠溶液产生的氢气质量为y
2Al + 6HCl = 2AlCl3 + 3H2↑
36.5×6 6
109.5g ×10% x
= ,x=0.3g
y=0.3g×2=0.6g
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
54 6
m 0.6g
=,m=5.4g。故选D。
8.C
【详解】A、中加入盐酸后锌会反应直到反应完,锌的质量会变为零,不符合题意;
B、中加入铜片后会置换出溶液中的银,固体的质量会增加,不符合题意;
C、加入的酸的质量相等,所以里面含有的氢元素的质量也是相等的,而镁的金属活动性大于锌,故其反应更快,符合题意;
D、加入的金属质量持续增加,金属是过量的,最后得到的氢气的质量是相等的,不符合题意。
故选C。
9.B
【详解】①显碱性的溶液不一定是碱溶液,例如碳酸钠溶液显碱性,也能使酚酞试液变红色,该选项说法不正确;
②洗涤剂除油污是利用乳化原理,则汽油除油污是利用了溶解原理,该选项说法不正确。
③分子和原子都是不显电性的粒子,不显电性的粒子不一定是分子或原子,可能中子,说法正确;
④生石灰和水、镁和盐酸混合都发生了化学反应。生石灰和水混合放出热量是反应热,则镁和盐酸混合放出的热量也是反应热,说法正确
综上所述:推理正确的是③④。故选:B。
10.D
【分析】硫酸和氢氧化钡反应生成硫酸钡和水,硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀。
【详解】A、向和的混合溶液中逐滴滴入溶液至过量,因为溶液显碱性,最终pH>7,图象与事实不符,故A不正确;
B、向和的混合溶液中逐滴滴入溶液,随着溶液的不断加入,不断消耗,质量不断减小,图象与事实不符,故B不正确;
C、随着溶液的不断加入,溶液质量不断增加,的质量分数不断减小,图象与事实不符,故C不正确;
D、向和的混合溶液中逐滴滴入溶液,与会发生中和反应,生成水和BaSO4沉淀;当反应完,与反应生成
和 两种沉淀;当反应完毕,即使不断加入,也不会产生沉淀了,图象与事实相符,故D正确。故选D。
11.B
【详解】A、Cu(NO3)2溶液和AgNO3均能与过量铁粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;
B、氢氧化钠固体具有吸水性,且不与氨气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
C、KClO3在二氧化锰的催化作用下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,能除去杂质但引入了新的杂质二氧化锰,不符合除杂原则,故选项所采取的方法错误;
D、NH4HCO3固体在加热条件下生成氨气、水和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选B。
12.B
【分析】A、C、D均含碳元素,且C、D组成元素相同,所以C、D分别一氧化碳和二氧化碳中的一种;E广泛用于玻璃、造纸的生产,E是碳酸钠,D和E可以相互转化,所以D是二氧化碳,C是一氧化碳,A可以转化为C、D,且含有碳元素,所以A为碳单质;B既可以和D二氧化碳反应,也可以和E碳酸钠反应,所以B为氢氧化钙或氢氧化钡等,代入验证,符合题意。
【详解】A、由上述分析可知,碳单质可以通过还原金属氧化物转化为二氧化碳和金属单质,该反应属于置换反应,所以A可通过置换反应生成D,故A正确;
B、由上述分析可知,B是氢氧化钙或氢氧化钡,故B错误;
C、由上述分析可知,C是一氧化碳,具有可燃性,可以作燃料,故C正确;
D、由上述分析可知,A为碳单质、B为氢氧化钙或氢氧化钡、C是一氧化碳、D是二氧化碳、E是碳酸钠,A-E五种物质中一定没有酸,故D正确。
故选B。
13.C
【详解】A、一氧化碳通过灼热的氧化铁,反应生成铁和二氧化碳,可观察到固体由红色变为黑色,故A正确;
B、铝在常温下,与氧气反应生成氧化铝,覆盖在铝丝表面,氧化铝不能与硝酸银反应,所以未打磨的铝丝伸入硝酸银溶液中,无明显现象,故B正确;
C、氢氧化镁难溶于水,所以向氢氧化镁中加入硫酸铜,无明显现象,故C错误;
D、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶瓶盖,挥发出的氯化氢气体与空气中的水蒸气结合成盐酸小液滴,瓶口出现白雾,故D正确;
故选:C。
14.B
【详解】A、酸质量相等,金属过量,最终产生氢气质量相等,产生相同质量的氢气时,消耗的锌的质量应大于铁的质量,与图像不符;
B、向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸,稀盐酸会先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成二氧化碳氯化钠和水,与图像相符,故选B;
C、催化剂只能改变反应速率,不能改变生成物的多少,用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气,生成氧气质量应该相等,与图像不符;
D、加水稀释只会使稀硫酸酸性减弱,不可能pH大于7,变为碱性,与图像不符。
【点睛】该题是一道图像题,图像题的难点在于图像信息和文字信息的转化,然后和实际反应情况对应是否相符。
15. NaOH CH4 Cu2(OH)2CO3 Al2O3
【详解】①高锰酸钾的化学式为,钾元素为+1价,氧元素为-2价,设锰元素的化合价为x,根据化学式中元素化合价代数和为0有,解得x=+7,即高锰酸钾中锰元素为+7价,元素化合价要标在元素符号正上方,则高锰酸钾中锰元素的化合价表示为;
②氢氧化钠俗称火碱、烧碱、苛性钠,化学式为NaOH;
③甲烷广泛存在于天然气、可燃冰、坑道煤气、瓦斯等物质中,化学式为;
④碱式碳酸铜属于复盐,根据复盐读法和书写规则,碱式碳酸铜的化学式为;
⑤地壳中含量最高的金属元素为Al,含量最高的非金属为O,组成的化合物为三氧化二铝,化学式为。
16. CH4 Hg H2O2
【详解】(1)“西气东输”工程中输送的气体是天然气,其主要成分是甲烷,其化学式为:CH4.
(2)水银不是银,是一种金属的俗称,这种金属是汞,其化学式为:Hg.
(3)氧元素的质量分数最多的氧化物是过氧化氢,其化学式为:H2O2.
故答案为(1)CH4;(2)Hg;(3)H2O2.
17. ③ ④ ② ① ⑤
【详解】(1)小苏打受热会分解产生二氧化碳气体使糕点疏松多孔,因此可用于焙制糕点;故填:③。
(2)常用作建筑装饰材料的是碳酸钙;故填:④。
(3)氯化钠是生活中常用的调味品,因此可用于腌制咸菜的是氯化钠;故填:②。
(4)石墨具有优良的导电性,可作干电池电极;故填:①。
(5)熟石灰是一种碱,能与酸性物质反应,可用于改良酸性土壤;故填:⑤。
18. 天然纤维 分子在不断运动 使温度达到木炭的着火点 铁与空气中的氧气和水
【详解】(1)羊毛衫由羊毛制成,羊毛属于天然纤维;
(2)闻到了扑鼻的花香,是因为分子在不断运动,引起花香的分子四处扩散;
(3)选择用枯草引燃木炭,是因为枯草的着火点低,枯草燃烧放出热量,可使温度达到木炭的着火点;
铁锅生锈是因为铁与空气中的氧气和水发生了一系列的化学反应;
(4)生石灰是氧化钙的俗称,氧化钙和水反应生成氢氧化钙,该反应的化学方程式为:。
19.(1)煮沸
(2)碘/I
(3)石墨
(4)涂油
(5)涤纶
【详解】(1)生活中可以使用加热煮沸的方法降低水的硬度,煮沸时水中的可溶性的钙镁化合物转化为沉淀,水的硬度降低;
(2)碘是合成甲状腺激素的主要元素,人体应适量摄入碘元素,以预防甲状腺肿大;
(3)石墨质软,石墨是制作铅笔芯所用的碳单质;
(4)铁生锈需要和氧气、水接触,自行车链条通常采取的防锈措施是涂油,阻止铁和氧气、水接触,达到防锈的目的;
(5)合成纤维性质稳定,具有耐腐蚀的优点,且强度高、弹性好,涤纶是合成纤维,故填:涤纶。
20.(1)CO2
(2)NH4Cl、Cu(NO3)2
(3)Na+、H+
【分析】已知固体混合物A是Na2CO3、KNO3和KC1三种物质中的两种,加入稀硫酸有气体C生成,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,故固体混合物A中一定有碳酸钠,溶液D中一定的生成的硫酸钠,固体混合物B可能含有NH4Cl、CuO、Cu(NO3)2三种物质中的一种或多种,加入适量的氢氧化钡有蓝色沉淀生成和气体生成,硝酸铜与氢氧化钡反应生成的蓝色氢氧化铜沉淀,氢氧化钡与氯化铵反应生成氨气,说明固体混合物B中一定含有NH4Cl、Cu(NO3)2,滤液E中一定有硝酸铜与氢氧化钡反应生成的硝酸钡,氢氧化钡与氯化铵反应生成的氯化钡,则溶液D与滤液E混合,硫酸钠与硝酸钡和氯化钡反应生成硫酸钡沉淀和硝酸钠与氯化钠,加入硝酸,硫酸钡、硝酸钠和氯化钠都不与硝酸反应,则白色沉淀I是硫酸钡,滤液H中一定有硝酸钠与氯化钠和硝酸。
【详解】(1)由分析可知,气体C是二氧化碳,化学式为CO2。
(2)由分析可知,混合物B中一定存在的物质是NH4Cl、Cu(NO3)2。
(3)由分析可知,滤液H中一定大量存在酸钠与氯化钠和硝酸,故滤液H中一定大量存在的阳离子有Na+、H+。
【点睛】
21.(1)
(2)Cu
(3)
(4)防止氯化亚铜氧化和见光分解
【分析】向废液(含FeCl3、CuCl2、FeCl2)中加入过量铁粉时,铁和氯化铁反应生成氯化亚铁,铁和氯化铜反应生成氯化亚铁和铜,铁不能和氯化亚铁反应,则过滤后的滤液1中含有氯化亚铁,滤渣1中含有生成的铜和过量的铁粉;向滤渣1中加入过量的盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不能和盐酸反应,则滤液2中含有生成的氯化亚铁和过量的盐酸,滤渣2中含有铜;滤液1和滤液2中主要成分是氯化亚铁,氯化亚铁和过氧化氢溶液反应生成氯化铁;滤渣2中是铜,铜和浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水,硫酸铜、二氧化硫和氯化铜经过一系列操作可以得到CuCl晶体。
【详解】(1)加入过量铁粉,铁和氯化铜发生置换反应生成铜和氯化亚铁,化学方程式为:;
(2) 根据上述分析可知,滤液1中溶质为氯化亚铁,滤渣1为铜和铁,滤渣1加入过量稀盐酸,铁和稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,故滤渣2为铜,化学式为Cu;
(3)根据质量守恒定律,反应前后原子的种类、数目不变,反应前共有4个氢原子、2个氧原子、2个铁原子、6个氯原子,反应后共有2个铁原子、6个氯原子,故2X需提供4个氢原子、2个氧原子,故X的化学式为H2O;
(4)由查阅资料可知,氯化亚铜易氧化变质且见光分解,所以生产中应防止氯化亚铜氧化和见光分解,减少产品氯化亚铜的损失。
22. 排出装置中的空气,防止一氧化碳混有一定量的空气,高温时爆炸 不需要,因为熄灭酒精喷灯后还要继续通入一氧化碳至恢复到室温 验纯 铜和氧化铁的质量比为1∶3 产生无色气体,溶液变为浅绿色,有红色固体残留 Fe、Cu、Ag Fe(NO3)2
【详解】讨论交流:
(1)反应前通入一段时间一氧化碳的目的是:一氧化碳具有可燃性,可燃性气体混有一定量的空气,遇明火容易发生爆炸,故先通入一段时间一氧化碳,将装置内的空气排尽,防止发生爆炸;
(2)不需要,因为熄灭酒精喷灯后,还要继续通一段时间一氧化碳至恢复至室温;
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,一氧化碳具有可燃性,混有一定量的空气,遇明火容易发生爆炸,故点燃前应对气体验纯;
进行实验:
(1)硬质玻璃管中出现黑色物质,是因为氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为:;
(2)澄清石灰水变浑浊是因为氢氧化钙与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:;
定量分析:,反应后,装置内减少的质量为氧化铁中氧元素的质量,氧元素的质量为:64.6g+8.0g-70.8g=1.8g,红色粉末中氧化铁的质量为:,红色粉末中铜的质量为:8.0g-6g=2g,故红色粉末中铜和氧化铁的质量比为:2g:6g=1:3;
拓展研究:
(1)将上述实验反应后硬质玻璃管中的固体研磨成粉末,取少量粉末于烧杯中,加入足量稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,故实验现象为:有气泡生成,溶液变为浅绿色,有红色固体残留;
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,铁先与硝酸银反应生成硝酸亚铁和银,待铁完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,说明铁过量,硝酸银已经完全被置换,铜未参与反应,故滤渣为:Fe、Cu、Ag;
铁过量,说明只有铁和硝酸银发生了反应生成了硝酸亚铁和银,且硝酸银已经完全反应,故滤液中的溶质为:Fe(NO3)2。
23.(1)4.4
(2)解:设该样品中碳酸钠的质量分数为x
x≈88.3%
答:该样品中碳酸钠的质量分数为88.3%
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量不变,则生成二氧化碳的质量为:12.0g+100.0g-107.6g=4.4g;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
