3.3 盐类水解 课件 (共22张PPT)
文档属性
| 名称 | 3.3 盐类水解 课件 (共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-20 19:17:51 | ||
图片预览





文档简介
(共22张PPT)
第1讲 盐类的水解
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
CaSO4
Fe2(SO4)3
Al2(SO4)3
MgSO4
SiO2
CaCO3
NaCl
Na2CO3
模块一 盐溶液呈现不同酸碱性的原因
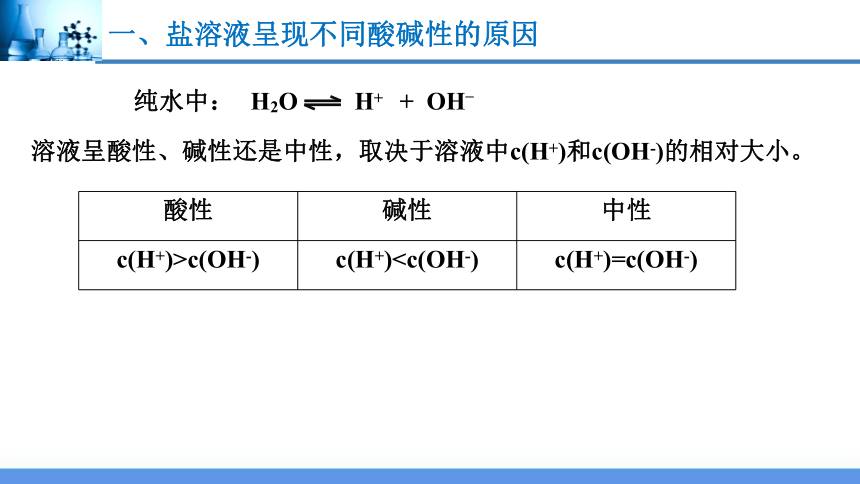
一、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。
酸性 碱性 中性
c(H+)>c(OH-) c(H+)一、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
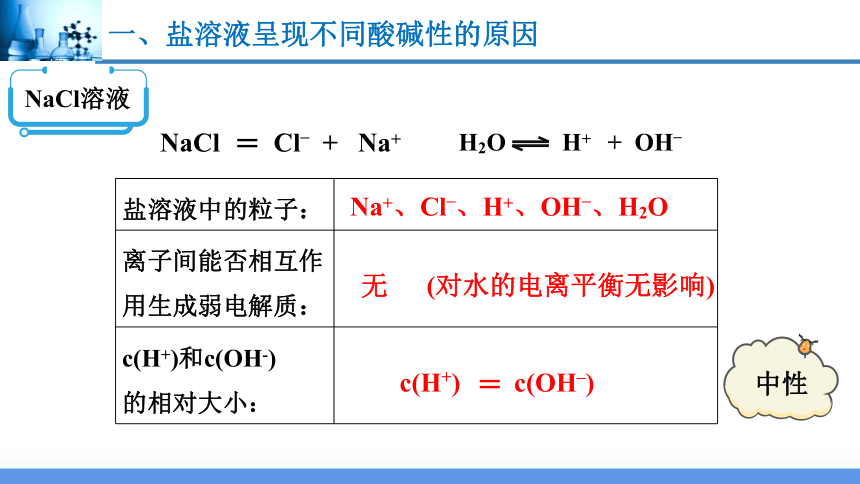
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
(对水的电离平衡无影响)
NaCl Cl– + Na+
=
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NaCl溶液
一、盐溶液呈现不同酸碱性的原因
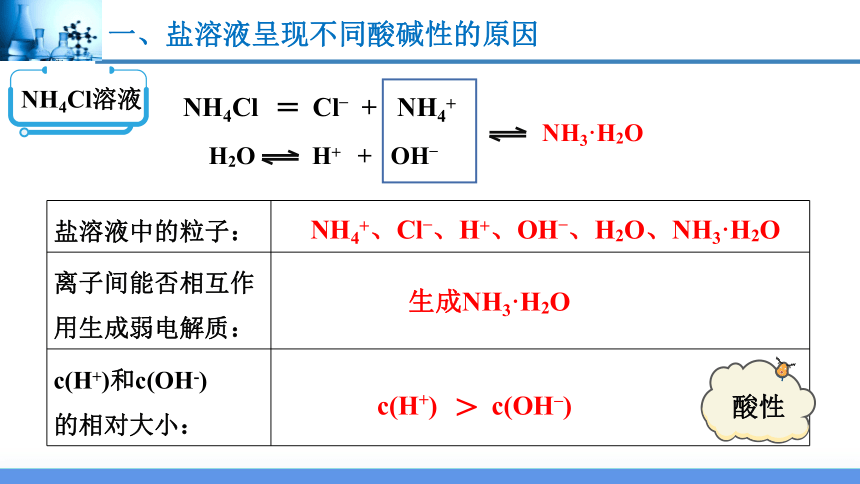
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NH4+、Cl–、H+、OH–、H2O、NH3·H2O
生成NH3·H2O
c(H+) c(OH–)
>
酸性
一、盐溶液呈现不同酸碱性的原因
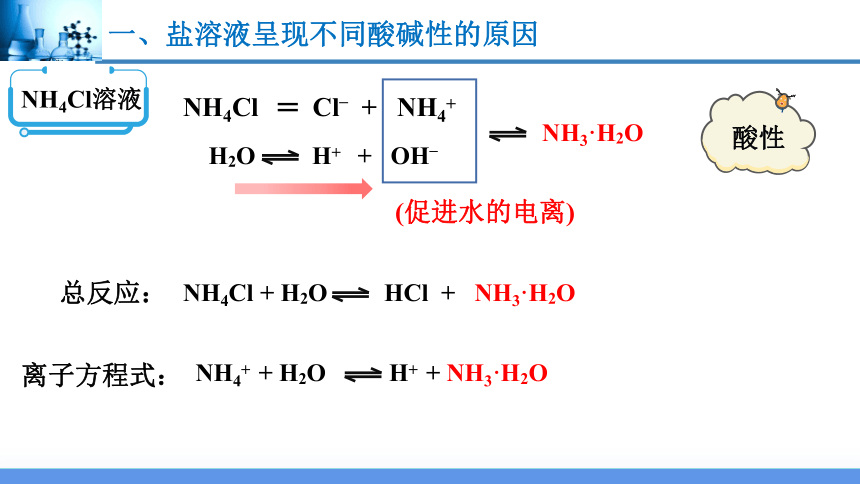
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
酸性
(促进水的电离)
NH4Cl + H2O HCl + NH3·H2O
总反应:
离子方程式:
NH4+ + H2O H+ + NH3·H2O
一、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
Na+、CH3COO–、H+、OH–、H2O、CH3COOH
生成CH3COOH
c(H+) c(OH–)
<
碱性
一、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
碱性
(促进水的电离)
CH3COONa + H2O CH3COOH + NaOH
总反应:
离子方程式:
CH3COO– + H2O CH3COOH + OH–
一、盐溶液呈现不同酸碱性的原因
1.盐类的水解
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成弱电解质的反应,叫做盐类的水解。
弱酸阴离子
或弱碱阳离子
弱酸或弱碱
一、盐溶液呈现不同酸碱性的原因
2.盐类水解的实质
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成
弱电解质
是中和反应的逆反应
CaSO4
Fe2(SO4)3
Al2(SO4)3
MgSO4
SiO2
CaCO3
NaCl
Na2CO3
试写出以下盐水解的方程式
NaClO
(NH4)2SO4
NaHCO3
FeCl3
ClO- + H2O OH- +HClO
NH4+ + H2O NH3·H2O + H+
HCO3- + H2O OH- +H2CO3
Fe3+ + 3H2O 3H+ + Fe(OH)3
3.水解方程式的书写
“治废”——探究盐碱地的碱性
写出Na2CO3水解离子方程式
Na2CO3 溶液为什么显碱性?
H2CO3 ====HCO3– + H+ Ka1 =4.2 × 10-7
HCO3– ===CO32– + H+ Ka2 =5.6 × 10-11
问题2:Na2CO3 的水解是一步还是分步?
任务: “治废”——探究盐碱地的碱性
H+ = H2CO3
CO32– + H+ = HCO3–
c(CO2)
盐酸
HCO3– +
Na2CO3溶液
VHCl
CO32– + H2O HCO3– + OH–
Na2CO3溶液
第一步水解:
第二步水解:
HCO3– + H2O H2CO3 + OH–
第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小
不会放出CO2 气体
微提醒
第一步水解程度比第二步水解程度大得多(与电离类似),以第一步为主,绝对不能两步合并写。
盐类水解(单一离子水解)一般是比较微弱的过程
通常用“ ”表示,水解生成的难溶物及气体,
一般不标“↓”或“↑”
多元弱酸的酸根离子水解是分步进行的(多元弱碱一步写完)
问题:0.1mol/L的NH4Cl 溶液中NH4+ 反应了多少?
H2O H+ + OH-
10 -5 10 -9
盐类的水解:可逆、微弱
消耗NH4+
10 -5 - 10 -9
一、盐溶液呈现不同酸碱性的原因
可逆、微弱、吸热,存在水解平衡状态
有弱才水解,无弱不水解;
都弱都水解,越弱越水解;
谁强显谁性,同强显中性。
4.盐类水解的特点
5.盐类水解的规律
课堂检测
1.写出下列盐类水解的离子方程式:
①NaClO:_______________________________________________,
②(NH4)2SO4:______________________________________________,
③Na2CO3:______________________________________________,
④AlCl3:_________________________________________________。
ClO-+H2O HClO+OH-
NH4++H2O NH3·H2O+H+
CO32-+H2O HCO3-+OH-
Al3++3H2O Al(OH)3+3H+
课堂检测
2.下列有关盐类水解的说法不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液不一定呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
答案 D
课堂检测
3.下列关于盐溶液呈酸性或碱性的说法错误的是( )
A.盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离出的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
答案 C
第1讲 盐类的水解
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
CaSO4
Fe2(SO4)3
Al2(SO4)3
MgSO4
SiO2
CaCO3
NaCl
Na2CO3
模块一 盐溶液呈现不同酸碱性的原因
一、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。
酸性 碱性 中性
c(H+)>c(OH-) c(H+)
H2O H+ + OH–
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
(对水的电离平衡无影响)
NaCl Cl– + Na+
=
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NaCl溶液
一、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NH4+、Cl–、H+、OH–、H2O、NH3·H2O
生成NH3·H2O
c(H+) c(OH–)
>
酸性
一、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
酸性
(促进水的电离)
NH4Cl + H2O HCl + NH3·H2O
总反应:
离子方程式:
NH4+ + H2O H+ + NH3·H2O
一、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
Na+、CH3COO–、H+、OH–、H2O、CH3COOH
生成CH3COOH
c(H+) c(OH–)
<
碱性
一、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
碱性
(促进水的电离)
CH3COONa + H2O CH3COOH + NaOH
总反应:
离子方程式:
CH3COO– + H2O CH3COOH + OH–
一、盐溶液呈现不同酸碱性的原因
1.盐类的水解
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成弱电解质的反应,叫做盐类的水解。
弱酸阴离子
或弱碱阳离子
弱酸或弱碱
一、盐溶液呈现不同酸碱性的原因
2.盐类水解的实质
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成
弱电解质
是中和反应的逆反应
CaSO4
Fe2(SO4)3
Al2(SO4)3
MgSO4
SiO2
CaCO3
NaCl
Na2CO3
试写出以下盐水解的方程式
NaClO
(NH4)2SO4
NaHCO3
FeCl3
ClO- + H2O OH- +HClO
NH4+ + H2O NH3·H2O + H+
HCO3- + H2O OH- +H2CO3
Fe3+ + 3H2O 3H+ + Fe(OH)3
3.水解方程式的书写
“治废”——探究盐碱地的碱性
写出Na2CO3水解离子方程式
Na2CO3 溶液为什么显碱性?
H2CO3 ====HCO3– + H+ Ka1 =4.2 × 10-7
HCO3– ===CO32– + H+ Ka2 =5.6 × 10-11
问题2:Na2CO3 的水解是一步还是分步?
任务: “治废”——探究盐碱地的碱性
H+ = H2CO3
CO32– + H+ = HCO3–
c(CO2)
盐酸
HCO3– +
Na2CO3溶液
VHCl
CO32– + H2O HCO3– + OH–
Na2CO3溶液
第一步水解:
第二步水解:
HCO3– + H2O H2CO3 + OH–
第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小
不会放出CO2 气体
微提醒
第一步水解程度比第二步水解程度大得多(与电离类似),以第一步为主,绝对不能两步合并写。
盐类水解(单一离子水解)一般是比较微弱的过程
通常用“ ”表示,水解生成的难溶物及气体,
一般不标“↓”或“↑”
多元弱酸的酸根离子水解是分步进行的(多元弱碱一步写完)
问题:0.1mol/L的NH4Cl 溶液中NH4+ 反应了多少?
H2O H+ + OH-
10 -5 10 -9
盐类的水解:可逆、微弱
消耗NH4+
10 -5 - 10 -9
一、盐溶液呈现不同酸碱性的原因
可逆、微弱、吸热,存在水解平衡状态
有弱才水解,无弱不水解;
都弱都水解,越弱越水解;
谁强显谁性,同强显中性。
4.盐类水解的特点
5.盐类水解的规律
课堂检测
1.写出下列盐类水解的离子方程式:
①NaClO:_______________________________________________,
②(NH4)2SO4:______________________________________________,
③Na2CO3:______________________________________________,
④AlCl3:_________________________________________________。
ClO-+H2O HClO+OH-
NH4++H2O NH3·H2O+H+
CO32-+H2O HCO3-+OH-
Al3++3H2O Al(OH)3+3H+
课堂检测
2.下列有关盐类水解的说法不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液不一定呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
答案 D
课堂检测
3.下列关于盐溶液呈酸性或碱性的说法错误的是( )
A.盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离出的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
答案 C
