1.2.1有机物的分离、提纯和确定实验式(共64张PPT) 人教版高二化学选择性必修3课件
文档属性
| 名称 | 1.2.1有机物的分离、提纯和确定实验式(共64张PPT) 人教版高二化学选择性必修3课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 01:25:27 | ||
图片预览








文档简介
(共64张PPT)
人教版高二化学选择性必修3第一章1.2.1
第一章 研究有机化合物的一般方法
第二节 研究有机化合物的一般方法
第1课时 有机物的分离、提纯和确定实验式
核心素养目标
1.宏观辨识与微观探析:根据实验事实,掌握有机化合物的分离、提纯方法。
2.变化观念与平衡思想:能说出测定有机化合物分子结构的常用仪器及分析方法,能结合简单图谱信息分析判新有机化合物的分子结构。
3.证据推理与模型认知:知道红外光谱、核共振等现代仪器分析方法在有机化合物分子结构测定中的应用。
4.科学探究与创新意识: 掌握李比希提出的燃烧有机物对产物的定量测定确定实验式,
5.科学精神与社会责任 :感受现代物理学及计算机技术对有机化学发展的推动作用,体验严谨求实的有机化合物研究过程,
教学目标
教学重点:根据实验事实,掌握有机化合物的分离、提纯方法。
教学难点:知道红外光谱、核共振等现代仪器分析方法在有机化合物分子结构测定中的应用。
情境导入
中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,全球数亿人因这种"中国神药"而受益,她因此荣获2015年诺贝尔生理学或医学奖。
情境导入
讨论:得到了纯净有机物,还需要知道哪些信息才能确定它的结构呢?
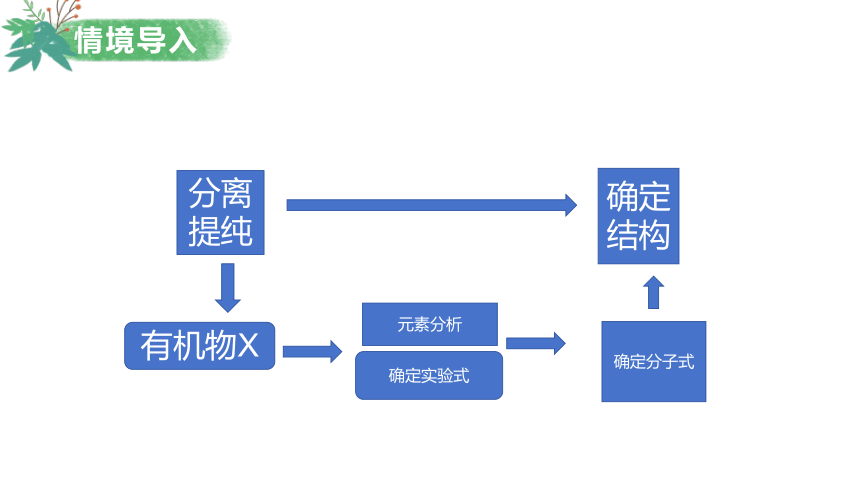
情境导入
分离
提纯
确定
结构
有机物X
元素分析
确定实验式
确定分子式
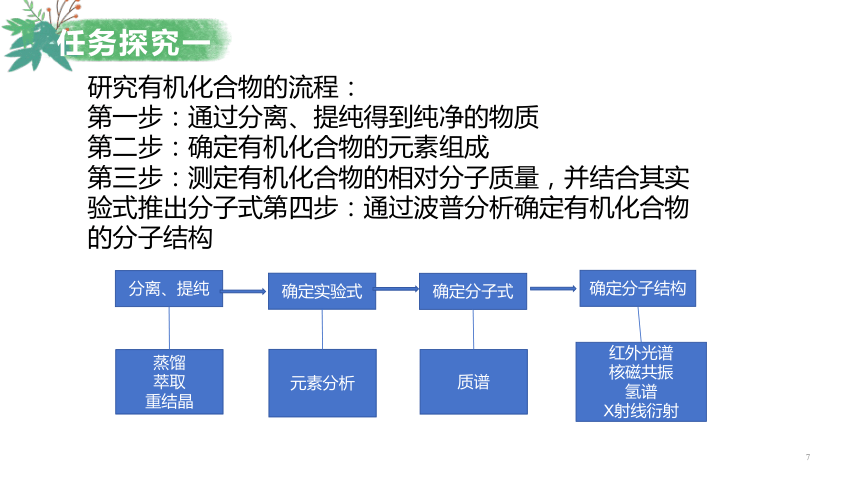
任务探究一研究有机化合物的流程:第一步:通过分离、提纯得到纯净的物质第二步:确定有机化合物的元素组成第三步:测定有机化合物的相对分子质量,并结合其实验式推出分子式第四步:通过波普分析确定有机化合物的分子结构分离、提纯红外光谱核磁共振氢谱X射线衍射质谱元素分析蒸馏萃取重结晶确定实验式确定分子式确定分子结构任务探究一思考:如何能够确定有机物的元素组成呢?李比希元素分析法尤斯图斯·冯·李比希(1803--1873)德国化学家任务探究一
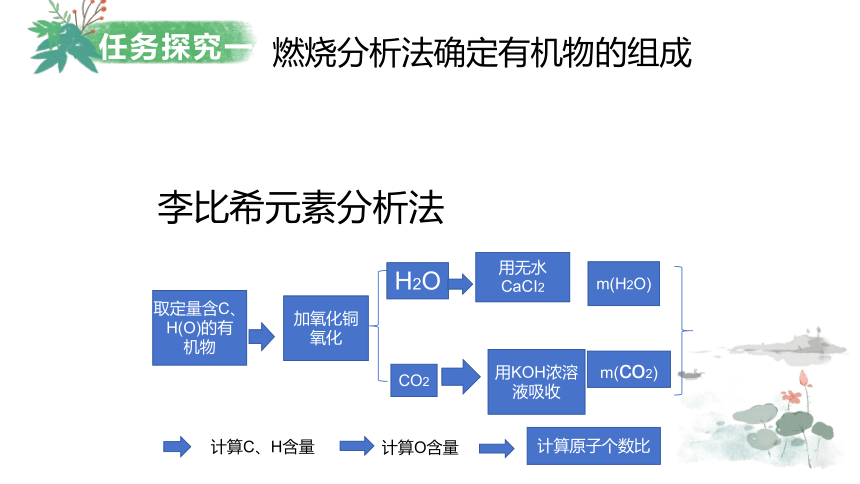
燃烧分析法确定有机物的组成
李比希元素分析法
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
用无水CaCI2
m(H2O)
CO2
用KOH浓溶液吸收
m(co2)
计算C、H含量
计算O含量
计算原子个数比
任务探究一
一、物质分离和提纯
(一)物质分离和提纯的区别
分离是把混合物分成几种纯净物,提纯是除去杂质。
(二)物质提纯的原则:
不增、不减、易分“杂转纯,杂变沉,化为气,溶剂分”的思想。
(三)物质分离提纯的一般方法:
蒸馏 (液态有机物)
重结晶 (固态有机物)
萃取分液 (固态或液态)
色谱法 (固态或液态)
任务探究二
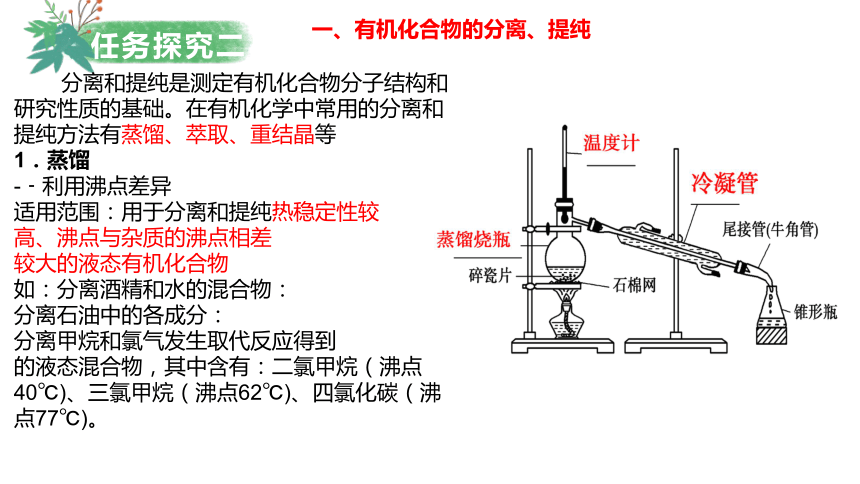
分离和提纯是测定有机化合物分子结构和研究性质的基础。在有机化学中常用的分离和提纯方法有蒸馏、萃取、重结晶等
1.蒸馏
-﹣利用沸点差异
适用范围:用于分离和提纯热稳定性较
高、沸点与杂质的沸点相差
较大的液态有机化合物
如:分离酒精和水的混合物:
分离石油中的各成分:
分离甲烷和氯气发生取代反应得到
的液态混合物,其中含有:二氯甲烷(沸点40℃)、三氯甲烷(沸点62℃)、四氯化碳(沸点77℃)。
一、有机化合物的分离、提纯
任务探究二注意事项:①温度计水银球位于。②碎瓷片的作用:。③冷凝管中水流的方向是口进入,口流出。蒸馏烧瓶支管口处使液体平稳沸腾,防止暴沸下上萃取:萃取包括液﹣液萃取和固﹣液萃取。作萃取用的溶剂称为萃取剂。(1)萃取原理:①液﹣液萃取是利用待分离组分在_两种不互溶的_溶剂中的_溶解度_不同,将其从一种溶剂转移到另一种溶剂的过程。②固一液萃取是用溶剂从固体物质_中溶解出待分离组分的过程任务探究二萃取装置(写出相应预期的名称)任务探究二
(2)萃取剂的条件及常用试剂待分离组分在萃取剂中的溶解度较 ,常用的萃取剂有 、 二氯甲烷等。
(3)分液:将萃取后的两层液体分开的操作。
(4)主要玻璃仪器为 、烧杯。
大
乙醚
乙酸乙酯
分液漏斗
点拨:
①分液时,上层液体从上口倒出。
②萃取剂与原溶剂不能互溶,且不与溶质反应。
任务探究二
3.重结晶——提纯 有机化合物常用的方法
(1)原理:利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去。
(2)溶剂的选择
①杂质在所选溶剂中的溶解度 ,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,能够进行 。
固体
溶解度
很大或溶解度很小
冷却结晶
任务探究八
(3)苯甲酸重结晶的实验装置及步骤
任务探究九二、元素分析1.定性分析。用化学方法鉴定有机化合物的元素组成。如完全燃烧后,般情况下:C→ CO, ;H→ H,O ;S→ SO,2.定量分析﹣﹣确定有机化合物的实验式(最简式)。(1)测定原理。将一定量的有机化合物燃烧并测定各产物的质量,从而推断出各元素的质量分数,然后计算出有机化合物分子中所含元素原子的最简整数比,确定有机化合物的最简式。任务探究九
测定步骤(李比希法)
思考1要证明某有机化合物属于烃的含氧衍生物,应完成的实验内容有哪些?任务探究九提示:要证明该有机化合物中存在氢元素、碳元素和氧元素,应测定该试样的质量及完全燃烧后生成CO2和H2O的质量,然后根据生成CO2和H2O的质量,测定该有机化合物中碳和氢的质量,然后根据有机化合物的总质量,就可以判断出该有机化合物中是否含有氧元素。任务探究十
三、有机化合物相对分子质量的测定﹣﹣质谱法
1.质荷比:带正电荷的分子离子、碎片离子的相对质量与其电荷数 的比值。
2.质谱图中,质荷比的最大值就表示了样品分子的相对分子质量。例如,根据下图可知,样品分子的相对分子质量为_46。
任务探究十一
四、分子结构的确定
1.红外光谱。
(1)原理:不同官能团或化学键的吸收频率不同在红外
光谱图上将处于不同的位置。
(2)作用:可以初步获得分子中含有的
官能团 或化学键的信息
任务探究十一
(3)实例:如根据下图某物质的红外光谱,可知该分子中有O----H 、C--H 和C-O,可以初步推测含有的官能团是-OH
任务探究十二2.核磁共振氢谱。(1)原理:处于不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,在谱图上出现的位置不同,而且吸收峰的面积与氢原子数目成正比。(2)作用:测定有机化合物分子中氢原子的类型和数目。(3)分析:吸收峰数目=氢原子的种类_,吸收峰面积比=氢原子个数比 。如CH3CH2OH的吸收峰面积比=3:2:1任务探究十二
3.X射线衍射。
根据X射线与晶体中的原子相互作用产生的衍射图,可以获得分子结构 的有关数据,包括 键长 、 键角等分子结构信息。
微思考2除利用红外光谱法判断某有机化合物中含有的化学键或官能团外,是否还可以利用其他方法判断?
提示:还可以根据有机化合物特殊的化学性质判断。
任务探究十二
下列有机化合物分子的核磁共振氢谱图,能给出三组峰的是( )。
D
任务探究十二
有机化合物的分离、提纯:
【例1】 现分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称。
a--------- b ----------
① --------- ②-----------: ③-----------
A ------------ B------------ C--------------
饱和Na2CO3溶液
H2SO4
分液
蒸馏
蒸馏
乙酸乙酯
乙酸钠、乙醇
乙酸钠
任务探究十二选项目的分离方法原理A分离溶于水的碘乙醇萃取碘在乙醇中的溶解度较大B分离乙酸乙酯和乙醇分液乙酸乙酯和乙醇的密度不同C除去KNO3固体中混杂的NaCl重结晶NaCl在水中的溶解度很大D除去丁醇中的乙醚蒸馏丁醇与乙醚的沸点相差较大下列实验中,所采取的分离方法与对应原理都正确的是()。D小结方法归纳:液体混合物分离方法选择两种液体不互溶分液互溶沸点差别大蒸馏沸点差别化学反应沸点差别大蒸馏不大其中一种易溶于另一种溶剂萃取、分液任务探究十三某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?重结晶法提纯苯甲酸[资料]苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为,熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:温度/℃255075溶解度/g0.340.852.2任务探究十三实验粗苯甲酸加热溶解不溶杂质和溶液趁热过滤苯甲酸和溶于水的杂质形成溶液冷却结晶苯甲酸晶体和溶于水的杂质过滤苯甲酸晶体ⅠⅡ任务探究十三任务探究十三[讨论](1)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?(3)如何检验提纯后的苯甲酸中氯化钠已被除净?[提示](1)促进苯甲酸的快速溶解;防止苯甲酸析出,使苯甲酸与不溶杂质分离。(2)溶解时,加速溶解;过滤时,引流。(3)取提纯的苯甲酸少许,加入水溶解,然后加入硝酸酸化的AgNO3溶液,若无沉淀,说明苯甲酸中NaCl已除净。任务探究十三有机物的分离、提纯方法目的主要仪器实例蒸馏分离、提纯沸点相差很大的液态混合物蒸馏烧瓶、冷凝管分离乙酸和乙醇萃取将有机物从一种溶剂转移到另一种溶剂分液漏斗用四氯化碳将碘水中的碘提取出来任务探究十三分液分离互不相溶的液态混合物分液漏斗分离汽油和水重结晶利用温度对溶解度的影响提纯有机物烧杯、酒精灯、蒸发皿、漏斗提纯苯甲酸洗气分离提纯气体混合物洗气瓶除去甲烷中的乙烯任务探究十三点拨:分离提纯物质的“四原则”不增不减易分离易复原不增加新的杂质不减少被提纯的物质被提纯物质与杂质易分离被提纯物质易恢复原状任务探究十三1.现有一瓶A和B的混合液,已知A和B的某些性质如下:物质分子式熔点/℃沸点/℃密度/(g ·cm-3)水溶性AC3H6O2-241410.99可溶BC4H8O2-84770.90可溶由此推知分离A和B的最佳方法是( )A.萃取 B.结晶 C.蒸馏 D.分液任务探究十三C [观察表中数据,得知A、B两种物质都是有机物,都溶于水,不能用萃取或分液方法进行分离;它们的熔点都比较低,常温下为液体,不能结晶方法析出;它们的沸点相差较大,故可以用蒸馏的方法将A、B分离。]任务探究十三2.下列有关苯甲酸重结晶实验操作中说法正确的是( )A.粗苯甲酸加热溶解后可以直接趁热过滤B.趁热过滤中,为了防止苯甲酸结晶,可先将漏斗进行预热C.趁热过滤后,为了析出更多晶体,热滤液用冰盐水充分冷却,同时缩短结晶的时间D.温度越低,苯甲酸的溶解度越小,所以温度越低越有利于苯甲酸的重结晶实验任务探究十三B [粗苯甲酸加热溶解后,为防止苯甲酸晶体提前析出,滞留在过滤器中,需在过滤前适当稀释,不能直接过滤,A项错误;漏斗进行预热,可减小温差,B项正确;趁热过滤后,用冰盐水冷却形成的结晶很小,比表面积大,吸附的杂质多,C项错误;重结晶过程中温度太低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的,D项错误。]任务探究十三4.下列关于物质的分离、提纯、鉴别的实验中的一些操作或做法,正确的是( )①在组装蒸馏装置时,温度计的水银球应伸入液面以下;②用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏;③溴水能鉴别出乙醇、甲苯、四氯化碳、环己烯;④在苯甲酸重结晶实验中,待粗苯甲酸完全溶解,冷却到常温后过滤。A.①②B.③④C.①④D.②③任务探究十三D [①在组装蒸馏装置时,温度计需要测量的是蒸气的温度,所以应该将温度计的水银球放在蒸馏烧瓶支管口处,错误;②酒精中含有少量的水,一般加入CaO(生石灰)来除去酒精中少量的水,CaO与水反应生成Ca(OH)2,氢氧化钙是离子化合物,沸点较高,利用此性质蒸馏将乙醇蒸出,正确;③乙醇、甲苯、四氯化碳、环己烯中加入溴水,现象分别为互溶、不分层不褪色,分层、上层为橙黄色,分层、下层为橙黄色,褪色,现象各不相同,能鉴别出来,正确;④在苯甲酸重结晶实验中,为了减少苯甲酸的损耗,待粗苯甲酸完全溶解后要趁热过滤,错误。]任务探究十四二、有机化合物分子式的确定某有机化合物的结构确定:(1)测定实验式:某含C、H、O三种元素的有机化合物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是(2)确定分子式:如图是该有机化合物的质谱图,则其相对分子质量为;分子式为C4H10O74C4H10O任务探究十四已知由C、H、O元素组成的某化合物9.2 g完全燃烧后可以得到17.6 g CO2和10.8 g H2O,通过计算确定该化合物的实验式。(写出解题过程)任务探究十四任务探究十四
一般来说,某有机物完全燃烧后,若产物只有CO2和H2O,其组成元素可能为碳、氢元素或碳、氢、氧元素。欲判断该有机物分子是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将C、H的质量之和与原来有机物质量比较,若两者相等,则原有机物分子的组成中不含氧元素;否则,原有机物分子的组成中含氧元素。
一般有机物中氧元素的确定方法
任务探究十四
三、有机化合物结构式的确定
有机化合物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤
实验步骤 解释或实验结论
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 (1)A的相对分子质量
为-----------
90
任务探究十四
实验步骤 解释或实验结论
(2)将此9.0gA在足量氧气中充分燃烧,并使产物缓缓通过足量的无水氯化钙和 KOH 浓溶液,发现两者分别增重5.4g和13.2
(2)A的分子式为----------
C3H6O3
任务探究十四
实验步骤 解释或实验结论
(3)另取A 9.0g,与足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) (3)用结构简式表示A中含
有的官能团----------------、
-------------------
---COOH
-----OH
任务探究十四
4
任务探究十四
1.提纯下列物质(括号中为杂质),选择试剂和分离方法都正确的是( )。
C
选项 被提纯的物质 除杂试剂 分离方法
A 甲烷(乙烯) 酸性高锰酸钾溶液 洗气
B 苯(硝基苯) 水 分液
C 乙酸乙酯(乙酸) 饱和碳酸钠溶液 分液
D 硝酸钾(氯化钠) 水 萃取
任务探究十四
2.下列有关实验的说法中错误的是( )。
A.在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.工业乙醇用直接蒸馏的方法不能得到无水乙醇
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大
D
任务探究十四
3.某有机化合物在空气中完全燃烧时,生成水和二氧化碳的分子数之比为2:1,则该物质可能是( )。
①CH4 ②C2H4
③C2H5OH ④CH3OH
A.② ③ B.①④
C.①③ D.②④
B
任务探究十四
4.为测定某有机化合物A的结构,进行如下实验:
(1)将有机化合物A置于O,流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗O26.72L(标准状况),则该物质中各元素的原子个数比是N(C):N(H):N(O)=
(2)用质谱仪测定该有机化合物的相对
分子质量,则该物质的分子式是:
2:6:1
C2H6O
任务探究十四
(3)核磁共振氢谱能对有机化合物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(CICH20CH3)有两种氢原子如图2。经测定,有机化合物A的核磁共振氢谱示意图如图3,则A的结构简式为:
任务探究十四
(4)A在一定条件下脱水可生成B,B可合
成包装塑料C,请写出B转化为C的化
学方程式:
任务探究十四
正丁醛是一种化工原料。某实验小组利用如图所示的装置合成正丁醛。
任务探究十四
任务探究十四
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加入30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液,滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以上的馏分。将馏出物倒入分液漏斗中,除去水层,将有机层干燥后蒸馏,收集75~77 ℃馏分,产量为2.0 g。
任务探究十四
(1)装置中D冷凝管能否换成球形冷凝管?为什么?
[提示] 否,若用球形冷凝管,冷凝所得的馏分不能流出。
(2)C1温度计的作用是什么?
[提示] 控制反应温度90~95 ℃。
(3)A中加入沸石的作用是什么?若加热后发现忘加沸石,应如何操作?
[提示] 防止加热时液体暴沸。冷却后补加沸石。
任务探究十四
(4)将收集的正丁醛粗产品置于分液漏斗中除去其中的水时,水在哪层?为什么?
[提示] 水在下层,正丁醛微溶于水且密度小于水的密度。
任务探究十四
(5)本实验中,正丁醛的产率为多少?
[提示] 根据关系式:C4H10O---C4H8O 74 72 4.0 g m74∶72=4.0 g∶m,m≈3.89 g,产率= ×100%≈51.4%。
2.0
3.89
小结
分离、提纯
常用方法
蒸馏:沸点不同
萃取:溶解度不同
重结晶:溶解度不同
实验式
李比希燃烧法测定燃烧产物
确定元素的原子个数比
体系构建
人教版高二化学选择性必修3第一章1.2.1
第一章 研究有机化合物的一般方法
第二节 研究有机化合物的一般方法
第1课时 有机物的分离、提纯和确定实验式
核心素养目标
1.宏观辨识与微观探析:根据实验事实,掌握有机化合物的分离、提纯方法。
2.变化观念与平衡思想:能说出测定有机化合物分子结构的常用仪器及分析方法,能结合简单图谱信息分析判新有机化合物的分子结构。
3.证据推理与模型认知:知道红外光谱、核共振等现代仪器分析方法在有机化合物分子结构测定中的应用。
4.科学探究与创新意识: 掌握李比希提出的燃烧有机物对产物的定量测定确定实验式,
5.科学精神与社会责任 :感受现代物理学及计算机技术对有机化学发展的推动作用,体验严谨求实的有机化合物研究过程,
教学目标
教学重点:根据实验事实,掌握有机化合物的分离、提纯方法。
教学难点:知道红外光谱、核共振等现代仪器分析方法在有机化合物分子结构测定中的应用。
情境导入
中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,全球数亿人因这种"中国神药"而受益,她因此荣获2015年诺贝尔生理学或医学奖。
情境导入
讨论:得到了纯净有机物,还需要知道哪些信息才能确定它的结构呢?
情境导入
分离
提纯
确定
结构
有机物X
元素分析
确定实验式
确定分子式
任务探究一研究有机化合物的流程:第一步:通过分离、提纯得到纯净的物质第二步:确定有机化合物的元素组成第三步:测定有机化合物的相对分子质量,并结合其实验式推出分子式第四步:通过波普分析确定有机化合物的分子结构分离、提纯红外光谱核磁共振氢谱X射线衍射质谱元素分析蒸馏萃取重结晶确定实验式确定分子式确定分子结构任务探究一思考:如何能够确定有机物的元素组成呢?李比希元素分析法尤斯图斯·冯·李比希(1803--1873)德国化学家任务探究一
燃烧分析法确定有机物的组成
李比希元素分析法
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
用无水CaCI2
m(H2O)
CO2
用KOH浓溶液吸收
m(co2)
计算C、H含量
计算O含量
计算原子个数比
任务探究一
一、物质分离和提纯
(一)物质分离和提纯的区别
分离是把混合物分成几种纯净物,提纯是除去杂质。
(二)物质提纯的原则:
不增、不减、易分“杂转纯,杂变沉,化为气,溶剂分”的思想。
(三)物质分离提纯的一般方法:
蒸馏 (液态有机物)
重结晶 (固态有机物)
萃取分液 (固态或液态)
色谱法 (固态或液态)
任务探究二
分离和提纯是测定有机化合物分子结构和研究性质的基础。在有机化学中常用的分离和提纯方法有蒸馏、萃取、重结晶等
1.蒸馏
-﹣利用沸点差异
适用范围:用于分离和提纯热稳定性较
高、沸点与杂质的沸点相差
较大的液态有机化合物
如:分离酒精和水的混合物:
分离石油中的各成分:
分离甲烷和氯气发生取代反应得到
的液态混合物,其中含有:二氯甲烷(沸点40℃)、三氯甲烷(沸点62℃)、四氯化碳(沸点77℃)。
一、有机化合物的分离、提纯
任务探究二注意事项:①温度计水银球位于。②碎瓷片的作用:。③冷凝管中水流的方向是口进入,口流出。蒸馏烧瓶支管口处使液体平稳沸腾,防止暴沸下上萃取:萃取包括液﹣液萃取和固﹣液萃取。作萃取用的溶剂称为萃取剂。(1)萃取原理:①液﹣液萃取是利用待分离组分在_两种不互溶的_溶剂中的_溶解度_不同,将其从一种溶剂转移到另一种溶剂的过程。②固一液萃取是用溶剂从固体物质_中溶解出待分离组分的过程任务探究二萃取装置(写出相应预期的名称)任务探究二
(2)萃取剂的条件及常用试剂待分离组分在萃取剂中的溶解度较 ,常用的萃取剂有 、 二氯甲烷等。
(3)分液:将萃取后的两层液体分开的操作。
(4)主要玻璃仪器为 、烧杯。
大
乙醚
乙酸乙酯
分液漏斗
点拨:
①分液时,上层液体从上口倒出。
②萃取剂与原溶剂不能互溶,且不与溶质反应。
任务探究二
3.重结晶——提纯 有机化合物常用的方法
(1)原理:利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去。
(2)溶剂的选择
①杂质在所选溶剂中的溶解度 ,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,能够进行 。
固体
溶解度
很大或溶解度很小
冷却结晶
任务探究八
(3)苯甲酸重结晶的实验装置及步骤
任务探究九二、元素分析1.定性分析。用化学方法鉴定有机化合物的元素组成。如完全燃烧后,般情况下:C→ CO, ;H→ H,O ;S→ SO,2.定量分析﹣﹣确定有机化合物的实验式(最简式)。(1)测定原理。将一定量的有机化合物燃烧并测定各产物的质量,从而推断出各元素的质量分数,然后计算出有机化合物分子中所含元素原子的最简整数比,确定有机化合物的最简式。任务探究九
测定步骤(李比希法)
思考1要证明某有机化合物属于烃的含氧衍生物,应完成的实验内容有哪些?任务探究九提示:要证明该有机化合物中存在氢元素、碳元素和氧元素,应测定该试样的质量及完全燃烧后生成CO2和H2O的质量,然后根据生成CO2和H2O的质量,测定该有机化合物中碳和氢的质量,然后根据有机化合物的总质量,就可以判断出该有机化合物中是否含有氧元素。任务探究十
三、有机化合物相对分子质量的测定﹣﹣质谱法
1.质荷比:带正电荷的分子离子、碎片离子的相对质量与其电荷数 的比值。
2.质谱图中,质荷比的最大值就表示了样品分子的相对分子质量。例如,根据下图可知,样品分子的相对分子质量为_46。
任务探究十一
四、分子结构的确定
1.红外光谱。
(1)原理:不同官能团或化学键的吸收频率不同在红外
光谱图上将处于不同的位置。
(2)作用:可以初步获得分子中含有的
官能团 或化学键的信息
任务探究十一
(3)实例:如根据下图某物质的红外光谱,可知该分子中有O----H 、C--H 和C-O,可以初步推测含有的官能团是-OH
任务探究十二2.核磁共振氢谱。(1)原理:处于不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,在谱图上出现的位置不同,而且吸收峰的面积与氢原子数目成正比。(2)作用:测定有机化合物分子中氢原子的类型和数目。(3)分析:吸收峰数目=氢原子的种类_,吸收峰面积比=氢原子个数比 。如CH3CH2OH的吸收峰面积比=3:2:1任务探究十二
3.X射线衍射。
根据X射线与晶体中的原子相互作用产生的衍射图,可以获得分子结构 的有关数据,包括 键长 、 键角等分子结构信息。
微思考2除利用红外光谱法判断某有机化合物中含有的化学键或官能团外,是否还可以利用其他方法判断?
提示:还可以根据有机化合物特殊的化学性质判断。
任务探究十二
下列有机化合物分子的核磁共振氢谱图,能给出三组峰的是( )。
D
任务探究十二
有机化合物的分离、提纯:
【例1】 现分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称。
a--------- b ----------
① --------- ②-----------: ③-----------
A ------------ B------------ C--------------
饱和Na2CO3溶液
H2SO4
分液
蒸馏
蒸馏
乙酸乙酯
乙酸钠、乙醇
乙酸钠
任务探究十二选项目的分离方法原理A分离溶于水的碘乙醇萃取碘在乙醇中的溶解度较大B分离乙酸乙酯和乙醇分液乙酸乙酯和乙醇的密度不同C除去KNO3固体中混杂的NaCl重结晶NaCl在水中的溶解度很大D除去丁醇中的乙醚蒸馏丁醇与乙醚的沸点相差较大下列实验中,所采取的分离方法与对应原理都正确的是()。D小结方法归纳:液体混合物分离方法选择两种液体不互溶分液互溶沸点差别大蒸馏沸点差别化学反应沸点差别大蒸馏不大其中一种易溶于另一种溶剂萃取、分液任务探究十三某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?重结晶法提纯苯甲酸[资料]苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为,熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:温度/℃255075溶解度/g0.340.852.2任务探究十三实验粗苯甲酸加热溶解不溶杂质和溶液趁热过滤苯甲酸和溶于水的杂质形成溶液冷却结晶苯甲酸晶体和溶于水的杂质过滤苯甲酸晶体ⅠⅡ任务探究十三任务探究十三[讨论](1)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?(3)如何检验提纯后的苯甲酸中氯化钠已被除净?[提示](1)促进苯甲酸的快速溶解;防止苯甲酸析出,使苯甲酸与不溶杂质分离。(2)溶解时,加速溶解;过滤时,引流。(3)取提纯的苯甲酸少许,加入水溶解,然后加入硝酸酸化的AgNO3溶液,若无沉淀,说明苯甲酸中NaCl已除净。任务探究十三有机物的分离、提纯方法目的主要仪器实例蒸馏分离、提纯沸点相差很大的液态混合物蒸馏烧瓶、冷凝管分离乙酸和乙醇萃取将有机物从一种溶剂转移到另一种溶剂分液漏斗用四氯化碳将碘水中的碘提取出来任务探究十三分液分离互不相溶的液态混合物分液漏斗分离汽油和水重结晶利用温度对溶解度的影响提纯有机物烧杯、酒精灯、蒸发皿、漏斗提纯苯甲酸洗气分离提纯气体混合物洗气瓶除去甲烷中的乙烯任务探究十三点拨:分离提纯物质的“四原则”不增不减易分离易复原不增加新的杂质不减少被提纯的物质被提纯物质与杂质易分离被提纯物质易恢复原状任务探究十三1.现有一瓶A和B的混合液,已知A和B的某些性质如下:物质分子式熔点/℃沸点/℃密度/(g ·cm-3)水溶性AC3H6O2-241410.99可溶BC4H8O2-84770.90可溶由此推知分离A和B的最佳方法是( )A.萃取 B.结晶 C.蒸馏 D.分液任务探究十三C [观察表中数据,得知A、B两种物质都是有机物,都溶于水,不能用萃取或分液方法进行分离;它们的熔点都比较低,常温下为液体,不能结晶方法析出;它们的沸点相差较大,故可以用蒸馏的方法将A、B分离。]任务探究十三2.下列有关苯甲酸重结晶实验操作中说法正确的是( )A.粗苯甲酸加热溶解后可以直接趁热过滤B.趁热过滤中,为了防止苯甲酸结晶,可先将漏斗进行预热C.趁热过滤后,为了析出更多晶体,热滤液用冰盐水充分冷却,同时缩短结晶的时间D.温度越低,苯甲酸的溶解度越小,所以温度越低越有利于苯甲酸的重结晶实验任务探究十三B [粗苯甲酸加热溶解后,为防止苯甲酸晶体提前析出,滞留在过滤器中,需在过滤前适当稀释,不能直接过滤,A项错误;漏斗进行预热,可减小温差,B项正确;趁热过滤后,用冰盐水冷却形成的结晶很小,比表面积大,吸附的杂质多,C项错误;重结晶过程中温度太低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的,D项错误。]任务探究十三4.下列关于物质的分离、提纯、鉴别的实验中的一些操作或做法,正确的是( )①在组装蒸馏装置时,温度计的水银球应伸入液面以下;②用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏;③溴水能鉴别出乙醇、甲苯、四氯化碳、环己烯;④在苯甲酸重结晶实验中,待粗苯甲酸完全溶解,冷却到常温后过滤。A.①②B.③④C.①④D.②③任务探究十三D [①在组装蒸馏装置时,温度计需要测量的是蒸气的温度,所以应该将温度计的水银球放在蒸馏烧瓶支管口处,错误;②酒精中含有少量的水,一般加入CaO(生石灰)来除去酒精中少量的水,CaO与水反应生成Ca(OH)2,氢氧化钙是离子化合物,沸点较高,利用此性质蒸馏将乙醇蒸出,正确;③乙醇、甲苯、四氯化碳、环己烯中加入溴水,现象分别为互溶、不分层不褪色,分层、上层为橙黄色,分层、下层为橙黄色,褪色,现象各不相同,能鉴别出来,正确;④在苯甲酸重结晶实验中,为了减少苯甲酸的损耗,待粗苯甲酸完全溶解后要趁热过滤,错误。]任务探究十四二、有机化合物分子式的确定某有机化合物的结构确定:(1)测定实验式:某含C、H、O三种元素的有机化合物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是(2)确定分子式:如图是该有机化合物的质谱图,则其相对分子质量为;分子式为C4H10O74C4H10O任务探究十四已知由C、H、O元素组成的某化合物9.2 g完全燃烧后可以得到17.6 g CO2和10.8 g H2O,通过计算确定该化合物的实验式。(写出解题过程)任务探究十四任务探究十四
一般来说,某有机物完全燃烧后,若产物只有CO2和H2O,其组成元素可能为碳、氢元素或碳、氢、氧元素。欲判断该有机物分子是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将C、H的质量之和与原来有机物质量比较,若两者相等,则原有机物分子的组成中不含氧元素;否则,原有机物分子的组成中含氧元素。
一般有机物中氧元素的确定方法
任务探究十四
三、有机化合物结构式的确定
有机化合物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤
实验步骤 解释或实验结论
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 (1)A的相对分子质量
为-----------
90
任务探究十四
实验步骤 解释或实验结论
(2)将此9.0gA在足量氧气中充分燃烧,并使产物缓缓通过足量的无水氯化钙和 KOH 浓溶液,发现两者分别增重5.4g和13.2
(2)A的分子式为----------
C3H6O3
任务探究十四
实验步骤 解释或实验结论
(3)另取A 9.0g,与足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) (3)用结构简式表示A中含
有的官能团----------------、
-------------------
---COOH
-----OH
任务探究十四
4
任务探究十四
1.提纯下列物质(括号中为杂质),选择试剂和分离方法都正确的是( )。
C
选项 被提纯的物质 除杂试剂 分离方法
A 甲烷(乙烯) 酸性高锰酸钾溶液 洗气
B 苯(硝基苯) 水 分液
C 乙酸乙酯(乙酸) 饱和碳酸钠溶液 分液
D 硝酸钾(氯化钠) 水 萃取
任务探究十四
2.下列有关实验的说法中错误的是( )。
A.在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.工业乙醇用直接蒸馏的方法不能得到无水乙醇
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大
D
任务探究十四
3.某有机化合物在空气中完全燃烧时,生成水和二氧化碳的分子数之比为2:1,则该物质可能是( )。
①CH4 ②C2H4
③C2H5OH ④CH3OH
A.② ③ B.①④
C.①③ D.②④
B
任务探究十四
4.为测定某有机化合物A的结构,进行如下实验:
(1)将有机化合物A置于O,流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗O26.72L(标准状况),则该物质中各元素的原子个数比是N(C):N(H):N(O)=
(2)用质谱仪测定该有机化合物的相对
分子质量,则该物质的分子式是:
2:6:1
C2H6O
任务探究十四
(3)核磁共振氢谱能对有机化合物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(CICH20CH3)有两种氢原子如图2。经测定,有机化合物A的核磁共振氢谱示意图如图3,则A的结构简式为:
任务探究十四
(4)A在一定条件下脱水可生成B,B可合
成包装塑料C,请写出B转化为C的化
学方程式:
任务探究十四
正丁醛是一种化工原料。某实验小组利用如图所示的装置合成正丁醛。
任务探究十四
任务探究十四
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加入30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液,滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以上的馏分。将馏出物倒入分液漏斗中,除去水层,将有机层干燥后蒸馏,收集75~77 ℃馏分,产量为2.0 g。
任务探究十四
(1)装置中D冷凝管能否换成球形冷凝管?为什么?
[提示] 否,若用球形冷凝管,冷凝所得的馏分不能流出。
(2)C1温度计的作用是什么?
[提示] 控制反应温度90~95 ℃。
(3)A中加入沸石的作用是什么?若加热后发现忘加沸石,应如何操作?
[提示] 防止加热时液体暴沸。冷却后补加沸石。
任务探究十四
(4)将收集的正丁醛粗产品置于分液漏斗中除去其中的水时,水在哪层?为什么?
[提示] 水在下层,正丁醛微溶于水且密度小于水的密度。
任务探究十四
(5)本实验中,正丁醛的产率为多少?
[提示] 根据关系式:C4H10O---C4H8O 74 72 4.0 g m74∶72=4.0 g∶m,m≈3.89 g,产率= ×100%≈51.4%。
2.0
3.89
小结
分离、提纯
常用方法
蒸馏:沸点不同
萃取:溶解度不同
重结晶:溶解度不同
实验式
李比希燃烧法测定燃烧产物
确定元素的原子个数比
体系构建
