1.3.2常见的氧化剂、还原剂,氧化还原规律课件(共18张PPT) 人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2常见的氧化剂、还原剂,氧化还原规律课件(共18张PPT) 人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 36.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 01:30:42 | ||
图片预览




文档简介
(共18张PPT)
化学必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第2课时 常见的氧化剂与还原剂、氧化还原规律
抗氧化剂能在自然饮食中找到,如维生素C、维生素E、和β-胡萝卜素。自然界中被称为抗氧化之王的虾青素其抗氧化能力是维生素C的6000倍,是维生素E的1000倍,是β-胡萝卜素功效的100倍;他们可以利用自身结构的特性来稳定自由基多余的电子,防止对细胞造成老化。
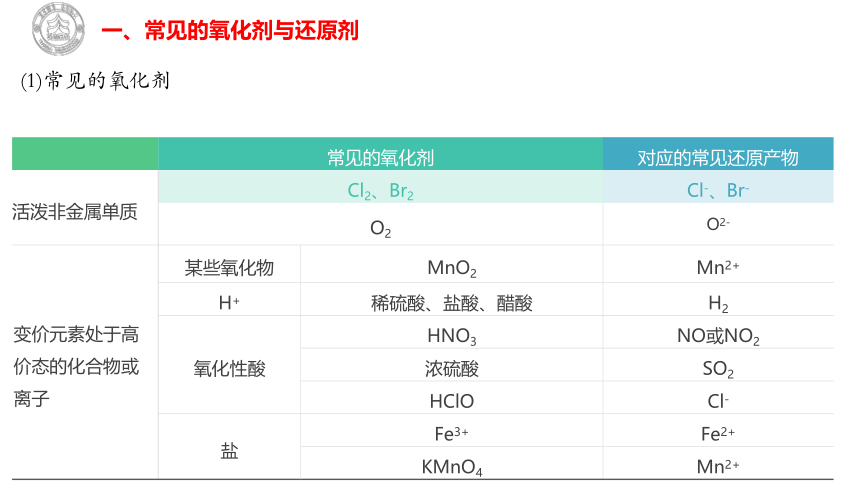
(1)常见的氧化剂
常见的氧化剂 对应的常见还原产物
活泼非金属单质 Cl2、Br2 Cl-、Br-
O2 O2-
变价元素处于高价态的化合物或离子 某些氧化物 MnO2 Mn2+
H+ 稀硫酸、盐酸、醋酸 H2
氧化性酸 HNO3 NO或NO2
浓硫酸 SO2
HClO Cl-
盐 Fe3+ Fe2+
KMnO4 Mn2+
一、常见的氧化剂与还原剂
(2)常见的还原剂
常见的还原剂 对应的常见氧化产物
金属单质 M Mn+
不活泼的非金属单质 C CO、CO2
元素处于低价态的化合物或离子 某些氧化物 CO CO2
SO2 SO3
酸 H2S S、SO2
HI I2
盐 SO32- SO42-
Fe2+ Fe3+
一、常见的氧化剂与还原剂
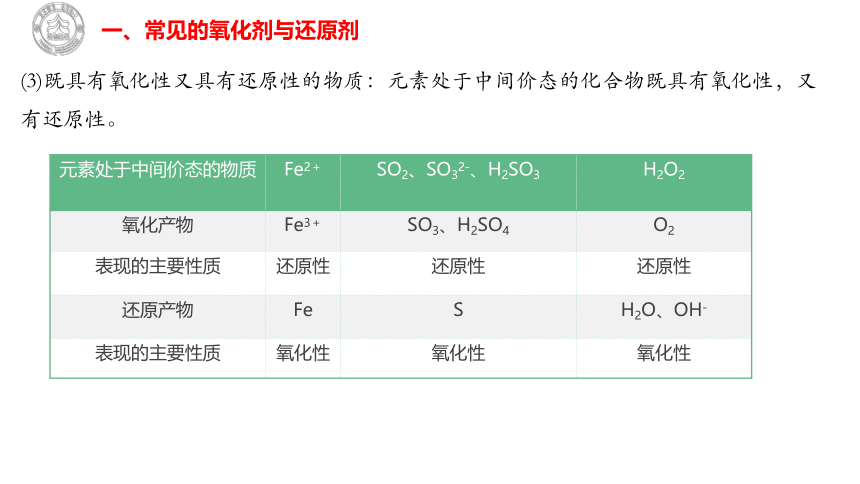
(3)既具有氧化性又具有还原性的物质:元素处于中间价态的化合物既具有氧化性,又有还原性。
一、常见的氧化剂与还原剂
元素处于中间价态的物质 Fe2+ SO2、SO32-、H2SO3 H2O2
氧化产物 Fe3+ SO3、H2SO4 O2
表现的主要性质 还原性 还原性 还原性
还原产物 Fe S H2O、OH-
表现的主要性质 氧化性 氧化性 氧化性
二、氧化性、还原性强弱的比较
1.根据氧化还原反应方程式判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
物质氧化性或还原性的强弱取决于其得失电子的难易程度,与得失电子的多少无关。
3. 根据反应条件的难易来判断
当不同的氧化剂(或还原剂)与相同还原剂(或氧化剂)反应时,若氧化产物(或还原产物)中元素价态相同,则反应的条件越简单,反应就越容易发生,物质氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:__________
点燃
Cl2 > S
△
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
1. 价态决定性质规律
(1)处于最高价态的元素 → 只有 性;
(2)处于最低价态的元素 → 只有 性;
(3)处于中间价态的元素 → 性。
氧化
还原
既有氧化性又有还原
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;(特例:HClO4 <HClO3 < HClO2 < HClO)
还原性:H2S > S > SO2。
三、氧化还原反应的规律
已知 H2S 与浓硫酸反应的方程式如下,请画出双线桥。
你画出来的双线桥,跟其他同学画的一样吗?
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
2. 相邻价态转化规律(不交叉规律)
元素也很“懒”。在化学反应中,化合价能不变就不变,价态变化值能少就少。
(1)同种元素相邻价态间不发生氧化还原反应;
(2)同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉。
( ) ( ) ( )
√
√
×
用双向桥法表示下列反应中电子转移方向和数目
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
课堂练习
3. 反应先后规律
(1)当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
(2)当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入过量锌粉,反应的先后顺序是?
先和Ag+反应,再和Cu2+ 反应
4. 得失电子守恒规律
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
本质:得失电子总数相同
表征:化合价升降总数相同
课堂练习
1、人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( )
A、亚硝酸钠表现还原性
B、维生素C表现了还原性
C、亚硝酸钠被氧化
D、维生素C作为氧化剂
B
2、根据下列反应判断H2SO3 、 I- 、 Fe2+ 、 NO的还原性由强到弱的顺序是 。
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
H2SO3 > I- > Fe2+ > NO
(H2SO3 > I-)
( I- > Fe2+ )
(Fe2+ > NO)
课堂练习
点拨:标化合价,明确变价元素,找出还原剂和还原产物,比较还原性
化学必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第2课时 常见的氧化剂与还原剂、氧化还原规律
抗氧化剂能在自然饮食中找到,如维生素C、维生素E、和β-胡萝卜素。自然界中被称为抗氧化之王的虾青素其抗氧化能力是维生素C的6000倍,是维生素E的1000倍,是β-胡萝卜素功效的100倍;他们可以利用自身结构的特性来稳定自由基多余的电子,防止对细胞造成老化。
(1)常见的氧化剂
常见的氧化剂 对应的常见还原产物
活泼非金属单质 Cl2、Br2 Cl-、Br-
O2 O2-
变价元素处于高价态的化合物或离子 某些氧化物 MnO2 Mn2+
H+ 稀硫酸、盐酸、醋酸 H2
氧化性酸 HNO3 NO或NO2
浓硫酸 SO2
HClO Cl-
盐 Fe3+ Fe2+
KMnO4 Mn2+
一、常见的氧化剂与还原剂
(2)常见的还原剂
常见的还原剂 对应的常见氧化产物
金属单质 M Mn+
不活泼的非金属单质 C CO、CO2
元素处于低价态的化合物或离子 某些氧化物 CO CO2
SO2 SO3
酸 H2S S、SO2
HI I2
盐 SO32- SO42-
Fe2+ Fe3+
一、常见的氧化剂与还原剂
(3)既具有氧化性又具有还原性的物质:元素处于中间价态的化合物既具有氧化性,又有还原性。
一、常见的氧化剂与还原剂
元素处于中间价态的物质 Fe2+ SO2、SO32-、H2SO3 H2O2
氧化产物 Fe3+ SO3、H2SO4 O2
表现的主要性质 还原性 还原性 还原性
还原产物 Fe S H2O、OH-
表现的主要性质 氧化性 氧化性 氧化性
二、氧化性、还原性强弱的比较
1.根据氧化还原反应方程式判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
物质氧化性或还原性的强弱取决于其得失电子的难易程度,与得失电子的多少无关。
3. 根据反应条件的难易来判断
当不同的氧化剂(或还原剂)与相同还原剂(或氧化剂)反应时,若氧化产物(或还原产物)中元素价态相同,则反应的条件越简单,反应就越容易发生,物质氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:__________
点燃
Cl2 > S
△
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
1. 价态决定性质规律
(1)处于最高价态的元素 → 只有 性;
(2)处于最低价态的元素 → 只有 性;
(3)处于中间价态的元素 → 性。
氧化
还原
既有氧化性又有还原
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;(特例:HClO4 <HClO3 < HClO2 < HClO)
还原性:H2S > S > SO2。
三、氧化还原反应的规律
已知 H2S 与浓硫酸反应的方程式如下,请画出双线桥。
你画出来的双线桥,跟其他同学画的一样吗?
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
2. 相邻价态转化规律(不交叉规律)
元素也很“懒”。在化学反应中,化合价能不变就不变,价态变化值能少就少。
(1)同种元素相邻价态间不发生氧化还原反应;
(2)同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉。
( ) ( ) ( )
√
√
×
用双向桥法表示下列反应中电子转移方向和数目
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
课堂练习
3. 反应先后规律
(1)当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
(2)当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入过量锌粉,反应的先后顺序是?
先和Ag+反应,再和Cu2+ 反应
4. 得失电子守恒规律
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
本质:得失电子总数相同
表征:化合价升降总数相同
课堂练习
1、人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( )
A、亚硝酸钠表现还原性
B、维生素C表现了还原性
C、亚硝酸钠被氧化
D、维生素C作为氧化剂
B
2、根据下列反应判断H2SO3 、 I- 、 Fe2+ 、 NO的还原性由强到弱的顺序是 。
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
H2SO3 > I- > Fe2+ > NO
(H2SO3 > I-)
( I- > Fe2+ )
(Fe2+ > NO)
课堂练习
点拨:标化合价,明确变价元素,找出还原剂和还原产物,比较还原性
