2.1.3钠盐课件 (共24张PPT)人教版(2019)必修第一册
文档属性
| 名称 | 2.1.3钠盐课件 (共24张PPT)人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 01:33:05 | ||
图片预览





文档简介
(共24张PPT)
第3课时 钠盐
第二章 第一节 钠及其化合物
阅读使用说明
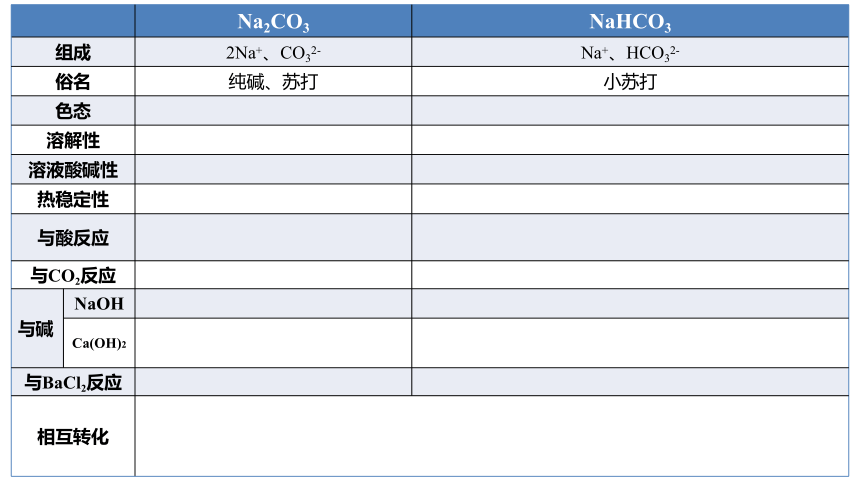
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态
溶解性
溶液酸碱性
热稳定性
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 碳酸钠
碳酸氢钠
白色粉末
细小的白色晶体
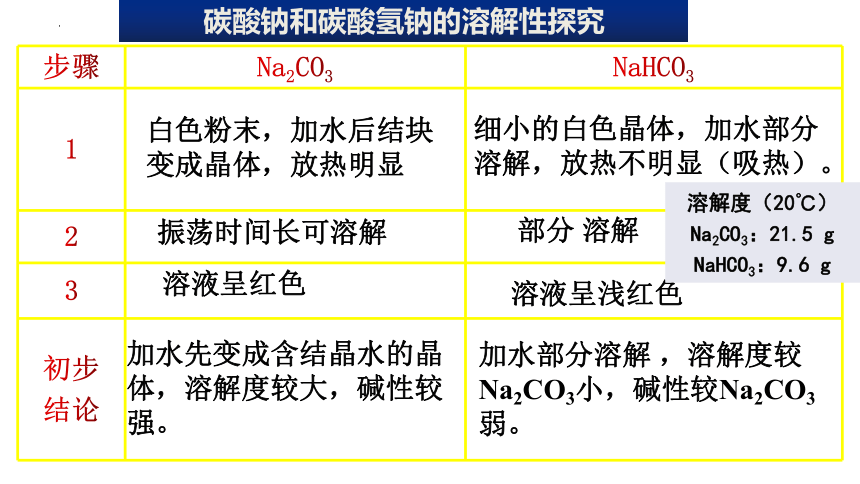
碳酸钠和碳酸氢钠的溶解性探究
步骤 Na2CO3 NaHCO3
1
2
3
初步 结论
白色粉末,加水后结块变成晶体,放热明显
细小的白色晶体,加水部分溶解,放热不明显(吸热)。
部分 溶解
振荡时间长可溶解
溶液呈红色
溶液呈浅红色
加水先变成含结晶水的晶体,溶解度较大,碱性较强。
加水部分溶解 ,溶解度较Na2CO3小,碱性较Na2CO3弱。
碳酸钠和碳酸氢钠的溶解性探究
溶解度(20℃)
Na2CO3:21.5 g
NaHCO3:9.6 g
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
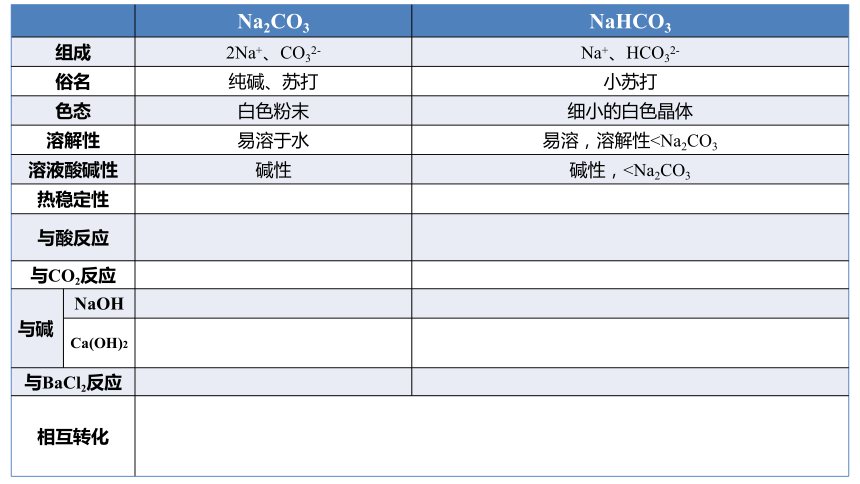
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
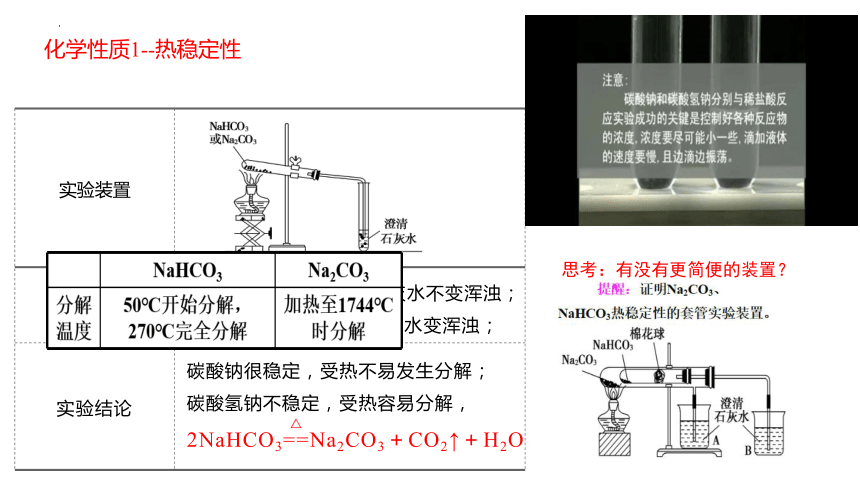
相互转化 实验装置
实验现象
实验结论
化学性质1--热稳定性
加热 Na2CO3 时澄清石灰水不变浑浊;加热NaHCO3时澄清石灰水变浑浊;
碳酸钠很稳定,受热不易发生分解;
碳酸氢钠不稳定,受热容易分解,2NaHCO3==Na2CO3+CO2↑+H2O
△
思考:有没有更简便的装置?
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性 稳定 2NaHCO3==Na2CO3+CO2↑+H2O
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 △
分别向碳酸钠和碳酸氢钠溶液中逐滴加盐酸,立即有气泡产生的是 。
碳酸钠:
碳酸氢钠:
NaHCO3
①CO32-+H+ == HCO3-
②HCO3-+H+ == CO2↑+H2O
HCO3-+H+ == CO2↑+H2O
化学性质2--与酸反应
化学性质4--与CO2反应
思考:向NaOH溶液中通入CO2,当CO2少量、过量时,会发生什么反应?
①CO 2 +2OH- == CO32- + H2O
②CO32- + H2O + CO2 == 2HCO3-
碳酸钠:CO32- + H2O + CO2 == 2HCO3-
碳酸氢钠:不反应
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性 稳定 2NaHCO3==Na2CO3+CO2↑+H2O
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 △
化学性质3--与碱反应
(1)与氢氧化钠反应
①Na2CO3与NaOH不反应。
②NaHCO3: 。
(2)与澄清石灰水反应(写离子方程式)
①Na2CO3: 。
②NaHCO3与少量Ca(OH)2反应:
。
③NaHCO3与过量Ca(OH)2反应:
。
NaHCO3+NaOH===Na2CO3+H2O
Ca2++CO32- == CaCO3↓
2HCO3-+Ca2++2OH- == CaCO3↓+CO32-+2H2O
HCO3-+Ca2++OH- == CaCO3↓+H2O
化学性质4--与盐反应
与BaCl2溶液(钙盐、钡盐)反应
①Na2CO3: 。
②NaHCO3与BaCl2溶液不反应
Ba2++CO32- == BaCO3↓
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性 稳定 2NaHCO3==Na2CO3+CO2↑+H2O
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 △
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性 稳定 2NaHCO3==Na2CO3+CO2↑+H2O
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 Na2CO3 NaHCO3 △
少量H+ / CO2 、H2O
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性溶液酸碱性 碱性 碱性,热稳定性 稳定 2NaHCO3==Na2CO3+CO2↑+H2O
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 Na2CO3 NaHCO3 △
少量H+ / CO2 、H2O
加热
/ NaOH
1、鉴别
如何鉴别碳酸钠与碳酸氢钠?
①固体——加热法
②溶液——沉淀法、气体法
A、取少量待测液于试管中,滴加 ,产生 的是 。
B、取少量待测液于试管中,逐滴滴加 ,立即产生 的是 。
BaCl2/CaCl2溶液
白色沉淀
气泡
Na2CO 3
稀盐酸
NaHCO3
碳酸钠、碳酸氢钠的鉴别和除杂
除杂方法或所用试剂 反应原理
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热
通入足量CO2
Na2CO3+H2O+CO2=2NaHCO3
加入适量的NaOH溶液
NaHCO3+NaOH=Na2CO3+H2O
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
Na2CO3与NaHCO3的除杂与转化
2、除杂
Na2CO3、NaHCO3的应用
玻璃制品
造纸、纺织
制皂、洗涤剂
Na2CO3 :
NaHCO3 :
发酵剂
制药
灭火
思考:一块钠裸露在空气中,会发生怎样的现象变化,最后会生成什么?
银白色金属钠
表面变暗,生成Na2O
O2
出现白色固体,生成NaOH
H2O
H2O
表面变成溶液,NaOH潮解。
CO2
生成白色块状物质——碳酸钠晶体。
风化
生成白色粉末状物质——碳酸钠
① 4Na + O2 == 2Na2O
② Na2O + H2O == 2NaOH
③ 2NaOH + CO2 == Na2CO3 + H2O
Na2CO3 + 10H2O == Na2CO3·10H2O
④ Na2CO3·xH2O == Na2CO3 + xH2O
①
②
③
④
1.下列有关Na2CO3与NaHCO3的性质中不正确的是( )
A.相同浓度两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同浓度的稀硫酸反应放出气泡的速率:NaHCO3D.热稳定性:NaHCO3C
随堂演练
2、下列说法中正确的是 ( )
A.加水溶解NaHCO3和Na2CO3固体,都放热
B.石灰水能与Na2CO3反应,而不能与NaHCO3反应
C.等质量的Na2CO3与盐酸反应制得的CO2比NaHCO3多
D.等浓度的NaHCO3和Na2CO3溶液与等浓度的盐酸反应,NaHCO3 反应更剧烈
D
随堂演练
3、现有混有少量NaHCO3的Na2CO3固体,下列有关提纯Na2CO3的方法中正确的是( )
A. 加入过量的NaOH溶液
B. 加入适量的盐酸
C. 将固体充分加热,直到质量不变为止
D. 加入CaCl2溶液
C
随堂演练
4、向氢氧化钠溶液中通入二氧化碳,向所得溶液中滴加稀盐酸,图像如下:写出滴加盐酸前的溶质各是什么?
A
B
C
D
A. Na2CO3和NaOH
B. NaHCO3和Na2CO3
C.Na2CO3
D.NaHCO3
随堂演练
第3课时 钠盐
第二章 第一节 钠及其化合物
阅读使用说明
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态
溶解性
溶液酸碱性
热稳定性
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 碳酸钠
碳酸氢钠
白色粉末
细小的白色晶体
碳酸钠和碳酸氢钠的溶解性探究
步骤 Na2CO3 NaHCO3
1
2
3
初步 结论
白色粉末,加水后结块变成晶体,放热明显
细小的白色晶体,加水部分溶解,放热不明显(吸热)。
部分 溶解
振荡时间长可溶解
溶液呈红色
溶液呈浅红色
加水先变成含结晶水的晶体,溶解度较大,碱性较强。
加水部分溶解 ,溶解度较Na2CO3小,碱性较Na2CO3弱。
碳酸钠和碳酸氢钠的溶解性探究
溶解度(20℃)
Na2CO3:21.5 g
NaHCO3:9.6 g
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 实验装置
实验现象
实验结论
化学性质1--热稳定性
加热 Na2CO3 时澄清石灰水不变浑浊;加热NaHCO3时澄清石灰水变浑浊;
碳酸钠很稳定,受热不易发生分解;
碳酸氢钠不稳定,受热容易分解,2NaHCO3==Na2CO3+CO2↑+H2O
△
思考:有没有更简便的装置?
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应
与CO2反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 △
分别向碳酸钠和碳酸氢钠溶液中逐滴加盐酸,立即有气泡产生的是 。
碳酸钠:
碳酸氢钠:
NaHCO3
①CO32-+H+ == HCO3-
②HCO3-+H+ == CO2↑+H2O
HCO3-+H+ == CO2↑+H2O
化学性质2--与酸反应
化学性质4--与CO2反应
思考:向NaOH溶液中通入CO2,当CO2少量、过量时,会发生什么反应?
①CO 2 +2OH- == CO32- + H2O
②CO32- + H2O + CO2 == 2HCO3-
碳酸钠:CO32- + H2O + CO2 == 2HCO3-
碳酸氢钠:不反应
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH
Ca(OH)2
与BaCl2反应
相互转化 △
化学性质3--与碱反应
(1)与氢氧化钠反应
①Na2CO3与NaOH不反应。
②NaHCO3: 。
(2)与澄清石灰水反应(写离子方程式)
①Na2CO3: 。
②NaHCO3与少量Ca(OH)2反应:
。
③NaHCO3与过量Ca(OH)2反应:
。
NaHCO3+NaOH===Na2CO3+H2O
Ca2++CO32- == CaCO3↓
2HCO3-+Ca2++2OH- == CaCO3↓+CO32-+2H2O
HCO3-+Ca2++OH- == CaCO3↓+H2O
化学性质4--与盐反应
与BaCl2溶液(钙盐、钡盐)反应
①Na2CO3: 。
②NaHCO3与BaCl2溶液不反应
Ba2++CO32- == BaCO3↓
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 △
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 Na2CO3 NaHCO3 △
少量H+ / CO2 、H2O
Na2CO3 NaHCO3
组成 2Na+、CO32- Na+、HCO32-
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小的白色晶体
溶解性 易溶于水 易溶,溶解性
与酸反应 酸少量:CO32-+H+ == HCO3- 酸足量:CO32-+2H+=H2O+CO2↑ HCO3-+H+ == CO2↑+H2O
与CO2反应 Na2CO3+H2O+CO2=2NaHCO3 不反应
与碱 NaOH 不反应 NaHCO3+NaOH===Na2CO3+H2O
Ca(OH)2 Ca2++CO32- == CaCO3↓ 碱少量:Ca2++2OH-+2HCO3-== CaCO3↓+CO32-+2H2O
碱过量:HCO3-+Ca2++OH- == CaCO3↓+H2O
与BaCl2反应 Ba2++CO32- == BaCO3↓ 不反应
相互转化 Na2CO3 NaHCO3 △
少量H+ / CO2 、H2O
加热
/ NaOH
1、鉴别
如何鉴别碳酸钠与碳酸氢钠?
①固体——加热法
②溶液——沉淀法、气体法
A、取少量待测液于试管中,滴加 ,产生 的是 。
B、取少量待测液于试管中,逐滴滴加 ,立即产生 的是 。
BaCl2/CaCl2溶液
白色沉淀
气泡
Na2CO 3
稀盐酸
NaHCO3
碳酸钠、碳酸氢钠的鉴别和除杂
除杂方法或所用试剂 反应原理
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热
通入足量CO2
Na2CO3+H2O+CO2=2NaHCO3
加入适量的NaOH溶液
NaHCO3+NaOH=Na2CO3+H2O
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
Na2CO3与NaHCO3的除杂与转化
2、除杂
Na2CO3、NaHCO3的应用
玻璃制品
造纸、纺织
制皂、洗涤剂
Na2CO3 :
NaHCO3 :
发酵剂
制药
灭火
思考:一块钠裸露在空气中,会发生怎样的现象变化,最后会生成什么?
银白色金属钠
表面变暗,生成Na2O
O2
出现白色固体,生成NaOH
H2O
H2O
表面变成溶液,NaOH潮解。
CO2
生成白色块状物质——碳酸钠晶体。
风化
生成白色粉末状物质——碳酸钠
① 4Na + O2 == 2Na2O
② Na2O + H2O == 2NaOH
③ 2NaOH + CO2 == Na2CO3 + H2O
Na2CO3 + 10H2O == Na2CO3·10H2O
④ Na2CO3·xH2O == Na2CO3 + xH2O
①
②
③
④
1.下列有关Na2CO3与NaHCO3的性质中不正确的是( )
A.相同浓度两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同浓度的稀硫酸反应放出气泡的速率:NaHCO3
随堂演练
2、下列说法中正确的是 ( )
A.加水溶解NaHCO3和Na2CO3固体,都放热
B.石灰水能与Na2CO3反应,而不能与NaHCO3反应
C.等质量的Na2CO3与盐酸反应制得的CO2比NaHCO3多
D.等浓度的NaHCO3和Na2CO3溶液与等浓度的盐酸反应,NaHCO3 反应更剧烈
D
随堂演练
3、现有混有少量NaHCO3的Na2CO3固体,下列有关提纯Na2CO3的方法中正确的是( )
A. 加入过量的NaOH溶液
B. 加入适量的盐酸
C. 将固体充分加热,直到质量不变为止
D. 加入CaCl2溶液
C
随堂演练
4、向氢氧化钠溶液中通入二氧化碳,向所得溶液中滴加稀盐酸,图像如下:写出滴加盐酸前的溶质各是什么?
A
B
C
D
A. Na2CO3和NaOH
B. NaHCO3和Na2CO3
C.Na2CO3
D.NaHCO3
随堂演练
