3.1.1铁单质课件 (共23张PPT)人教版(2019)必修第一册
文档属性
| 名称 | 3.1.1铁单质课件 (共23张PPT)人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 41.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 01:34:23 | ||
图片预览






文档简介
(共23张PPT)
第三章 第一节 铁及其化合物
第1课时 铁的单质
学习目标
GOAL
结合生活中的真实情境,了解铁的主要性质
了解铁在生产、生活中的应用
通过铁与不同氧化剂反应生成不同价态的物质,明确物质的变化观
一
二
三
活动一:回顾铁的存在与冶炼
单质
铁元素的存在及使用
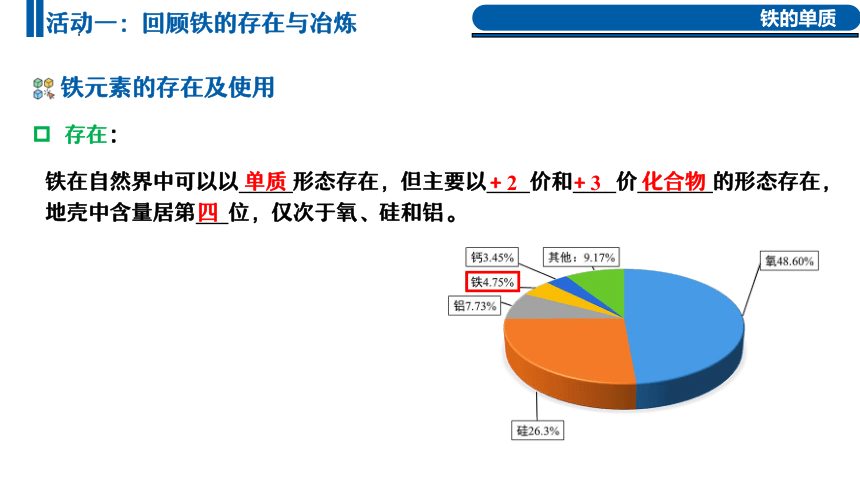
铁在自然界中可以以_______ 形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
存在:
请同学们阅读教材P68,说一说铁在自然界中以什么形态存在呢?铁元素在地壳中的含量排第几位?
活动一:回顾铁的存在与冶炼
铁在自然界中可以以_____形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
单质
+2
+3
化合物
赤铁矿Fe2O3
菱铁矿FeCO3
磁铁矿Fe3O4
黄铁矿FeS2
铁元素的存在及使用
存在:
铁还有+6价,如K2FeO4
活动一:回顾铁的存在与冶炼
铁在自然界中可以以_____形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
单质
+2
+3
化合物
铁元素的存在及使用
存在:
四
活动一:回顾铁的存在与冶炼
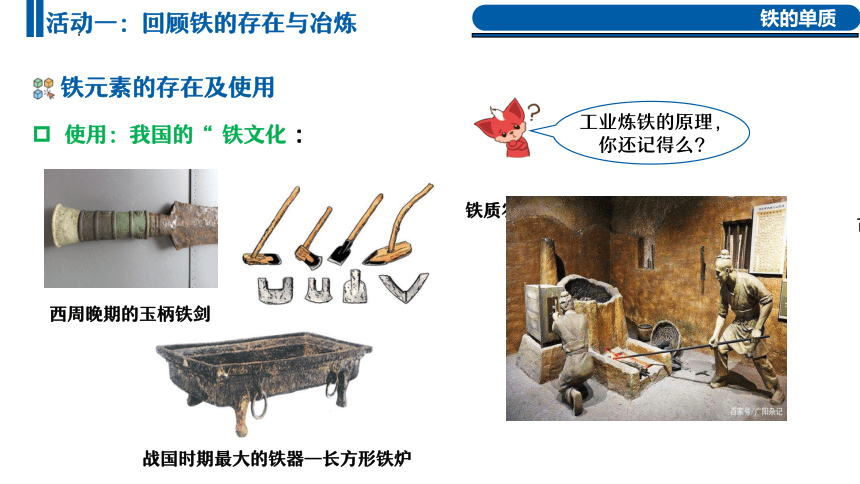
铁质农具
古代冶铁
战国时期最大的铁器—长方形铁炉
铁元素的存在及使用
使用:我国的“ 铁文化 :
西周晚期的玉柄铁剑
工业炼铁的原理,
你还记得么?
活动一:回顾铁的存在与冶炼
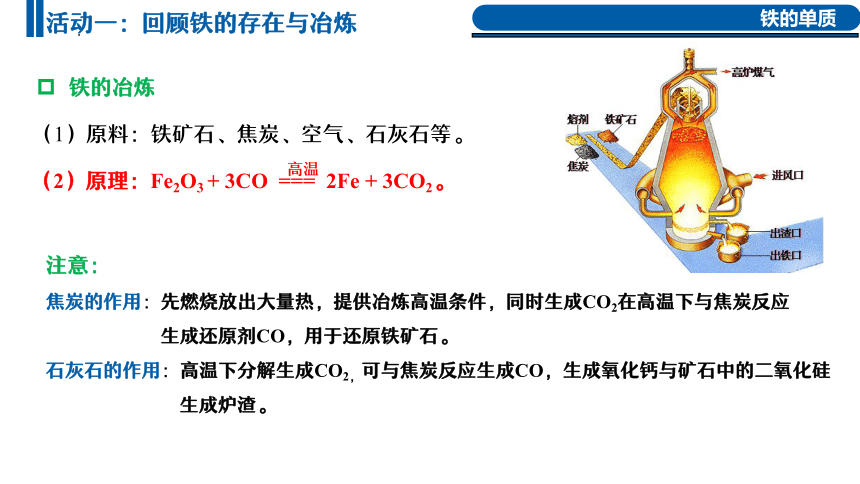
注意:
焦炭的作用:先燃烧放出大量热,提供冶炼高温条件,同时生成CO2在高温下与焦炭反应
生成还原剂CO,用于还原铁矿石。
石灰石的作用:高温下分解生成CO2,可与焦炭反应生成CO,生成氧化钙与矿石中的二氧化硅
生成炉渣。
(2)原理:Fe2O3 + 3CO === 2Fe + 3CO2。
高温
(1)原料:铁矿石、焦炭、空气、石灰石等。
铁的冶炼
活动二:铁的物理性质和化学性质
铁的物理性质
纯铁是一种光亮的______金属,铁有_____性、_____性、_____性,但其导电性不如________,铁还能被______吸引。其熔、沸点较____,熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm-3。
延展
导热
导电
铜和铝
磁体
高
铁皮
铁锅
电极
特别注意:纯铁是银白色金属,而铁粉是黑色的。
银白色
1.纯净铁的物理性质有
①光亮的银白色 ②黑色 ③在潮湿的空气中易被腐蚀 ④有延展性
⑤能导电导热 ⑥硬而脆 ⑦能被磁铁吸,引易被磁化
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
【答案】B
【解析】纯净的铁为银白色固体,具有很强的抗腐蚀能力,具有延展性,能导电导热,能被磁铁吸,引易被磁化;只有①④⑤⑦符合题意,故答案选B。
活动二:铁的物理性质和化学性质
与某些非金属单质、酸和盐溶液反应
化学性质 化学方程式举例
①Fe与非金属单质反应
铁丝在氧气中燃烧
铁丝在氯气中燃烧
铁丝与硫磺的反应
铁的化学性质—还原性
Fe 1s22s22p63s23p63d64s2
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
②Fe与非氧化性酸反应(H2SO4)
Fe+H2SO4===FeSO4+H2↑
铁丝与稀硫酸反应
与某些非金属单质、酸和盐溶液反应
铁的化学性质—还原性
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
③Fe与盐溶液反应(CuSO4)
Fe+CuSO4===Cu+FeSO4
铁丝与硫酸铜反应
与某些非金属单质、酸和盐溶液反应
铁的化学性质—还原性
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
①Fe与非金属单质反应
②Fe与非氧化性酸反应(H2SO4)
③Fe与盐溶液反应(CuSO4)
Fe在反应中作_____剂,遇到较强的_____剂(如Cl2、Br2、浓硫酸、硝酸等)生成____价铁的化合物,遇到较弱的_____剂(如S、I2、H+、Fe3+、Cu2+等)生成____价铁的化合物。
Fe+H2SO4===FeSO4+H2↑
Fe+CuSO4===Cu+FeSO4
还原
氧化
+3
氧化
+2
结论:
铁的化学性质—还原性
(3)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
(2)根据铁与Cl2、S反应的条件可以判断Cl2、S的氧化性强弱( )
1.判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)FeS、FeCl2、FeCl3均可以通过单质化合得到 ( )
×
×
[解析] FeCl2不能通过单质化合得到。
×
[解析]铁与氯气在点燃条件下反应生成氯化铁,铁与硫加热反应生成硫化亚铁,根据反应产物可判断Cl2、S的氧化性的强弱。
[解析] 铁与氯气反应只能生成FeCl3,与氯气的用量无关。
思考与讨论
我们用铁锅烧水、煮饭。说明铁与冷水、热水都不反应。
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水。这是为什么呢?
①从理论上来说,铁是否具备与水反应的可能性?
②利用所学知识,推测铁与水作用的产物?
铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色粉末 红棕色粉末 黑色晶体 白色 红褐色
受热 不分解 不稳定,在高温下可被水蒸气或者O2氧化 6Fe2O3=4Fe3O4+O2↑ 高温下比Fe2O3稳定 受热易分解 500 ℃
分解为Fe2O3
相关资料:
思考与讨论
①如何验证气体产物?
Fe + H2O(g) → Fe3O4 + H2
高温
②进行还原铁粉与水蒸气反应并验证气体产物,其实验装置应有几部分构成?
水蒸气的产生装置
水蒸气与铁粉的反应装置
气体产物检验装置
活动三:探究铁与水蒸气的反应
实验探究
探究:有人设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验。请讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
活动三:探究铁与水蒸气的反应
铁粉与水蒸气的反应
实验装置
操作现象 用火柴点燃肥皂液,听到_____声,证明生成了______。
实验结论 在高温下,铁能与水蒸气反应,化学方程式为
_______________________________________________________________。
爆鸣
H2
湿棉花的作用是受热时提供反应所需的水蒸气。
反应物中的H2O要注明状态(g),生成的H2不标“↑”
小结:金属与水反应规律
2Na + 2H2O = 2NaOH + H2↑
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
与冷水反应
与热水反应
与水蒸气反应
不与水反应
碱 和 H2
氧化物和H2
Mg + 2H2O = Mg(OH)2 + H2↑
△
3Fe + 4H2O(g) = Fe3O4 + 4H2
高温
金属性越强,越容易与水反应,反应越剧烈
1.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液 B.氯气
C.硫酸铜溶液 D.稀盐酸
B
2.下列关于铁与水蒸气反应的描述中,不正确的是( )
A.铁与水蒸气的反应是氧化还原反应
B.铁与水蒸气反应的产物是黑色的Fe2O3
C.红热的铁能与水蒸气反应,放出的气体点燃时能发生爆鸣声
D.常温下,铁与H2O不反应,但在空气中O2、H2O共同作用下能发生反应
B
3.在含有Fe3+、Cu2+、Cl-、H+的混合溶液中加入铁粉,充分反应后,溶液中所剩余的固体可能被磁铁吸引。此时溶液中存在较多的阳离子是 (填离子符号)。
Fe2+
(1)A 装置的作用是 ,烧瓶底部放碎瓷片的作用是 。
(2) 写出装置B中发生反应的化学方程式: 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A 、B两个装置中应先点燃 处的酒精灯(或酒精喷灯 ) ,点燃 E处酒精灯之前应进行的操 作是 。
4.某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
收集H2并检验其纯度
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
课堂总结
Fe+2H+===Fe2++H2↑
钝化
+3
Fe+Cu2+===Fe2++Cu
2Fe3++Fe===3Fe2+
作业布置
课本P77练习与应用
习题1、2、3、4
写在作业本上
第三章 第一节 铁及其化合物
第1课时 铁的单质
学习目标
GOAL
结合生活中的真实情境,了解铁的主要性质
了解铁在生产、生活中的应用
通过铁与不同氧化剂反应生成不同价态的物质,明确物质的变化观
一
二
三
活动一:回顾铁的存在与冶炼
单质
铁元素的存在及使用
铁在自然界中可以以_______ 形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
存在:
请同学们阅读教材P68,说一说铁在自然界中以什么形态存在呢?铁元素在地壳中的含量排第几位?
活动一:回顾铁的存在与冶炼
铁在自然界中可以以_____形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
单质
+2
+3
化合物
赤铁矿Fe2O3
菱铁矿FeCO3
磁铁矿Fe3O4
黄铁矿FeS2
铁元素的存在及使用
存在:
铁还有+6价,如K2FeO4
活动一:回顾铁的存在与冶炼
铁在自然界中可以以_____形态存在,但主要以____价和____价_______的形态存在,地壳中含量居第___位,仅次于氧、硅和铝。
单质
+2
+3
化合物
铁元素的存在及使用
存在:
四
活动一:回顾铁的存在与冶炼
铁质农具
古代冶铁
战国时期最大的铁器—长方形铁炉
铁元素的存在及使用
使用:我国的“ 铁文化 :
西周晚期的玉柄铁剑
工业炼铁的原理,
你还记得么?
活动一:回顾铁的存在与冶炼
注意:
焦炭的作用:先燃烧放出大量热,提供冶炼高温条件,同时生成CO2在高温下与焦炭反应
生成还原剂CO,用于还原铁矿石。
石灰石的作用:高温下分解生成CO2,可与焦炭反应生成CO,生成氧化钙与矿石中的二氧化硅
生成炉渣。
(2)原理:Fe2O3 + 3CO === 2Fe + 3CO2。
高温
(1)原料:铁矿石、焦炭、空气、石灰石等。
铁的冶炼
活动二:铁的物理性质和化学性质
铁的物理性质
纯铁是一种光亮的______金属,铁有_____性、_____性、_____性,但其导电性不如________,铁还能被______吸引。其熔、沸点较____,熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm-3。
延展
导热
导电
铜和铝
磁体
高
铁皮
铁锅
电极
特别注意:纯铁是银白色金属,而铁粉是黑色的。
银白色
1.纯净铁的物理性质有
①光亮的银白色 ②黑色 ③在潮湿的空气中易被腐蚀 ④有延展性
⑤能导电导热 ⑥硬而脆 ⑦能被磁铁吸,引易被磁化
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
【答案】B
【解析】纯净的铁为银白色固体,具有很强的抗腐蚀能力,具有延展性,能导电导热,能被磁铁吸,引易被磁化;只有①④⑤⑦符合题意,故答案选B。
活动二:铁的物理性质和化学性质
与某些非金属单质、酸和盐溶液反应
化学性质 化学方程式举例
①Fe与非金属单质反应
铁丝在氧气中燃烧
铁丝在氯气中燃烧
铁丝与硫磺的反应
铁的化学性质—还原性
Fe 1s22s22p63s23p63d64s2
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
②Fe与非氧化性酸反应(H2SO4)
Fe+H2SO4===FeSO4+H2↑
铁丝与稀硫酸反应
与某些非金属单质、酸和盐溶液反应
铁的化学性质—还原性
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
③Fe与盐溶液反应(CuSO4)
Fe+CuSO4===Cu+FeSO4
铁丝与硫酸铜反应
与某些非金属单质、酸和盐溶液反应
铁的化学性质—还原性
活动2:铁的物理性质和化学性质
化学性质 化学方程式举例
①Fe与非金属单质反应
②Fe与非氧化性酸反应(H2SO4)
③Fe与盐溶液反应(CuSO4)
Fe在反应中作_____剂,遇到较强的_____剂(如Cl2、Br2、浓硫酸、硝酸等)生成____价铁的化合物,遇到较弱的_____剂(如S、I2、H+、Fe3+、Cu2+等)生成____价铁的化合物。
Fe+H2SO4===FeSO4+H2↑
Fe+CuSO4===Cu+FeSO4
还原
氧化
+3
氧化
+2
结论:
铁的化学性质—还原性
(3)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
(2)根据铁与Cl2、S反应的条件可以判断Cl2、S的氧化性强弱( )
1.判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)FeS、FeCl2、FeCl3均可以通过单质化合得到 ( )
×
×
[解析] FeCl2不能通过单质化合得到。
×
[解析]铁与氯气在点燃条件下反应生成氯化铁,铁与硫加热反应生成硫化亚铁,根据反应产物可判断Cl2、S的氧化性的强弱。
[解析] 铁与氯气反应只能生成FeCl3,与氯气的用量无关。
思考与讨论
我们用铁锅烧水、煮饭。说明铁与冷水、热水都不反应。
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水。这是为什么呢?
①从理论上来说,铁是否具备与水反应的可能性?
②利用所学知识,推测铁与水作用的产物?
铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色粉末 红棕色粉末 黑色晶体 白色 红褐色
受热 不分解 不稳定,在高温下可被水蒸气或者O2氧化 6Fe2O3=4Fe3O4+O2↑ 高温下比Fe2O3稳定 受热易分解 500 ℃
分解为Fe2O3
相关资料:
思考与讨论
①如何验证气体产物?
Fe + H2O(g) → Fe3O4 + H2
高温
②进行还原铁粉与水蒸气反应并验证气体产物,其实验装置应有几部分构成?
水蒸气的产生装置
水蒸气与铁粉的反应装置
气体产物检验装置
活动三:探究铁与水蒸气的反应
实验探究
探究:有人设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验。请讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
活动三:探究铁与水蒸气的反应
铁粉与水蒸气的反应
实验装置
操作现象 用火柴点燃肥皂液,听到_____声,证明生成了______。
实验结论 在高温下,铁能与水蒸气反应,化学方程式为
_______________________________________________________________。
爆鸣
H2
湿棉花的作用是受热时提供反应所需的水蒸气。
反应物中的H2O要注明状态(g),生成的H2不标“↑”
小结:金属与水反应规律
2Na + 2H2O = 2NaOH + H2↑
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
与冷水反应
与热水反应
与水蒸气反应
不与水反应
碱 和 H2
氧化物和H2
Mg + 2H2O = Mg(OH)2 + H2↑
△
3Fe + 4H2O(g) = Fe3O4 + 4H2
高温
金属性越强,越容易与水反应,反应越剧烈
1.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液 B.氯气
C.硫酸铜溶液 D.稀盐酸
B
2.下列关于铁与水蒸气反应的描述中,不正确的是( )
A.铁与水蒸气的反应是氧化还原反应
B.铁与水蒸气反应的产物是黑色的Fe2O3
C.红热的铁能与水蒸气反应,放出的气体点燃时能发生爆鸣声
D.常温下,铁与H2O不反应,但在空气中O2、H2O共同作用下能发生反应
B
3.在含有Fe3+、Cu2+、Cl-、H+的混合溶液中加入铁粉,充分反应后,溶液中所剩余的固体可能被磁铁吸引。此时溶液中存在较多的阳离子是 (填离子符号)。
Fe2+
(1)A 装置的作用是 ,烧瓶底部放碎瓷片的作用是 。
(2) 写出装置B中发生反应的化学方程式: 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A 、B两个装置中应先点燃 处的酒精灯(或酒精喷灯 ) ,点燃 E处酒精灯之前应进行的操 作是 。
4.某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
收集H2并检验其纯度
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
课堂总结
Fe+2H+===Fe2++H2↑
钝化
+3
Fe+Cu2+===Fe2++Cu
2Fe3++Fe===3Fe2+
作业布置
课本P77练习与应用
习题1、2、3、4
写在作业本上
