3.1物质的聚集状态与晶体常识课件(共48张PPT) 人教版(2019)选择性必修2
文档属性
| 名称 | 3.1物质的聚集状态与晶体常识课件(共48张PPT) 人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 01:39:08 | ||
图片预览








文档简介
(共48张PPT)
年 级:高二 学 科:化学(人教版)
第三章 晶体结构与性质
第一节物质的聚集状态与晶体常识
1.了解物质的聚集状态。
2.认识晶体和非晶体的本质差异。
3.了解晶体中微粒的空间排布存在周期性。
学习目标
1.认识物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料,培养变化观念与平衡思想的核心素养。
2.了解晶体中微粒的空间排布存在周期性,认识简单的晶胞,培养证据推理与模型认知的核心素养。
3.知道晶体X射线衍射实验是测定物质结构的基本方法和实验手段,培养科学探究与创新意识的核心素养。
你知道吗
日常生活中所接触到的物质会有哪些状态呢?
钻石
松香
塑料
玻璃
固态:
流水
液态:
氧气
气态:
极光
雷电
那么雷电和极光里的物质又是什么状态的呢?
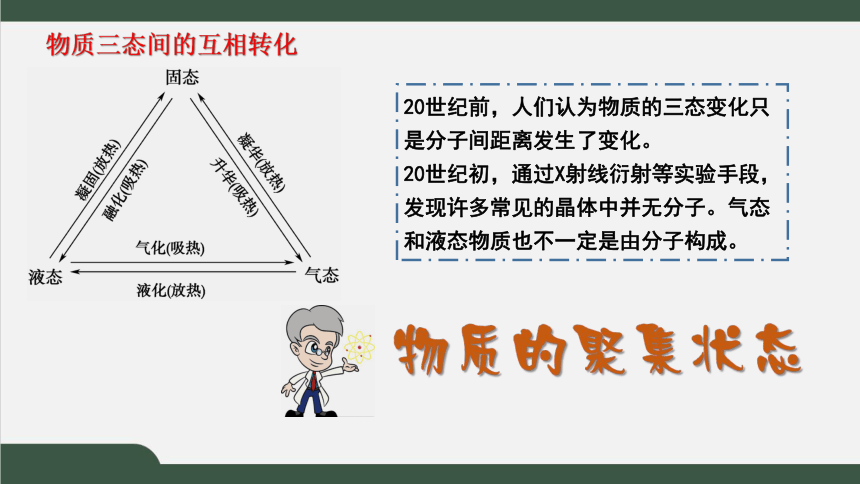
物质三态间的互相转化
20世纪前,人们认为物质的三态变化只是分子间距离发生了变化。
20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子。气态和液态物质也不一定是由分子构成。
【主干知识梳理】
一、物质的聚集状态
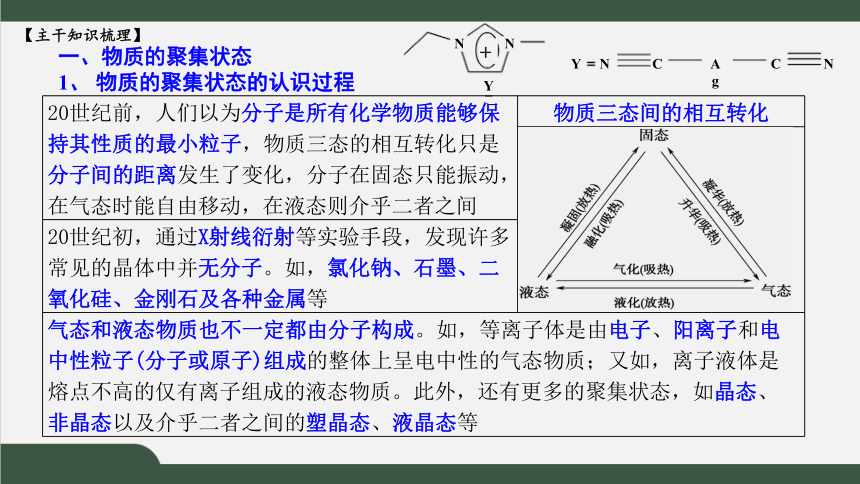
1、 物质的聚集状态的认识过程
20世纪前,人们以为分子是所有化学物质能够保持其性质的最小粒子,物质三态的相互转化只是分子间的距离发生了变化,分子在固态只能振动,在气态时能自由移动,在液态则介乎二者之间 物质三态间的相互转化
20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子。如,氯化钠、石墨、二氧化硅、金刚石及各种金属等 气态和液态物质也不一定都由分子构成。如,等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质;又如,离子液体是熔点不高的仅有离子组成的液态物质。此外,还有更多的聚集状态,如晶态、非晶态以及介乎二者之间的塑晶态、液晶态等 N
N
+
Y-
Y
N
C
Ag
C
N
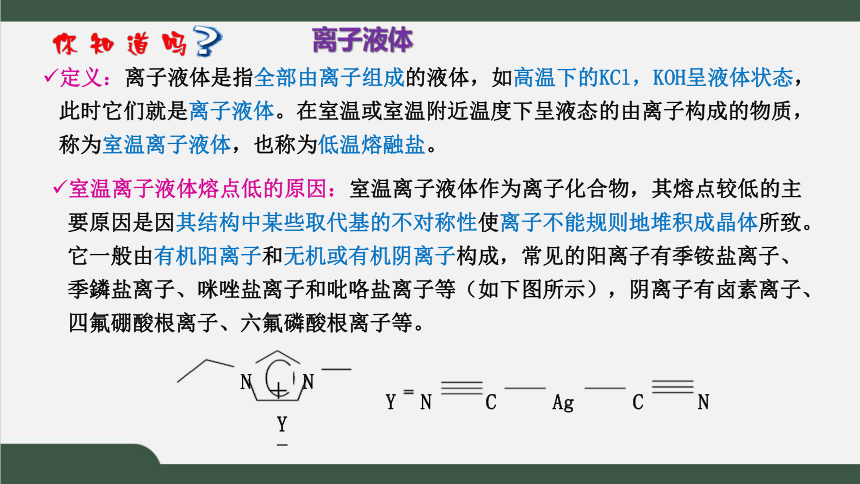
离子液体
定义:离子液体是指全部由离子组成的液体,如高温下的KCl,KOH呈液体状态,此时它们就是离子液体。在室温或室温附近温度下呈液态的由离子构成的物质,称为室温离子液体,也称为低温熔融盐。
室温离子液体熔点低的原因:室温离子液体作为离子化合物,其熔点较低的主要原因是因其结构中某些取代基的不对称性使离子不能规则地堆积成晶体所致。它一般由有机阳离子和无机或有机阴离子构成,常见的阳离子有季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等(如下图所示),阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。
N
N
+
Y-
Y
N
C
Ag
C
N
【思考】从结构的角度看,离子液体熔点低的原因?
【提示】在离子化合物中,阴阳离子之间的作用力为静电作用,其大小与阴阳离子的所带电荷及离子半径有关,离子半径越大,它们之间的作用力越小,这种离子化合物的熔点就越低。离子液体的阴阳离子体积很大,结构松散,导致它们之间的作用力较低,以至于熔点接近室温。
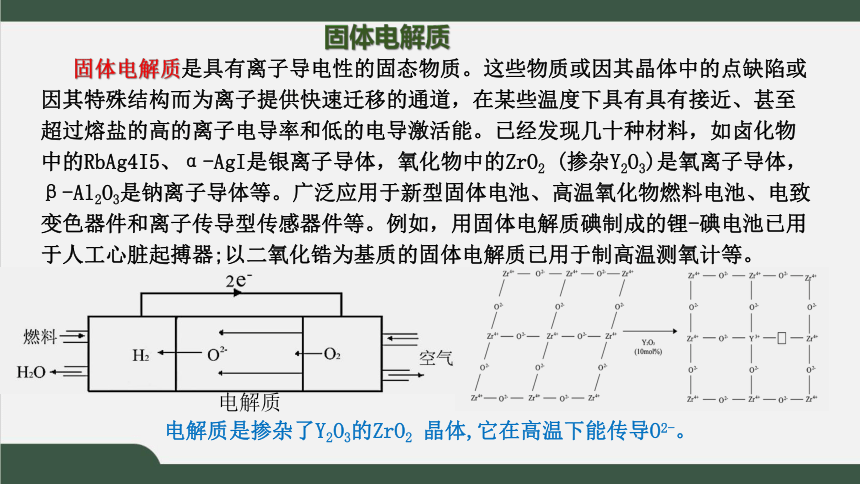
固体电解质
固体电解质是具有离子导电性的固态物质。这些物质或因其晶体中的点缺陷或因其特殊结构而为离子提供快速迁移的通道,在某些温度下具有具有接近、甚至超过熔盐的高的离子电导率和低的电导激活能。已经发现几十种材料,如卤化物中的RbAg4I5、α-AgI是银离子导体,氧化物中的ZrO2 (掺杂Y2O3)是氧离子导体,β-Al2O3是钠离子导体等。广泛应用于新型固体电池、高温氧化物燃料电池、电致变色器件和离子传导型传感器件等。例如,用固体电解质碘制成的锂-碘电池已用于人工心脏起搏器;以二氧化锆为基质的固体电解质已用于制高温测氧计等。
电解质
电解质是掺杂了Y2O3的ZrO2 晶体,它在高温下能传导O2-。
2、物质的聚集状态
物质的聚集状态除了气态、液态、固态外,还有更多的聚集状态如晶态、非晶态以及介乎二者之间的塑晶态、液晶态等
3、等离子体
(1)概念:气态物质在高温或者外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的物质聚集状态称为等离子体
(2)特点:等离子体中含有带电粒子且能够自由运动,使等离子体具有良好的导电性和流动性,因此等离子体的应用十分广泛。如:利用等离子体显示技术可以制造等离子体显示器;利用等离子体可以进行化学合成;核聚变也是在等离子体状态下发生的
(3)存在:等离子体是一种特殊的气体,存在于我们周围,常被视为是除去固、液、气外,物质存在的第四态。如:在日光灯和霓虹灯的灯管里,在蜡烛的火焰里,在极光和雷电里,都能找到等离子体
4、液晶
(1)概念:某些物质在熔融状态或被溶剂溶解之后,尽管失去固态物质的刚性,却获得了液体的易流动性,并保留着部分晶态物质分子的各向异性有序排列,形成一种兼有晶体和液体的部分性质的中间态,这种由固态向液态转化过程中存在的取向有序流体称为液晶
(2)特点:液晶是介于液态和晶态之间的物质状态,既具有液体的流动性、黏度、变形性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性
(3)应用:液晶已有广泛应用。如:手机、电脑和电视的液晶显示器,由于施加电场可使液晶的长轴取向发生不同程度的改变,从而显示数字、文字或图像;合成高强度液晶纤维已广泛应用于飞机、火箭、坦克、舰船、防弹衣、防弹头盔等
【对点训练1】
准晶
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体。具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性。普通晶体只能具有二次、三次、四次或六次旋转对称性,但是准晶的布拉格衍射图具有其他的对称性,例如五次对称性或者更高的如六次以上的对称性。获得2011年诺贝尔化学奖的丹·舍特曼是第一个正式报道发现了准晶的人。1984年他和以色列理工学院的同事们在快速冷却的铝锰合金中发现了一种新的金属相,其电子衍射斑具有明显的五次对称性。准晶体具有独特的属性,其坚硬又有弹性、非常平滑,而且,与大多数金属不同的是,其导电、导热性很差,在日常生活中可用来制造不粘锅、发光二极管、热电转化设备等。
二、晶体与非晶体
思考与交流 观察晶体和非晶体的投影示意图,分析晶体内部和非晶体的内部微粒排列的情况 投影示意图 晶体二氧化硅
非晶体二氧化硅
结论 ①晶体:组成晶体的微粒在空间按一定规律呈周期性排列 ②非晶体:组成非晶体的微粒在空间杂乱无章地排列 1、晶体和非晶体的概念
(1)晶体:内部粒子(原子、离子或分子)在三维空间按一定规律呈周期性重复排列构成的固体物质。如:高锰酸钾、金刚石、干冰、金属铜、石墨等
(2)非晶体:内部原子或分子的排列呈杂乱无章的分布状态的固体物质。如:玻璃、松香、硅藻土、橡胶、沥青等
(3)分类根据组成晶体的微粒和微粒间的相互作用,可分为:
【微点拨】
①绝大多数常见的固体都是晶体
②排列的周期性是指在一定方向上每隔一定距离重复出现相同的排列
晶体
离子晶体
共价晶体
分子晶体
金属晶体
让我们一起先欣赏几种美丽的晶体
2、晶体的特点
(1)晶体具有自范性
实验探究 在室温下,将一块不规则的CuSO4·5H2O固体放入饱和CuSO4溶液中,经过一段时间后会发生什么变化?
实验现象 CuSO4·5H2O固体会变成规则的立方体
实验结论 晶体能自发地呈现多面体外形
①定义:是指晶体在适当条件下可以自发地呈现封闭的、规则的多面体外形的性质
②形成条件:晶体生长的速率适当
③本质原因:晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。有没有自范性是晶体与非晶体的本质区别.
【微点拨】
①晶体具有整齐规则的几何外形是晶体自动发生的过程,是天然形成而非人为加工而成,如:冬季的雪花是水蒸气在空气中凝华时形成的晶体,一般为六角形的规则图案
②所谓自发过程,即自动发生的过程。但需要注意的是,“自发”过程的实现,仍需一定的条件,如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。自范性需要一定的条件,其中最重要的条件是晶体生长的速率要适当(生成晶体的速率不能快、溶液的浓度不能过大、温度变化不能过快)
③熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到肉眼看不到多面体外形的粉末或没有规则外形的块状物,甚至形成的只是非晶态(玻璃态),如:天然水晶球是岩浆里熔融态的SiO2侵入地壳内的空洞冷却形成的。剖开水晶球,它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶,不同的是玛瑙是熔融SiO2快速冷却形成的,而水晶则是熔融态SiO2缓慢冷却形成的
④晶体具有整齐规则的几何外形与物质的外观是有区别的,如:氯化钠晶体的几何外形是立方的,而食盐小颗粒用肉眼是看不到晶体外形的,但在光学显微镜或电子显微镜下仍观察到其规则的晶体外形。因此,许多固体的粉末用肉眼是看不到晶体外形,但在光学显微镜或电子显微镜下仍观察到其规则的晶体外形,这充分证明固体粉末仍是晶体,只因晶粒太小,肉眼看不到而已
(2)晶体具有固定的熔点
实验探究 将冰和玻璃加热各有什么现象?
实验结论 加热冰时,0 ℃达到冰的熔点,冰开始熔化,在全部熔化以前,继续加热,温度基本保持不变,完全熔化后,温度才开始升高
加热玻璃,温度升高到某一程度后开始变软,继续加热流动性增强,最后变为液体。玻璃从软化到完全熔化,中间经过较大的温度范围
①晶体有固定的熔点
加热晶体,温度达到熔点时即开始融化;在没有全部融化以前继续加热,温度不再升高,这时所供给的热量都用来晶体融化;完全溶化后,温度才开始升高。这说明晶体有固定的熔点 晶体熔化曲线
②非晶体没有固定的熔点
加热非晶体时,温度升高到某一程度后开始软化,流动性增强,最后变为液体。从软化到完全熔化,中间经过较长的温度范围,这说明非晶体没有固定的熔点 非晶体熔化过程
(3)晶体具有各向异性
①石墨晶体导电性的探究
石墨晶体导电性测量 石墨晶体层面(平行方向)的导电性比层与层之间(竖直)的导电性强
实验结论 石墨晶体在不同方向上导电性不同 ②晶体与非晶体导热性的探究
实验探究 将热的铁针分别插入涂有石蜡的水晶片和涂有石蜡的玻璃片,观察石蜡在不同方向上的熔化速度 示意图
实验现象 石蜡在水晶片上不同方向的熔化的快慢不同,而在玻璃片上熔化的快慢相同 实验结论 晶体在不同方向上导热性不同;而非晶体在不同方向上导热性相同 ③各向异性:指在不同的方向上表现出不同的物理性质,如强度、导热性、光学性质等。这是因为晶体内部微粒在各个方向上排列的距离不同而引起性质上的差异,而且通过这些性质可以了解晶体的内部排列与结构的一些信息,而非晶体不具有各向异性。对于同一幅图案来说,从不同的方向审视,也会产生不同的感受,那么对于晶体来说,许多物理性质,如:硬度、导热性、光学性质等,因研究角度不同而产生差异,即:为各向异性。如:蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104
(4)外形和内部质点排列的高度有序性
3、获得晶体的途径
(1)熔融态物质凝固。如:从熔融态结晶出来的硫晶体
(2)气态物质冷却不经过液态直接凝固(凝华)。如:凝华得到的碘晶体
(3)溶质从溶液中析出。如:从硫酸铜饱和溶液中析出的硫酸铜晶体
4、晶体与非晶体的特征和性质
晶体 非晶体
结构特征(本质区别) 结构微粒周期性有序排列 结构微粒无序排列
性质特征 自范性 有 无
熔、沸点 固定 不固定
某些物理性质 各向异性 各向同性
二者区别方法 间接方法 看是否有固定的熔、沸点 科学方法 对固体进行X 射线衍射实验 【对点训练2】
①同一物质可以是晶体,也可以是非晶体,如晶体SiO2和非晶体SiO2。
②有着规则几何外形或者美观、对称外形的固体,不一定是晶体。例如,玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外观。
③具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成。
④晶体不一定都有规则的几何外形,如玛瑙。
判断正误(正确的画“√”,错误的画“×”)。
(1)晶体和非晶体的本质区别是晶体中粒子在微观空间里呈周期性的有序排列 ( )
(2)通过X-射线衍射实验的方法不能区分晶体和非晶体 ( )
(3)凡有规则外形的固体一定是晶体 ( )
(4)晶体的熔点一定比非晶体的熔点高 ( )
(5)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )
【答案】(1)√ (2)× (3)× (4)× (5)√
1、晶胞的概念:描述晶体结构的基本单元叫做晶胞。晶胞是晶体中最小的结构重复单元
三、晶胞
由于晶体的微粒在微观空间中是呈现有规律的周期性排列,因此,描述晶体在微观空间里原子的排列时,常从晶体微观空间里“截取”一个具有代表性的基本单元
2、晶胞与晶体的关系:一般来说,晶胞都是平行六面体,晶体可以看作是数量巨大的晶胞“无隙并置”而成
(1)“无隙”:相邻晶胞之间无任何间隙
(2)“并置”:所有晶胞都是平行排列的,取向相同
(3)晶胞只是晶体微观空间里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部含有的原子种数、个数及几何排列都是完全相同的
(4)晶体是由无数个晶胞堆积得到的。知道晶胞的大小和形状以及晶胞中粒子的种类、数目和粒子所处的空间位置,就可以认识整个晶体的结构
氯化钠晶体
铜晶体
平行六面体
无隙并置
2.判断下列六面体是否是晶胞?
A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
【思考与讨论】
3、均摊法确定晶胞中粒子的个数
均摊法:在晶体中,一个粒子为n个晶胞所共有,则该粒子的1/n属于这个晶胞
(1)长方体(正方体)晶胞中不同位置的粒子数的计算
①处于顶点上的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞
②处于棱边上的粒子,同时为4个晶胞所共有,每个粒子有1/4属于该晶胞
③处于晶面上的粒子,同时为2个晶胞所共有,每个粒子有1/2属于该晶胞
④处于晶胞内部的粒子,则完全属于该晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
晶胞对质点的占有率
六方晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
(1)立方体
(2)三棱柱
(3)六棱柱
体心
1
面心
1/2
棱边
1/4
顶点
1/8
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
例1、下图是金属铜晶胞,用均摊法计算一个金属铜晶胞中含有的原子数为_________
例2、下图分别是金属钠、金属锌、碘、金刚石晶胞的示意图,数一数,它们分别平均含有几个原子?
钠 锌 碘 金刚石
晶胞
原子的数目
(2)六棱柱晶胞中不同位置的粒子数的计算
均摊法 如图所示,六方晶胞中所含粒子数目为
12×+3+2×=6
①位于顶角,有 属于该晶胞 ②位于棱上,有 属于该晶胞 ③位于面上,有 属于该晶胞 ④位于内部,完全属于该晶胞
(3)非长方体和六方晶胞中粒子数目计算时视具体情况而定
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占
(4)晶体密度的计算
晶体密度的计算公式推导过程 若1个晶胞中含有x个微粒,则晶胞的物质的量为: mol 晶胞的质量为:m=n·M= g密度为:ρ= 右图为CsCl晶体的晶胞
假设相邻的两个Cs+的核间距为acm,NA为阿伏加德罗常数,CsCl的摩尔质量用Mg·mol-1表示,则CsCl晶体的密度为ρ= g·cm-3 【对点训练3】
四、晶体结构的测定
1、测定晶体结构最常用的仪器是X射线衍射仪。当单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰;而同一条件下摄取非晶体谱图中却看不到分立的斑点或者明锐的谱线
将单一波长的X射线分别通过晶体SiO2和非晶体SiO2时,晶体SiO2则会在记录仪上看到分立的斑点或者明锐的谱线,而非晶体SiO2却看不到分立的斑点或者明锐的谱线
2、由衍射图形获得晶体结构的信息包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等
3、区别晶体与非晶体最可靠的科学方法是利用X射线衍射实验
【课后作业】
A
B
例3、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
化学式:
AB
化学式:
A2B
BA2
A
B
化学式:
例4、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
AB
B
化学式:
A
C
ABC3
例5、下图为高温超导领域的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
1)在该物质的晶体中,每个钛离子周围与它最接近且距离相等的钛离子共有 个
2)该晶体结构单元中,氧、钛、钙离子的个数比是 。
6
3∶1∶1
Ti
O
Ca
O:12×1/4=3
Ti: 8 ×1/8=1
Ca:1
例6、金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )
A.1∶2∶1 B.11∶8∶4
C.9∶8∶4 D.9∶14∶9
A
例7、纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因, 假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为 ( )
A、33.3% B、50%
C、87.5% D、96.3%
D
例8、某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
A
年 级:高二 学 科:化学(人教版)
第三章 晶体结构与性质
第一节物质的聚集状态与晶体常识
1.了解物质的聚集状态。
2.认识晶体和非晶体的本质差异。
3.了解晶体中微粒的空间排布存在周期性。
学习目标
1.认识物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料,培养变化观念与平衡思想的核心素养。
2.了解晶体中微粒的空间排布存在周期性,认识简单的晶胞,培养证据推理与模型认知的核心素养。
3.知道晶体X射线衍射实验是测定物质结构的基本方法和实验手段,培养科学探究与创新意识的核心素养。
你知道吗
日常生活中所接触到的物质会有哪些状态呢?
钻石
松香
塑料
玻璃
固态:
流水
液态:
氧气
气态:
极光
雷电
那么雷电和极光里的物质又是什么状态的呢?
物质三态间的互相转化
20世纪前,人们认为物质的三态变化只是分子间距离发生了变化。
20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子。气态和液态物质也不一定是由分子构成。
【主干知识梳理】
一、物质的聚集状态
1、 物质的聚集状态的认识过程
20世纪前,人们以为分子是所有化学物质能够保持其性质的最小粒子,物质三态的相互转化只是分子间的距离发生了变化,分子在固态只能振动,在气态时能自由移动,在液态则介乎二者之间 物质三态间的相互转化
20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子。如,氯化钠、石墨、二氧化硅、金刚石及各种金属等 气态和液态物质也不一定都由分子构成。如,等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质;又如,离子液体是熔点不高的仅有离子组成的液态物质。此外,还有更多的聚集状态,如晶态、非晶态以及介乎二者之间的塑晶态、液晶态等 N
N
+
Y-
Y
N
C
Ag
C
N
离子液体
定义:离子液体是指全部由离子组成的液体,如高温下的KCl,KOH呈液体状态,此时它们就是离子液体。在室温或室温附近温度下呈液态的由离子构成的物质,称为室温离子液体,也称为低温熔融盐。
室温离子液体熔点低的原因:室温离子液体作为离子化合物,其熔点较低的主要原因是因其结构中某些取代基的不对称性使离子不能规则地堆积成晶体所致。它一般由有机阳离子和无机或有机阴离子构成,常见的阳离子有季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等(如下图所示),阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。
N
N
+
Y-
Y
N
C
Ag
C
N
【思考】从结构的角度看,离子液体熔点低的原因?
【提示】在离子化合物中,阴阳离子之间的作用力为静电作用,其大小与阴阳离子的所带电荷及离子半径有关,离子半径越大,它们之间的作用力越小,这种离子化合物的熔点就越低。离子液体的阴阳离子体积很大,结构松散,导致它们之间的作用力较低,以至于熔点接近室温。
固体电解质
固体电解质是具有离子导电性的固态物质。这些物质或因其晶体中的点缺陷或因其特殊结构而为离子提供快速迁移的通道,在某些温度下具有具有接近、甚至超过熔盐的高的离子电导率和低的电导激活能。已经发现几十种材料,如卤化物中的RbAg4I5、α-AgI是银离子导体,氧化物中的ZrO2 (掺杂Y2O3)是氧离子导体,β-Al2O3是钠离子导体等。广泛应用于新型固体电池、高温氧化物燃料电池、电致变色器件和离子传导型传感器件等。例如,用固体电解质碘制成的锂-碘电池已用于人工心脏起搏器;以二氧化锆为基质的固体电解质已用于制高温测氧计等。
电解质
电解质是掺杂了Y2O3的ZrO2 晶体,它在高温下能传导O2-。
2、物质的聚集状态
物质的聚集状态除了气态、液态、固态外,还有更多的聚集状态如晶态、非晶态以及介乎二者之间的塑晶态、液晶态等
3、等离子体
(1)概念:气态物质在高温或者外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的物质聚集状态称为等离子体
(2)特点:等离子体中含有带电粒子且能够自由运动,使等离子体具有良好的导电性和流动性,因此等离子体的应用十分广泛。如:利用等离子体显示技术可以制造等离子体显示器;利用等离子体可以进行化学合成;核聚变也是在等离子体状态下发生的
(3)存在:等离子体是一种特殊的气体,存在于我们周围,常被视为是除去固、液、气外,物质存在的第四态。如:在日光灯和霓虹灯的灯管里,在蜡烛的火焰里,在极光和雷电里,都能找到等离子体
4、液晶
(1)概念:某些物质在熔融状态或被溶剂溶解之后,尽管失去固态物质的刚性,却获得了液体的易流动性,并保留着部分晶态物质分子的各向异性有序排列,形成一种兼有晶体和液体的部分性质的中间态,这种由固态向液态转化过程中存在的取向有序流体称为液晶
(2)特点:液晶是介于液态和晶态之间的物质状态,既具有液体的流动性、黏度、变形性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性
(3)应用:液晶已有广泛应用。如:手机、电脑和电视的液晶显示器,由于施加电场可使液晶的长轴取向发生不同程度的改变,从而显示数字、文字或图像;合成高强度液晶纤维已广泛应用于飞机、火箭、坦克、舰船、防弹衣、防弹头盔等
【对点训练1】
准晶
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体。具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性。普通晶体只能具有二次、三次、四次或六次旋转对称性,但是准晶的布拉格衍射图具有其他的对称性,例如五次对称性或者更高的如六次以上的对称性。获得2011年诺贝尔化学奖的丹·舍特曼是第一个正式报道发现了准晶的人。1984年他和以色列理工学院的同事们在快速冷却的铝锰合金中发现了一种新的金属相,其电子衍射斑具有明显的五次对称性。准晶体具有独特的属性,其坚硬又有弹性、非常平滑,而且,与大多数金属不同的是,其导电、导热性很差,在日常生活中可用来制造不粘锅、发光二极管、热电转化设备等。
二、晶体与非晶体
思考与交流 观察晶体和非晶体的投影示意图,分析晶体内部和非晶体的内部微粒排列的情况 投影示意图 晶体二氧化硅
非晶体二氧化硅
结论 ①晶体:组成晶体的微粒在空间按一定规律呈周期性排列 ②非晶体:组成非晶体的微粒在空间杂乱无章地排列 1、晶体和非晶体的概念
(1)晶体:内部粒子(原子、离子或分子)在三维空间按一定规律呈周期性重复排列构成的固体物质。如:高锰酸钾、金刚石、干冰、金属铜、石墨等
(2)非晶体:内部原子或分子的排列呈杂乱无章的分布状态的固体物质。如:玻璃、松香、硅藻土、橡胶、沥青等
(3)分类根据组成晶体的微粒和微粒间的相互作用,可分为:
【微点拨】
①绝大多数常见的固体都是晶体
②排列的周期性是指在一定方向上每隔一定距离重复出现相同的排列
晶体
离子晶体
共价晶体
分子晶体
金属晶体
让我们一起先欣赏几种美丽的晶体
2、晶体的特点
(1)晶体具有自范性
实验探究 在室温下,将一块不规则的CuSO4·5H2O固体放入饱和CuSO4溶液中,经过一段时间后会发生什么变化?
实验现象 CuSO4·5H2O固体会变成规则的立方体
实验结论 晶体能自发地呈现多面体外形
①定义:是指晶体在适当条件下可以自发地呈现封闭的、规则的多面体外形的性质
②形成条件:晶体生长的速率适当
③本质原因:晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。有没有自范性是晶体与非晶体的本质区别.
【微点拨】
①晶体具有整齐规则的几何外形是晶体自动发生的过程,是天然形成而非人为加工而成,如:冬季的雪花是水蒸气在空气中凝华时形成的晶体,一般为六角形的规则图案
②所谓自发过程,即自动发生的过程。但需要注意的是,“自发”过程的实现,仍需一定的条件,如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。自范性需要一定的条件,其中最重要的条件是晶体生长的速率要适当(生成晶体的速率不能快、溶液的浓度不能过大、温度变化不能过快)
③熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到肉眼看不到多面体外形的粉末或没有规则外形的块状物,甚至形成的只是非晶态(玻璃态),如:天然水晶球是岩浆里熔融态的SiO2侵入地壳内的空洞冷却形成的。剖开水晶球,它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶,不同的是玛瑙是熔融SiO2快速冷却形成的,而水晶则是熔融态SiO2缓慢冷却形成的
④晶体具有整齐规则的几何外形与物质的外观是有区别的,如:氯化钠晶体的几何外形是立方的,而食盐小颗粒用肉眼是看不到晶体外形的,但在光学显微镜或电子显微镜下仍观察到其规则的晶体外形。因此,许多固体的粉末用肉眼是看不到晶体外形,但在光学显微镜或电子显微镜下仍观察到其规则的晶体外形,这充分证明固体粉末仍是晶体,只因晶粒太小,肉眼看不到而已
(2)晶体具有固定的熔点
实验探究 将冰和玻璃加热各有什么现象?
实验结论 加热冰时,0 ℃达到冰的熔点,冰开始熔化,在全部熔化以前,继续加热,温度基本保持不变,完全熔化后,温度才开始升高
加热玻璃,温度升高到某一程度后开始变软,继续加热流动性增强,最后变为液体。玻璃从软化到完全熔化,中间经过较大的温度范围
①晶体有固定的熔点
加热晶体,温度达到熔点时即开始融化;在没有全部融化以前继续加热,温度不再升高,这时所供给的热量都用来晶体融化;完全溶化后,温度才开始升高。这说明晶体有固定的熔点 晶体熔化曲线
②非晶体没有固定的熔点
加热非晶体时,温度升高到某一程度后开始软化,流动性增强,最后变为液体。从软化到完全熔化,中间经过较长的温度范围,这说明非晶体没有固定的熔点 非晶体熔化过程
(3)晶体具有各向异性
①石墨晶体导电性的探究
石墨晶体导电性测量 石墨晶体层面(平行方向)的导电性比层与层之间(竖直)的导电性强
实验结论 石墨晶体在不同方向上导电性不同 ②晶体与非晶体导热性的探究
实验探究 将热的铁针分别插入涂有石蜡的水晶片和涂有石蜡的玻璃片,观察石蜡在不同方向上的熔化速度 示意图
实验现象 石蜡在水晶片上不同方向的熔化的快慢不同,而在玻璃片上熔化的快慢相同 实验结论 晶体在不同方向上导热性不同;而非晶体在不同方向上导热性相同 ③各向异性:指在不同的方向上表现出不同的物理性质,如强度、导热性、光学性质等。这是因为晶体内部微粒在各个方向上排列的距离不同而引起性质上的差异,而且通过这些性质可以了解晶体的内部排列与结构的一些信息,而非晶体不具有各向异性。对于同一幅图案来说,从不同的方向审视,也会产生不同的感受,那么对于晶体来说,许多物理性质,如:硬度、导热性、光学性质等,因研究角度不同而产生差异,即:为各向异性。如:蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104
(4)外形和内部质点排列的高度有序性
3、获得晶体的途径
(1)熔融态物质凝固。如:从熔融态结晶出来的硫晶体
(2)气态物质冷却不经过液态直接凝固(凝华)。如:凝华得到的碘晶体
(3)溶质从溶液中析出。如:从硫酸铜饱和溶液中析出的硫酸铜晶体
4、晶体与非晶体的特征和性质
晶体 非晶体
结构特征(本质区别) 结构微粒周期性有序排列 结构微粒无序排列
性质特征 自范性 有 无
熔、沸点 固定 不固定
某些物理性质 各向异性 各向同性
二者区别方法 间接方法 看是否有固定的熔、沸点 科学方法 对固体进行X 射线衍射实验 【对点训练2】
①同一物质可以是晶体,也可以是非晶体,如晶体SiO2和非晶体SiO2。
②有着规则几何外形或者美观、对称外形的固体,不一定是晶体。例如,玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外观。
③具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成。
④晶体不一定都有规则的几何外形,如玛瑙。
判断正误(正确的画“√”,错误的画“×”)。
(1)晶体和非晶体的本质区别是晶体中粒子在微观空间里呈周期性的有序排列 ( )
(2)通过X-射线衍射实验的方法不能区分晶体和非晶体 ( )
(3)凡有规则外形的固体一定是晶体 ( )
(4)晶体的熔点一定比非晶体的熔点高 ( )
(5)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )
【答案】(1)√ (2)× (3)× (4)× (5)√
1、晶胞的概念:描述晶体结构的基本单元叫做晶胞。晶胞是晶体中最小的结构重复单元
三、晶胞
由于晶体的微粒在微观空间中是呈现有规律的周期性排列,因此,描述晶体在微观空间里原子的排列时,常从晶体微观空间里“截取”一个具有代表性的基本单元
2、晶胞与晶体的关系:一般来说,晶胞都是平行六面体,晶体可以看作是数量巨大的晶胞“无隙并置”而成
(1)“无隙”:相邻晶胞之间无任何间隙
(2)“并置”:所有晶胞都是平行排列的,取向相同
(3)晶胞只是晶体微观空间里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部含有的原子种数、个数及几何排列都是完全相同的
(4)晶体是由无数个晶胞堆积得到的。知道晶胞的大小和形状以及晶胞中粒子的种类、数目和粒子所处的空间位置,就可以认识整个晶体的结构
氯化钠晶体
铜晶体
平行六面体
无隙并置
2.判断下列六面体是否是晶胞?
A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
【思考与讨论】
3、均摊法确定晶胞中粒子的个数
均摊法:在晶体中,一个粒子为n个晶胞所共有,则该粒子的1/n属于这个晶胞
(1)长方体(正方体)晶胞中不同位置的粒子数的计算
①处于顶点上的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞
②处于棱边上的粒子,同时为4个晶胞所共有,每个粒子有1/4属于该晶胞
③处于晶面上的粒子,同时为2个晶胞所共有,每个粒子有1/2属于该晶胞
④处于晶胞内部的粒子,则完全属于该晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
晶胞对质点的占有率
六方晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
(1)立方体
(2)三棱柱
(3)六棱柱
体心
1
面心
1/2
棱边
1/4
顶点
1/8
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
例1、下图是金属铜晶胞,用均摊法计算一个金属铜晶胞中含有的原子数为_________
例2、下图分别是金属钠、金属锌、碘、金刚石晶胞的示意图,数一数,它们分别平均含有几个原子?
钠 锌 碘 金刚石
晶胞
原子的数目
(2)六棱柱晶胞中不同位置的粒子数的计算
均摊法 如图所示,六方晶胞中所含粒子数目为
12×+3+2×=6
①位于顶角,有 属于该晶胞 ②位于棱上,有 属于该晶胞 ③位于面上,有 属于该晶胞 ④位于内部,完全属于该晶胞
(3)非长方体和六方晶胞中粒子数目计算时视具体情况而定
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占
(4)晶体密度的计算
晶体密度的计算公式推导过程 若1个晶胞中含有x个微粒,则晶胞的物质的量为: mol 晶胞的质量为:m=n·M= g密度为:ρ= 右图为CsCl晶体的晶胞
假设相邻的两个Cs+的核间距为acm,NA为阿伏加德罗常数,CsCl的摩尔质量用Mg·mol-1表示,则CsCl晶体的密度为ρ= g·cm-3 【对点训练3】
四、晶体结构的测定
1、测定晶体结构最常用的仪器是X射线衍射仪。当单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰;而同一条件下摄取非晶体谱图中却看不到分立的斑点或者明锐的谱线
将单一波长的X射线分别通过晶体SiO2和非晶体SiO2时,晶体SiO2则会在记录仪上看到分立的斑点或者明锐的谱线,而非晶体SiO2却看不到分立的斑点或者明锐的谱线
2、由衍射图形获得晶体结构的信息包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等
3、区别晶体与非晶体最可靠的科学方法是利用X射线衍射实验
【课后作业】
A
B
例3、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
化学式:
AB
化学式:
A2B
BA2
A
B
化学式:
例4、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)
AB
B
化学式:
A
C
ABC3
例5、下图为高温超导领域的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
1)在该物质的晶体中,每个钛离子周围与它最接近且距离相等的钛离子共有 个
2)该晶体结构单元中,氧、钛、钙离子的个数比是 。
6
3∶1∶1
Ti
O
Ca
O:12×1/4=3
Ti: 8 ×1/8=1
Ca:1
例6、金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )
A.1∶2∶1 B.11∶8∶4
C.9∶8∶4 D.9∶14∶9
A
例7、纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因, 假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为 ( )
A、33.3% B、50%
C、87.5% D、96.3%
D
例8、某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
A
