化学人教版(2019)必修第二册6.1.1化学能与热能(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.1化学能与热能(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 35.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 13:23:28 | ||
图片预览






文档简介
(共28张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
环节一:生活设疑,引入新课
感知生活中的热量变化
环节一:生活设疑,引入新课
感知生活中的热量变化
CaO + H2O = Ca(OH)2
环节一:生活设疑,引入新课
感知生活中的热量变化
暖宝宝
Fe + O2 + H2O → Fe2O3·xH2O
环节一:生活设疑,引入新课
感知生活中的热量变化
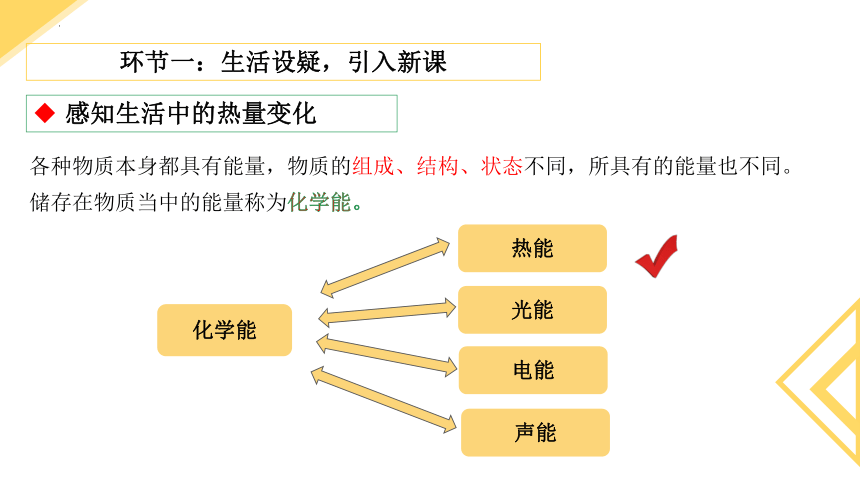
化学能
热能
光能
电能
声能
各种物质本身都具有能量,物质的组成、结构、状态不同,所具有的能量也不同。储存在物质当中的能量称为化学能。
环节二:实验探究,宏观推断
实验探究化学反应中的热量变化
实验探究——盐酸与镁反应前后溶液温度的变化
Mg + 2HCl === MgCl2 + H2↑
实验操作
在试管中加入2 mL 2 mol/L 盐酸,再放入用砂纸打磨光亮的镁条,用温度计测量过程的温度变化
实验现象
镁条逐渐溶解,有气泡产生,温度计温度上升,用手触摸试管壁,有温热感
反应原理
实验结论
镁与盐酸反应放出热量
环节二:实验探究,宏观推断
实验探究——氢氧化钡晶体与氯化铵晶体的反应
实验操作
将20g Ba(OH)2 8H2O晶体研细后与10g NH4Cl在烧杯中混合,放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯
实验现象
有刺激性气味气体产生;木片上的水结成冰,与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉
反应原理
实验结论
氢氧化钡晶体与氯化铵晶体反应吸收热量
Ba(OH)2·8H2O + 2NH4Cl === BaCl2 + 2NH3↑+ 10H2O
实验探究化学反应中的热量变化
环节二:实验探究,宏观推断
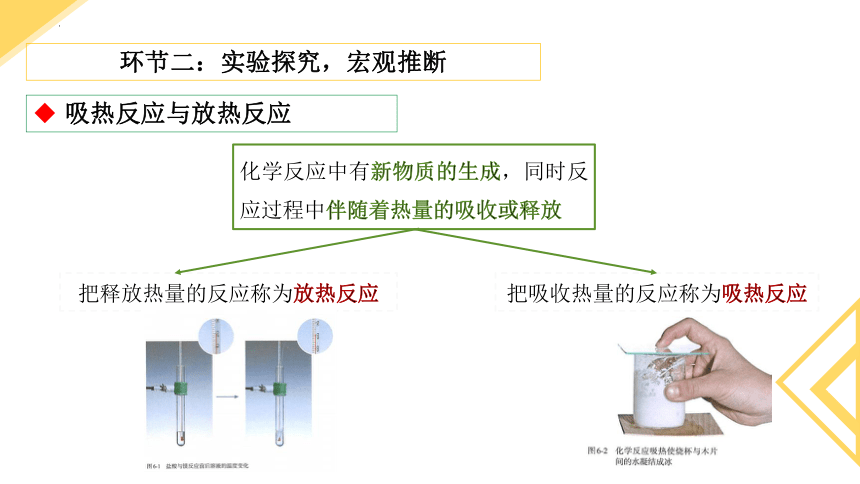
吸热反应与放热反应
化学反应中有新物质的生成,同时反应过程中伴随着热量的吸收或释放
把释放热量的反应称为放热反应
把吸收热量的反应称为吸热反应
环节三:自主阅读,归纳小结
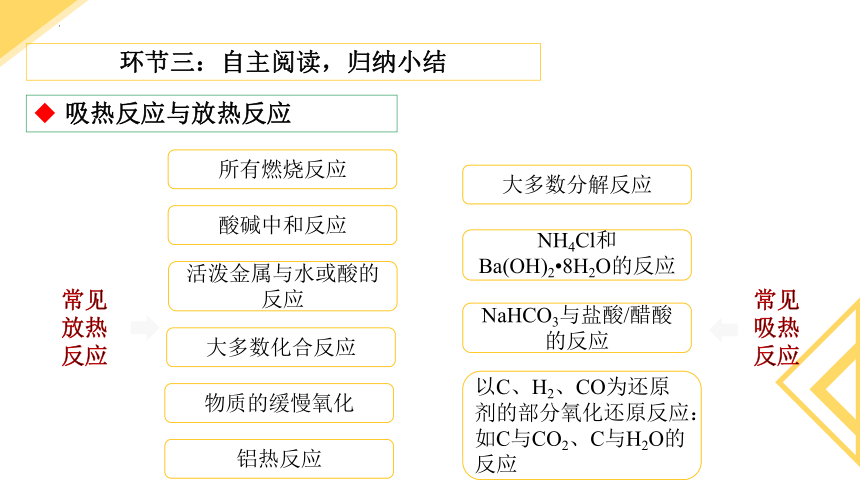
吸热反应与放热反应
常见放热反应
所有燃烧反应
酸碱中和反应
活泼金属与水或酸的反应
大多数化合反应
物质的缓慢氧化
铝热反应
大多数分解反应
NH4Cl和Ba(OH)2 8H2O的反应
以C、H2、CO为还原剂的部分氧化还原反应:如C与CO2、C与H2O的反应
NaHCO3与盐酸/醋酸的反应
常见吸热反应
环节三:自主阅读,归纳小结
注意:吸热反应、放热反应是指反应过程中吸收还是放出热量,与反应是否需要加热等条件没有直接联系。
如:大多数燃烧反应都需要加热,但燃烧反应都是放热反应;
NH4Cl和Ba(OH)2 8H2O的反应 在常温下就可反生,但它是吸热反应。
吸热反应一定需要加热,放热反应一定不需要加热,这种说法正确吗?
吸热反应与放热反应
环节四:理解本质,建构模型
化学反应与热量变化的本质探究
化学反应为什么会伴随着热量的变化?热量来自于哪里?
为什么有的化学反应放出热量?有的化学反应吸收热量?
化学反应的特征
化学反应的实质
有新物质的生成
旧键断裂,新键形成
吸收能量
释放能量
环节四:理解本质,建构模型
请根据下列信息判断氢气和氯气化合生成氯化氢的反应是吸收能量还是放出能量?
旧化学键断裂需要吸收的能量:
436 + 243 = 679kJ
新化学键形成需要释放的能量:
2×431 = 862kJ
能量变化(放出热量):
862 - 679 = 183kJ
化学反应与热量变化的本质探究
环节四:理解本质,建构模型
化学反应与热量变化的本质探究
E1>E2,反应________能量;E1释放
吸收
吸收
释放
注:键能越大,化学键越 ,分子越 。
牢固
稳定
环节四:理解本质,建构模型
化学反应与热量变化的宏观表征
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
吸热反应
放热反应
释放能量
吸收能量
放热反应:反应物的总能量 > 生成物的总能量
吸热反应:反应物的总能量 < 生成物的总能量
环节四:理解本质,建构模型
生成物
反应物
的总能量
生成物
的总能量
能量
能量
生成物
反应物
图1
生成物
的总能量
反应物
反应物
的总能量
图2
吸收热量
放出热量
化学反应与热量变化的宏观表征
环节四:理解本质,建构模型
物质的能量和物质稳定性的关系
冰
水
水蒸气
温度不断升高,自身能量不断增大,稳定性越来越低
能量越低越稳定
环节五:能源利用,提升价值
能源的开发与应用
人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
环节五:能源利用,提升价值
能源的开发与应用
现阶段人类获取热能的主要途径
煤的燃烧
石油的燃烧
其他物质的燃烧
天然气的燃烧
主要形式
环节五:能源利用,提升价值
能源的开发与应用
化石燃料获取能量面临的问题
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
环节五:能源利用,提升价值
能源的开发与应用
能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
节能
环节五:能源利用,提升价值
能源的开发与应用
节能:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
能源可持续发展的措施
环节五:能源利用,提升价值
能源的开发与应用
寻找新能源:
(1)特点:资源丰富、可以再生,对环境无污染。
(2)人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等。
可再生能源:在自然界中可以不断再生并有规律地得到补充的能源。
非再生能源:经过亿万年的形成,短期内无法恢复的能源。
能源可持续发展的措施
环节六:归纳整理,巩固提升
归纳整理
1.宏观角度:反应物和生成物的总能量相对大小判断
Q(反应物)>Q(生成物)→放热反应;
Q(反应物)2.微观角度:化学键断裂和形成时能量变化大小判断
E(反应物断键吸收能量)< E(产物成键放出能量)→放热反应;
E(反应物断键吸收能量)> E(产物成键放出能量)→吸热反应。
判断吸热反应和放热反应的两种方法:
环节六:归纳整理,巩固提升
巩固提升
1.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①②
C.①②③④ D.②③④
A
巩固提升
环节六:归纳整理,巩固提升
2.“太阳能燃料”国际会议于2019年10月在我国武汉举行,旨在交流和探讨太阳能光催化分解水制氢、太阳能光催化二氧化碳转化为燃料等问题。下列说法错误的是( )
A.太阳能燃料属于一次能源
B.直接电催化CO2制取燃料时,燃料是阴极产物
C.光催化分解水产生的H2是理想的绿色能源
D.研发和利用太阳能燃料,有利于经济的可持续发展
A
巩固提升
环节六:归纳整理,巩固提升
3.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
B
巩固提升
环节六:归纳整理,巩固提升
4.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝与氧化铁粉末反应
D.氧化钙溶于水
A
谢谢观看!
单击此处添加副标题内容
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
环节一:生活设疑,引入新课
感知生活中的热量变化
环节一:生活设疑,引入新课
感知生活中的热量变化
CaO + H2O = Ca(OH)2
环节一:生活设疑,引入新课
感知生活中的热量变化
暖宝宝
Fe + O2 + H2O → Fe2O3·xH2O
环节一:生活设疑,引入新课
感知生活中的热量变化
化学能
热能
光能
电能
声能
各种物质本身都具有能量,物质的组成、结构、状态不同,所具有的能量也不同。储存在物质当中的能量称为化学能。
环节二:实验探究,宏观推断
实验探究化学反应中的热量变化
实验探究——盐酸与镁反应前后溶液温度的变化
Mg + 2HCl === MgCl2 + H2↑
实验操作
在试管中加入2 mL 2 mol/L 盐酸,再放入用砂纸打磨光亮的镁条,用温度计测量过程的温度变化
实验现象
镁条逐渐溶解,有气泡产生,温度计温度上升,用手触摸试管壁,有温热感
反应原理
实验结论
镁与盐酸反应放出热量
环节二:实验探究,宏观推断
实验探究——氢氧化钡晶体与氯化铵晶体的反应
实验操作
将20g Ba(OH)2 8H2O晶体研细后与10g NH4Cl在烧杯中混合,放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯
实验现象
有刺激性气味气体产生;木片上的水结成冰,与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉
反应原理
实验结论
氢氧化钡晶体与氯化铵晶体反应吸收热量
Ba(OH)2·8H2O + 2NH4Cl === BaCl2 + 2NH3↑+ 10H2O
实验探究化学反应中的热量变化
环节二:实验探究,宏观推断
吸热反应与放热反应
化学反应中有新物质的生成,同时反应过程中伴随着热量的吸收或释放
把释放热量的反应称为放热反应
把吸收热量的反应称为吸热反应
环节三:自主阅读,归纳小结
吸热反应与放热反应
常见放热反应
所有燃烧反应
酸碱中和反应
活泼金属与水或酸的反应
大多数化合反应
物质的缓慢氧化
铝热反应
大多数分解反应
NH4Cl和Ba(OH)2 8H2O的反应
以C、H2、CO为还原剂的部分氧化还原反应:如C与CO2、C与H2O的反应
NaHCO3与盐酸/醋酸的反应
常见吸热反应
环节三:自主阅读,归纳小结
注意:吸热反应、放热反应是指反应过程中吸收还是放出热量,与反应是否需要加热等条件没有直接联系。
如:大多数燃烧反应都需要加热,但燃烧反应都是放热反应;
NH4Cl和Ba(OH)2 8H2O的反应 在常温下就可反生,但它是吸热反应。
吸热反应一定需要加热,放热反应一定不需要加热,这种说法正确吗?
吸热反应与放热反应
环节四:理解本质,建构模型
化学反应与热量变化的本质探究
化学反应为什么会伴随着热量的变化?热量来自于哪里?
为什么有的化学反应放出热量?有的化学反应吸收热量?
化学反应的特征
化学反应的实质
有新物质的生成
旧键断裂,新键形成
吸收能量
释放能量
环节四:理解本质,建构模型
请根据下列信息判断氢气和氯气化合生成氯化氢的反应是吸收能量还是放出能量?
旧化学键断裂需要吸收的能量:
436 + 243 = 679kJ
新化学键形成需要释放的能量:
2×431 = 862kJ
能量变化(放出热量):
862 - 679 = 183kJ
化学反应与热量变化的本质探究
环节四:理解本质,建构模型
化学反应与热量变化的本质探究
E1>E2,反应________能量;E1
吸收
吸收
释放
注:键能越大,化学键越 ,分子越 。
牢固
稳定
环节四:理解本质,建构模型
化学反应与热量变化的宏观表征
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
吸热反应
放热反应
释放能量
吸收能量
放热反应:反应物的总能量 > 生成物的总能量
吸热反应:反应物的总能量 < 生成物的总能量
环节四:理解本质,建构模型
生成物
反应物
的总能量
生成物
的总能量
能量
能量
生成物
反应物
图1
生成物
的总能量
反应物
反应物
的总能量
图2
吸收热量
放出热量
化学反应与热量变化的宏观表征
环节四:理解本质,建构模型
物质的能量和物质稳定性的关系
冰
水
水蒸气
温度不断升高,自身能量不断增大,稳定性越来越低
能量越低越稳定
环节五:能源利用,提升价值
能源的开发与应用
人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
环节五:能源利用,提升价值
能源的开发与应用
现阶段人类获取热能的主要途径
煤的燃烧
石油的燃烧
其他物质的燃烧
天然气的燃烧
主要形式
环节五:能源利用,提升价值
能源的开发与应用
化石燃料获取能量面临的问题
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
环节五:能源利用,提升价值
能源的开发与应用
能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
节能
环节五:能源利用,提升价值
能源的开发与应用
节能:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
能源可持续发展的措施
环节五:能源利用,提升价值
能源的开发与应用
寻找新能源:
(1)特点:资源丰富、可以再生,对环境无污染。
(2)人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等。
可再生能源:在自然界中可以不断再生并有规律地得到补充的能源。
非再生能源:经过亿万年的形成,短期内无法恢复的能源。
能源可持续发展的措施
环节六:归纳整理,巩固提升
归纳整理
1.宏观角度:反应物和生成物的总能量相对大小判断
Q(反应物)>Q(生成物)→放热反应;
Q(反应物)
E(反应物断键吸收能量)< E(产物成键放出能量)→放热反应;
E(反应物断键吸收能量)> E(产物成键放出能量)→吸热反应。
判断吸热反应和放热反应的两种方法:
环节六:归纳整理,巩固提升
巩固提升
1.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①②
C.①②③④ D.②③④
A
巩固提升
环节六:归纳整理,巩固提升
2.“太阳能燃料”国际会议于2019年10月在我国武汉举行,旨在交流和探讨太阳能光催化分解水制氢、太阳能光催化二氧化碳转化为燃料等问题。下列说法错误的是( )
A.太阳能燃料属于一次能源
B.直接电催化CO2制取燃料时,燃料是阴极产物
C.光催化分解水产生的H2是理想的绿色能源
D.研发和利用太阳能燃料,有利于经济的可持续发展
A
巩固提升
环节六:归纳整理,巩固提升
3.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
B
巩固提升
环节六:归纳整理,巩固提升
4.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝与氧化铁粉末反应
D.氧化钙溶于水
A
谢谢观看!
单击此处添加副标题内容
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
