10.2第2课时酸碱中和反应的实质说课-课件(共32张PPT内嵌视频)九年级化学人教版下册
文档属性
| 名称 | 10.2第2课时酸碱中和反应的实质说课-课件(共32张PPT内嵌视频)九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 329.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 22:04:57 | ||
图片预览










文档简介
酸碱中和反应的实质
教师:
学校:
01. 教材和实验背景分析 04. 实验教学目标
02. 实验改进要点 05. 教学过程
03. 实验原理 06. 实验教学效果评价
目录 | CONTENTS
一、教材和实验背景分析
人教版化学教材九年级下册
第十单元“酸和碱”
课题2“酸和碱的中和反应”
第二课时“酸碱中和反应的实质”
1.使用教材
一、教材和实验背景分析
2.课标分析[1]
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}主题
大概念
核心知识
基本思路与方法
重要态度
必做实验及实践活动
(一)科学探究与化学实验
体会实验探究和模型建构是化学科学探究的基本方法;勇于质疑、批判和创新的精神。
初步学会在教师指导下根据实验需要选择实验试剂和仪器,并能安全操作;学会使用酸碱指示剂检验溶液的酸碱性;初步学会观察实验现象并如实记录、处理实验数据等技能。
学习控制变量和对比实验的实验设计方法。
初步学会批判性思维方法,具有敢于提出并坚持自己的见解、勇于修正或放弃错误观点的科学精神。
常见酸碱的化学性质
(二)物质的性质与应用
知道物质具有独特的物理性质和化学性质,同类物质在性质上具有一定的相似性。
通过实验探究认识酸、碱的主要性质;了解检验溶液酸碱性的基本方法。
了解观察、实验,以及对事实进行归纳概括、分析解释等认识物质性质的基本方法。
结合实例体会化学品的保存、选择和使用与物质性质的重要关系。
一、教材和实验背景分析
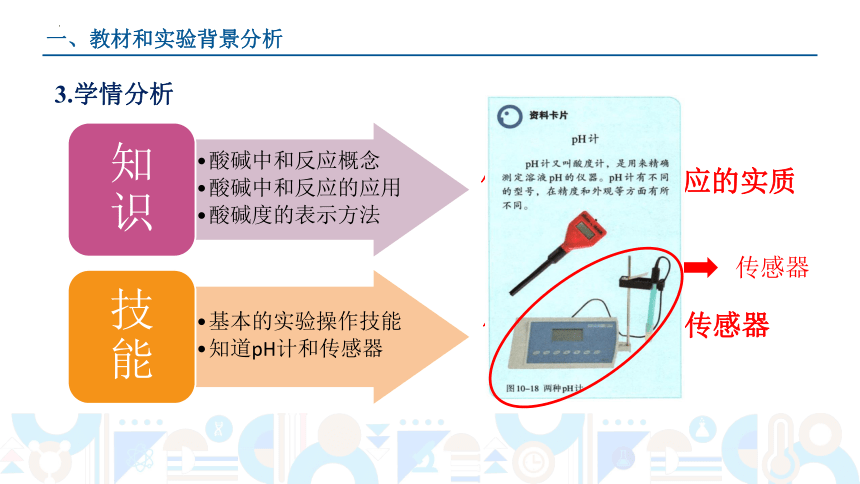
3.学情分析
酸碱中和反应概念
酸碱中和反应的应用
酸碱度的表示方法
知识
基本的实验操作技能
知道pH计和传感器
技能
但不理解中和反应的实质
但不会使用相关传感器
传感器
一、教材和实验背景分析
4.实验背景分析
优点:实验简单、现象明显
缺点:角度单一、宏观现象无法反应微观实质
优点:比较直观看出微观实质
缺点:接受式学习,没有体验得出结论的过程
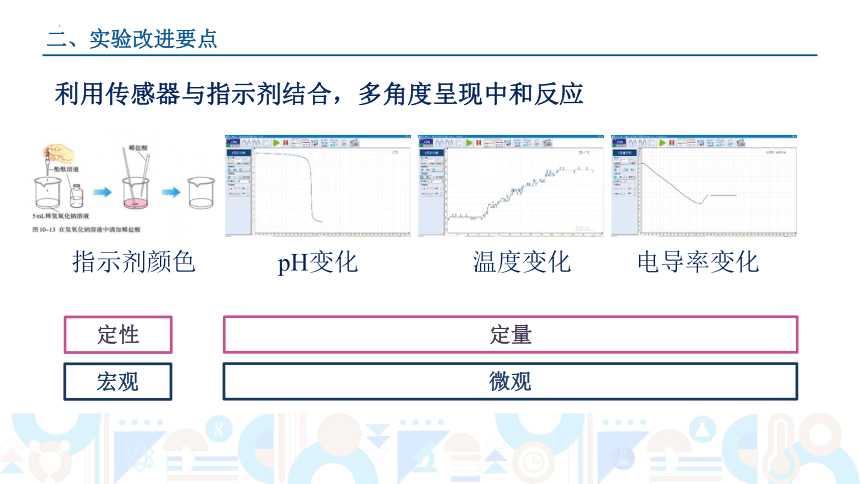
二、实验改进要点
利用传感器与指示剂结合,多角度呈现中和反应
指示剂颜色 pH变化 温度变化 电导率变化
定性
定量
宏观
微观
三、实验原理
酸碱性变化
NaOH + HCl = NaCl + H2O
pH变化
温度变化
导电性变化
酸碱指示剂
颜色改变
pH传感器
pH曲线
温度传感器
温度曲线
电导率传感器
电导率曲线
四、实验教学目标
1.通过酸碱指示剂的变色与数字化实验,体会化学学习中定性与定量结合的研究方法,以及对比实验在研究中的重要作用,并在实验中养成严谨求实的科学态度;
2.通过数字化实验获得证据,会分析酸碱中和反应的实质,初步形成认识复分解反应的微观视角,建立“宏—微—符”的三重表征;
3.通过收集中和反应中pH、温度、电导率等变化的实证,体验化学实验数据处理和分析的一般过程;
4.通过定性与定量、宏观与微观的角度对中和反应的研究,初步形成研究无明显现象反应的思维模型。
五、教学过程
(一)复习引入
每粒含氢氧化铝140毫克
用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸,也可用于慢性胃炎
五、教学过程
(一)复习引入
提出问题:酸碱中和反应是否都有现象?
氢氧化铝悬浊液
滴入稀盐酸
溶液变澄清
五、教学过程
(一)复习引入
提出问题:如何验证氢氧化钠溶液与稀盐酸发生反应?
氢氧化钠溶液
滴入稀盐酸
溶液无明显变化
五、教学过程
(二)环节1——设计实验
指示剂
pH
温度
电导率
资料
电导率[2]:是用来衡量物质中带电电荷移动强弱参数。电导率越大,则导电能力越强。
五、教学过程
(三)环节2——学生分组实验
五、教学过程
(四)环节3——实验结果分析
1.指示剂:
溶液碱性减弱直至变为中性,再变为酸性
结论:碱性减弱,氢氧化钠被消耗,说明氢氧化钠与稀盐酸发生了反应
稀氢氧化钠溶液呈碱性
五、教学过程
(四)环节3——实验结果分析
2.pH:
五、教学过程
(四)环节3——实验结果分析
7
A
恰好完全反应
溶质:只有NaCl
B
氢氧化钠过量
溶质:NaCl和NaOH
C
稀盐酸过量
溶质:NaCl和HCl
结论:氢氧化钠被消耗,说明氢氧化钠与稀盐酸发生了反应
pH变化曲线
2.pH:
五、教学过程
3.电导率:
电导率变化曲线
A
恰好完全反应
离子: Na+、Cl-
B
氢氧化钠过量
离子:Na+、Cl-和OH-
C
稀盐酸过量
离子: Na+、Cl-和H+
提问:这条变化曲线是否可以说明该反应的发生?
资料
电导率:传导电流的能力。当溶液中,可移动的自由离子浓度越大,该溶液的电导率越强。
(四)环节3——实验结果分析
五、教学过程
(四)环节3——实验结果分析
3.电导率:
方案一:向一定浓度、一定体积的稀盐酸中滴入等浓度等体积的氯化钠溶液,测量电导率
补充实验:
方案二:向一定浓度、一定体积的氢氧化钠溶液中滴入等浓度等体积的氯化钠溶液,测量电导率
资料
电导率:传导电流的能力。当溶液中,可移动的自由离子浓度越大,该溶液的电导率越强。
离子:Na+、Cl-、H+(或OH-)
对照实验与控制变量
五、教学过程
(四)环节3——实验结果分析
3.电导率:
补充实验:
盐酸+氯化钠溶液
五、教学过程
(四)环节3——实验结果分析
盐酸+氯化钠溶液
盐酸+氢氧化钠溶液
结论:氢氧根离子减少,说明氢氧化钠与稀盐酸发生了反应。
中和反应的实质:H++ OH-=H2O
五、教学过程
(四)环节3——实验结果分析
4.温度:
温度变化曲线
A
温度达到最高
恰好完全反应
反应放热
提问:热量来源于哪些微粒的结合?
五、教学过程
(四)环节3——实验结果分析
3.温度:
猜想1:热量来源于氢离子和氢氧根离子的结合
猜想2:热量来源于氯离子和钠离子的结合
对照实验控制变量
追问:热量来源于哪些微粒的结合?
NaOH + HCl = NaCl + H2O
方案1:向一定浓度、一定体积的硫酸钠溶液中滴入等浓度、等体积的氯化钙溶液,测量温度
方案2:向一定浓度、一定体积的硝酸钠溶液中滴入等浓度、等体积的氯化钾溶液,测量温度
五、教学过程
(四)环节3——实验结果分析
3.温度:
硫酸钠溶液+氯化钙溶液
硝酸钠溶液+氯化钾溶液
热量不是来源于氯离子和钠离子的结合
五、教学过程
(四)环节3——实验结果分析
3.温度:
结论:中和反应为放热反应,且热量来源于氢离子与氢氧根离子的结合,进而证明氢氧化钠与盐酸发生了反应
硝酸钠溶液+氯化钾溶液
盐酸+氢氧化钠溶液
硫酸钠溶液+氯化钙溶液
五、教学过程
(五)环节4——总结与拓展
1.中和反应
实质:H++OH-=H2O
放热反应
五、教学过程
(五)环节4——总结与拓展
2.研究无明显现象反应的一般方法
验证反应物的减少
验证生成物的增加
五、教学过程
(五)环节4——总结与拓展
3.课后拓展
设计实验验证氢氧化钠溶液与二氧化碳是否发生反应。
验证Na2CO3增加
六、实验教学效果评价
(一)利用指示剂与传感器,将无明显现象可视化
教材实验:指示剂
pH传感器
温度传感器
电导率传感器
指示剂颜色变化
pH变化曲线
温度变化曲线
电导率变化曲线
宏观现象
定性
宏观现象
定性
(二)利用微观知识解释宏观现象,建立“宏-微-符”的三重表征
六、实验教学效果评价
符
宏
H++ OH-=H2O
微
指示剂变色
离子变化
中和反应的实质
(三)通过验证无明显现象的中和反应的发生,建立研究无明显现象反应的思维模型
六、实验教学效果评价
验证NaOH与HCl发生了反应
验证NaOH与CO2发生了反应
课堂实验
课后思考
验证无明显现象反应思维模型
反应物的减少
生成物的增多
谢谢观看!
教师:
学校:
01. 教材和实验背景分析 04. 实验教学目标
02. 实验改进要点 05. 教学过程
03. 实验原理 06. 实验教学效果评价
目录 | CONTENTS
一、教材和实验背景分析
人教版化学教材九年级下册
第十单元“酸和碱”
课题2“酸和碱的中和反应”
第二课时“酸碱中和反应的实质”
1.使用教材
一、教材和实验背景分析
2.课标分析[1]
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}主题
大概念
核心知识
基本思路与方法
重要态度
必做实验及实践活动
(一)科学探究与化学实验
体会实验探究和模型建构是化学科学探究的基本方法;勇于质疑、批判和创新的精神。
初步学会在教师指导下根据实验需要选择实验试剂和仪器,并能安全操作;学会使用酸碱指示剂检验溶液的酸碱性;初步学会观察实验现象并如实记录、处理实验数据等技能。
学习控制变量和对比实验的实验设计方法。
初步学会批判性思维方法,具有敢于提出并坚持自己的见解、勇于修正或放弃错误观点的科学精神。
常见酸碱的化学性质
(二)物质的性质与应用
知道物质具有独特的物理性质和化学性质,同类物质在性质上具有一定的相似性。
通过实验探究认识酸、碱的主要性质;了解检验溶液酸碱性的基本方法。
了解观察、实验,以及对事实进行归纳概括、分析解释等认识物质性质的基本方法。
结合实例体会化学品的保存、选择和使用与物质性质的重要关系。
一、教材和实验背景分析
3.学情分析
酸碱中和反应概念
酸碱中和反应的应用
酸碱度的表示方法
知识
基本的实验操作技能
知道pH计和传感器
技能
但不理解中和反应的实质
但不会使用相关传感器
传感器
一、教材和实验背景分析
4.实验背景分析
优点:实验简单、现象明显
缺点:角度单一、宏观现象无法反应微观实质
优点:比较直观看出微观实质
缺点:接受式学习,没有体验得出结论的过程
二、实验改进要点
利用传感器与指示剂结合,多角度呈现中和反应
指示剂颜色 pH变化 温度变化 电导率变化
定性
定量
宏观
微观
三、实验原理
酸碱性变化
NaOH + HCl = NaCl + H2O
pH变化
温度变化
导电性变化
酸碱指示剂
颜色改变
pH传感器
pH曲线
温度传感器
温度曲线
电导率传感器
电导率曲线
四、实验教学目标
1.通过酸碱指示剂的变色与数字化实验,体会化学学习中定性与定量结合的研究方法,以及对比实验在研究中的重要作用,并在实验中养成严谨求实的科学态度;
2.通过数字化实验获得证据,会分析酸碱中和反应的实质,初步形成认识复分解反应的微观视角,建立“宏—微—符”的三重表征;
3.通过收集中和反应中pH、温度、电导率等变化的实证,体验化学实验数据处理和分析的一般过程;
4.通过定性与定量、宏观与微观的角度对中和反应的研究,初步形成研究无明显现象反应的思维模型。
五、教学过程
(一)复习引入
每粒含氢氧化铝140毫克
用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸,也可用于慢性胃炎
五、教学过程
(一)复习引入
提出问题:酸碱中和反应是否都有现象?
氢氧化铝悬浊液
滴入稀盐酸
溶液变澄清
五、教学过程
(一)复习引入
提出问题:如何验证氢氧化钠溶液与稀盐酸发生反应?
氢氧化钠溶液
滴入稀盐酸
溶液无明显变化
五、教学过程
(二)环节1——设计实验
指示剂
pH
温度
电导率
资料
电导率[2]:是用来衡量物质中带电电荷移动强弱参数。电导率越大,则导电能力越强。
五、教学过程
(三)环节2——学生分组实验
五、教学过程
(四)环节3——实验结果分析
1.指示剂:
溶液碱性减弱直至变为中性,再变为酸性
结论:碱性减弱,氢氧化钠被消耗,说明氢氧化钠与稀盐酸发生了反应
稀氢氧化钠溶液呈碱性
五、教学过程
(四)环节3——实验结果分析
2.pH:
五、教学过程
(四)环节3——实验结果分析
7
A
恰好完全反应
溶质:只有NaCl
B
氢氧化钠过量
溶质:NaCl和NaOH
C
稀盐酸过量
溶质:NaCl和HCl
结论:氢氧化钠被消耗,说明氢氧化钠与稀盐酸发生了反应
pH变化曲线
2.pH:
五、教学过程
3.电导率:
电导率变化曲线
A
恰好完全反应
离子: Na+、Cl-
B
氢氧化钠过量
离子:Na+、Cl-和OH-
C
稀盐酸过量
离子: Na+、Cl-和H+
提问:这条变化曲线是否可以说明该反应的发生?
资料
电导率:传导电流的能力。当溶液中,可移动的自由离子浓度越大,该溶液的电导率越强。
(四)环节3——实验结果分析
五、教学过程
(四)环节3——实验结果分析
3.电导率:
方案一:向一定浓度、一定体积的稀盐酸中滴入等浓度等体积的氯化钠溶液,测量电导率
补充实验:
方案二:向一定浓度、一定体积的氢氧化钠溶液中滴入等浓度等体积的氯化钠溶液,测量电导率
资料
电导率:传导电流的能力。当溶液中,可移动的自由离子浓度越大,该溶液的电导率越强。
离子:Na+、Cl-、H+(或OH-)
对照实验与控制变量
五、教学过程
(四)环节3——实验结果分析
3.电导率:
补充实验:
盐酸+氯化钠溶液
五、教学过程
(四)环节3——实验结果分析
盐酸+氯化钠溶液
盐酸+氢氧化钠溶液
结论:氢氧根离子减少,说明氢氧化钠与稀盐酸发生了反应。
中和反应的实质:H++ OH-=H2O
五、教学过程
(四)环节3——实验结果分析
4.温度:
温度变化曲线
A
温度达到最高
恰好完全反应
反应放热
提问:热量来源于哪些微粒的结合?
五、教学过程
(四)环节3——实验结果分析
3.温度:
猜想1:热量来源于氢离子和氢氧根离子的结合
猜想2:热量来源于氯离子和钠离子的结合
对照实验控制变量
追问:热量来源于哪些微粒的结合?
NaOH + HCl = NaCl + H2O
方案1:向一定浓度、一定体积的硫酸钠溶液中滴入等浓度、等体积的氯化钙溶液,测量温度
方案2:向一定浓度、一定体积的硝酸钠溶液中滴入等浓度、等体积的氯化钾溶液,测量温度
五、教学过程
(四)环节3——实验结果分析
3.温度:
硫酸钠溶液+氯化钙溶液
硝酸钠溶液+氯化钾溶液
热量不是来源于氯离子和钠离子的结合
五、教学过程
(四)环节3——实验结果分析
3.温度:
结论:中和反应为放热反应,且热量来源于氢离子与氢氧根离子的结合,进而证明氢氧化钠与盐酸发生了反应
硝酸钠溶液+氯化钾溶液
盐酸+氢氧化钠溶液
硫酸钠溶液+氯化钙溶液
五、教学过程
(五)环节4——总结与拓展
1.中和反应
实质:H++OH-=H2O
放热反应
五、教学过程
(五)环节4——总结与拓展
2.研究无明显现象反应的一般方法
验证反应物的减少
验证生成物的增加
五、教学过程
(五)环节4——总结与拓展
3.课后拓展
设计实验验证氢氧化钠溶液与二氧化碳是否发生反应。
验证Na2CO3增加
六、实验教学效果评价
(一)利用指示剂与传感器,将无明显现象可视化
教材实验:指示剂
pH传感器
温度传感器
电导率传感器
指示剂颜色变化
pH变化曲线
温度变化曲线
电导率变化曲线
宏观现象
定性
宏观现象
定性
(二)利用微观知识解释宏观现象,建立“宏-微-符”的三重表征
六、实验教学效果评价
符
宏
H++ OH-=H2O
微
指示剂变色
离子变化
中和反应的实质
(三)通过验证无明显现象的中和反应的发生,建立研究无明显现象反应的思维模型
六、实验教学效果评价
验证NaOH与HCl发生了反应
验证NaOH与CO2发生了反应
课堂实验
课后思考
验证无明显现象反应思维模型
反应物的减少
生成物的增多
谢谢观看!
同课章节目录
