化学人教版(2019)必修第一册2.3.1物质的量(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1物质的量(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-21 23:00:58 | ||
图片预览






文档简介
(共35张PPT)
500g水里有多少个水分子呢?
思考
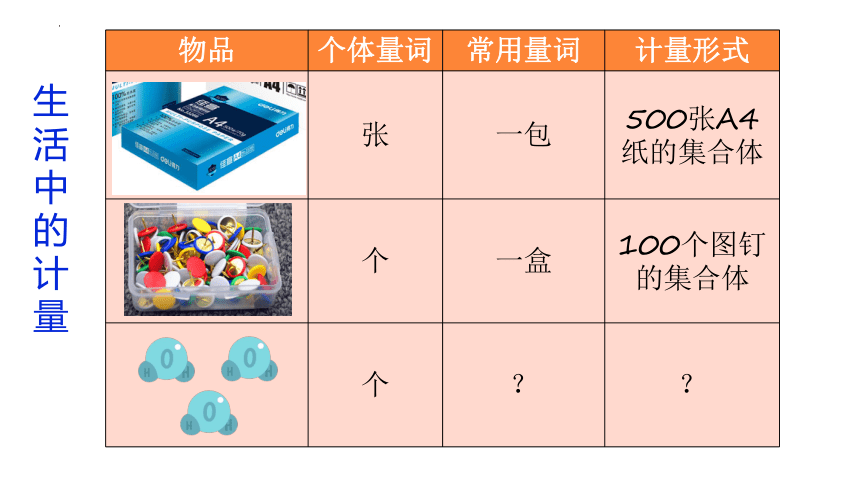
物品 个体量词 常用量词 计量形式
张 一包 500张A4纸的集合体
个 一盒 100个图钉的集合体
个 ? ?
生活中的计量
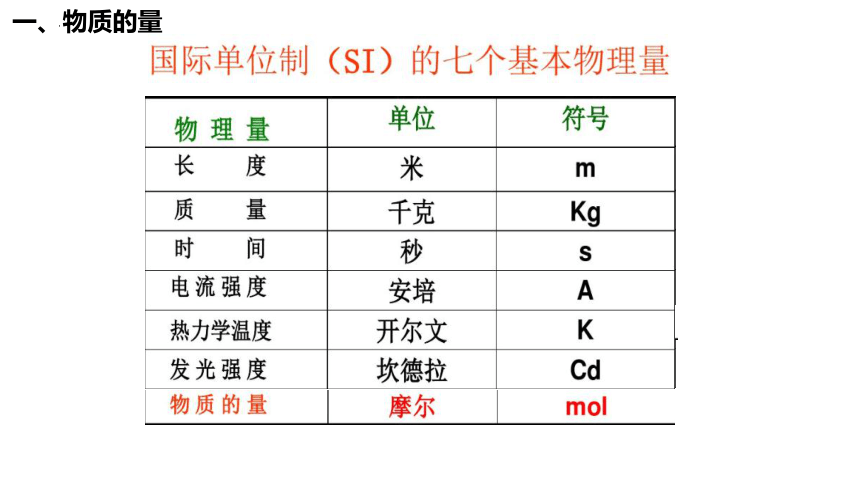
一、物质的量
【概念辨析】
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1mol任何物质含有分子数约为6.02×1023个。
1、判断下列说法是否正确。
2、下列说法正确的是____________
①1mol大米 ②1mol氢 ③1molH ④1molH2 ⑤1mol氢元素
③④
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
二、阿伏加德罗常数
1mol任何粒子的粒子数
1、定义:
2、符号:
NA
NA≈6.02×1023mol-1
3、数值:
约为6.02×1023 mol-1
例如:1 mol CO2所含的分子数为6.02×1023
判断:1 mol CO2和H2的混合气体所含的分子数约为6.02×1023
?
正确,1 mol任何粒子集合体所含的粒子数约为6.02×1023,这里的粒子集合体可以是纯净物,也可以是混合物。
如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次
感受阿伏加德罗常数
※物质的量、阿伏伽德罗常数、微粒数之间有怎样的关系呢?
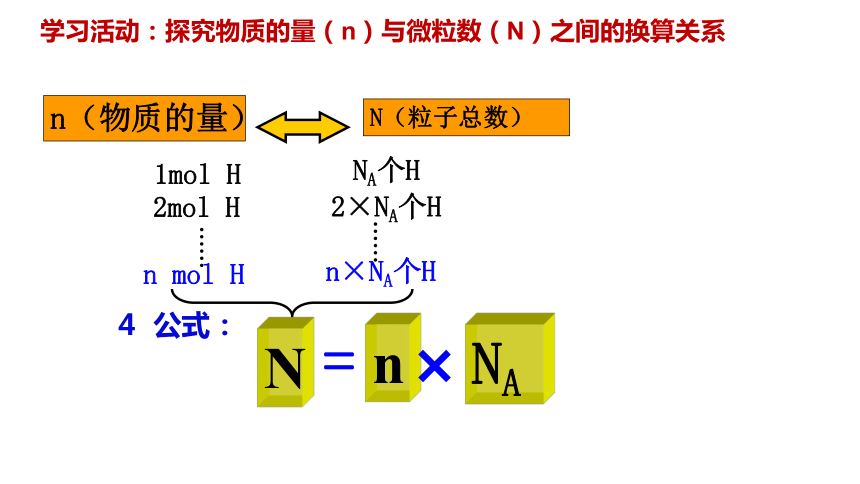
学习活动:探究物质的量(n)与微粒数(N)之间的换算关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
……
……
n mol H
n×NA个H
4 公式:
NA
n
N
=
×
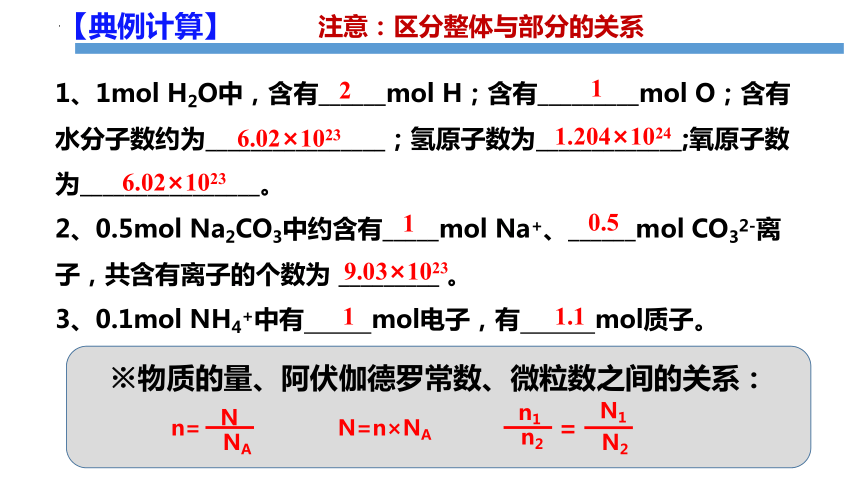
1、1mol H2O中,含有______mol H;含有_________mol O;含有水分子数约为________________;氢原子数为_____________;氧原子数为________________。
2、0.5mol Na2CO3中约含有_____mol Na+、______mol CO32-离子,共含有离子的个数为 _________ 。
3、0.1mol NH4+中有 mol电子,有 mol质子。
※物质的量、阿伏伽德罗常数、微粒数之间的关系:
n=
N
NA
N=n×NA
=
N1
N2
n1
n2
2
1
6.02×1023
1
0.5
9.03×1023
1
1.1
注意:区分整体与部分的关系
【典例计算】
6.02×1023
1.204×1024
例1.完成下列计算
⑴0.5mol氢分子含有 个氢分子
⑵1. 204×1023 个HCl分子的物质的量为 mol
0.5NA或3. 01 × 1023
0.2
0.1molH2O中与 molCO2所含的氧原子数目相同,
与 个CH4分子中所含氢原子数相同。
0.05
例2.下列物质中含分子数目由大到小顺序为
A.0.5molO2
B.6.02×1023个N2
C.6.02×1024个HCl
C B A
1mol
10mol
0.05NA或3. 01 × 1022
注意:区分整体与部分的关系及总结计算规律
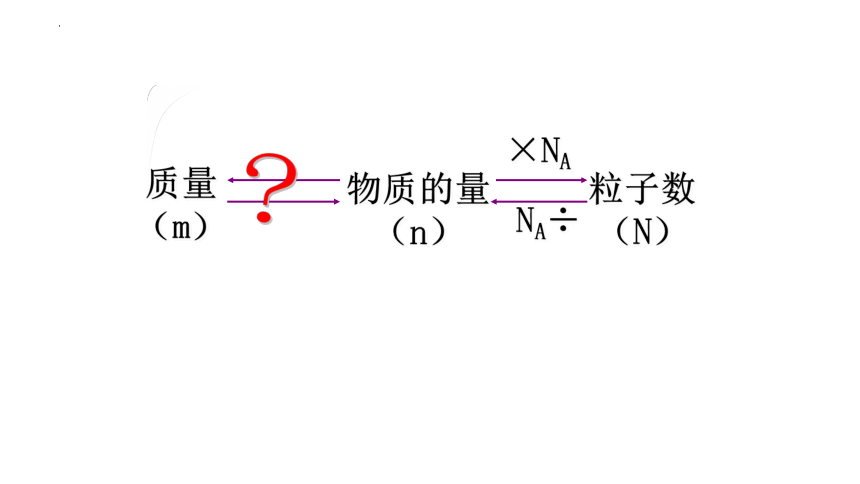
物质的量
(n)
质量(m)
粒子数
(N)
×NA
NA÷
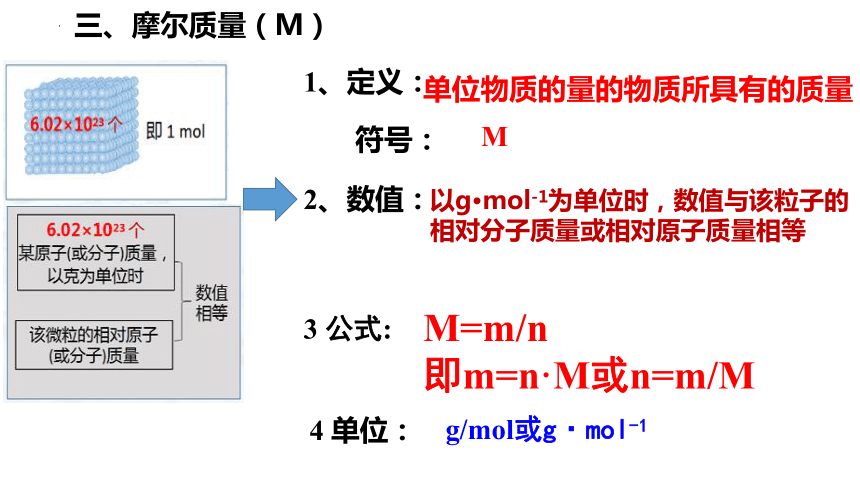
三、摩尔质量(M)
1、定义:
4 单位:
g/mol或g·mol-1
2、数值:
3 公式:
M=m/n
即m=n·M或n=m/M
以g·mol-1为单位时,数值与该粒子的
相对分子质量或相对原子质量相等
单位物质的量的物质所具有的质量
符号:
M
【概念辨析】
1、摩尔质量 = 相对原子(分子)质量=1 mol 物质的质量
?
2、钠的相对原子质量为:
钠的摩尔质量为:
1 mol 钠的质量为:
23
23 g/mol
23 g
注意:当摩尔质量、1 mol 物质的质量分别以g/mol、g为单位时,三者数值相等 。三者含义、单位不相同。
(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4)CO32-的摩尔质量是__________,2molCO32-的质量是_______。
【练一练】
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
500g H2O中有多少水分子?
【解】H2O的相对分子质量为18,摩尔质量为18g/mol。
n(H2O)=
m(H2O)
M(H2O)
500g
18g/mol
=
≈ 27.78mol
答:500g H2O中水分子数是1.67×1025。
n
m
N
M
NA
NA
M
N(H2O)=
n(H2O)×NA
27.78mol×6.02×1023mol-1
=
≈ 1.67×1025
物质的量在化学反应方程式中应用:
化学计量数(系数): 2 1 2
粒子数(个):
同时乘以NA(个) :
物质的量(n):
质量(m):
2个 1个 2个
2NA 1NA 2NA
2mol 1mol 2 mol
4g 32g 36g
结论:化学反应方程式中,各物质系数之比等于微粒个数比也等于物质的量之比
拓展应用
1.(2021吉林长春高一月考)下列叙述中错误的是 ( )
A.1 mol任何物质都含有6.02×1023个分子
B.16 g O2约含有6.02×1023个氧原子
C.4 mol水中含有8 mol H和4 mol O
D.1 mol Ne中含有6.02×1024个电子
A
2.设阿伏加德罗常数的值为NA,下列叙述错误的是 ( )
A.1 mol SO2中含有2 mol氧原子和1 mol硫原子
B.1 mol N2中约含有1.204×1024个氮气分子
C.0.1 mol H2O中含有的原子数目为0.3NA
D.3.01×1023个CO2分子中氧原子的物质的量约为1 mol
巩固练习
B
体积相同
粒子数相同
体积不同
体积不同
影响物质体积大小的因素
课本P52
结论:
(1)相同条件下(同温同压),1mol(粒子数相同)不同液体或固体体积不相同。
(2)相同条件下(同温同压),1mol(粒子数相同)不同气体体积相同。
?
问题1 为什么相同条件下,1mol不同固体和液体的
体积不同,而1mol不同气体的体积几乎相同?
与物质的体积那些因素有关?
(3)标准状况下(0℃,101KPa),1mol不同气体体积都约为22.4L。
粒子数目
粒子间的距离
粒子本身的大小
从微观角度探究影响物质体积大小的因素
四、影响物质体积的因素
影响物质体积的三个因素:
粒子数目
粒子之间间距
粒子的大小
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?
气体物质
固体液体粒子间的距离非常小
气体粒子间的距离(一般指平均距离)远大于粒子本身的直径
现在我们看看固体、液体、气体微粒间的排列方式。
固体物质
液体物质
四、影响物质体积的因素
影响物质体积的三个因素:
粒子数目
粒子之间距离
粒子本身大小
}
固体、液体体积
决定
}
决定
气体体积
结论:
(1)在相同条件下,1mol不同固态或液态物质的体积 ;
(2)在同温同压条件下,1mol任何气体的体积都 。
不相同
相同
1、定义:
五、气体摩尔体积
单位物质的量的气体所占的体积。
2、符号:
3、 公式:
5、 特殊值:
在标准状况下(0℃,101KPa) ,Vm ≈ 22.4 L/mol (非精确值)
4、单位:
6、影响因素:
温度和压强
Vm
L/mol (或L mol-1)和 m3/mol(或m3 mol-1)
V=n×Vm
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
判断正误,并说明理由
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
【概念辨析】
6. 在标准状况下,22.4L的四氯化碳约为1mol。
(错,四氯化碳不是气体)
(错)
7.常温常压下,22.4L氦气含有原子数为NA
8、若1 mol气体的体积约为22.4 L,则它一定处于标准状况下
9、1 mol SO2在20 ℃时的体积比22.4 L大。
10、只要不是标准状况,1 mol气体的体积就不是22.4 L。
11、标准状况下,1 mol H2与1 mol空气的体积不相等。
(错)
(错)
(错)
(错)
归纳总结气体摩尔体积使用注意问题
1.适用范围:气体(纯净/混合)
气体摩尔体积的注意事项:
2.标准状况下的气体摩尔体积
(1)1个条件:必须为标准状况。标况下气体摩尔体积一定约为 22.4L/mol ;气体摩尔体积为22.4L/mol 不一定是标况,因此在使用气体摩尔体积时,一定要看清气体所处的条件。
如:在25 ℃、101 kPa 时, Vm=约为24.5 L/mol
(2)1种状态:必须为气体。如水、酒精、CCl4 、 HF、SO3等物质在标准状况下不是气体。
(3)2个数据:“1 mol”“约22.4 L”。
3.使用气体体积时:必须指明温度和压强
1. 标准状况下,体积均为11.2 L的O2所含有的分子数目为多少
3.4g 氨(NH3) 在标准状况时体积是多少升
3、标准状况下,含有1 mol Cl2和1.5 mol O2的混合气体所占体积是多少L?
【练习】
应用:标准状况下气体摩尔体积的有关计算:
问题探究:
同温、同压下,体积相同的H2、O2、H2和O2的混合气体中所含分子数是否相同?
六、阿伏伽德罗定律及重要推论
阿伏伽德罗(Amedeo Avogadro、1776年-1856年),意大利化学家,生于都灵的显赫家族。全名Lorenzo Romano Amedeo Carlo Avogadro di Quaregua。
1811年发表了阿伏伽德罗假说,也就是今日的阿伏伽德罗定律,并提出分子概念及原子、分子区别等重要化学问题。
六、阿伏伽德罗定律及重要推论
(1)概念:
在相同的温度和压强下,相同体积的任何气体都含有
相同数目的粒子(分子数)。
气体,可以是单一气体,也可以是混合气体
(2)适用范围:
(3)理想气体状态方程
1.阿伏加德罗定律
pV=nRT
P:气体压强
V:气体体积
n:物质的量
T:热力学温度
R:常数
8.314
三同定一同
推论1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
N1
=
N2
2.推论:
pV=nRT
推论2:同温同压下,气体密度之比 = 摩尔质量之比
pV=nRT
推论3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
2
1
2
1
n
n
P
P
=
N1
=
N2
2.推论:
pV=nRT
例1:同温同压下,A容器中充满O2,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是________。
(2)若两容器中所含气体原子总数相等,则A容器和B容器的容积之比是________。
(3)若两容器的容积之比为3:2,则O2和O3的物质的量之比为________,质量之比为_________,密度之比为__________。
1:1
3:2
3:2
1:1
2:3
例2:一密闭容器中有一可自由滑动的隔板(厚度不计)将容器分为两部分,当右边充入0.1mol C2H4,左边充入一定量SO2时,隔板处于如图位置(保持温度不变),下列说法正确的是
A. 右边与左边的分子数之比为4:1
B. 左侧SO2所含氧原子数为1.2NA
C. 左侧气体密度是相同条件下氢气密度的16倍
D. 若使左右两边体积相同,可在容器右边再充入8.4gN2
D
特例
取决于
体积
粒子大小
粒子数目
粒子距离
固体、液体体积
气体体积
气体摩尔体积
阿伏加德罗定律及推论
单位物质的量的气体所占体积
22.4L·mol-1(标况)
三同定一同
课堂小结
pV=nRT
500g水里有多少个水分子呢?
思考
物品 个体量词 常用量词 计量形式
张 一包 500张A4纸的集合体
个 一盒 100个图钉的集合体
个 ? ?
生活中的计量
一、物质的量
【概念辨析】
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1mol任何物质含有分子数约为6.02×1023个。
1、判断下列说法是否正确。
2、下列说法正确的是____________
①1mol大米 ②1mol氢 ③1molH ④1molH2 ⑤1mol氢元素
③④
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
二、阿伏加德罗常数
1mol任何粒子的粒子数
1、定义:
2、符号:
NA
NA≈6.02×1023mol-1
3、数值:
约为6.02×1023 mol-1
例如:1 mol CO2所含的分子数为6.02×1023
判断:1 mol CO2和H2的混合气体所含的分子数约为6.02×1023
?
正确,1 mol任何粒子集合体所含的粒子数约为6.02×1023,这里的粒子集合体可以是纯净物,也可以是混合物。
如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次
感受阿伏加德罗常数
※物质的量、阿伏伽德罗常数、微粒数之间有怎样的关系呢?
学习活动:探究物质的量(n)与微粒数(N)之间的换算关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
……
……
n mol H
n×NA个H
4 公式:
NA
n
N
=
×
1、1mol H2O中,含有______mol H;含有_________mol O;含有水分子数约为________________;氢原子数为_____________;氧原子数为________________。
2、0.5mol Na2CO3中约含有_____mol Na+、______mol CO32-离子,共含有离子的个数为 _________ 。
3、0.1mol NH4+中有 mol电子,有 mol质子。
※物质的量、阿伏伽德罗常数、微粒数之间的关系:
n=
N
NA
N=n×NA
=
N1
N2
n1
n2
2
1
6.02×1023
1
0.5
9.03×1023
1
1.1
注意:区分整体与部分的关系
【典例计算】
6.02×1023
1.204×1024
例1.完成下列计算
⑴0.5mol氢分子含有 个氢分子
⑵1. 204×1023 个HCl分子的物质的量为 mol
0.5NA或3. 01 × 1023
0.2
0.1molH2O中与 molCO2所含的氧原子数目相同,
与 个CH4分子中所含氢原子数相同。
0.05
例2.下列物质中含分子数目由大到小顺序为
A.0.5molO2
B.6.02×1023个N2
C.6.02×1024个HCl
C B A
1mol
10mol
0.05NA或3. 01 × 1022
注意:区分整体与部分的关系及总结计算规律
物质的量
(n)
质量(m)
粒子数
(N)
×NA
NA÷
三、摩尔质量(M)
1、定义:
4 单位:
g/mol或g·mol-1
2、数值:
3 公式:
M=m/n
即m=n·M或n=m/M
以g·mol-1为单位时,数值与该粒子的
相对分子质量或相对原子质量相等
单位物质的量的物质所具有的质量
符号:
M
【概念辨析】
1、摩尔质量 = 相对原子(分子)质量=1 mol 物质的质量
?
2、钠的相对原子质量为:
钠的摩尔质量为:
1 mol 钠的质量为:
23
23 g/mol
23 g
注意:当摩尔质量、1 mol 物质的质量分别以g/mol、g为单位时,三者数值相等 。三者含义、单位不相同。
(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4)CO32-的摩尔质量是__________,2molCO32-的质量是_______。
【练一练】
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
500g H2O中有多少水分子?
【解】H2O的相对分子质量为18,摩尔质量为18g/mol。
n(H2O)=
m(H2O)
M(H2O)
500g
18g/mol
=
≈ 27.78mol
答:500g H2O中水分子数是1.67×1025。
n
m
N
M
NA
NA
M
N(H2O)=
n(H2O)×NA
27.78mol×6.02×1023mol-1
=
≈ 1.67×1025
物质的量在化学反应方程式中应用:
化学计量数(系数): 2 1 2
粒子数(个):
同时乘以NA(个) :
物质的量(n):
质量(m):
2个 1个 2个
2NA 1NA 2NA
2mol 1mol 2 mol
4g 32g 36g
结论:化学反应方程式中,各物质系数之比等于微粒个数比也等于物质的量之比
拓展应用
1.(2021吉林长春高一月考)下列叙述中错误的是 ( )
A.1 mol任何物质都含有6.02×1023个分子
B.16 g O2约含有6.02×1023个氧原子
C.4 mol水中含有8 mol H和4 mol O
D.1 mol Ne中含有6.02×1024个电子
A
2.设阿伏加德罗常数的值为NA,下列叙述错误的是 ( )
A.1 mol SO2中含有2 mol氧原子和1 mol硫原子
B.1 mol N2中约含有1.204×1024个氮气分子
C.0.1 mol H2O中含有的原子数目为0.3NA
D.3.01×1023个CO2分子中氧原子的物质的量约为1 mol
巩固练习
B
体积相同
粒子数相同
体积不同
体积不同
影响物质体积大小的因素
课本P52
结论:
(1)相同条件下(同温同压),1mol(粒子数相同)不同液体或固体体积不相同。
(2)相同条件下(同温同压),1mol(粒子数相同)不同气体体积相同。
?
问题1 为什么相同条件下,1mol不同固体和液体的
体积不同,而1mol不同气体的体积几乎相同?
与物质的体积那些因素有关?
(3)标准状况下(0℃,101KPa),1mol不同气体体积都约为22.4L。
粒子数目
粒子间的距离
粒子本身的大小
从微观角度探究影响物质体积大小的因素
四、影响物质体积的因素
影响物质体积的三个因素:
粒子数目
粒子之间间距
粒子的大小
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?
气体物质
固体液体粒子间的距离非常小
气体粒子间的距离(一般指平均距离)远大于粒子本身的直径
现在我们看看固体、液体、气体微粒间的排列方式。
固体物质
液体物质
四、影响物质体积的因素
影响物质体积的三个因素:
粒子数目
粒子之间距离
粒子本身大小
}
固体、液体体积
决定
}
决定
气体体积
结论:
(1)在相同条件下,1mol不同固态或液态物质的体积 ;
(2)在同温同压条件下,1mol任何气体的体积都 。
不相同
相同
1、定义:
五、气体摩尔体积
单位物质的量的气体所占的体积。
2、符号:
3、 公式:
5、 特殊值:
在标准状况下(0℃,101KPa) ,Vm ≈ 22.4 L/mol (非精确值)
4、单位:
6、影响因素:
温度和压强
Vm
L/mol (或L mol-1)和 m3/mol(或m3 mol-1)
V=n×Vm
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
判断正误,并说明理由
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
【概念辨析】
6. 在标准状况下,22.4L的四氯化碳约为1mol。
(错,四氯化碳不是气体)
(错)
7.常温常压下,22.4L氦气含有原子数为NA
8、若1 mol气体的体积约为22.4 L,则它一定处于标准状况下
9、1 mol SO2在20 ℃时的体积比22.4 L大。
10、只要不是标准状况,1 mol气体的体积就不是22.4 L。
11、标准状况下,1 mol H2与1 mol空气的体积不相等。
(错)
(错)
(错)
(错)
归纳总结气体摩尔体积使用注意问题
1.适用范围:气体(纯净/混合)
气体摩尔体积的注意事项:
2.标准状况下的气体摩尔体积
(1)1个条件:必须为标准状况。标况下气体摩尔体积一定约为 22.4L/mol ;气体摩尔体积为22.4L/mol 不一定是标况,因此在使用气体摩尔体积时,一定要看清气体所处的条件。
如:在25 ℃、101 kPa 时, Vm=约为24.5 L/mol
(2)1种状态:必须为气体。如水、酒精、CCl4 、 HF、SO3等物质在标准状况下不是气体。
(3)2个数据:“1 mol”“约22.4 L”。
3.使用气体体积时:必须指明温度和压强
1. 标准状况下,体积均为11.2 L的O2所含有的分子数目为多少
3.4g 氨(NH3) 在标准状况时体积是多少升
3、标准状况下,含有1 mol Cl2和1.5 mol O2的混合气体所占体积是多少L?
【练习】
应用:标准状况下气体摩尔体积的有关计算:
问题探究:
同温、同压下,体积相同的H2、O2、H2和O2的混合气体中所含分子数是否相同?
六、阿伏伽德罗定律及重要推论
阿伏伽德罗(Amedeo Avogadro、1776年-1856年),意大利化学家,生于都灵的显赫家族。全名Lorenzo Romano Amedeo Carlo Avogadro di Quaregua。
1811年发表了阿伏伽德罗假说,也就是今日的阿伏伽德罗定律,并提出分子概念及原子、分子区别等重要化学问题。
六、阿伏伽德罗定律及重要推论
(1)概念:
在相同的温度和压强下,相同体积的任何气体都含有
相同数目的粒子(分子数)。
气体,可以是单一气体,也可以是混合气体
(2)适用范围:
(3)理想气体状态方程
1.阿伏加德罗定律
pV=nRT
P:气体压强
V:气体体积
n:物质的量
T:热力学温度
R:常数
8.314
三同定一同
推论1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
N1
=
N2
2.推论:
pV=nRT
推论2:同温同压下,气体密度之比 = 摩尔质量之比
pV=nRT
推论3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
2
1
2
1
n
n
P
P
=
N1
=
N2
2.推论:
pV=nRT
例1:同温同压下,A容器中充满O2,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是________。
(2)若两容器中所含气体原子总数相等,则A容器和B容器的容积之比是________。
(3)若两容器的容积之比为3:2,则O2和O3的物质的量之比为________,质量之比为_________,密度之比为__________。
1:1
3:2
3:2
1:1
2:3
例2:一密闭容器中有一可自由滑动的隔板(厚度不计)将容器分为两部分,当右边充入0.1mol C2H4,左边充入一定量SO2时,隔板处于如图位置(保持温度不变),下列说法正确的是
A. 右边与左边的分子数之比为4:1
B. 左侧SO2所含氧原子数为1.2NA
C. 左侧气体密度是相同条件下氢气密度的16倍
D. 若使左右两边体积相同,可在容器右边再充入8.4gN2
D
特例
取决于
体积
粒子大小
粒子数目
粒子距离
固体、液体体积
气体体积
气体摩尔体积
阿伏加德罗定律及推论
单位物质的量的气体所占体积
22.4L·mol-1(标况)
三同定一同
课堂小结
pV=nRT
