第二章分子结构与性质检测卷-2023-2024学年高中化学选择性必修2(含答案)
文档属性
| 名称 | 第二章分子结构与性质检测卷-2023-2024学年高中化学选择性必修2(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 995.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 13:10:30 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二章分子结构与性质检测卷-2023-2024学年高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为,反应的离子方程式为。设为阿伏加德罗常数的值,下列说法错误的是
A.消耗,反应转移的电子数为
B.消耗时,溶液中增加的数目为
C.标准状况下,中含键数目为
D.液态水中含有的氢键数目少于
2.与在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法错误的是
A.NO为极性分子
B.H2S的VSEPR模型为三角锥形
C.HSNO的结构式为
D.NO与H2S反应生成的两种单质为S、N2
3.下列化学用语或图示表达错误的是
A.的球棍模型为
B.的VSEPR模型为正四面体形
C.基态原子的价层电子轨道表示式为
D.顺-2-丁烯的分子结构模型:
4.能形成结构式如图所示的离子。所含的4种元素位于主族,在每个短周期均有分布,和同族,和同周期。的轨道有2个未成对电子,下列说法正确的是
A.元素电负性: B.原子半径:
C.最简单氢化物沸点: D.和中的杂化轨道类型相同
5.催化剂能催化脱除烟气中的,反应的化学方程式为。下列说法正确的是
A.的电子式为
B.的模型名称为直线形
C.的价层电子的轨道表示式为
D.是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
6.甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应:HCHO+O2H2O+CO2.下列有关叙述正确的是
A.HCHO分子中σ键和π键的数目之比为2:1
B.HCHO分子中存在分子间氢键
C.H2O是由极性键构成的非极性分子
D.CO2中碳原子的杂化方式为sp
7.下列关于晶体的说法正确的个数是
①2p、3p、4p能级的轨道数依次增加
②金刚石、NaF、NaCl、H2S、H2O晶体的熔点依次降低
③形成氢键的三个原子不一定在同一条直线上
④晶体中分子间作用力越大,分子越稳定
⑤HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
⑥同周期,与Sc元素未成对电子数相等的元素有3种
⑦基态Cr3+的最高能层中成对电子与未成对电子的数目比为8:3
⑧元素Ge位于周期表第四周期ⅣA族,核外电子排布式为[Ar]4s24p2,属于P区
A.2 B.3 C.4 D.5
8.二氯化二硫是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用浸润)中通入。已知:常温下遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
A.分子中所有原子均满足8电子结构
B.中S原子的杂化类型为杂化
C.与结构相似
D.与反应的化学方程式可能为:
9.利用和溴酸盐溶液制备高溴酸盐的反应为(未配平).下列说法正确的是
A.氧化剂为,还原产物为 B.若生成,则该反应中转移电子
C.中各原子均满足8电子稳定结构 D.中心原子的价层电子对数为2,杂化方式为
10.设为阿伏加德罗常数的值.下列说法错误的是
A.中含有的共用电子对数目为
B.的溶液中的数目为
C.标准状况下,1.12LSO3中含有电子的数目为
D.正丁烷和异丁烷的混合物中含有的极性键数目为
二、解答题
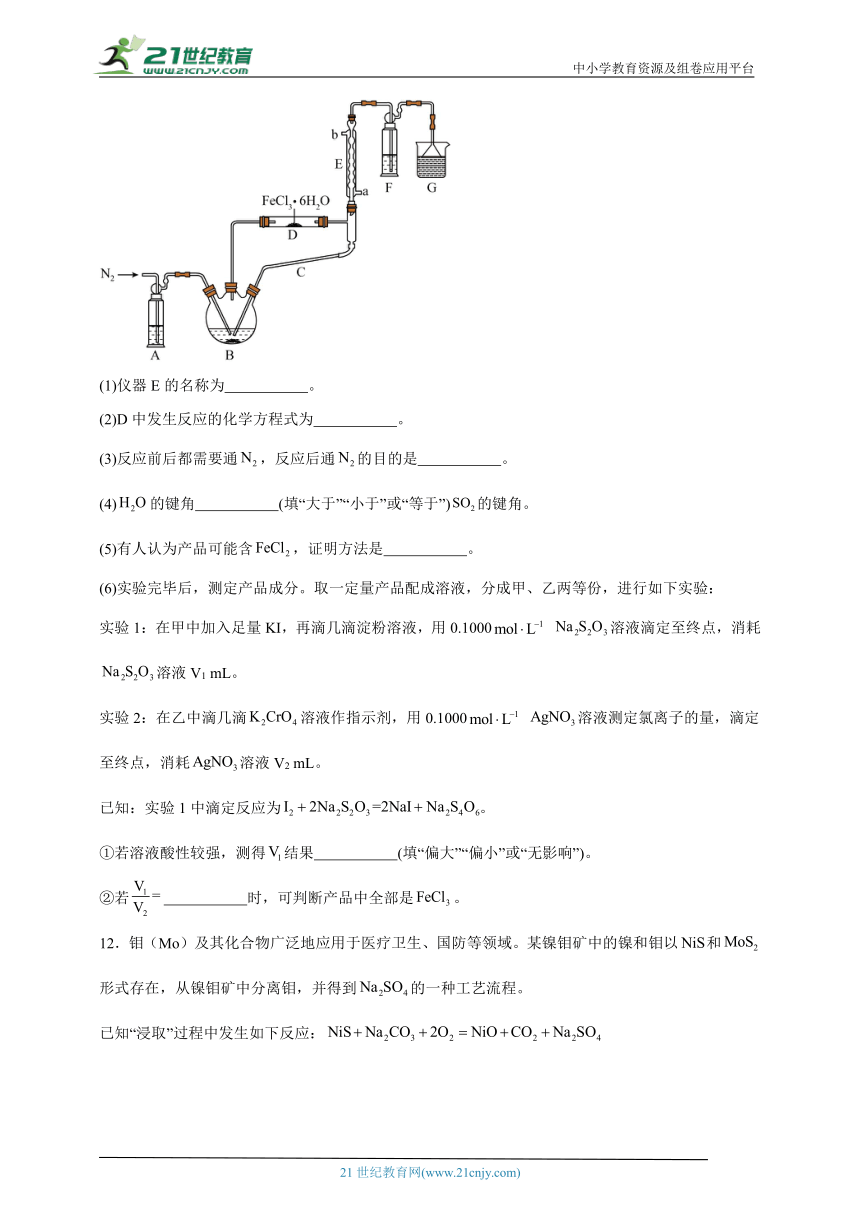
11.实验室用和亚硫酰氯()共热制备无水的装置如图所示(加热及夹持装置略)。已知:的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)仪器E的名称为 。
(2)D中发生反应的化学方程式为 。
(3)反应前后都需要通,反应后通的目的是 。
(4)的键角 (填“大于”“小于”或“等于”)的键角。
(5)有人认为产品可能含,证明方法是 。
(6)实验完毕后,测定产品成分。取一定量产品配成溶液,分成甲、乙两等份,进行如下实验:
实验1:在甲中加入足量KI,再滴几滴淀粉溶液,用0.1000 溶液滴定至终点,消耗溶液V1 mL。
实验2:在乙中滴几滴溶液作指示剂,用0.1000 溶液测定氯离子的量,滴定至终点,消耗溶液V2 mL。
已知:实验1中滴定反应为。
①若溶液酸性较强,测得结果 (填“偏大”“偏小”或“无影响”)。
②若 时,可判断产品中全部是。
12.钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以和形式存在,从镍钼矿中分离钼,并得到的一种工艺流程。
已知“浸取”过程中发生如下反应:
(1)位于元素周期表第 周期第 族。
(2)“焙烧”中生成的反应如下所示,请配平该化学方程式 。
上述反应中共价化合物的中心原子杂化方式是 杂化。
(3)下列说法正确的是________。(不定项)
A.电负性: B.离子半径:
C.第一电离能: D.基态的简化电子排布式
用量对钼浸出率和浸取液中浓度的影响如左下图所示,的溶解度曲线如右下图所示。
(4)分析实际生产中选择用量为理论用量1.2倍的原因是: 。
(5)为充分分离,工艺流程中的“操作”应为________。
A.蒸发结晶 B.低温结晶 C.蒸馏 D.萃取
(6)中存在的相互作用有________。
A.分子间作用力 B.金属键 C.共价键 D.离子键
(7)分解可得。高温下,用铝粉还原得到金属钼的化学方程式为: 。
13.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)表中元素,电负性最强的是 (填元素符号),J的元素名称为 。N基态原子核外能级上有 未成对电子。
(2)D元素原子的价电子排布图为 ,核外有 种不同运动状态的电子。该元素形成的常见单质分子中σ键和π键个数比为
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是 (填“极性”或“非极性”)分子。
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是 (填字母)。
a. b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
14.乙二胺双缩水杨醛合钴(Ⅱ)是一种简单的载氧体,对开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。乙二胺双缩水杨醛合钴(Ⅱ)的制备原理如下图所示:
已知:①乙二胺双缩水杨醛合钴(Ⅱ)由于制备条件不同可以得到两种不同的固体形态:一种是棕色的胶状物,在室温下易被氧化;另一种是暗红色晶体,在室温下稳定。
②水杨醛:微溶于水,易溶于乙醇;乙二胺;溶于水、乙醇、温度过高会引起爆炸。
制备过程如下:
I.按照图示安装仪器,在仪器A中加入80mL95%乙醇,再加入1.65mL含0.0157mol的水杨醛。
Ⅱ.在搅拌条件下,加入0.55mL含0.0078mol的乙二胺,反应4~5min,生成亮黄色的乙二胺双缩水杨醛片状晶体。
Ⅲ.溶解0.0078 mol Co(CH3COO)2于热水中。
……
请回答:
(1)乙二胺中H-N-C的夹角 乙二胺双缩水杨醛合钴(Ⅱ)中C-N-C的夹角(填“大于”“小于”或“等于”)。
(2)仪器A的名称为 。
(3)步骤Ⅲ后的操作如下:
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
D.向仪器A中通入N2,并调节氮气流速至稳定;
E.停止加热,用冷水冷却仪器A;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→ →G。
②向仪器A中通入N2的目的是 。
③步骤F中保持温度在70~80℃的原因是 。
④用乙醇洗涤晶体的目的是 。
(4)产品的产率为 (列出计算式即可)。
参考答案:
1.B
【详解】
A.Al转变为,化合价升高3,则消耗,反应转移的电子数为,A项正确;
B.在水溶液中会水解,消耗时,溶液中增加的数目应小于,B项错误;
C.1个分子中含有2个键,标准状况下,物质的量为,含键数目为,C项正确;
D.冰中含有氢键,液态水中的氢键数目少于冰,因此液态水中含有的氢键数目少于,D项正确;
故选B。
2.B
【详解】A.NO为仅含极性键的双原子分子,为极性分子,故A正确;
B.H2S中S的价层电子对数为4,VSEPR模型为四面体形,故B错误;
C.HSNO的结构式为,故C正确;
D.H2S易被氧化为S,而NO中仅N能被还原,则生成的两种单质为S、N2,故D正确;
故答案为:B。
3.B
【详解】
A.为V形,球棍模型为,A正确;
B.中心原子B原子上含有3个σ键,中心原子上的孤电子对数为0,故其VSEPR模型为平面三角形,B错误;
C.基态原子的3d轨道半充满较稳定,价层电子轨道表示式为,C正确;
D.顺-2-丁烯的两个甲基在碳碳双键的同一侧,分子结构模型:,D正确;
故选B。
4.D
【分析】W的3p轨道有2个未成对电子,即W为Si或S,图中W可形成6个键,即W为S,和同族,且Y可形成2个化学键,即Y为O,X和Y同周期,且X可形成4个键,即X为C,Z能形成1个化学键,且在每个短周期均有分布,因此Z在第一周期,Z为H。
【详解】A.同周期元素从左往右电负性逐渐增大,同族元素从上到下,电负性逐渐减小,即电负性:Y(O)>W(S)>Z(H),故A错误;
B.电子层数越大原子半径越大,电子层数相同时,核电荷数越大原子半径越小,即原子半径: W(S)>X(C)>Y(O)>Z(H),故B错误;
C.由于H2O可形成分子间氢键,导致其沸点较大,即最简单氢化物沸点: Y(O)>W(S)>X(C),故C错误;
D.(SO2)的价层电子对数为,即S为sp2杂化,(SO3)的价层电子对数为,即S为sp2杂化,故D正确;
故选D。
5.C
【详解】
A.的电子式为:,A错误;
B.的模型名称为四面体形,B错误;
C.的价层电子的轨道表示式为,C正确;
D.是极性分子,分子的空间结构为三角锥形,N原子处在三角锥形的锥顶,3个H原子位于锥底,D错误;
故选:C。
6.D
【详解】A.甲醛分子中单键为σ键,双键中含有1个σ键和1个π键,则分子中σ键和π键的数目之比为3:1,故A错误;
B.甲醛分子不能形成分子间氢键,故B错误;
C.水分子是由极性键构成的极性分子,故C错误;
D.二氧化碳分子中碳原子的价层电子对数为2、孤对电子对数为0,则碳原子的杂化方式为sp杂化,故D正确;
故选D。
7.A
【详解】①p能级电子云轮廓图形状均呈哑铃形且能级的轨道数均为3个,①错误;
②金刚石属于原子晶体,熔点最高,NaF、NaCl属于离子晶体,氟离子半径小于氯离子半径,故NaF的晶格能大于NaCl,则NaF的熔点更高,H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高,所以金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低,②错误;
③氢键结合的通式,可用X-H Y表示,式中X和Y代表F、O、N等电负性大而原子半径较小的非金属原子;X和Y可以是两种相同的元素,也可以是两种不同的元素,但不一定在一条直线上,如邻羟基苯甲醛中的氢键,③正确;
④共价键键能越大,分子越稳定,与分子间作用力大小无关,④错误;
⑤HF和属于分子晶体,分子晶体的相对分子质量越大,其沸点越高,但是分子间存在氢键,故HF晶体沸点高于,⑤错误;
⑥Sc原子位于第四周期,电子排布式为1s22s22p63s23p63d14s2,有1个未成对电子,则与Sc同周期且其基态原子的未成对电子数与基态Sc原子相同的元素有K、Cu、Ga、Br共4种,⑥错误;
⑦基态Cr3+的最高能层为M层,排布式为3s23p63d3,有8个成对电子,3个未成对单电子,所以基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3,⑦正确;
⑧元素Ge位于周期表第四周期IVA族,核外电子排布式为[Ar]3d104s24p2, 属于p区,故⑧错误;正确的有③⑦;
故选A。
8.B
【详解】A.S2Cl2分子中S原子连接2个共价键,Cl原子连接1个共价键,S2Cl2分子中所有原子均满足8电子结构,故A正确;
B.S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故B错误;
C.溴元素与氯元素位于同主族,所以S2Cl2与S2Br2的结构相似,故C正确;
D.常温下,遇水易水解,并产生能使品红褪色的气体为二氧化硫,在反应过程中硫元素由+1价一部分升高到+4价(生成SO2),S2Cl2中Cl元素化合价为 1价,不能再得电子,只能是一部分S元素化合价降低到0价(生成S),所以反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故D正确;
故选B。
9.B
【详解】
A.中Xe化合价降低,为氧化剂,溴元素化合价升高,被 氧化得到氧化产物,A错误;
B.溴元素化合价由+5变为+7,电子转移为,若生成(为0.2mol),则该反应中转移电子,B正确;
C.中Xe本来最外层有8个电子,又形成2个共价键,故不是8电子结构,C错误;
D.H2O分子中中心O原子价层电子对数为2+=4,杂化方式为,D错误;
故选B。
10.C
【详解】A.1个中含共用电子对数4对,故1molHCN中含有的共用电子对数目为4NA,故A正确;
B.的溶液中,c(H+)=0.01mol/L,H+的物质的量=0.01mol/L×1.0L=0.01mol,H+的数目为0.01NA,故B正确;
C.标况下三氧化硫为固体,其物质的量不能根据气体摩尔体积来计算,故C错误;
D.正丁烷和异丁烷混合物的物质的量为:,正丁烷和异丁烷均含有10个极性键,0.1mol混合物中共价键数目为1NA,故D正确;
故选:C。
11.(1)球形冷凝管
(2)
(3)反应后将滞留在装置内的氯化氢气体全部赶入装置G中,使其全部吸收;
(4)大于
(5)生成的二氧化硫气体具有还原性,可能将铁离子还原为亚铁离子
(6) 偏大 3
【分析】
B中盛放SOCl2液体,水浴加热B形成SOCl2蒸汽与D中的反应生成无水、SO2和HCl,气体通过冷凝管E冷凝回流未反应的亚硫酰氯(SOCl2),提高其转化率,最后注意尾气处理,以此解题。
【详解】(1)由图可知,仪器E的名称为球形冷凝管;
(2)根据遇水极易反应生成两种酸性气体知,装置D内发生的反应可以看成是先分解产生FeCl3和水蒸气,水蒸气再与发生反应生成SO2、HCl。反应的化学方程式为;
(3)反应后会有一些氯化氢气体残留在装置中,则反应后通N2的目的是反应后将滞留在装置内的氯化氢气体全部赶入装置G中,使其全部吸收;
(4)孤对电子能够排斥化学键,由于二氧化硫的孤对电子多,将二氧化硫的键角压缩,故水的键角大,H2O的键角大于SO2的键角,故答案为:大于;
(5)生成的二氧化硫气体具有还原性,可能将铁离子还原为亚铁离子,使得产品可能含;
(6)
①若溶液酸性较强,酸性条件下发生,导致Na2 S2O3酸性条件下分解,消耗偏多,测得V1结果偏大;
②铁离子和碘离子发生反应生成碘单质:,碘单质和Na2S2O3反应:,通过测定消耗的碘单质的量,求出I2的量,进而求出Fe3+的量,由反应可知,,所以n(Fe3+) =0.1000V1×10-3 mol,Cl-~Ag+所以n(Ag+)=0.1000V2×10-3 mol,结合化学式FeCl3,当若=3时,可判断产品中全部是FeCl3。
12.(1) 四 VIII
(2) 2MoS2+6Na2CO3+9O2=2Na2MoO4+6CO2+4Na2SO4 sp
(3)D
(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,若低于1.2倍,钼浸出率较低
(5)B
(6)CD
(7)
【分析】镍钼矿与碳酸钠、通空气焙烧后,加水浸取得到含NiO的浸渣,滤液中含Na2MoO4、Na2SO4等,加入MgSO4净化后,滤液进行操作X得到Na2SO4,溶液进行离子交换萃取得到交换溶液,最后萃取液经系列操作得(NH4)2MoO4。
【详解】(1)Ni元素在元素周期表中位于第四周期第Ⅷ族。
(2)反应MoS2+Na2CO3+O2→Na2MoO4+CO2+Na2SO4中Mo元素的化合价由+4价升至+6价、S元素的化合价由-2价升至+6价,1molMoS2参与反应失去18mol电子,1molO2得到4mol电子,根据得失电子守恒和原子守恒,配平后的方程式为2MoS2+6Na2CO3+9O2=2Na2MoO4+6CO2+4Na2SO4;该反应中的共价化合物为CO2,CO2中中心碳原子的价层电子对数为2+×(4-2×2)=2,C采取sp杂化。
(3)A.同周期从左到右主族元素的电负性逐渐增大,同主族从上到下电负性逐渐减小,元素的非金属性越强、电负性越大,则电负性:O>S>C,A项错误;
B.根据“层多径大、序大径小”,离子半径:Na+<O2-<S2-,B项错误;
C.同周期从左到右主族元素的第一电离能呈增大趋势,第ⅡA、ⅤA族大于相邻元素,同主族从上到下元素的第一电离能逐渐减小,则第一电离能:Na<O<N,C项错误;
D.基态Ni的简化电子排布式为[Ar]3d84s2,基态Ni2+的简化电子排布式为[Ar]3d8,D项正确;
答案选D。
(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,由图可知,若低于1.2倍,钼浸出率较低,故实际生产中选择碳酸钠用量为理论用量1.2倍。
(5)由Na2MoO4和Na2SO4的溶解度曲线可知,为充分分离Na2SO4,工艺流程中的“操作X”应为低温结晶,答案选B。
(6)(NH4)2MoO4中与之间为离子键,中N与H、中Mo与O之间为共价键,答案选CD。
(7)Al与MoO3发生铝热反应生成Al2O3和Mo,反应的化学方程式为2Al+MoO3Al2O3+Mo。
13.(1) F 硅 3
(2) 7 1∶2
(3)非极性
(4)d
【分析】根据元素周期表中元素的位置可知A~N分别为H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Co;
【详解】(1)非金属性越强电负性越大,则表中元素,电负性最强的是F,J为Si,元素名称为硅;N为Co,Co位于周期表中第4周期,第ⅤⅢ族,价电子排布式为3d74s2,基态Co原子核外能级上有3个未成对电子;
(2)D为N元素,N原子的价电子排布式为2s22p3,价电子排布图为;N原子核外有7个电子,每个电子的运动状态都不同,则核外有7种不同运动状态的电子。该元素形成的常见单质分子是N2,结构式为N≡N,三键由1个σ键和2个π键形成,σ键和π键个数比1:2;
(3)根据相似相溶原理,ME2L2能与CCl4、CS2等互溶,已知CS2是非极性分子,据此可判断ME2L2是非极性分子;
(4)饱和C原子采取sp3杂化,双键C原子和苯环C原子采取sp2杂化,三键C原子采取sp杂化,
a. 中环上C原子采用sp2杂化、甲基上C原子采用sp3杂化,故错误;
b.CH4 上C原子采用sp3杂化,故错误;
c.CH2═CHCH3中连接双键的碳原子采用sp2杂化、甲基上C原子采用sp3杂化,故错误;
d.CH3CH2C≡CH中连接三键的碳原子采用sp杂化,甲基和亚甲基上C原子采用sp3杂化,故正确;
故答案为:d。
14.(1)小于
(2)三口烧瓶
(3) A→E→B→C 排出A中的空气防止乙二胺双缩水杨醛合钴(Ⅱ)被氧化 温度低反应速率慢,乙二胺温度过高会引起爆炸 洗去杂质水杨醛、乙二胺
(4)
【分析】水杨醛与乙二胺反应生成亮黄色的乙二胺双缩水杨醛片状晶体,向A中通入氮气排出A中的空气,加热A,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体,冷却、过滤,洗涤的产品乙二胺双缩水杨醛合钴(Ⅱ)。
【详解】(1)乙二胺中N原子采用sp3杂化,乙二胺双缩水杨醛合钴(Ⅱ)中N原子采用sp2杂化,所以乙二胺中H-N-C的夹角小于乙二胺双缩水杨醛合钴(Ⅱ)中C-N-C的夹角。
(2)根据图示,仪器A的名称为三口烧瓶;
(3)步骤Ⅲ后的操作步骤为:
D.向仪器A中通入N2,并调节氮气流速至稳定;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
E.停止加热,用冷水冷却仪器A;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→A→E→B→C→G。
②常温下,乙二胺双缩水杨醛合钴(Ⅱ)易被氧化,向仪器A中通入N2的目的是排出A中的空气防止乙二胺双缩水杨醛合钴(Ⅱ)被氧化。
③温度低反应速率慢,乙二胺温度过高会引起爆炸,所以步骤F中保持温度在70~80℃。
④水杨醛、乙二胺都易溶于乙醇,用乙醇洗涤晶体的目的是洗去杂质水杨醛、乙二胺。
(4)理论上生成乙二胺双缩水杨醛合钴(Ⅱ)的物质的量为0.0078mol,产品的产率为
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章分子结构与性质检测卷-2023-2024学年高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为,反应的离子方程式为。设为阿伏加德罗常数的值,下列说法错误的是
A.消耗,反应转移的电子数为
B.消耗时,溶液中增加的数目为
C.标准状况下,中含键数目为
D.液态水中含有的氢键数目少于
2.与在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法错误的是
A.NO为极性分子
B.H2S的VSEPR模型为三角锥形
C.HSNO的结构式为
D.NO与H2S反应生成的两种单质为S、N2
3.下列化学用语或图示表达错误的是
A.的球棍模型为
B.的VSEPR模型为正四面体形
C.基态原子的价层电子轨道表示式为
D.顺-2-丁烯的分子结构模型:
4.能形成结构式如图所示的离子。所含的4种元素位于主族,在每个短周期均有分布,和同族,和同周期。的轨道有2个未成对电子,下列说法正确的是
A.元素电负性: B.原子半径:
C.最简单氢化物沸点: D.和中的杂化轨道类型相同
5.催化剂能催化脱除烟气中的,反应的化学方程式为。下列说法正确的是
A.的电子式为
B.的模型名称为直线形
C.的价层电子的轨道表示式为
D.是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
6.甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应:HCHO+O2H2O+CO2.下列有关叙述正确的是
A.HCHO分子中σ键和π键的数目之比为2:1
B.HCHO分子中存在分子间氢键
C.H2O是由极性键构成的非极性分子
D.CO2中碳原子的杂化方式为sp
7.下列关于晶体的说法正确的个数是
①2p、3p、4p能级的轨道数依次增加
②金刚石、NaF、NaCl、H2S、H2O晶体的熔点依次降低
③形成氢键的三个原子不一定在同一条直线上
④晶体中分子间作用力越大,分子越稳定
⑤HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
⑥同周期,与Sc元素未成对电子数相等的元素有3种
⑦基态Cr3+的最高能层中成对电子与未成对电子的数目比为8:3
⑧元素Ge位于周期表第四周期ⅣA族,核外电子排布式为[Ar]4s24p2,属于P区
A.2 B.3 C.4 D.5
8.二氯化二硫是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用浸润)中通入。已知:常温下遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
A.分子中所有原子均满足8电子结构
B.中S原子的杂化类型为杂化
C.与结构相似
D.与反应的化学方程式可能为:
9.利用和溴酸盐溶液制备高溴酸盐的反应为(未配平).下列说法正确的是
A.氧化剂为,还原产物为 B.若生成,则该反应中转移电子
C.中各原子均满足8电子稳定结构 D.中心原子的价层电子对数为2,杂化方式为
10.设为阿伏加德罗常数的值.下列说法错误的是
A.中含有的共用电子对数目为
B.的溶液中的数目为
C.标准状况下,1.12LSO3中含有电子的数目为
D.正丁烷和异丁烷的混合物中含有的极性键数目为
二、解答题
11.实验室用和亚硫酰氯()共热制备无水的装置如图所示(加热及夹持装置略)。已知:的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)仪器E的名称为 。
(2)D中发生反应的化学方程式为 。
(3)反应前后都需要通,反应后通的目的是 。
(4)的键角 (填“大于”“小于”或“等于”)的键角。
(5)有人认为产品可能含,证明方法是 。
(6)实验完毕后,测定产品成分。取一定量产品配成溶液,分成甲、乙两等份,进行如下实验:
实验1:在甲中加入足量KI,再滴几滴淀粉溶液,用0.1000 溶液滴定至终点,消耗溶液V1 mL。
实验2:在乙中滴几滴溶液作指示剂,用0.1000 溶液测定氯离子的量,滴定至终点,消耗溶液V2 mL。
已知:实验1中滴定反应为。
①若溶液酸性较强,测得结果 (填“偏大”“偏小”或“无影响”)。
②若 时,可判断产品中全部是。
12.钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以和形式存在,从镍钼矿中分离钼,并得到的一种工艺流程。
已知“浸取”过程中发生如下反应:
(1)位于元素周期表第 周期第 族。
(2)“焙烧”中生成的反应如下所示,请配平该化学方程式 。
上述反应中共价化合物的中心原子杂化方式是 杂化。
(3)下列说法正确的是________。(不定项)
A.电负性: B.离子半径:
C.第一电离能: D.基态的简化电子排布式
用量对钼浸出率和浸取液中浓度的影响如左下图所示,的溶解度曲线如右下图所示。
(4)分析实际生产中选择用量为理论用量1.2倍的原因是: 。
(5)为充分分离,工艺流程中的“操作”应为________。
A.蒸发结晶 B.低温结晶 C.蒸馏 D.萃取
(6)中存在的相互作用有________。
A.分子间作用力 B.金属键 C.共价键 D.离子键
(7)分解可得。高温下,用铝粉还原得到金属钼的化学方程式为: 。
13.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)表中元素,电负性最强的是 (填元素符号),J的元素名称为 。N基态原子核外能级上有 未成对电子。
(2)D元素原子的价电子排布图为 ,核外有 种不同运动状态的电子。该元素形成的常见单质分子中σ键和π键个数比为
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是 (填“极性”或“非极性”)分子。
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是 (填字母)。
a. b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
14.乙二胺双缩水杨醛合钴(Ⅱ)是一种简单的载氧体,对开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。乙二胺双缩水杨醛合钴(Ⅱ)的制备原理如下图所示:
已知:①乙二胺双缩水杨醛合钴(Ⅱ)由于制备条件不同可以得到两种不同的固体形态:一种是棕色的胶状物,在室温下易被氧化;另一种是暗红色晶体,在室温下稳定。
②水杨醛:微溶于水,易溶于乙醇;乙二胺;溶于水、乙醇、温度过高会引起爆炸。
制备过程如下:
I.按照图示安装仪器,在仪器A中加入80mL95%乙醇,再加入1.65mL含0.0157mol的水杨醛。
Ⅱ.在搅拌条件下,加入0.55mL含0.0078mol的乙二胺,反应4~5min,生成亮黄色的乙二胺双缩水杨醛片状晶体。
Ⅲ.溶解0.0078 mol Co(CH3COO)2于热水中。
……
请回答:
(1)乙二胺中H-N-C的夹角 乙二胺双缩水杨醛合钴(Ⅱ)中C-N-C的夹角(填“大于”“小于”或“等于”)。
(2)仪器A的名称为 。
(3)步骤Ⅲ后的操作如下:
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
D.向仪器A中通入N2,并调节氮气流速至稳定;
E.停止加热,用冷水冷却仪器A;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→ →G。
②向仪器A中通入N2的目的是 。
③步骤F中保持温度在70~80℃的原因是 。
④用乙醇洗涤晶体的目的是 。
(4)产品的产率为 (列出计算式即可)。
参考答案:
1.B
【详解】
A.Al转变为,化合价升高3,则消耗,反应转移的电子数为,A项正确;
B.在水溶液中会水解,消耗时,溶液中增加的数目应小于,B项错误;
C.1个分子中含有2个键,标准状况下,物质的量为,含键数目为,C项正确;
D.冰中含有氢键,液态水中的氢键数目少于冰,因此液态水中含有的氢键数目少于,D项正确;
故选B。
2.B
【详解】A.NO为仅含极性键的双原子分子,为极性分子,故A正确;
B.H2S中S的价层电子对数为4,VSEPR模型为四面体形,故B错误;
C.HSNO的结构式为,故C正确;
D.H2S易被氧化为S,而NO中仅N能被还原,则生成的两种单质为S、N2,故D正确;
故答案为:B。
3.B
【详解】
A.为V形,球棍模型为,A正确;
B.中心原子B原子上含有3个σ键,中心原子上的孤电子对数为0,故其VSEPR模型为平面三角形,B错误;
C.基态原子的3d轨道半充满较稳定,价层电子轨道表示式为,C正确;
D.顺-2-丁烯的两个甲基在碳碳双键的同一侧,分子结构模型:,D正确;
故选B。
4.D
【分析】W的3p轨道有2个未成对电子,即W为Si或S,图中W可形成6个键,即W为S,和同族,且Y可形成2个化学键,即Y为O,X和Y同周期,且X可形成4个键,即X为C,Z能形成1个化学键,且在每个短周期均有分布,因此Z在第一周期,Z为H。
【详解】A.同周期元素从左往右电负性逐渐增大,同族元素从上到下,电负性逐渐减小,即电负性:Y(O)>W(S)>Z(H),故A错误;
B.电子层数越大原子半径越大,电子层数相同时,核电荷数越大原子半径越小,即原子半径: W(S)>X(C)>Y(O)>Z(H),故B错误;
C.由于H2O可形成分子间氢键,导致其沸点较大,即最简单氢化物沸点: Y(O)>W(S)>X(C),故C错误;
D.(SO2)的价层电子对数为,即S为sp2杂化,(SO3)的价层电子对数为,即S为sp2杂化,故D正确;
故选D。
5.C
【详解】
A.的电子式为:,A错误;
B.的模型名称为四面体形,B错误;
C.的价层电子的轨道表示式为,C正确;
D.是极性分子,分子的空间结构为三角锥形,N原子处在三角锥形的锥顶,3个H原子位于锥底,D错误;
故选:C。
6.D
【详解】A.甲醛分子中单键为σ键,双键中含有1个σ键和1个π键,则分子中σ键和π键的数目之比为3:1,故A错误;
B.甲醛分子不能形成分子间氢键,故B错误;
C.水分子是由极性键构成的极性分子,故C错误;
D.二氧化碳分子中碳原子的价层电子对数为2、孤对电子对数为0,则碳原子的杂化方式为sp杂化,故D正确;
故选D。
7.A
【详解】①p能级电子云轮廓图形状均呈哑铃形且能级的轨道数均为3个,①错误;
②金刚石属于原子晶体,熔点最高,NaF、NaCl属于离子晶体,氟离子半径小于氯离子半径,故NaF的晶格能大于NaCl,则NaF的熔点更高,H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高,所以金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低,②错误;
③氢键结合的通式,可用X-H Y表示,式中X和Y代表F、O、N等电负性大而原子半径较小的非金属原子;X和Y可以是两种相同的元素,也可以是两种不同的元素,但不一定在一条直线上,如邻羟基苯甲醛中的氢键,③正确;
④共价键键能越大,分子越稳定,与分子间作用力大小无关,④错误;
⑤HF和属于分子晶体,分子晶体的相对分子质量越大,其沸点越高,但是分子间存在氢键,故HF晶体沸点高于,⑤错误;
⑥Sc原子位于第四周期,电子排布式为1s22s22p63s23p63d14s2,有1个未成对电子,则与Sc同周期且其基态原子的未成对电子数与基态Sc原子相同的元素有K、Cu、Ga、Br共4种,⑥错误;
⑦基态Cr3+的最高能层为M层,排布式为3s23p63d3,有8个成对电子,3个未成对单电子,所以基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3,⑦正确;
⑧元素Ge位于周期表第四周期IVA族,核外电子排布式为[Ar]3d104s24p2, 属于p区,故⑧错误;正确的有③⑦;
故选A。
8.B
【详解】A.S2Cl2分子中S原子连接2个共价键,Cl原子连接1个共价键,S2Cl2分子中所有原子均满足8电子结构,故A正确;
B.S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故B错误;
C.溴元素与氯元素位于同主族,所以S2Cl2与S2Br2的结构相似,故C正确;
D.常温下,遇水易水解,并产生能使品红褪色的气体为二氧化硫,在反应过程中硫元素由+1价一部分升高到+4价(生成SO2),S2Cl2中Cl元素化合价为 1价,不能再得电子,只能是一部分S元素化合价降低到0价(生成S),所以反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故D正确;
故选B。
9.B
【详解】
A.中Xe化合价降低,为氧化剂,溴元素化合价升高,被 氧化得到氧化产物,A错误;
B.溴元素化合价由+5变为+7,电子转移为,若生成(为0.2mol),则该反应中转移电子,B正确;
C.中Xe本来最外层有8个电子,又形成2个共价键,故不是8电子结构,C错误;
D.H2O分子中中心O原子价层电子对数为2+=4,杂化方式为,D错误;
故选B。
10.C
【详解】A.1个中含共用电子对数4对,故1molHCN中含有的共用电子对数目为4NA,故A正确;
B.的溶液中,c(H+)=0.01mol/L,H+的物质的量=0.01mol/L×1.0L=0.01mol,H+的数目为0.01NA,故B正确;
C.标况下三氧化硫为固体,其物质的量不能根据气体摩尔体积来计算,故C错误;
D.正丁烷和异丁烷混合物的物质的量为:,正丁烷和异丁烷均含有10个极性键,0.1mol混合物中共价键数目为1NA,故D正确;
故选:C。
11.(1)球形冷凝管
(2)
(3)反应后将滞留在装置内的氯化氢气体全部赶入装置G中,使其全部吸收;
(4)大于
(5)生成的二氧化硫气体具有还原性,可能将铁离子还原为亚铁离子
(6) 偏大 3
【分析】
B中盛放SOCl2液体,水浴加热B形成SOCl2蒸汽与D中的反应生成无水、SO2和HCl,气体通过冷凝管E冷凝回流未反应的亚硫酰氯(SOCl2),提高其转化率,最后注意尾气处理,以此解题。
【详解】(1)由图可知,仪器E的名称为球形冷凝管;
(2)根据遇水极易反应生成两种酸性气体知,装置D内发生的反应可以看成是先分解产生FeCl3和水蒸气,水蒸气再与发生反应生成SO2、HCl。反应的化学方程式为;
(3)反应后会有一些氯化氢气体残留在装置中,则反应后通N2的目的是反应后将滞留在装置内的氯化氢气体全部赶入装置G中,使其全部吸收;
(4)孤对电子能够排斥化学键,由于二氧化硫的孤对电子多,将二氧化硫的键角压缩,故水的键角大,H2O的键角大于SO2的键角,故答案为:大于;
(5)生成的二氧化硫气体具有还原性,可能将铁离子还原为亚铁离子,使得产品可能含;
(6)
①若溶液酸性较强,酸性条件下发生,导致Na2 S2O3酸性条件下分解,消耗偏多,测得V1结果偏大;
②铁离子和碘离子发生反应生成碘单质:,碘单质和Na2S2O3反应:,通过测定消耗的碘单质的量,求出I2的量,进而求出Fe3+的量,由反应可知,,所以n(Fe3+) =0.1000V1×10-3 mol,Cl-~Ag+所以n(Ag+)=0.1000V2×10-3 mol,结合化学式FeCl3,当若=3时,可判断产品中全部是FeCl3。
12.(1) 四 VIII
(2) 2MoS2+6Na2CO3+9O2=2Na2MoO4+6CO2+4Na2SO4 sp
(3)D
(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,若低于1.2倍,钼浸出率较低
(5)B
(6)CD
(7)
【分析】镍钼矿与碳酸钠、通空气焙烧后,加水浸取得到含NiO的浸渣,滤液中含Na2MoO4、Na2SO4等,加入MgSO4净化后,滤液进行操作X得到Na2SO4,溶液进行离子交换萃取得到交换溶液,最后萃取液经系列操作得(NH4)2MoO4。
【详解】(1)Ni元素在元素周期表中位于第四周期第Ⅷ族。
(2)反应MoS2+Na2CO3+O2→Na2MoO4+CO2+Na2SO4中Mo元素的化合价由+4价升至+6价、S元素的化合价由-2价升至+6价,1molMoS2参与反应失去18mol电子,1molO2得到4mol电子,根据得失电子守恒和原子守恒,配平后的方程式为2MoS2+6Na2CO3+9O2=2Na2MoO4+6CO2+4Na2SO4;该反应中的共价化合物为CO2,CO2中中心碳原子的价层电子对数为2+×(4-2×2)=2,C采取sp杂化。
(3)A.同周期从左到右主族元素的电负性逐渐增大,同主族从上到下电负性逐渐减小,元素的非金属性越强、电负性越大,则电负性:O>S>C,A项错误;
B.根据“层多径大、序大径小”,离子半径:Na+<O2-<S2-,B项错误;
C.同周期从左到右主族元素的第一电离能呈增大趋势,第ⅡA、ⅤA族大于相邻元素,同主族从上到下元素的第一电离能逐渐减小,则第一电离能:Na<O<N,C项错误;
D.基态Ni的简化电子排布式为[Ar]3d84s2,基态Ni2+的简化电子排布式为[Ar]3d8,D项正确;
答案选D。
(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,由图可知,若低于1.2倍,钼浸出率较低,故实际生产中选择碳酸钠用量为理论用量1.2倍。
(5)由Na2MoO4和Na2SO4的溶解度曲线可知,为充分分离Na2SO4,工艺流程中的“操作X”应为低温结晶,答案选B。
(6)(NH4)2MoO4中与之间为离子键,中N与H、中Mo与O之间为共价键,答案选CD。
(7)Al与MoO3发生铝热反应生成Al2O3和Mo,反应的化学方程式为2Al+MoO3Al2O3+Mo。
13.(1) F 硅 3
(2) 7 1∶2
(3)非极性
(4)d
【分析】根据元素周期表中元素的位置可知A~N分别为H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Co;
【详解】(1)非金属性越强电负性越大,则表中元素,电负性最强的是F,J为Si,元素名称为硅;N为Co,Co位于周期表中第4周期,第ⅤⅢ族,价电子排布式为3d74s2,基态Co原子核外能级上有3个未成对电子;
(2)D为N元素,N原子的价电子排布式为2s22p3,价电子排布图为;N原子核外有7个电子,每个电子的运动状态都不同,则核外有7种不同运动状态的电子。该元素形成的常见单质分子是N2,结构式为N≡N,三键由1个σ键和2个π键形成,σ键和π键个数比1:2;
(3)根据相似相溶原理,ME2L2能与CCl4、CS2等互溶,已知CS2是非极性分子,据此可判断ME2L2是非极性分子;
(4)饱和C原子采取sp3杂化,双键C原子和苯环C原子采取sp2杂化,三键C原子采取sp杂化,
a. 中环上C原子采用sp2杂化、甲基上C原子采用sp3杂化,故错误;
b.CH4 上C原子采用sp3杂化,故错误;
c.CH2═CHCH3中连接双键的碳原子采用sp2杂化、甲基上C原子采用sp3杂化,故错误;
d.CH3CH2C≡CH中连接三键的碳原子采用sp杂化,甲基和亚甲基上C原子采用sp3杂化,故正确;
故答案为:d。
14.(1)小于
(2)三口烧瓶
(3) A→E→B→C 排出A中的空气防止乙二胺双缩水杨醛合钴(Ⅱ)被氧化 温度低反应速率慢,乙二胺温度过高会引起爆炸 洗去杂质水杨醛、乙二胺
(4)
【分析】水杨醛与乙二胺反应生成亮黄色的乙二胺双缩水杨醛片状晶体,向A中通入氮气排出A中的空气,加热A,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体,冷却、过滤,洗涤的产品乙二胺双缩水杨醛合钴(Ⅱ)。
【详解】(1)乙二胺中N原子采用sp3杂化,乙二胺双缩水杨醛合钴(Ⅱ)中N原子采用sp2杂化,所以乙二胺中H-N-C的夹角小于乙二胺双缩水杨醛合钴(Ⅱ)中C-N-C的夹角。
(2)根据图示,仪器A的名称为三口烧瓶;
(3)步骤Ⅲ后的操作步骤为:
D.向仪器A中通入N2,并调节氮气流速至稳定;
F.向冷凝管中通入冷凝水,开始加热A,并保持温度在70~80℃;
A.待亮黄色片状晶体全部溶解后,将Co(CH3COO)2迅速加入仪器A中,生成棕色胶状沉淀,恒温搅拌1h,使棕色胶状沉淀全部转变为暗红色晶体;
E.停止加热,用冷水冷却仪器A;
B.停止通入N2
C.过滤晶体,用5mL水洗涤3次,再用乙醇洗涤;
G.真空干燥箱烘干产品,称重得2.03g产品。
①正确的操作顺序为D→F→A→E→B→C→G。
②常温下,乙二胺双缩水杨醛合钴(Ⅱ)易被氧化,向仪器A中通入N2的目的是排出A中的空气防止乙二胺双缩水杨醛合钴(Ⅱ)被氧化。
③温度低反应速率慢,乙二胺温度过高会引起爆炸,所以步骤F中保持温度在70~80℃。
④水杨醛、乙二胺都易溶于乙醇,用乙醇洗涤晶体的目的是洗去杂质水杨醛、乙二胺。
(4)理论上生成乙二胺双缩水杨醛合钴(Ⅱ)的物质的量为0.0078mol,产品的产率为
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
