3.3 金属晶体与离子晶体 课时3课件(共14张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3 金属晶体与离子晶体 课时3课件(共14张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 16:25:09 | ||
图片预览



文档简介
(共14张PPT)
第三章 晶体结构与性质
第三节金属晶体与离子晶体
课时3
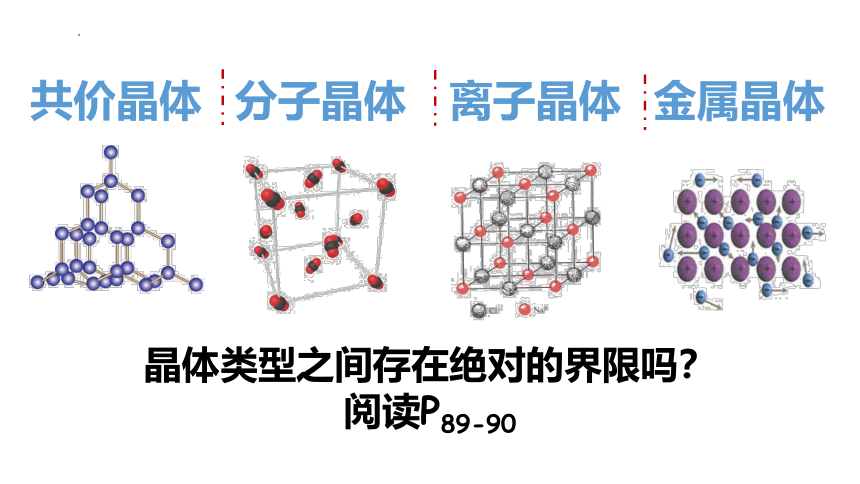
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗?
阅读P89-90
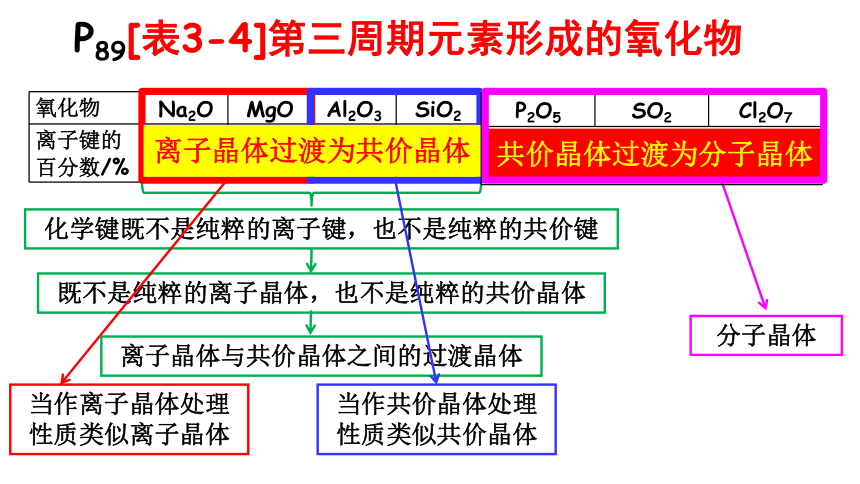
P89[表3-4]第三周期元素形成的氧化物
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
化学键既不是纯粹的离子键,也不是纯粹的共价键
既不是纯粹的离子晶体,也不是纯粹的共价晶体
当作离子晶体处理
性质类似离子晶体
当作共价晶体处理
性质类似共价晶体
离子晶体与共价晶体之间的过渡晶体
离子晶体过渡为共价晶体
P2O5 SO2 Cl2O7
离子键成分小,而且共价键不再贯穿整个晶体。 共价晶体过渡为分子晶体
分子晶体
过渡晶体
1.P89纯粹的典型晶体是不多的,大多数晶体是它们
之间的过渡晶体
2.P90四类晶体都有过渡型
3.过渡型远多于典型晶体
(典型晶体其实是理想模型的一种)
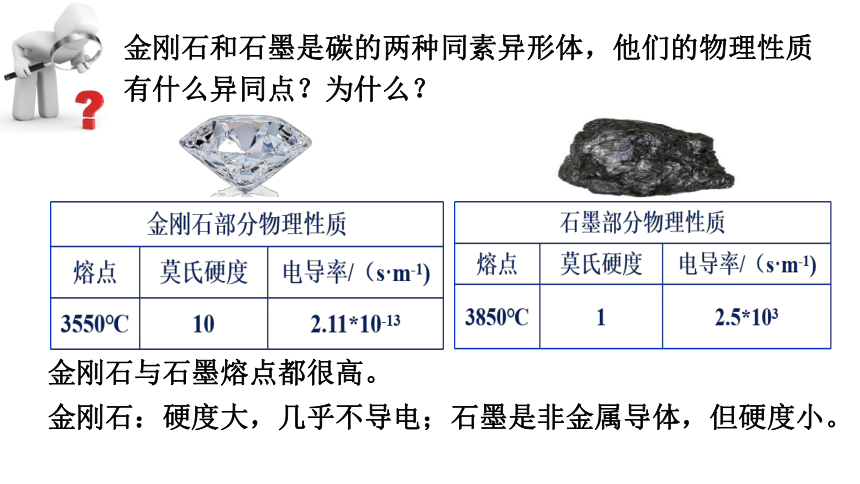
金刚石与石墨熔点都很高。
金刚石:硬度大,几乎不导电;石墨是非金属导体,但硬度小。
金刚石和石墨是碳的两种同素异形体,他们的物理性质
有什么异同点?为什么?
金
刚
石
与
石
墨
结
构
对
比
物质 金刚石 石墨
空间结构
碳原子杂化方式
最小碳环的原子数
C原子与C-C键之比
C原子的配位数
石墨的二维平面结构
正四面体空间网状结构
平面六元并环层状结构
sp3
sp2
6
6
1:2
2:3
4
3
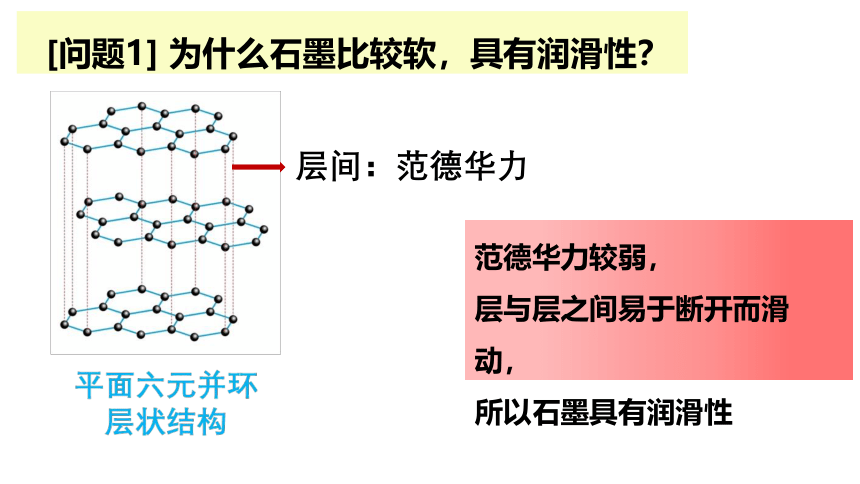
[问题1] 为什么石墨比较软,具有润滑性?
范德华力较弱,
层与层之间易于断开而滑动,
所以石墨具有润滑性
层间:范德华力
[问题2] 为什么石墨与金刚石一样熔点高?
金刚石与石墨熔化都要破坏C-C共价键,
共价键强度大,所以熔点高。
[问题3] 为什么石墨可以导电?
sp2
石墨结构未参与杂化的p轨道
每个C有一个未参与杂化的2p电子,所有的
p轨道相互平行而且相互肩并肩重叠(形成大π键),使p轨道的电子可在整个碳原子平面中运动。
所以,石墨能导电。(只能沿石墨平面的方向)
[问题3] 为什么石墨可以导电?
范德华力
混合型晶体
层内碳原子之间
未参与杂化的轨道上的电子可在层内运动
层与层
碳原子之间
共价键
有金属键的性质
像石墨这样的晶体既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
共价晶体
金属晶体
分子晶体
混合型晶体
1.定义:
具有两种或两种以上晶体的结构和性质的晶体
2.作用力:多种
3.实例:石墨
P90
①对事物的简单分类,尽管条理鲜明,但可能只是
概括了最典型的事实。
②许多晶体不能被简单的归类到四种晶体的某一类。
已知六方氮化硼类似于石墨的结构,如图所示:
①六方氮化硼的化学式:_____
BN
②六方氮化硼中N和B的杂化类型:_____
sp2
③硼与氮之间的化学键为 ,
层与层之间作用力为 。
属于的晶体类型: 。
极性共价键
分子间作用力
混合型晶体
④六方氮化硼熔点 ,硬度 。
较高 较小
第三章 晶体结构与性质
第三节金属晶体与离子晶体
课时3
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗?
阅读P89-90
P89[表3-4]第三周期元素形成的氧化物
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
化学键既不是纯粹的离子键,也不是纯粹的共价键
既不是纯粹的离子晶体,也不是纯粹的共价晶体
当作离子晶体处理
性质类似离子晶体
当作共价晶体处理
性质类似共价晶体
离子晶体与共价晶体之间的过渡晶体
离子晶体过渡为共价晶体
P2O5 SO2 Cl2O7
离子键成分小,而且共价键不再贯穿整个晶体。 共价晶体过渡为分子晶体
分子晶体
过渡晶体
1.P89纯粹的典型晶体是不多的,大多数晶体是它们
之间的过渡晶体
2.P90四类晶体都有过渡型
3.过渡型远多于典型晶体
(典型晶体其实是理想模型的一种)
金刚石与石墨熔点都很高。
金刚石:硬度大,几乎不导电;石墨是非金属导体,但硬度小。
金刚石和石墨是碳的两种同素异形体,他们的物理性质
有什么异同点?为什么?
金
刚
石
与
石
墨
结
构
对
比
物质 金刚石 石墨
空间结构
碳原子杂化方式
最小碳环的原子数
C原子与C-C键之比
C原子的配位数
石墨的二维平面结构
正四面体空间网状结构
平面六元并环层状结构
sp3
sp2
6
6
1:2
2:3
4
3
[问题1] 为什么石墨比较软,具有润滑性?
范德华力较弱,
层与层之间易于断开而滑动,
所以石墨具有润滑性
层间:范德华力
[问题2] 为什么石墨与金刚石一样熔点高?
金刚石与石墨熔化都要破坏C-C共价键,
共价键强度大,所以熔点高。
[问题3] 为什么石墨可以导电?
sp2
石墨结构未参与杂化的p轨道
每个C有一个未参与杂化的2p电子,所有的
p轨道相互平行而且相互肩并肩重叠(形成大π键),使p轨道的电子可在整个碳原子平面中运动。
所以,石墨能导电。(只能沿石墨平面的方向)
[问题3] 为什么石墨可以导电?
范德华力
混合型晶体
层内碳原子之间
未参与杂化的轨道上的电子可在层内运动
层与层
碳原子之间
共价键
有金属键的性质
像石墨这样的晶体既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
共价晶体
金属晶体
分子晶体
混合型晶体
1.定义:
具有两种或两种以上晶体的结构和性质的晶体
2.作用力:多种
3.实例:石墨
P90
①对事物的简单分类,尽管条理鲜明,但可能只是
概括了最典型的事实。
②许多晶体不能被简单的归类到四种晶体的某一类。
已知六方氮化硼类似于石墨的结构,如图所示:
①六方氮化硼的化学式:_____
BN
②六方氮化硼中N和B的杂化类型:_____
sp2
③硼与氮之间的化学键为 ,
层与层之间作用力为 。
属于的晶体类型: 。
极性共价键
分子间作用力
混合型晶体
④六方氮化硼熔点 ,硬度 。
较高 较小
