化学人教版(2019)选择性必修2 3.2.1分子晶体(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 16:33:29 | ||
图片预览







文档简介
(共24张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
同学们认真观察,找出两种晶体模型中的共同点
碘晶体结构
干冰晶体结构
构成微粒:分子
微粒内作用:共价键
微粒间作用:分子间作用力
晶胞中分子位置:顶角和面心
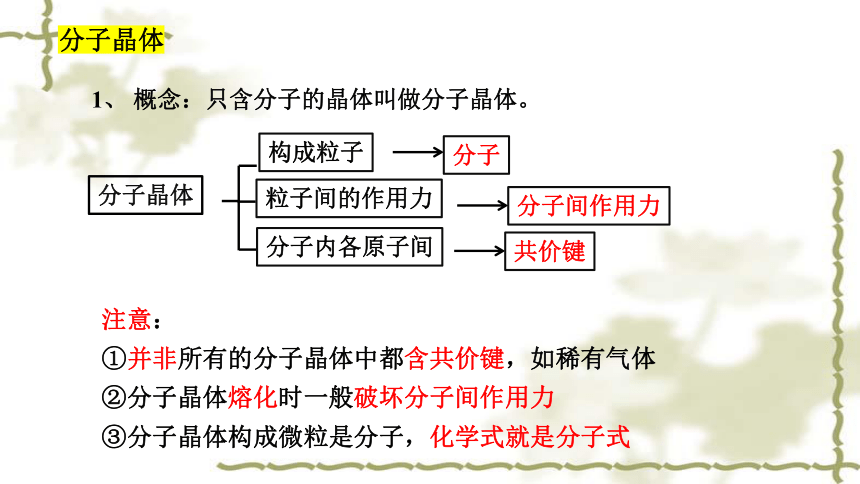
分子晶体
注意:
①并非所有的分子晶体中都含共价键,如稀有气体
②分子晶体熔化时一般破坏分子间作用力
③分子晶体构成微粒是分子,化学式就是分子式
1、 概念:只含分子的晶体叫做分子晶体。
分子晶体
构成粒子
分子
粒子间的作用力
分子间作用力
分子内各原子间
共价键
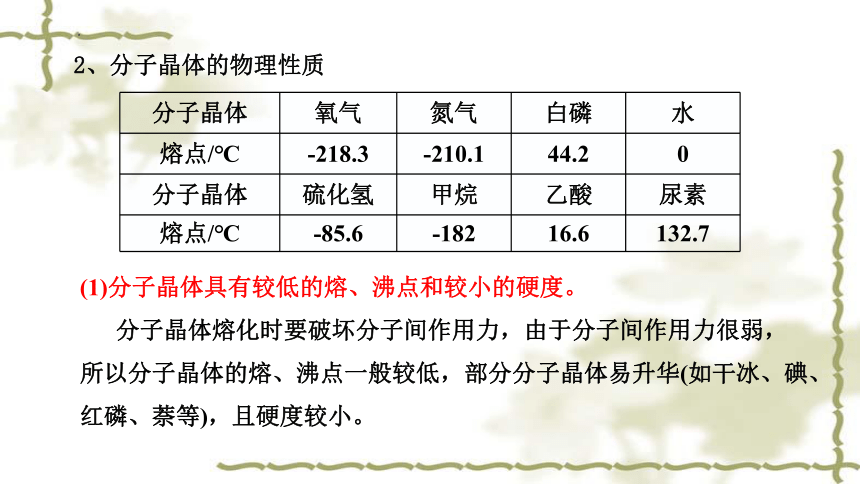
2、分子晶体的物理性质
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
原因:分子间作用力很弱
(1)部分非金属单质:X2、O2、H2、 S8、P4、C60
(4)部分非金属氧化物: CO2、SO2、NO2……
(5)几乎所有的酸: H2SO4、HNO3、H3PO4
(6)绝大多数有机物:乙醇、冰醋酸、蔗糖……
(2)稀有气体
大部分共价单质和共价化合物
3、 常见的分子晶体
(3)所有非金属氢化物:H2O、H2S、NH3、CH4、HX……
板书
分子晶体
定义: 只含分子的晶体叫~。
物性
有较低的熔、沸点和较小的硬度。
固体或熔融状态不导电。
分子晶体的溶解性一般符合“相似相溶”规律。
部分非金属单质、部分非金属氧化物
稀有气体、绝大多数有机物
常见的分子晶体
所有非金属氢化物、几乎所有的酸
4、 分子晶体的结构特征
特点:分子间作用力都只是范德华力,在立方体的顶角各有一个分子,6个面的中心又各有一个分子,这种堆积称为分子密堆积。
(1)、分子密堆积
碳60的晶胞
——大多数分子晶体的结构特征
碘晶体晶胞
干冰晶胞
面心立方最密堆积
干冰的晶体结构图
中心
CO2分子
以干冰晶体结构为例分析:分子密堆积的结构
①干冰中的CO2分子间作用力只存在 ,不存在 。
②每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
分子间氢键
分子间的主要作用力是氢键(当然存在范德华力),以1个分子为中心,周围有4个相邻分子,即分子非密堆积结构。如:HF 、NH3等
冰中1个水分子周围有4个水分子
冰的结构
(2)、冰的结构——非密堆积
0-4℃时,当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
水在4℃时的密度最大
板书
分子晶体
定义: 只含分子的晶体叫~。
物性
有较低的熔、沸点和较小的硬度。
晶体或固体熔融状态不导电。
分子晶体的溶解性一般符合“相似相溶”规律。
部分非金属单质、部分非金属氧化物
稀有气体、绝大多数有机物
常见的分子晶体
所有非金属氢化物、几乎所有的酸
结构特征
分子密堆积:面心立方、只有范德华力、12
非密堆积:有氢键、如冰
【思考与讨论】
1、硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
【思考与讨论】
2、如何判断哪些物质是分子晶体?
A、依据物质的类别判断
B、依据组成晶体的粒子及粒子间作用判断
C、依据物质的性质判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
分子晶体硬度小,熔、沸点低,在熔融状态或固体时均不导电。
3、都是分子晶体时,熔沸点高低如何判断?
①含有分子间氢键的分子晶体,熔沸点较高。H2O>H2Te>H2Se>H2S,HF>HCl。
氢键
②组成和结构相似的物质,不含氢键的分子晶体,相对分子质量越大,范德华力越大, 熔沸点越高。如:O2>N2,HI>HBr>HCl。
范德华力
③相对分子质量相等或相近,分子极性越大,熔沸点越高,如CO>N2。
极性
【思考与讨论】
同分异构体中:
在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;
1、比较下列化合物的熔、沸点的高低(填“>”或“<”)
①CO2 SO2; ②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2;
<
>
>
<
>
>
2、已知AlCl3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。
可测其在熔融状态下是否可导电,若不导电,则是共价化合物,
若导电,则是离子化合物。
科学 技术 社会—天然气水合物—一种潜在的能源
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气分子藏在水分子笼内
水分子笼是多种多样的
1、下列关于分子晶体的说法正确的是( )
A. 分子内均存在共价键 B. 分子间一定存在范德华力
C. 分子间一定存在氢键 D. 晶体的熔、沸点一般较高
2、下列各组物质都属于分子晶体的是( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
B
A
3、下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、H2O、Na2O2
B
4、下列物质固态时,一定是分子晶体的是( )
A、酸性氧化物 B、非金属单质
C、碱性氧化物 D、含氧酸
D
5、医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体 B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
6、下列性质适合于分子晶体的是( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③
C.②③ D.②④
C
7、海底有大量的天然气水合物,可满足人类1 000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
A.CH4·14H2O B.CH4·8H2O
C.CH4· H2O D.CH4·6H2O
B
176
a3 NA ×10-30
g·cm-3
8、如图为干冰的晶胞结构示意图。
(1)通过观察分析,有____种取向不同的CO2分子。
将CO2分子视作质点,设晶胞边长为a pm,则紧
邻的两个CO2分子的距离为______ pm。
(2)若以顶点上的1个CO2 为中心,周围等距离为a cm的CO2有_____个它们构成______面体
(3)其密度ρ为____________________________(1 pm=10-10 cm)。
6
八
√2a
2
4
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
同学们认真观察,找出两种晶体模型中的共同点
碘晶体结构
干冰晶体结构
构成微粒:分子
微粒内作用:共价键
微粒间作用:分子间作用力
晶胞中分子位置:顶角和面心
分子晶体
注意:
①并非所有的分子晶体中都含共价键,如稀有气体
②分子晶体熔化时一般破坏分子间作用力
③分子晶体构成微粒是分子,化学式就是分子式
1、 概念:只含分子的晶体叫做分子晶体。
分子晶体
构成粒子
分子
粒子间的作用力
分子间作用力
分子内各原子间
共价键
2、分子晶体的物理性质
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
原因:分子间作用力很弱
(1)部分非金属单质:X2、O2、H2、 S8、P4、C60
(4)部分非金属氧化物: CO2、SO2、NO2……
(5)几乎所有的酸: H2SO4、HNO3、H3PO4
(6)绝大多数有机物:乙醇、冰醋酸、蔗糖……
(2)稀有气体
大部分共价单质和共价化合物
3、 常见的分子晶体
(3)所有非金属氢化物:H2O、H2S、NH3、CH4、HX……
板书
分子晶体
定义: 只含分子的晶体叫~。
物性
有较低的熔、沸点和较小的硬度。
固体或熔融状态不导电。
分子晶体的溶解性一般符合“相似相溶”规律。
部分非金属单质、部分非金属氧化物
稀有气体、绝大多数有机物
常见的分子晶体
所有非金属氢化物、几乎所有的酸
4、 分子晶体的结构特征
特点:分子间作用力都只是范德华力,在立方体的顶角各有一个分子,6个面的中心又各有一个分子,这种堆积称为分子密堆积。
(1)、分子密堆积
碳60的晶胞
——大多数分子晶体的结构特征
碘晶体晶胞
干冰晶胞
面心立方最密堆积
干冰的晶体结构图
中心
CO2分子
以干冰晶体结构为例分析:分子密堆积的结构
①干冰中的CO2分子间作用力只存在 ,不存在 。
②每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
分子间氢键
分子间的主要作用力是氢键(当然存在范德华力),以1个分子为中心,周围有4个相邻分子,即分子非密堆积结构。如:HF 、NH3等
冰中1个水分子周围有4个水分子
冰的结构
(2)、冰的结构——非密堆积
0-4℃时,当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
水在4℃时的密度最大
板书
分子晶体
定义: 只含分子的晶体叫~。
物性
有较低的熔、沸点和较小的硬度。
晶体或固体熔融状态不导电。
分子晶体的溶解性一般符合“相似相溶”规律。
部分非金属单质、部分非金属氧化物
稀有气体、绝大多数有机物
常见的分子晶体
所有非金属氢化物、几乎所有的酸
结构特征
分子密堆积:面心立方、只有范德华力、12
非密堆积:有氢键、如冰
【思考与讨论】
1、硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
【思考与讨论】
2、如何判断哪些物质是分子晶体?
A、依据物质的类别判断
B、依据组成晶体的粒子及粒子间作用判断
C、依据物质的性质判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
分子晶体硬度小,熔、沸点低,在熔融状态或固体时均不导电。
3、都是分子晶体时,熔沸点高低如何判断?
①含有分子间氢键的分子晶体,熔沸点较高。H2O>H2Te>H2Se>H2S,HF>HCl。
氢键
②组成和结构相似的物质,不含氢键的分子晶体,相对分子质量越大,范德华力越大, 熔沸点越高。如:O2>N2,HI>HBr>HCl。
范德华力
③相对分子质量相等或相近,分子极性越大,熔沸点越高,如CO>N2。
极性
【思考与讨论】
同分异构体中:
在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;
1、比较下列化合物的熔、沸点的高低(填“>”或“<”)
①CO2 SO2; ②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2;
<
>
>
<
>
>
2、已知AlCl3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。
可测其在熔融状态下是否可导电,若不导电,则是共价化合物,
若导电,则是离子化合物。
科学 技术 社会—天然气水合物—一种潜在的能源
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气分子藏在水分子笼内
水分子笼是多种多样的
1、下列关于分子晶体的说法正确的是( )
A. 分子内均存在共价键 B. 分子间一定存在范德华力
C. 分子间一定存在氢键 D. 晶体的熔、沸点一般较高
2、下列各组物质都属于分子晶体的是( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
B
A
3、下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、H2O、Na2O2
B
4、下列物质固态时,一定是分子晶体的是( )
A、酸性氧化物 B、非金属单质
C、碱性氧化物 D、含氧酸
D
5、医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体 B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
6、下列性质适合于分子晶体的是( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③
C.②③ D.②④
C
7、海底有大量的天然气水合物,可满足人类1 000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
A.CH4·14H2O B.CH4·8H2O
C.CH4· H2O D.CH4·6H2O
B
176
a3 NA ×10-30
g·cm-3
8、如图为干冰的晶胞结构示意图。
(1)通过观察分析,有____种取向不同的CO2分子。
将CO2分子视作质点,设晶胞边长为a pm,则紧
邻的两个CO2分子的距离为______ pm。
(2)若以顶点上的1个CO2 为中心,周围等距离为a cm的CO2有_____个它们构成______面体
(3)其密度ρ为____________________________(1 pm=10-10 cm)。
6
八
√2a
2
4
