第八单元金属和金属材料检测题(无答案)
文档属性
| 名称 | 第八单元金属和金属材料检测题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 103.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-22 20:49:52 | ||
图片预览

文档简介
2024年人教版九年级化学第八单元金属和金属材料检测题
一、选择题
1.下列金属中,活动性最强的是( )
A.钠 B.铝 C.铜 D.银
2.下列事实不能用金属活动性顺序解释的是( )
A. 铝制品抗腐蚀能力比铁制品强
B.铜能将银从硝酸银溶液中置换出来
C.不能用金属铜与稀硫酸反应制取氢气
D.相同条件下,镁和锌与稀盐酸反应的剧烈程度不同
3.有x、y、z三种金属,如果把x和y分别放人稀硫酸中,x溶解并产生氢气,而y 不反应;如果把y 和z分别放入硝酸银溶液中,过一会儿,在y 表面有银析出,而z没有变化。根据以上实验事实,判断x、y和z的金属活动顺序正确的是 ( )
A.X>y>Z B.X>Z>y, C.Z>y >X D.Z>X>y
4.物质性质决定用途。下列说法不正确的是( )
A.氧气能支持燃烧,用于做火箭的燃料
B.铜具有良好的导电性,用于做导线
C.铁粉容易生锈,用于食品脱氧剂
D.氢气有可燃性,用于高能燃料
5.对下列事实的解释或者结论,正确的是( )
A.氧气和臭氧的化学性质不同—由不同的分子构成
B.二氧化锰和氯酸钾中都含有氧元素—都属于氧化物
C.清末的铝制佛像至今保存完好—铝的化学性质不活泼
D.蜡烛燃烧生成水和二氧化碳—蜡烛中一定含有碳、氢、氧元素
6.室温下,向a克硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌粉。充分反应后过滤,所得滤液质量仍为a克。下列说法不正确的是( )
A.滤渣中一定有银和铜可能有铁和锌 B.滤液中一定没有硝酸银和硝酸铜
C.滤液中一定有硝酸锌 D.该过程至少发生了2个化学反应
7.有关“金属之最”的叙述中,正确的是( )
A.使用最广泛的金属是铝 B.密度最小的金属是Na
C.熔点最高的金属是钨 D.导电性最好的金属是Cu
8.向CuSO4溶液中加入一定质量的Zn粉,反应后过滤,得滤渣和蓝色滤液,下列说法正确的是( )
A.滤液中一定有CuSO4和ZnSO4
B.滤液中一定有CuSO4,可能有ZnSO4
C.向滤渣中滴加稀盐酸,一定有气泡产生
D.滤渣中一定有Cu,可能有Zn
9.将铁粉装入纱袋制成“吸金球”,以“吸”出含有金盐的电镀废液中的金,变废为宝.“吸金”利用的原理是( )
A.铁粉具有吸附性 B.铁粉具有磁性
C.铁的金属活动性比金强 D.铁的导电性比金强
10.下列化学方程式书写正确的是
A.CuO + H2SO4=CuSO4 + H2O B.3 Cu+Al2(SO4)3=2Al+3CuSO4
C.2Fe + 3CuCl2=2FeCl3 + 3Cu D.Cu+H2SO4=CuSO4+H2↑
11.现有X、Y、Z三种金属,已知:①
②
③不反应,则下列符合要求的X、Y、Z分别是( )
A.Cu、Zn、Fe B.Cu、Fe、Ag C.Ag、Zn、Mg D.Ag、Zn、Cu
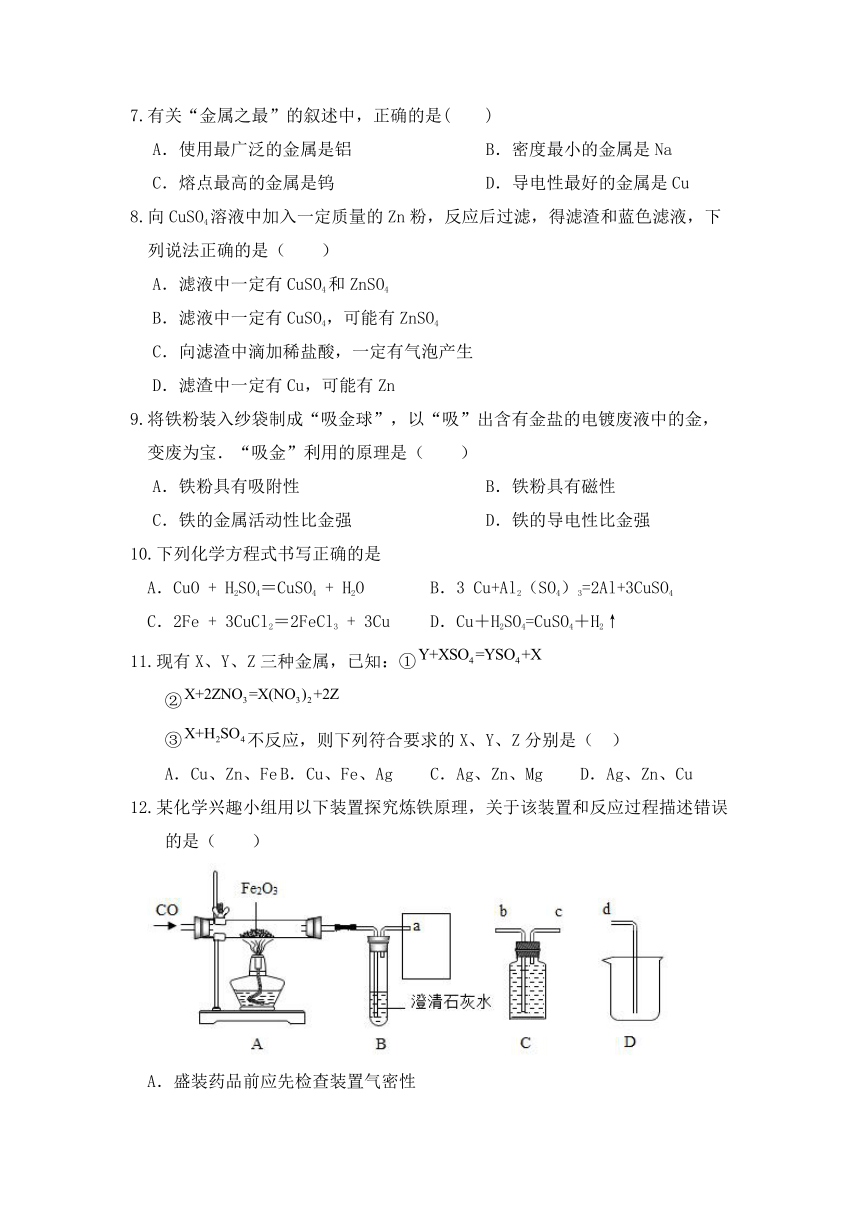
12.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
13.下列用数轴表示的化学知识不正确的是( )
A. B.
C. D.
14.下列关于反应的描述、反应的化学方程式及反应类型完全正确的是( )
A.实验室用加热高锰酸钾制取氧气
分解反应
B.铁丝在氧气中燃烧 化合反应
C.高炉炼铁原理 置换反应
D.将铁片投入足量的稀盐酸中 置换反应
15.某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品。加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。下列判断不正确的是( )
A.若滤渣中有镁粉,则滤液中一定没有Cu(NO3)2、AgNO3
B.若滤渣中有铜粉,则滤液中一定含有Mg(NO3)2,可能含有Cu(NO3)2
C.若滤渣中没有铜粉,则滤液中一定含有Mg(NO3)2、Cu(NO3)2、AgNO3
D.反应后得到滤渣的质量一定大于反应前所加固体的质量
二、填空题
16.铁是生产、生活中应用广泛的金属材料。
(1)某种含铁粉的麦片,食用后在胃酸(盐酸)作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。
(2)对铁质零件进行“发蓝”处理后,其表面会形成致密氧化膜,从而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是__________________________。
②为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,由此可知“发蓝”处理效果不好,因为__________(用化学方程式表示)。
17.根据所学知识回答下列有关金属的问题。
(1)根据金属活动顺序表判断:Mg和Ag中能与稀硫酸发生反应的是 _____;
(2)将铜片和黄铜片相互刻画,_____的表面会留下划痕;
(3)工业炼铁反应原理为:3CO+Fe2O32Fe+3CO2,_____发生氧化反应;
(4)家用“锡纸”中的金属是锡还是铝,将打磨后的“锡纸”与 混合即可完成鉴别(填序号)。
A.稀盐酸 B.ZnCl2溶液 C.AgNO3溶液 D.SnCl2溶液
18.银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
(1)可将铜丝浸入 溶液中来验证铜、银两种金属的活动性强弱.
(2)写出渣料加入稀硫酸反应的化学方程式 .
(3)硫酸铜溶液可用于制备硫酸铜晶体,其基本操作是 、冷却结晶、过滤.
(4)理论上银铜合金废料中的铜可完全转化为硫酸铜.已知废料的质量为100kg,若最后所得的硫酸铜溶液中含80kg 硫酸铜,则废料中铜的质量分数为 .
三、简答题
19.如图是实验室制取气体常用装置,请回答下列问题:
(1)写出图中标号仪器的名称:a____,b_____。
(2)实验室用装置A制取氧气,反应的化学方程式是_____,若需要收集一瓶比较纯净的氧气,其收集装置应选择____,某同学做铁丝在氧气中燃烧的实验时发现集气瓶炸裂,原因可能是____。
(3)如图,通过B装置反应前后的质量变化来测定某赤铁矿石中氧化铁的质量分数。图中A装置的作用是____。若无装置C,则测出氧化铁的质量分数会____(填“偏大”、“偏小”或“没有影响”)。
20.小王同学想测定某Cu—Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为_________g。
(2)计算合金中铜的质量分数________。
一、选择题
1.下列金属中,活动性最强的是( )
A.钠 B.铝 C.铜 D.银
2.下列事实不能用金属活动性顺序解释的是( )
A. 铝制品抗腐蚀能力比铁制品强
B.铜能将银从硝酸银溶液中置换出来
C.不能用金属铜与稀硫酸反应制取氢气
D.相同条件下,镁和锌与稀盐酸反应的剧烈程度不同
3.有x、y、z三种金属,如果把x和y分别放人稀硫酸中,x溶解并产生氢气,而y 不反应;如果把y 和z分别放入硝酸银溶液中,过一会儿,在y 表面有银析出,而z没有变化。根据以上实验事实,判断x、y和z的金属活动顺序正确的是 ( )
A.X>y>Z B.X>Z>y, C.Z>y >X D.Z>X>y
4.物质性质决定用途。下列说法不正确的是( )
A.氧气能支持燃烧,用于做火箭的燃料
B.铜具有良好的导电性,用于做导线
C.铁粉容易生锈,用于食品脱氧剂
D.氢气有可燃性,用于高能燃料
5.对下列事实的解释或者结论,正确的是( )
A.氧气和臭氧的化学性质不同—由不同的分子构成
B.二氧化锰和氯酸钾中都含有氧元素—都属于氧化物
C.清末的铝制佛像至今保存完好—铝的化学性质不活泼
D.蜡烛燃烧生成水和二氧化碳—蜡烛中一定含有碳、氢、氧元素
6.室温下,向a克硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌粉。充分反应后过滤,所得滤液质量仍为a克。下列说法不正确的是( )
A.滤渣中一定有银和铜可能有铁和锌 B.滤液中一定没有硝酸银和硝酸铜
C.滤液中一定有硝酸锌 D.该过程至少发生了2个化学反应
7.有关“金属之最”的叙述中,正确的是( )
A.使用最广泛的金属是铝 B.密度最小的金属是Na
C.熔点最高的金属是钨 D.导电性最好的金属是Cu
8.向CuSO4溶液中加入一定质量的Zn粉,反应后过滤,得滤渣和蓝色滤液,下列说法正确的是( )
A.滤液中一定有CuSO4和ZnSO4
B.滤液中一定有CuSO4,可能有ZnSO4
C.向滤渣中滴加稀盐酸,一定有气泡产生
D.滤渣中一定有Cu,可能有Zn
9.将铁粉装入纱袋制成“吸金球”,以“吸”出含有金盐的电镀废液中的金,变废为宝.“吸金”利用的原理是( )
A.铁粉具有吸附性 B.铁粉具有磁性
C.铁的金属活动性比金强 D.铁的导电性比金强
10.下列化学方程式书写正确的是
A.CuO + H2SO4=CuSO4 + H2O B.3 Cu+Al2(SO4)3=2Al+3CuSO4
C.2Fe + 3CuCl2=2FeCl3 + 3Cu D.Cu+H2SO4=CuSO4+H2↑
11.现有X、Y、Z三种金属,已知:①
②
③不反应,则下列符合要求的X、Y、Z分别是( )
A.Cu、Zn、Fe B.Cu、Fe、Ag C.Ag、Zn、Mg D.Ag、Zn、Cu
12.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
13.下列用数轴表示的化学知识不正确的是( )
A. B.
C. D.
14.下列关于反应的描述、反应的化学方程式及反应类型完全正确的是( )
A.实验室用加热高锰酸钾制取氧气
分解反应
B.铁丝在氧气中燃烧 化合反应
C.高炉炼铁原理 置换反应
D.将铁片投入足量的稀盐酸中 置换反应
15.某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品。加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。下列判断不正确的是( )
A.若滤渣中有镁粉,则滤液中一定没有Cu(NO3)2、AgNO3
B.若滤渣中有铜粉,则滤液中一定含有Mg(NO3)2,可能含有Cu(NO3)2
C.若滤渣中没有铜粉,则滤液中一定含有Mg(NO3)2、Cu(NO3)2、AgNO3
D.反应后得到滤渣的质量一定大于反应前所加固体的质量
二、填空题
16.铁是生产、生活中应用广泛的金属材料。
(1)某种含铁粉的麦片,食用后在胃酸(盐酸)作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。
(2)对铁质零件进行“发蓝”处理后,其表面会形成致密氧化膜,从而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是__________________________。
②为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,由此可知“发蓝”处理效果不好,因为__________(用化学方程式表示)。
17.根据所学知识回答下列有关金属的问题。
(1)根据金属活动顺序表判断:Mg和Ag中能与稀硫酸发生反应的是 _____;
(2)将铜片和黄铜片相互刻画,_____的表面会留下划痕;
(3)工业炼铁反应原理为:3CO+Fe2O32Fe+3CO2,_____发生氧化反应;
(4)家用“锡纸”中的金属是锡还是铝,将打磨后的“锡纸”与 混合即可完成鉴别(填序号)。
A.稀盐酸 B.ZnCl2溶液 C.AgNO3溶液 D.SnCl2溶液
18.银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
(1)可将铜丝浸入 溶液中来验证铜、银两种金属的活动性强弱.
(2)写出渣料加入稀硫酸反应的化学方程式 .
(3)硫酸铜溶液可用于制备硫酸铜晶体,其基本操作是 、冷却结晶、过滤.
(4)理论上银铜合金废料中的铜可完全转化为硫酸铜.已知废料的质量为100kg,若最后所得的硫酸铜溶液中含80kg 硫酸铜,则废料中铜的质量分数为 .
三、简答题
19.如图是实验室制取气体常用装置,请回答下列问题:
(1)写出图中标号仪器的名称:a____,b_____。
(2)实验室用装置A制取氧气,反应的化学方程式是_____,若需要收集一瓶比较纯净的氧气,其收集装置应选择____,某同学做铁丝在氧气中燃烧的实验时发现集气瓶炸裂,原因可能是____。
(3)如图,通过B装置反应前后的质量变化来测定某赤铁矿石中氧化铁的质量分数。图中A装置的作用是____。若无装置C,则测出氧化铁的质量分数会____(填“偏大”、“偏小”或“没有影响”)。
20.小王同学想测定某Cu—Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为_________g。
(2)计算合金中铜的质量分数________。
同课章节目录
